Высокомолекулярные соединения (серия Б), 2020, T. 62, № 4, стр. 243-252
Полимеризация 5-этилиден-2-норборнена в присутствии N-гетероциклических карбеновых Pd-комплексов с фосфиновыми и пиридиновыми лигандами
Е. В. Бермешева a, b, А. И. Возняк a, М. В. Бермешев a, *, А. Ф. Асаченко a, М. А. Топчий a, М. С. Нечаев a, c, М. П. Филатова a, А. П. Хрычикова a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
b Московский государственный медицинский университет имени И.М. Сеченова
119991 Москва, Трубецкая ул., 8, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: bmv@ips.ac.ru
Поступила в редакцию 03.12.2019
После доработки 29.01.2020
Принята к публикации 05.02.2020
Аннотация
Исследована полимеризация промышленно доступного напряженного циклоалкена 5-этилиден-2-норборнена в присутствии N-гетероциклических карбеновых Pd-комплексов (два из которых впервые синтезированы), содержащих фосфиновые или пиридиновые лиганды. Изученные Pd-комплексы при активации боратом Na+[B(3,5-(CF3)2C6H3)4)]– катализируют полимеризацию 5-этилиден-2-норборнена по аддитивной схеме. Полимеризация протекает селективно с вовлечением в реакцию только эндоциклической (норборненовой) двойной связи мономера, в то время как экзоциклическая (этилиденовая) двойная связь остается не затронутой. N-гетероциклические карбеновые Pd-комплексы с фосфиновыми лигандами оказались малоактивными в полимеризации, в то время как аналогичные комплексы с 3-хлорпиридиновыми лигандами проявили более высокую активность. Синтезированы два новых Pd-комплекса.
ВВЕДЕНИЕ
Виниловые гомо- и сополимеры циклоолефинов обладают рядом интересных свойств: высокой прозрачностью [1–3], низким влагопоглощением, высокой температурой стеклования [4, 5], термической и химической стабильностью и т.д. Они представляют интерес в качестве перспективных материалов для опто- и микроэлектроники [6, 7], мембранного газоразделения [8–12] и первапорации [13, 14], ионпроводящих мембран [15, 16]. Получение таких материалов стало возможным благодаря разработке каталитических систем, позволяющих вовлекать в полимеризацию мономеры с различными функциональными группами [17–19]. Однако, несмотря на достигнутый прогресс в создании катализаторов для аддитивной полимеризации циклоалкенов, по-прежнему остается актуальным вопрос поиска новых каталитических систем, обладающих высокой активностью, толерантностью по отношению к функциональным группам и способных селективно вовлекать в полимеризацию би- и полифункциональные мономеры. Доступным и перспективным классом циклоолефинов для оценки каталитической активности являются производные норборнена [17, 20, 21]. Полимеры на основе данного типа мономеров в настоящее время уже нашли промышленное применение [1, 20, 22, 23] в качестве сорбентов, высокопрозрачных материалов, фоторезистов, упаковочных материалов и т.д. Один из наиболее доступных и интересных мономеров среди норборненов – 5-этилиден-2-норборнен (ЭНБ), использующийся при производстве тройных сополимеров этилен–пропилен–диен. Этот мономер содержит две двойные связи: эндоциклическую (норборненовую) и экзоцикличскую (этилиденовую), т.е. является бифункциональным. Ранее мы показали, что высокоактивными и селективными катализаторами аддитивной полимеризация ЭНБ являются двух-, трехкомпонентные каталитические системы на основе N-гетероциклических карбеновых Pd-комплексов с циннамильным лигандом [24]. В настоящей работе мы впервые изучили полимеризацию ЭНБ в присутствии родственных систем – N-гетероциклических карбеновых Pd-комплексов с фосфиновым и пиридиновым лигандами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты
5-Этилиден-2-норборнен, трициклогексилфосфин (PCy3) и все растворители были приобретены у “Sigma-Aldrich”, Na+[B(3,5-(CF3)2C6H3)4]– (NaBARF) был закуплен у “J&K Scientific”.
Толуол, ЭНБ перед применением перегоняли над натрием в атмосфере аргона. NaBARF, PCy3 использовали без дополнительной очистки. 1,2-Дихлорэтан сушили над P2O5 и перегоняли в атмосфере аргона. Хлороформ сушили над CaH2 и перегоняли в атмосфере аргона.
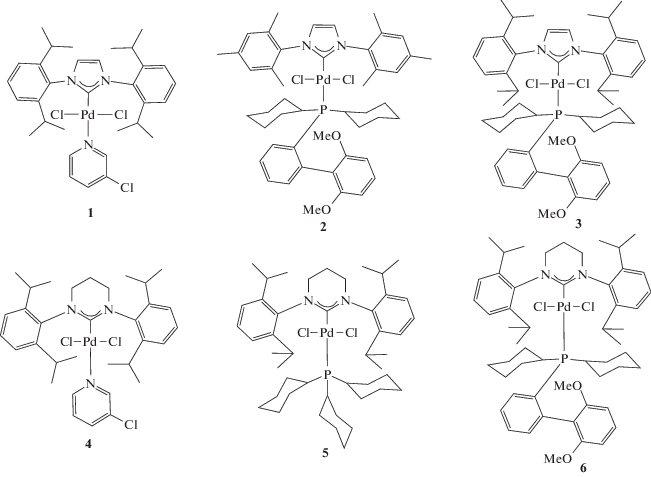
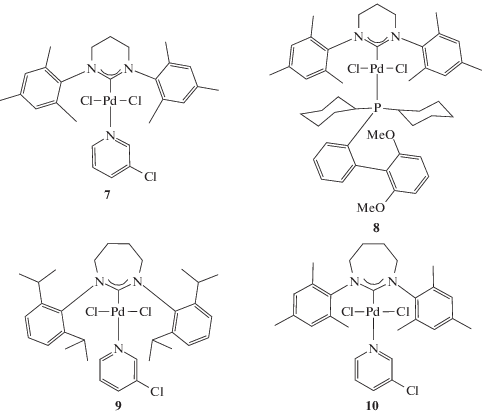
Все синтезы с участием чувствительных к воздуху и влаге соединений проводили в сухом и очищенном аргоне с использованием стандартных методов Шленка и вакуумной линии. Все мономеры хранили в инертной атмосфере. Pd-комплекс 1 синтезировали по методике [25], комплексы 2, 3, 6 и 8 – по методике [26], комплексы 7 – по методике [27].
Методы исследований
Спектры ЯМР регистрировали на ЯМР-спектрометре “Bruker AvancerTM 600”. Для спектров ЯМР 1Н частота регистрации составляла 600.22 МГц, для спектров ЯМР 13С – 150.92 МГц. Сигналы в спектрах ПМР относили по остаточным протонам CDCl3 (7.24 м.д.), в спектрах ЯМР 13С – по центральному пику CDCl3 (77.00 м.д.).
Газохроматографический анализ проводили на газовом хроматографе “Кристалл 5000” с капиллярной колонкой “SGE Analytical Sci” и пламенно-ионизационным детектором. Длина колонки 25 м × 0.32 мм, фаза НТЕ8 (полисилоксанкарборан, содержащий 8% фенильных групп), газ-носитель азот. Параметры пламенно-ионизационного детектора: температура на детекторе 200°С, расход водорода 25 мл/мин, расход воздуха 250 мл/мин, расход азота 25 мл/мин. Параметры колонки: температура термостатирования колонки 40°С, давление газа-носителя 71.519 кПа, поток газа-носителя 2.5 мл/мин, скорость газа-носителя 39.7 см/c, сбросный расход 30 мл/мин. Температура на испарителе 250°С.
ИК-спектры зарегистрированы в тонких пленках с KBr фурье-спектрометром “Bruker FS-66 v/s”, а также при помощи ИК-микроскопа “HYPERION 2000” (“Bruker”) сопряженного с фурье-спектрометром “IFS-66 v/s” методом отражения с поверхности.
Молекулярную массу определяли методом ГПХ на хроматографе высокого давления “Waters”, оснащенном рефрактометрическим детектором (колонка Microgel mix 1–5 mcm 500 mm × 7.7 mm Chrompack, растворитель хлороформ, объем пробы 200 мкл, концентрация образцов 1 мг/мл). Калибровку проводили по полистирольным стандартам с М = (1 × 103)– (2.6 × 106). Молекулярно-массовые характеристики рассчитывали по калибровочной зависимости, которая была линейной в диапазоне М = (1 × 103)–(1 × 106).
Синтез комплекса 4
К раствору 331 мг (0.5 ммоля) (6Dipp)Pd(cinn)Cl в 5 мл дихлорметана добавляли 1 мл 3.8 М HCl в 1,4-диоксане. Реакционную смесь перемешивали при комнатной температуре до полной конверсии исходного палладиевого комплекса (по ТСХ, ~1 ч). Полученный оранжевый раствор упаривали досуха и сушили в вакууме (0.5 мм рт.ст.). Твердый остаток растворяли в 5 мл дихлорметана и добавляли 0.5 мл 3-хлорпиридина. Реакционную смесь перемешивали 1 ч, затем отфильтровывали через слой силикагеля толщиной 1 см, силикагель промывали избытком дихлорметана. Фильтрат упаривали, остаток сушили в вакууме и перекристаллизовывали из смеси дихлорметан–пентан. Получили 223 мг комплекса (64%) в виде желтого порошка. Тпл = 260–263°С.
ЯМР 1H (CDCl3, δ, м.д.): 8.20 д (J = 2.2 Гц, 1H), 8.13 дд (J = 5.5, 1.2 Гц, 1H), 7.45 ддд (J = 8.2, 2.3, 1.3 Гц, 1H), 7.43–7.39 м (2H), 7.32 д (J = 7.7 Гц, 4H), 6.95 дд (J = 8.2, 5.5 Гц, 1H), 3.76–3.72 м (4H), 3.60 п (J = 6.7 Гц, 4H), 2.37 п (J = 5.9 Гц, 2H), 1.54 д (J = 6.6 Гц, 12H), 1.22 д (J = 6.9 Гц, 12H).
ЯМР 13C(1H) (CDCl3, δ, м.д.): 182.8, 150.2, 149.2, 147.4, 141.6, 137.1 , 131.8, 129.4, 129.4, 124.5, 124.5, 124.3, 51.5, 29.2, 27.3, 24.2, 21.5.
ИК (KBr): 3095, 3061, 3031, 2968, 2931, 2866, 1589, 1562, 1505, 1463, 1439, 1417, 1399, 1379, 1359, 1327, 1310, 1256, 1200, 1178, 1121, 1114, 1098, 1077, 1051, 1035, 994, 952, 928, 902, 799, 753, 687, 641.
HRMS (APPI) рассчитано для C33H45Cl3N3Pd [M + H]+: 694.1713, 695.1714, 696.1701, 697.1714, 698.1693; найдено: 694.1713, 695.1715, 696.1701, 697.1713, 698.1693.
Синтез комплекса 5
К раствору 331 мг (0.5 ммоля) (6Dipp)Pd(cinn)Cl в 5 мл дихлорметана добавили 1 мл 3.8 М HCl в 1,4-диоксане. Реакционную смесь перемешивали при комнатной температуре до полной конверсии исходного палладиевого комплекса (по ТСХ, ~1 ч). Полученный оранжевый раствор упаривали досуха и высушили в вакууме (0.5 мм рт.ст.). Твердый остаток растворяли в 5 мл дихлорметана и добавляли 147 мг (1.05 экв.) трициклогексилфосфина. Реакционную смесь перемешивали 1 ч, затем отфильтровали через слой силикагеля толщиной 1 см, силикагель промыли избытком дихлорметана. Фильтрат упаривали, остаток сушили в вакууме и перекристаллизовывали из смеси дихлорметан–пентан. Получили комплекс с выходом 89% в виде желтого порошка. Тразл = 240–243°С.
ЯМР 1H (CDCl3, δ, м.д.): 7.31–7.27 м (2H), 7.23 д (J = 7.6 Гц, 4H), 3.75– 3.67 м (4H), 3.67–3.56 м (4H), 2.27 с (2H), 1.94 к (J = 11.8, 10.9 Гц, 3H), 1.55 д (J = 8.3 Гц, 10H), 1.48 д (J = 6.4 Гц, 12H), 1.41 д (J = 10.4 Гц, 6H), 1.20–1.01 м (26H).
ЯМР 13C(1H) (CDCl3, δ, м.д.): 198.5 д (J = 178.4 Гц), 147.7, 142.4, 128.5, 123.8, 50.7, 50.7, 31.3, 31.2, 29.2, 29.1, 27.7, 27.6, 27.5, 26.5, 23.6, 20.1.
ИК (KBr): 3433, 3062, 2964, 2928, 2849, 1492, 1443, 1380, 1362, 1320, 1300, 1257, 1198, 1175, 1111, 994, 929, 891, 850, 800, 757.
HRMS (APPI) рассчитано для C46H73Cl2N2PPd [M]+: 859.3939, 860.3928, 861.3934, 862.3918, 863.3939, 864.3917; найдено: 859.3934, 860.3924, 861.3928, 862.3913, 863.3933, 864.3911.
Синтез комплекса 9
К раствору 339 мг (0.5 ммоля) (7Dipp)Pd(cinn)Cl в 5 мл дихлорметана добавляли 1 мл 3.8 М HCl в 1,4-диоксане. Реакционную смесь перемешивали при комнатной температуре до полной конверсии исходного палладиевого комплекса (по ТСХ, ~1 ч). Полученный оранжевый раствор упаривали досуха и сушили в вакууме (0.5 мм рт.ст.). Твердый остаток растворяли в 5 мл дихлорметана и добавляли 0.5 мл 3-хлорпиридина. Реакционную смесь перемешивали 1 ч, затем отфильтровали через слой силикагеля толщиной 1 см, силикагель промывали избытком дихлорметана. Фильтрат упаривали, остаток сушили в вакууме и перекристаллизовывали из смеси дихлорметан–пентан. Получили 211 мг комплекса (59%) в виде желтого порошка.
ЯМР 1H (CDCl3 , δ , м.д.): 8.19 д (J = 2.1 Гц, 1H), 8.15 дд (J = 5.0, 1.1 Гц, 1H), 7.45 ддд (J = 8.2, 2.3, 1.3 Гц, 1H), 7.4–7.47 м (1H), 7.36 т (J = 7.7 Гц, 2H), 7.29 д (J = 7.8 Гц, 4H), 4.04 м (4H), 3.61 м (4H), 2.35 м (4H), 1.44 д (J = 6.6 Гц, 12H), 1.23 д (J = = 6.7 Гц, 12H).
ЯМР 13C(1H) (CDCl3, δ, м.д.): 187.8, 151.0, 149.7, 147.1, 141.2, 137.7, 131.2, 129.5, 129.6, 123.8, 123.7, 122.3, 56.0, 48.4, 29.1, 27.4, 23.7, 21.5.
ИК (KBr): 3042, 2971, 2873, 1595, 1563, 1505, 1466, 1432, 1416, 1404, 1381, 1353, 1321, 1317, 1260, 1178, 1125, 1116, 1092, 1083, 1053, 1040, 991, 956, 921, 905, 797, 750, 689, 642.
Описание общей процедуры полимеризации
В реакторах Шленка, снабженных магнитными мешалками, в токе аргона приготавливали растворы Pd-катализатора, борорганического активатора и фосфинового лиганда. Затем в отдельном реакторе готовили каталитическую систему, добавляя последовательно растворы бората, комплекса палладия и фосфина в требуемых соотношениях; полученную смесь тщательно перемешивали. Далее в виалки помещали расчетные количества катализатора, растворителей и мономера при перемешивании. Образцы выдерживали в течение требуемого времени, при нужной температуре. Полученные полимеры осаждали этанолом и сушили в вакууме в течение 8 ч при температуре 90°C. После этого полимер переосаждали из его раствора в толуоле этанолом и снова сушили в вакууме, процедуру повторяли дважды.
Пример11 аддитивной полимеризации ЭНБ
Раствор катализатора получали путем смешивания растворов комплекса 2 в 1,2-дихлорэтане (2.98 мл, 2.98 × 10–3 ммоль, 1 × 10–3 моль/л), NaBARF в 1,2-дихлорэтане (2.44 мл, 1.48 × 10–2 ммоль, 6.1 × 10–3 моль/л) и раствора PCy3 в 1,2-дихлорэтане (1.95 мл, 5.95 × 10–3 ммоль, 3.0 × 10–3 моль/л). Раствор катализатора перемешивали в течение 1 ч. В стеклянную виалку вводили мономер (ЭНБ, 0.20 мл, 1.49 ммоля). Виалку нагревали в сушильном шкафу до 30°C. Затем добавляли предварительно приготовленный раствор катализатора (0.74 мл) при перемешивании. Реакционную смесь перемешивали еще в течение 1 мин, и виалку с реакционной смесью хранили при 30°C в течение 5 мин. После этого виалку открывали и в реакционную смесь добавляли этанол. Полимер трижды промывали этанолом и затем сушили в вакууме (0.05 мм рт.ст.) при 80–90°C до постоянной массы.
Полимер выделяли в виде белого твердого соединения. Выход 0.1 г (56%). Спектры полученного полимера аналогичны ранее опубликованным спектрам [28].
ЯМР 1Н (CDCl3, δ, м.д.): 5.50–4.80 м (1Н), 3.10–0.70 м (11Н).
ЯМР 13С (CDCl3, δ, м.д.): 149.2–144.7 м, 113.8–108.6 м, 55.3–34.2 м, 15.9– 12.5 м.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее было показано, что N-гетероциклические карбеновые Pd-комплексы с циннамильными лигандами являются не только очень активными в реакциях аддитивной полимеризации замещенных норборненов, но и к тому же обладают высокой толерантностью к различным функциональным группам [28–30]:
Это особенно важно для селективного вовлечения в полимеризацию бифункциональных мономеров, например, таких как 5-этилиден-2-норборнен (ЭНБ) и 5-винил-2-норборнен. В данной работе мы исследовали активность в аддитивной полимеризации ЭНБ серии родственных N-гетероциклических карбеновых Pd-комплексов, содержащих лиганды отличные от циннамильного:
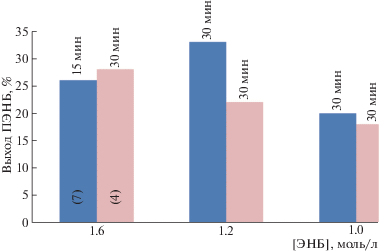
B изученных Pd-комплексах варьировали три параметра: размер гетероцикла и объем арильных групп в NHC-лиганде, а также природу монодентантного лиганда (фосфин, 3-хлорпиридин). Необходимо отметить, что все исследуемые Pd-комплексы при активации NaBARF в присутствии PCy3 катализировали полимеризацию ЭНБ, селективно протекающую с раскрытием только эндоциклической (норборненовой) двойной связи. Однако активность Pd-катализаторов и обнаруженные тенденции существенно зависели от размера гетероцикла в NHC-лиганде. Например, в случае Pd-комплекса с пятичленным NHC-лигандом ((IPr)Pd(сinn)Cl) замена циннамильного лиганда на 3-хлорпиридин и хлор привела к существенному снижению активности (рис. 1). Эта тенденция сохраняется при разных концентрациях мономера в смеси.
Рис. 1.
Зависимость выхода ПЭНБ от структуры Pd-комплексов, содержащих пятичленные NHC-лиганды. Сокатализатор NaBARF, мольное соотношение Pd : PCy3 : B = 1 : 2 : 5, температура 30°C, растворитель 1,2-дихлорэтан.
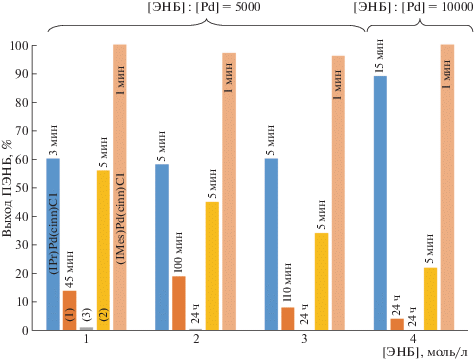
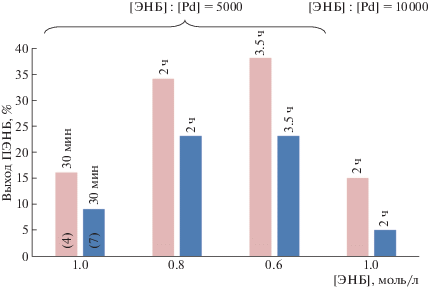
Замена 3-хлорпиридинового лиганда на фосфиновый в Pd-комплексах с пятичленными NHC-лигандами также вызывает существенное снижение активности соответствующих каталитических систем (рис. 1, 2).
Рис. 2.
Зависимость выхода ПЭНБ от структуры Pd-комплексов, содержащих шестичленные NHC-лиганды. Сокатализатор NaBARF, мольное соотношение Pd : PCy3 : B = 1 : 2 : 5, температура 30°C, растворитель 1,2-дихлорэтан.
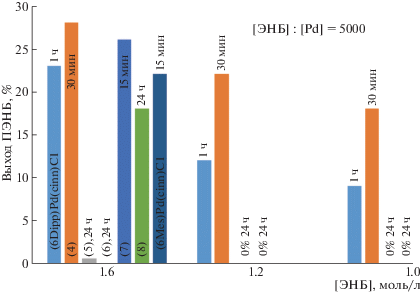
В случае Pd-комплексов с шестичленными NHC-лигандами ситуация несколько более сложная. Оказалось, что введение 3-хлорпиридинового лиганда и хлора напротив повышает активность таких комплексов по сравнению с родственными (NHC)Pd(cinn)Cl-комплексами. Особенно это хорошо заметно на комплексах с более объемными 2,6-ди-изо-пропилфенильными заместителями (рис. 2). Например, комплекс 4 дает больший выход полимера за 30 мин, чем (6-Dipp)Pd(сinn)Cl за 1 ч.
В то же время введение фосфинового лиганда как в пятичленных, так и в шестичленных (NHC)Pd-комплексах, приводит к резкому падению активности вплоть до ее полного исчезновения (рис. 1, 2).
Наблюдаемые закономерности, как мы полагаем, связаны с несколькими противоположными тенденциями. Так, ранее было показано, что ключевыми структурными факторами активных катализаторов для полимеризации норборненов являются наличие связи металл–углерод, лабильного лиганда и слабо координированного аниона (например, ${\text{BF}}_{4}^{ - }$, ${\text{SbF}}_{6}^{ - }$, и т.д). Pd-комплексы с циннамильными лигандами уже содержат сформированную связь Pd–C, а свободное координационное место для присоединения молекулы производного норборнена образуется при отщеплении атома Сl от Pd при активации NaBARF. Замена циннамильного лиганда на Cl и фосфиновый или 3-хлорпиридиновый лиганд осложняет процесс инициирования полимеризации, поскольку в исходном комплексе не содержится связь Pd–C (кроме неактивной связи Pd–карбен). Образование этой связи, по-видимому, требует больше времени и, скорее всего, происходит через расщепление связи B–ArF в анионе ${\text{BAr}}_{4}^{{{\text{F}} - }}$. Наличие фосфинового или пиридинового лиганда в таких комплексах стабилизирует положительный заряд на атоме Pd, затрудняя образование необходимой связи Pd–C и дальнейшее инициирование роста цепи. Наблюдаемая разница в активности между фосфиновыми и пиридиновыми Pd-комплексами хорошо согласуется с данным предположением: фосфиновый лиганд более сильный донор, чем пиридиновый, и лучше стабилизирует положительный заряд на Pd, делая комплекс в целом менее активным. Неожиданная более высокая активность в случае пиридиновых Pd-комплексов с шестичленными NHC-лигандами по сравнению с аналогичными комплексами Pd c циннамильными лигандами до конца не ясна и требует проведения дополнительных исследований, связанных с анализом строения активных частиц, образующихся при инициировании и в процессе полимеризации.
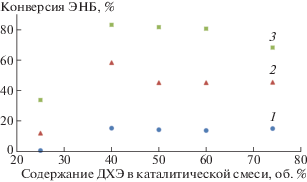
На примере фосфинсодержащих Pd-комплексов мы изучили влияние полярности растворителя на каталитическую активность (рис. 3). В качестве растворителя использовали смесь толуол и 1,2-дихлорэтан (ДХЭ). Оказалось, что максимальная активность достигается при содержании ДХЭ в смеси около 40 об. %. Это, скорее всего, связано с тем, что комбинация указанных растворителей создает оптимальную среду как для растворимости полимера, так и для диссоциации образующихся ионных активных частиц катализатора. ДХЭ является наиболее подходящим высокополярным растворителем для катализатора, но плохим растворителем для образующегося полимера, в то время как присутствие некоторого количества толуола в реакции обеспечивает хорошую растворимость ПЭНБ, предотвращая его осаждение, и поддерживает систему в гомогенном состоянии.
Рис. 3.
Влияние полярности растворителя на конверсию ЭНБ. Мольное соотношение ЭНБ : комплекс 8 : : NaBARF : PCy3 = 1000 : 1 : 5 : 2; [ЭНБ] = 1 моль/л; температура 30°C; время реакции 24 (1), 48 (2) и 72 ч (3).
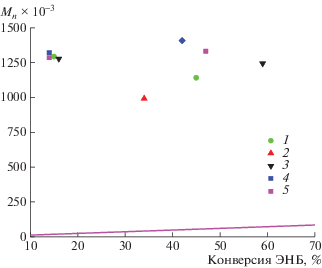
Молекулярная масса образцов ПЭНБ, полученных при проведении полимеризации в смесях растворителей различной полярности, оказалась выше теоретически рассчитанной (рис. 4) и практически не зависела от полярности среды. Более высокие значения молекулярной массы ПЭНБ по сравнению с теоретически рассчитанными свидетельствует о том, что не все молекулы исходного Pd-комплекса учувствуют в полимеризации.
Рис. 4.
Влияние полярности растворителя на молекулярную массу ПЭНБ. Мольное соотношение ЭНБ : : комплекс 8 : NaBARF : PCy3 = 1000 : 1 : 5 : 2; [ЭНБ] = 1 моль/л; температура 30°C. Содержание ДХЭ 25 (1), 40 (2), 50 (3), 60 (4) и 74 об. % (5); прямая – теория. Теоретическую молекулярную массу Mn образующегося ПЭНБ рассчитывали по формуле [ЭНБ]0 × конверсия × Mr(ЭНБ)/[Pd]0.
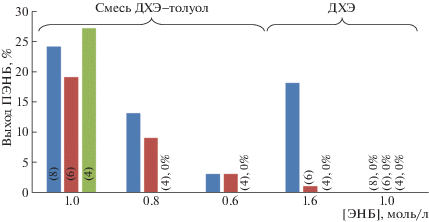
Подобное влияние полярности растворителя характерно и для других Pd-комплексов. Комплексы с фосфиновыми лигандами проявляют каталитическую активность лишь в смеси ДХЭ–толуол (рис. 5).
Рис. 5.
Сравнение выхода полимеров на катализаторах с фосфиновыми лигандами в ДХЭ и смеси растворителей ДХЭ–толуол. Время реакции 24 ч. Здесь и на рис. 6 и 7 мольное соотношение ЭНБ : Pd : NaBARF : PCy3 = = 1000 : 1 : 5 : 2, температура 30°C.
Необходимо отметить, что природа растворителя или состав смеси растворителей может осуществлять инверсию относительной каталитической активности комплексов. Например, активность комплекса 7 в ДХЭ выше, чем аналогичного комплекса 4 с более объемным карбеновым лигандом (рис. 2, 6, 7). Однако в смеси ДХЭ–толуол уже активность комплекса 4 становится заметно выше активности комплекса 7 (рис. 6). Такая существенная зависимость каталитической активности от полярности среды, используемой для проведения полимеризации, может быть связана с различием в степени диссоциации образующихся ионных частиц катализатора и, таким образом, различием в природе активных каталитических центров.
ЗАКЛЮЧЕНИЕ
В работе впервые исследована возможность проведения аддитивной полимеризации производных норборнена в присутствии восьми (два из которых синтезированы впервые) N-гетероциклических карбеновых Pd-комплексов с фосфиновыми и 3-хлорпиридиновыми лигандами. Полимеризация 5-этилиден-2-норборнена (бифункционального мономера) в присутствии данных комплексов протекала селективно: экзоциклическая двойная связь оставалась не затронутой. Показано, что фосфиновые комплексы менее активны по сравнению с родственными комплексами с 3-хлорпиридиновыми лигандами. Установлено, что активность каталитических систем на основе изученных комплексов существенно зависит от природы растворителей. Синтезированы два новых Pd-комплекса.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 17-19-01595). Часть исследования (синтез и исследование палладиевых комплексов 9 и 10) выполнена при поддержке Российского научного фонда (проект 17-13-01076). Анализ комплексов методом масс-спектрометрии высокого разрешения осуществлено в рамках Госзадания ИНХС РАН.
Список литературы
Khanarian G., Celanese H. // OPTICE. 2001. V. 40. № 6. P. 1024.
Bykov V.I., Makovetskii K.L., Popov D.S., Bermeshev M.V., Butenko T.A., Talyzenkov Y.A. // Dokl. Chem. 2011. V. 439. № 2. P. 227.
Bykov V.I., Makovetskii K.L., Popov D.S., Bermeshev M.V., Butenko T.A., Filatova M.P., Finkel’shtein E.S. // Polymer Science B. 2012. V. 54. № 1–2. P. 99.
Commarieu B., Potier J., Compaore M., Dessureault S., Goodall B.L., Li X., Claverie J.P. // Macromolecules. 2016. V. 49. № 3. P. 920.
Goodall B.L., McIntosh L.H. Pat. 20050215735A1 USA. 2005.
Ihara E., Ishii S., Yokoyama K., Fujiwara Y., Ueda T., Inoue K., Itoh T., Momose H., Nodono M. // Polym. J. 2013. V. 45. № 6. P. 606.
Rhodes L.F., Bell A., Jayaraman S., Lipian J.H., Goodall B.L., Shick R.A. Pat. 6232417 B1 USA. 2001.
Alentiev D.A., Egorova E.S., Bermeshev M.V., Starannikova L.E., Topchiy M.A., Asachenko A.F., Gribanov P.S., Nechaev M.S., Yampolskii Y.P., Finkelshtein E.S. // J. Mater. Chem. A. 2018. V. 6. № 40. P. 19393.
Wozniak A.I., Bermesheva E.V., Borisov I.L., Petukhov D.I., Bermeshev M.V., Volkov A.V., Finkelshtein E.S. // Macromol. Rapid Commun. 2019. V. 40. № 20. P. 1900206.
Morontsev A.A., Zhigarev V.A., Nikiforov R.Y., Belov N.A., Gringolts M.L., Finkelshtein E.S., Yampolskii Y.P. // Eur. Polym. J. 2018. V. 99. № P. 340.
Dujardin W., Van Goethem C., Steele J.A., Roeffaers M., Vankelecom I.F.J., Koeckelberghs G. // Polymers. 2019. V. 11. № 4. P. 704.
Alentiev D.A., Bermeshev M.V., Starannikova L.E., Bermesheva E.V., Shantarovich V.P., Bekeshev V.G., Yampolskii Y.P., Finkelshtein E.S. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 12. P. 1234.
Kang B.-G., Kim D.-G., Register R.A. // Macromolecules. 2018. V. 51. № 10. P. 3702.
Kim D.-G., Takigawa T., Kashino T., Burtovyy O., Bell A., Register R.A. // Chem. Mater. 2015. V. 27. № 19. P. 6791.
Chen W., Mandal M., Huang G., Wu X., He G., Kohl P.A. // ACS Appl. Energy Mater. 2019. V. 2. № 4. P. 2458.
He X., Jiang X., Wang Z., Deng Y., Han Z., Yang Y., Chen D. // Polym. Eng. Sci. 2017. V. 58. № 1. P. 13.
Bermeshev M.V., Chapala P.P. // Prog. Polym. Sci. 2018. V. 84. № P. 1.
Commarieu B., Claverie J.P. // Chem. Sci. 2015. V. 6. № 4. P. 2172.
Goodall B.L. // Late Transition Metal Polymerization Catalysis / Ed. by B.L. Goodall, B. Rieger, L.S. Baugh, S. Kacker, S. Striegler. Weinheim: Wiley-VCH, 2005. P. 101.
Blank F., Janiak C. // Coord. Chem. Rev. 2009. V. 253. № 7–8. P. 827.
Ma R., Hou Y., Gao J., Bao F. // Polym. Rev. 2009. V. 49. № 3. P. 249.
Ivin K.J., Mol J.C. // Olefin Metathesis and Metathesis Polymerization. London: Acad. Press, 1997. V. № P. 397.
Trimmer M.S. // Handbook of Metathesis. Weinheim: Wiley, 2008. V. 3. P. 407.
Wozniak A.I., Bermesheva E.V., Gavrilova N.N., Ilyasov I.R., Nechaev M.S., Asachenko A.F., Topchiy M.A., Gri-banov P.S., Bermeshev M.V. // Macromol. Chem. Phys. 2018. V. 219. № 24. P. 1800323.
Larrosa I., Somoza C., Banquy A., Goldup S.M. // Org. Lett. 2011. V. 13. № 1. P. 146.
Ageshina A.A., Sterligov G.K., Rzhevskiy S.A., Topchiy M.A., Chesnokov G.A., Gribanov P.S., Melnikova E.K., Nechaev M.S., Asachenko A.F., Bermeshev M.V. // Dalton Trans. 2019. V. 48. № 10. P. 3447.
Dunsford J.J., Cavell K.J. // Organometallics. 2014. V. 33. № 11. P. 2902.
Bermesheva E.V., Wozniak A.I., Andreyanov F.A., Karpov G.O., Nechaev M.S., Asachenko A.F., Topchiy M.A., Melnikova E.K., Nelyubina Y.V., Gribanov P.S., Bermeshev M.V. // ACS Catalysis. 2020. V. 10. № 3. P. 1663.
Jung I.G., Seo J., Chung Y.K., Shin D.M., Chun S.-H., Son S.U. // J. Polym. Sci., Polym. Chem. 2007. V. 45. № 14. P. 3042.
Lee D.J., Kim M., Kim C.K., Lee I.M. // Bull. Korean Chem. Soc. 2019. V. 40. № 7. P. 710.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)