Высокомолекулярные соединения (серия Б), 2021, T. 63, № 1, стр. 34-43
КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ЭПОКСИАМИННЫХ СИСТЕМ ГУАНИДИНСОДЕРЖАЩИМ ОЛИГОМЕРОМ ДЛЯ ПОВЫШЕНИЯ ИХ СТОЙКОСТИ К ДЕЙСТВИЮ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ
Е. С. Жаворонок a, *, И. П. Седишев a, М. С. Меркулова a, b, О. Я. Урюпина b, И. Н. Сенчихин b
a МИРЭА – Российский технологический университет. Институт тонких химических технологий им. М.В. Ломоносова
119571 Москва, пр. Вернадского, 86, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, Россия
* E-mail: zhavoronok_elena@mail.ru
Поступила в редакцию 30.04.2020
После доработки 29.06.2020
Принята к публикации 15.07.2020
Аннотация
Работа посвящена модификации эпоксиаминных систем новыми реакционноспособными соединениями – солями олигогексаметиленгуанидинов. Из промышленно выпускаемого гидрохлорида олигогексаметиленгуанидина выделены и охарактеризованы его гидросалицилат, гидро-5-сульфосалицилат и гидро-4-аминосалицилат. При получении солей основная макромолекулярная цепь олигогексаметиленгуанидина практически не затронута. Предложена схема ковалентного введения модификатора в эпоксиаминную сетку, заключающаяся в предварительном синтезировании аддукта эпоксидного олигомера и соли олигогексаметиленгуанидина, с последующим его отверждением олигоамином. Определены условия, при которых образуются несшитые вязкотекучие аддукты, хорошо совмещающиеся с эпоксидным олигомером и отвердителем. На основе этих аддуктов изготовлены отвержденные эластичные пленки, из которых наиболее выраженную активность по отношению к модельным микроорганизмам Mycobacterium smegmatis проявляют образцы, модифицированные гидро-4-аминосалицилатом олигогексаметиленгуанидина. Такие материалы перспективны в качестве основы покрытий с биоцидным действием.
ВВЕДЕНИЕ
Модификация эпоксидных композиций представляется одним из основных способов улучшения их свойств [1–5]. Ранее было показано [6, 7], что перспективными рекционноспособными модификаторами эпоксиаминных систем являются соли олигогексаметиленгуанидина (ОГМГ) и органических кислот. Они более гидрофобны, чем промышленно выпускаемый гидрохлорид олигогексаметиленгуанидина, и, вследствие этого, лучше растворимы в эпоксидных олигомерах. В свою очередь, улучшение растворимости позволяет снизить температуру начала реакции между эпоксидными олигомерами и ОГМГ, а также проводить ее в более мягких условиях, получая гомогенные растворы. Путем отверждения таких растворов алифатическим амином были сформированы однородные покрытия, поверхность которых подавляет дыхательную активность как грамположительных, так и грамотрицательных микроорганизмов [7].
Настоящая работа является продолжением этих исследований и посвящена расширению ассортимента солей ОГМГ для модификации эпоксидных олигомеров с целью создания эпоксиаминных покрытий, обладающих выраженной биоцидной активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Базовыми объектами исследования выступали диановый эпоксидный олигомер Epikote 828 (“Hexion”, США) и олигооксипропилендиамин Jeffamine D-230 (“Hunstman”, США), структурные формулы и основные свойства которых приведены в работе [7]. Перед выполнением экспериментов диановый эпоксидный олигомер выдерживали в течение 3 ч при 60°С для удаления кристаллитов. Соли ОГМГ и органических кислот, использованные в работе, синтезировали из промышленно выпускаемого гидрохлорида ОГМГ (“Фарма-Покров”, Россия) со среднечисловой молекулярной массой Mn = 951 и средним числом разветвлений на молекулу 0.47 экв/моль (определено по методике [8]). ОГМГ-гидрохлорид (ОГМГ-Гх) представляет собой слаборазветвленный продукт поликонденсации гуанидина и гексаметилендиамина:

где R ≡ $ - \mathop {\text{C}}\limits^{\,{\text{I}}} {\kern 1pt} {{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} \mathop {\text{C}}\limits^{\,{\text{II}}'} {\kern 1pt} {{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} \mathop {\text{C}}\limits^{\,{\text{III}}'} {\kern 1pt} {{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{N}}{{{\text{H}}}_{{\text{2}}}}$ или  ; HА ≡ HCl
; HА ≡ HCl
(римские цифры над атомами соответствуют условным обозначениям в расшифровках ЯМР-спектров раздела Результаты и их обсуждение).
Синтез органических солей ОГМГ (гидросалицилата, гидросульфосалицилата или гидро-4-аминосалицилата) вели из водного раствора ОГМГ-гидрохлорида и водорастворимой соли соответствующей органической кислоты. Загрузки компонентов для синтеза представлены в табл. 1. В соответствии с ними делали водный раствор ОГМГ-гидрохлорида и водный раствор калиевой соли органической кислоты. Раствор калиевой соли кислоты готовили из соответствующей кислоты и воды при добавлении небольшими порциями гидроксида калия и охлаждении раствора. Полученный раствор калиевой соли органической кислоты прибавляли из капельной воронки к раствору ОГМГ-гидрохлорида при интенсивном перемешивании. При внесении около половины раствора соли органической кислоты образовывалась вязкая масса, затрудняющая перемешивание. Далее к полученной смеси при нагревании ~85–90°С добавляли порциями по 50–100 мл этанола до полного растворения гидросалицилата, гидросульфосалицилата или гидроаминосалицилата ОГМГ. Затем смесь охлаждали и оставляли на ночь для полного отделения продукта. Маточник сливали, а олигомер сушили под вакуумом и измельчали. Высушенные продукты представляли собой желтоватые стекловидные порошки, интенсивность окраски которых зависела от степени измельчения.
Таблица 1.
Загрузка реагентов и выход продукта при синтезе органических солей ОГМГ
| Параметры | Синтезируемая соль ОГМГ | ||
|---|---|---|---|
| Гидро-салицилат | Гидро-5-сульфосалицилат | Гидро-4-аминосалицилат | |
| Загрузка компонентов для приготовления водного раствора ОГМГ-Гх | |||
| Загрузка ОГМГ-Гх, г (экв) | 152.4 (0.842) | 152.4 (0.842) | 152.4 (0.842) |
| Вода, мл | 150 | 150 | 150 |
| Загрузка компонентов для приготовления водного раствора соли органической кислоты | |||
| Органическая кислота | Салициловая | 5-Сульфосалициловая | 4-Аминосалициловая |
| Загрузка кислоты, г (моль) | 116.2 (0.842) | 183.7 (0.842) | 128.9 (0.842) |
| Вода, мл | 250 | 250 | 250 |
| Загрузка КОН, г (моль) | 47.1 (0.842) | 47.1 (0.842) | 47.1 (0.842) |
| Общий объем этанола, мл | 750 | 850 | 800 |
| Выход органической соли ОГМГ, г (%) | 199.2 (90.9) | 276.8 (92.4) | 223.9 (90.6) |
Синтез аддуктов солей ОГМГ с эпоксидным олигомером вели в среде диметилсульфоксида. Для этого соль ОГМГ растворяли в ДМСО квалификации х.ч. с получением 50 мас. % раствора. Затем данный раствор смешивали с эпоксидным олигомером и проводили исследования методами ИК-спектроскопии или дифференциальной сканирующей калориметрии. Для получения модифицированных эпоксиаминных пленок смесь эпоксидного олигомера с раствором ОГМГ выдерживали при 22 ± 2°С в лабораторном реакторе с магнитной мешалкой в течение заданного времени.
Смеси для получения модифицированных эпоксиаминных пленок готовили на основе эпоксидного олигомера и(или) его аддукта с ОГМГ со стехиометрическим количеством отвердителя в расчете на остаточное содержание эпоксидных групп. Отверждение выполняли при постоянной температуре 22 ± 2°С в течение суток.
Исследования осуществляли методами спектроскопии ЯМР 1Н, ЯМР 13С, ИК-фурье-спектроскопии и ДСК, а также определяли биологическую активность пленок, содержащих соли ОГМГ, по отношению к микобактериям.
Спектры ЯМР 1Н растворов органических солей ОГМГ в ДМСО-d6 регистрировали на ЯМР-фурье-спектрометре “DPX-300” (“Bruker”, Германия) со сверхпроводящим магнитом, рабочая частота 300 МГц. Спектры ЯМР 13С растворов органических солей ОГМГ в метаноле-d4 или дейтерированной трифторуксусной кислоте регистрировали на рабочей частоте 70 МГц тем же спектрометром. С целью количественного анализа состава образцов ОГМГ их спектры получали в режиме Inverse Gate, при котором происходит полное широкополосное подавление взаимодействия ядер 13С с протонами и отсутствует ядерный эффект Оверхаузера. Для предотвращения релаксационных эффектов задавали задержку между импульсами 1.8 с. Число сканирований составляло 3199. При анализе спектров химические сдвиги сигналов приводили относительно внутреннего стандарта – метанола-d4, диметилсульфоксида-d6 или СF3COOD.
ИК-спектры измеряли в режиме пропускания на фурье-спектрометре “Nicolet 6700” (“Thermo Fisher”, США) с разрешением 2 см–1 и усреднением 128 сканирований в диапазоне волновых чисел 400–4000 см–1 при 22 ± 2°С в воздушной атмосфере. Для этого из образцов формировали пленки на окнах из KBr.
Исследования солей ОГМГ, их аддуктов с эпоксидным олигомером и отвержденных систем методом ДСК проводили на приборе “DSC Q-100” (“TA Instruments”, США) в динамическом режиме при w+ = 10 К/мин в закрытых алюминиевых тиглях в атмосфере аргона.
Пленки на биологическую активность изучали по отношению к Mycobacterium smegmatis (“АТСС 607”), представляющих собой непатогенные микроорганизмы, сходные по структуре клеточной оболочки с Mycobacterium tuberculosis [9, 10]. Штамм M. smegmatis (“АТСС 607”) предварительно выращивали в соответствии с инструкцией “American Type Culture Collection” [11]. Для приготовления инокулята тест-микроорганизмы выращивали в течение 48 ч на жидкой среде Сабуро (Кс8) при 27°С. Затем переносили выращенные бактерии в колбу Эрленмейера, содержащую 100 мл питательной среды Кс9 и 50 г стеклянных шариков, и выдерживали при 25–27°С в течение 5 суток при постоянном перемешивании. Далее помещали в стерильную пробирку 1.0 мл суспензии тест-микроорганизмов и исследуемый образец (эпоксиаминные пленки, модифицированные ОГМГ) размером 10 × 10 мм при температуре 27°С. Биологическую активность определяли как степень дезактивации живых клеток тест-микроорганизма в суспензии с модифицированным образцом, по отношению к контрольному образцу. Контролем служили суспензии тест-микроорганизма, содержащие образцы эпоксиаминной пленки того же размера без ОГМГ. Приведенная методика основана на методе разбавлений в среде Сабуро [12], но отличается от нее тем, что образцом является пленка с антимикробным компонентом, а не его раствор.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
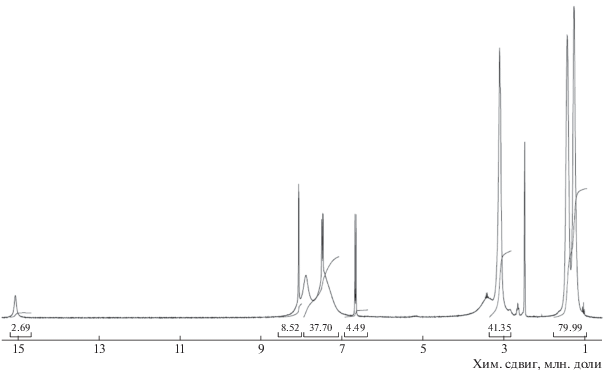
Синтезированные из гидрохлорида ОГМГ гидросалицилат, гидро-4-аминосалицилат и гидро-5-сульфосалицилат были очищены и охарактеризованы методом ЯМР. Типичные спектры ЯМР 1Н исходного гидрохлорида ОГМГ (ОГМГ-Гх) и гидросалицилата ОГМГ (ОГМГ-Гс) с расшифровками приведены в работе [7], а спектры ЯМР 1Н гидро-5-сульфосалицилата ОГМГ (ОГМГ-Гсс) и гидро-4-аминосалицилата ОГМГ (ОГМГ-Гас) представлены на рис. 1 и 2. На спектре ЯМР 1Н ОГМГ-Гсс (300 МГц, ДМСО-d6) (рис. 1) зарегистрированы следующие пики (δ, м.д., J, Гц): 1.28 (4Н, уш.с, СН2 – I); 1.44 (4Н, уш.с, СН2 – II); 3.11 (4Н, уш.с, СН2 – III); 6.68 (1Н, д, Аr 4, J3 = 8.4); 7.50 (1Н, д, Аr 3, J3 = 8.4 + 4Н, уш.с, NH); 7. 89 (>1Н, уш.с, ОН); 8.08 (1Н, с, Аr 6); 15.07 (1Н, уш.с, 2ОН). По соотношению интегральных интенсивностей разрешенных сигналов алифатических (1.28 и 1.44 м.д., 8Н) и ароматических (6.68 м.д., 1Н) протонов рассчитана степень замещения на 5-сульфосалицилат в ОГМГ-Гсс, которая составляет не менее 89.7%. При учете всех ароматических протонов, что уменьшает ошибку измерения, но требует вычета гуанидиновых NH (сигналы 15.07 м.д. + (от 8.08 до 6.66 м.д.) – 4Н гуанидиновых NH, которые определяются как половина алифатических (1.28 и 1.44 м.д., 8Н)), степень замещения на 5-сульфосалицилат в ОГМГ-Гсс составляет не менее 92.4%, и это представляется более точным.
На спектре ЯМР 1Н ОГМГ-Гас (300 МГц, ДМСО-d6) рис. 2 зарегистрированы следующие пики (δ, м.д., J, Гц): 1.30 (4Н, уш.с, СН2 – I); 1.47 (4Н, уш.с, СН2 – II); 3.09 (4Н, уш.с, СН2 – III); 5.22 (2Н, с, АrNH); 5.84 (1Н, с, Аr 3); 5.90 (1Н, д, Аr 5, J3 = 8.4); 7.36 (1Н, д, Аr 6, J3 = 8.3); 7.87 (>2Н, уш.с, гуанидин NH); 8.72 (1Н, уш.с, СООН); 14.65 (1Н, с, АrОН). По соотношению интегральных интенсивностей разрешенных сигналов алифатических (1.30 и 1.47 м.д., 8Н) к ароматическим (5.22, 5.84 и 5.90 м.д., 4Н) протонам рассчитана степень замещения на аминосалицилат в ОГМГ-Гас, которая составляет не менее 98.1%.
Типичные спектры ЯМР 13С исходного ОГМГ-Гх и синтезированного из него ОГМГ-Гс приведены в работе [7], ОГМГ-Гсс и ОГМГ-Гас показаны на рис. 3 и 4 соответственно. На спектре ЯМР 13С ОГМГ-Гсс (70 МГц, CF3COOD) зарегистрированы следующие пики (δ, м.д.): 25.74 (2С, СН2 – I); 26.78 (СН2 – II'); 28. 02 (2С, СН2 – II); 40.96 (СН2 – III'); 41.59 (2С, СН2 – III); 111.31 (1С, Аr 4); 118.49 (1С, Аr 5); 129.57 (1С, Аr 3); 130.09 (1С, Аr 6); 134.12 (1С, Аr 1); 154.38, 155.58, 156.56 (1С, гуанидин, IV'', IV', IV); 163.83 (1С, Аr 2); 172.86 (1С, АrСООН). По соотношению интегральных интенсивностей сигналов алифатических (27.38–42.50 м.д., 6С) к ароматическим (111.31–172.41 м.д., 7С) атомам углерода рассчитана степень замещения на салицилат в ОГМГ-Гcс, которая составляет не менее 97.4%.
На спектре ЯМР 13С ОГМГ-Гас (70 МГц, метанол-d4) зарегистрированы следующие пики (δ, м.д.): 27.36 (2С, СН2 – I); 28.64 (СН2 – II'); 29.84 (2С, СН2 – II); 40.78 (СН2 – III'); 42.57 (2С, СН2 – III); 101.62 (1С, Аr 4); 107.22 (1С, Аr 5); 109.72 (1С, Аr 3); 132.87 (1С, Аr 6); 154.35 (1С, Аr 1); 155.66, 157.47, 158.79 (1С, гуанидин, IV'', IV', IV); 177.26 (1С, Аr 2); 180.60 (1С, АrСООН). По соотношению интегральных интенсивностей сигналов алифатических (27.36– 42.57 м.д., 6С) к ароматическим (101.62–180.60 м.д., 7С) атомам углерода рассчитана степень замещения на аминосалицилат в ОГМГ-Гас, которая составляет не менее 95.1%.
По методике [8], разработанной ранее с участием авторов этой статьи, для образцов синтезированных солей ОГМГ с органическими кислотами на основании данных спектров ЯМР 13С были определены среднечисловая молекулярная масса Mn, содержание концевых гуанидиновых ([гуанидин]конц) и гексаметилендиаминовых ([ГМДА]конц) остатков, а также среднее количество разветвлений на молекулу ОГМГ (z). Результаты расчетов представлены в табл. 2. Из таблицы видно, что молекулярная масса полученных солей несколько выше, чем молекулярная масса исходного ОГМГ-Гх. Однако, судя по тому, что концентрация концевых групп и среднее число разветвлений на молекулу остаются примерно постоянными, а также учитывая мягкие условия синтеза, можно считать, что возрастание Mn происходит за счет потери низкомолекулярных фракций при очистке синтезированного образца путем переосаждения его в водно-этанольной смеси.
Таблица 2.
Молекулярно-массовые характеристики образцов солей ОГМГ
| • НА остаток кислоты |
Mn | [Гуанидин]конц., мас. % | [ГМДА]конц., мас. % | z, экв/моль |
|---|---|---|---|---|
| • НСl Гидрохлорид |
951 | 1.90 | 0.57 | 0.47 |
• Гидросалицилат |
1298 | 2.14 | 0.35 | 0.49 |
• Гидро-4-аминосалицилат |
1103 | 1.95 | 0.51 | 0.48 |
• Гидро-5-сульфосалицилат |
1345 | 2.47 | 0.18 | 0.61 |
Ранее [7] методом ДСК было установлено, что химическое взаимодействие между органическими солями ОГМГ и эпоксидными олигомерами начинается при более низких значениях температуры, чем химическое взаимодействие эпоксидных олигомеров с гидрохлоридом ОГМГ. Исходя из этого, модификацию эпоксидного олигомера целесообразно проводить путем его предварительного взаимодействия с органической солью ОГМГ, с последующим отверждением полученного аддукта амином. В рамках работы [7] показано, что синтезированный ОГМГ-Гс лучше растворим в эпоксидном олигомере, однако для введения достаточного количества фрагментов ОГМГ в общую эпоксиаминную сетку следует получать аддукты в среде растворителя – диметилсульфоксида.
Важной характеристикой, определяющей склонность системы к гелеобразованию при модификации, является средняя функциональность солей ОГМГ в реакциях с эпоксидным олигомером. Оценить этот показатель можно исходя из стехиометрического соотношения ОГМГ: эпоксидный олигомер, с учетом того факта, что для Epikote 828 fЭ = 1.99 [13]. В свою очередь, экспериментально установить это соотношение можно из данных ДСК по наибольшему тепловому эффекту, соответствующему стехиометрическому составу. Такой подход описан, например, в работе [14]. Зависимость теплового эффекта реакции между ОГМГ и эпоксидным олигомером от соотношения этих компонентов на примере ОГМГ-Гс представлена на рис. 5. Видно, что стехиометрическое соотношение Epikote 828 : ОГМГ-Гс = = 75 : 25 мас. % Учитывая эпоксиэквивалентную массу МЭ = Mn/fЭП, равную 188.9, это соотношение олигомеров соответствует средней эквивалентной массе ОГМГ в реакции с эпоксидным олигомером Mэкв = 62.7 г/экв. Учитывая, что для ОГМГ-Гс Mn = 1298 (табл. 2), можно оценить его среднюю функциональность как fОГМГ-Гс = Mn/Mэкв = = 20.7.
Напротив, исходя из структурной формулы ОГМГ и его молекулярно-массовых характеристик (табл. 2), можно оценить среднюю функциональность этого олигомера по конкретным реакционноспособным группам (табл. 3).
Таблица 3.
Средняя функциональность образца ОГМГ-гидросалицилата по реакционноспособным группам
| Группа | f |
|---|---|
| –NH2 концевая от ГМДА | 0.08 |
| –NH2 концевая от гуанидина | 0.28 |
| –NН– в неразветвленных звеньях | 16.62 |
| –NН– в разветвленных звеньях | 0.98 |
| –С=NН в разветвленных звеньях | 8.34 |
Учитывая заведомо более высокую реакционную способность концевых групп –NH2 по сравнению с остальными, можно считать, что реакция эпоксидных групп эпоксидного олигомера протекает, прежде всего, с их участием. Однако значение общей экспериментально определенной функциональности ОГМГ в реакции с эпоксидным олигомером (20.7) указывает на высокую вероятность реакции как по –NН– фрагментам цепи, так и, по-видимому, по –С=NН.
Контроль протекания химического взаимодействия между эпоксидным олигомером и ОГМГ был проведен методом ИК-спектроскопии. Типичные ИК-фурье-спектры реагирующих растворов эпоксидного олигомера с ОГМГ в ДМСО представлены на рис. 6. Анализ спектров также позволяет сделать вывод об участии в химическом процессе групп –N–Н (валентные колебания в области 3200–3400 см–1) и –C=NH (полоса 1682 см–1). К сожалению, ИК-спектроскопия в представленном варианте не позволяет разделить вклад групп –NH2, –NН– и –C=NH в обозначенные полосы и, таким образом, раздельно оценивать изменение концентрации этих групп при протекании химического процесса. Вместе с тем, ценную информацию о скорости химического процесса может дать хорошо разрешенная полоса поглощения эпоксидного цикла (деформационные колебания) при 960 см–1 (рис. 6, вставка). По изменению интенсивности этой полосы относительно базовой линии во времени можно рассчитать степень превращения эпоксидных групп:
где I0 и Ii – интенсивность полосы поглощения эпоксидной группы в начальный момент (t → 0) и в момент времени i.Рис. 6.
ИК-фурье-спектры реакционной смеси Epikote 828 : ОГМГ-Гс : ДМСО = 2 : 1 : 1 мас. доли при 25°С; на вставке – фрагмент ИК-фурье-спектров этой смеси. Время реакции 13 (1), 84 (2), 133 (3) и 1440 мин (4).

Рассчитанная по этому выражению степень превращения закономерно возрастает со временем синтеза (рис. 7), однако в координатах кинетического уравнения псевдопервого порядка (рис. 7, вставка) можно выделить, по крайней мере, три участка с постоянной скоростью реакции. Весьма вероятно, что такая трехстадийность обусловлена преимущественным протеканием на каждой стадии различных химических реакций, связанных с разными реагирующими функциональными группами ОГМГ.
Рис. 7.
Кинетическая зависимость степени превращения эпоксидных групп при синтезе аддукта в смеси Epikote 828 : : ОГМГ-Гс : ДМСО = 2 : 1 : 1 мас. доли при 25°С; на вставке – полулогарифмическая анаморфоза этой зависимости.
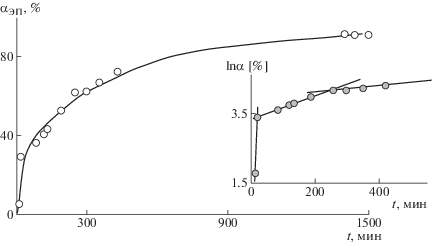
Согласно экспериментальным результатам (рис. 7), при 22 ± 2°С химическое взаимодействие ОГМГ и эпоксидного олигомера завершается примерно за сутки, причем для соотношения ОГМГ : эпоксидный олигомер = 25 : 75 мас. % предельно достигаемая степень превращения эпоксидных групп составляет ~90%. Следовательно, во избежание гелеобразования в процессе синтеза аддукта содержание ОГМГ в реакционной смеси с эпоксидным олигомером должно составлять как можно меньше, однако быть достаточным для проявления биоцидной активности в дальнейшем.
Продуктами синтеза при низком содержании ОГМГ по отношению к эпоксидному олигомеру являются вязкие прозрачные, слегка желтоватые аддукты, которые хорошо совмещаются и с исходным эпоксидным олигомером, и с аминным отвердителем. Некоторые из них были отверждены стехиометрическим количеством аминного отвердителя Jeffamine D-230 [7] с получением свободных эпоксиаминных пленок, ковалентно модифицированных 5 мас. % гидросалицилата, гидро-5-сульфосалицилата или гидро-4-аминосалицилата ОГМГ. По данным ДСК, температура стеклования всех этих пленок ниже 25°С, что указывает на эластифицирующий эффект ОГМГ.
Для полученных пленок была оценена биологическая активность по отношению к Mycobacterium smegmatis. Эти микобактерии представляют собой непатогенные и быстрорастущие микроорганизмы, что позволяет использовать их в качестве модели других микобактерий, в том числе Mycobacterium tuberculosis, являющихся возбудителями туберкулеза. На основании данных табл. 4 можно сделать вывод, что для эпоксиаминной пленки, модифицированной ОГМГ-Гс и ОГМГ-Гсс, активность по отношению к микобактериям в течение 4 суток падает достаточно быстро. Такое действие может быть связано как с особенностью M. smegmatis, обладающих специфической клеточной стенкой, так и с распределением в эпоксиаминной пленке фрагментов полимерной цепи модификатора ОГМГ. Более основательные выводы по результатам и причинам действия модифицированной ОГМГ эпоксиаминной пленки можно будет сделать после детальной характеристики образцов и количественной оценки их влияния на микроорганизмы.
Таблица 4.
Биологическая активность эпоксиаминных пленок по отношению к M. smegmatis (“АТСС 607”)
| Модификатор эпоксиаминной системы | Биологическая активность, % | |
|---|---|---|
| через 48 ч | через 96 ч | |
| Гидросалицилат ОГМГ | >98 | 25 |
| Гидро-5-сульфосалицилат ОГМГ | 75 | 50 |
| Гидро-5-аминосалицилат ОГМГ | >98 | >98 |
| Без модификатора | 0 | 0 |
В отличие от эпоксиаминной пленки, ковалентно модифицированной ОГМГ-Гс и ОГМГ-Гсс, ковалентная модификация ОГМГ-Гас обеспечивает практически полную дезактивацию M. smegmatis. Невысокая концентрация модификатора и его малая подвижность в эпоксиаминной сетке, по сравнению с раствором, указывают на ингибирование роста клеток, а не на бактерицидное действие поверхности пленки. Проявление бактериостатической активности, очевидно, связано с наличием в образце остатка 4-аминосалициловой кислоты, которая известна в качестве противотуберкулезного препарата. В этой связи, для M. smegmatis, очень близкой по строению клеточной стенки к Mycobacterium tuberculosis, вполне можно ожидать аналогичного действия. Кроме того, следует отметить, что соли 4-аминосалициловой кислоты обычно применяют в отношении активно размножающихся микобактерий туберкулеза [15] в комбинации с другими противотуберкулезными средствами первого ряда (например, стрептомицин, изониазид [16, 17]). Такое сочетание значительно тормозит развитие резистентности к активным веществам, а следовательно, повышает эффективность действия комбинированных препаратов.
Таким образом, предварительные результаты испытаний образцов свидетельствуют, что эпоксиаминные пленки, ковалентно модифицированные ОГМГ, могут приобретать биоцидные свойства не только из-за присутствия ОГМГ, но и остатка кислоты, которая образует с ним соль. Целенаправленный синтез подобных материалов следует проводить с учетом природы кислотного остатка и его распределения в полимерной матрице.
ЗАКЛЮЧЕНИЕ
Для повышения стойкости эпоксиаминных материалов к действию патогенных микроорганизмов в их состав был введен реакционноспособный модификатор – олигогексаметиленгуанидин. Для улучшения его растворимости в эпоксиаминных системах впервые получены, выделены и охарактеризованы его соли с салициловой, 5-сульфосалициловой и 4-аминосалициловой кислотами. Показано, что реакцию эпоксидных олигомеров с этими солями можно проводить при более низких значениях температуры, чем с исходным гидрохлоридом олигогексаметиленгуанидина. Определение оптимальных условий этой реакции позволило получить вязкотекучие аддукты эпоксидного олигомера и олигогексаметиленгуанидина, а после их отверждения олигооксипропилендиамином – эластичные пленки. Установлено, что наиболее выраженную активность по отношению к модельным микроорганизмам Mycobacterium smegmatis имеют пленки, модифицированные гидро-4-аминосалицилатом олигогексаметиленгуанидина.
Авторы выражают благодарность Е.К. Уродковой (ИФХЭ РАН) за содействие в измерении ИК-фурье-спектров, а также за возможность использования при проведении экспериментов оборудования ЦКП ИФХЭ РАН.
Работа выполнена по заданию Министерства науки и высшего образования РФ. Кроме того, авторы благодарят за финансовую поддержку Российский фонд фундаментальных исследований (проект 18-08-0125А).
Список литературы
Epoxy polymers. New Materials and Innovations / Eds. by J.-P. Pascault, R.J.J. Williams. Weinheim: Wiley-VCH, 2010.
Petrie E.M. Epoxy Adhesive Formulations. New York: McGraw-Hill, 2006.
Fink J.K. // Reactive Polymers – Fundamentals and Applications. Norwich: William Andrew Publ., 2005. P. 139.
Хозин В.Г. Усиление эпоксидных полимеров. Казань: Дом печати, 2004.
Зайцев Ю.С., Кочергин Ю.С., Пактер М.К., Кучер Р.В. Эпоксидные олигомеры и клеевые композиции. Киев: Наукова думка, 1990.
Senchikhin I.N., Zhavoronok E.S., Matveev A.V., Uryupina O.Ya., Roldughin V.I. // Colloid J. 2018. V. 80. № 3. P. 324.
Zhavoronok E.S., Sedishev I.P., Safonov A.V., Senchikhin I.N. // Polymer Science A. 2019. V. 61. № 5. P. 610.
Kedik S.A., Bocharova O.A., An H.K., Panov A.V., Sedishev I.P., Zhavoronok E.S., Timofeeva G.I., Suslov V.V., Beksaev S.G. // Pharm. Chem. J. 2010. V. 44. № 10. P. 568.
Салина Е.Г. Дис. … канд. биол. наук. М.: Институт биохимии им. А.Н. Баха, 2006.
Casali N., Nikolayevskyy V., Balabanova Ya., Harris S.R., Ignatyeva O., Kontsevaya I., Corander Ju., Bryant J., Parkhill Ju., Nejentsev S., Horstmann R.D., Brown T., Drobniewski F. // Nature Genetics. 2014. V. 46. P. 279.
Микобактерии // Европейская фармакопея на русском языке. М.: Группа ремедиум, 2015. С. 235. Т. 1.
Kedik S.A., Shatalov D.O., Isaykina P.M., Askretkov A.D., Sedishev I.P., Panov A.V., Evseeva A.S. // Pharm. Chem. J. 2017. V. 51. № 9. P. 773.
Энтелис С.Г., Евреинов В.В., Кузаев А.И. Реакционноспособные олигомеры. М.: Химия, 1985.
Garcia F.G., da Silva P.M., Soares B.G., Briones J.R. // Polym. Testing. 2007. V. 26. P. 95.
Sun Zh., Zhang J., Zhang X., Wang S., Zhang Y., Li Ch. // Int. J. Antimicrob. Agents. 2008. T. 31. № 2. P. 115.
Иванов А.К. Туберкулез. Особенности течения, возможности фармакотерапии. СПб.: Санкт-Петербургская гос. мед. акад. им. И.И. Мечникова, 2009.
Борисов С.Е., Соколова Г.Б. // Consilium Medicum. 2001. Т. 3. № 12. С. 595.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)