Высокомолекулярные соединения (серия Б), 2021, T. 63, № 1, стр. 16-24
СОПОЛИАРИЛЕНФТАЛИДЫ ДИФЕНИЛОКСИДНОГО РЯДА С РАЗНЫМ СООТНОШЕНИЕМ ФТАЛИДНЫХ И ДИФТАЛИДНЫХ ГРУПП
Т. А. Янгиров a, Б. М. Абдуллин a, А. А. Фатыхов a, Е. М. Захарова a, b, С. Н. Салазкин c, В. А. Крайкин a, *
a Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, пр. Октября, 69, Россия
b Башкирский государственный университет
450076 Уфа, ул. Заки Валиди, 32, Россия
c Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: kraikin@anrb.ru
Поступила в редакцию 04.03.2020
После доработки 17.07.2020
Принята к публикации 27.08.2020
Аннотация
Интербисополиконденсацией 3,3'-бис-(4-феноксифенил)-3,3'-дифталида и дифенилоксида с интермономером – псевдодихлорангидридом 4,4'-бис-(2-карбоксибензоил)дифенилоксида, протекающей по механизму электрофильного замещения Фриделя–Крафтса, синтезирован ряд новых сополиариленфталидов дифенилоксидного ряда с различным соотношением фталидных и дифталидных групп в полимерной цепи. Показано, что соотношение дифталидных (мезо- и рацемических) и обычных фталидных групп в основной цепи существенно влияет на морфологическую структуру сополимеров. Обнаружена побочная реакция “перефталидирования”, заключающаяся в каталитическом расщеплении дифталидной группы с образованием двух фталоильных карбкатионов, которые наряду с интермономером взаимодействуют с дифенилоксидом, участвуя в полимеробразующей реакции.
ВВЕДЕНИЕ
Один из широко применяемых подходов к созданию полимерных материалов с заданными характеристиками основан на синтезе статистических сополимеров, свойства которых можно регулировать, меняя мольные соотношения исходных мономеров. При поликонденсационном способе синтеза сополимеров наиболее часто используют реакцию интербисополиконденсации [1] двух (или более) сомономеров, не вступающих в реакцию между собой, но реагирующих с интермономером. По такой схеме осуществлен синтез и изучены структурные, термические, механические, оптические и некоторые другие характеристики широкого круга статистических полигетероариленов: сополиариленкетонов [2], ароматических сополикарбонатов (в смесях с полистиролом) [3], сополиамидов [4], сополиариленэфирнитрилов [5], сополиариленэфирсульфонов [5–10].
Среди других классов полигетероариленов значительное место занимают полиариленфталиды (ПАФ), в которых высокие тепло-, термо- и хемостойкость, а также механическая прочность и необычные электрофизические свойства [11–20] сочетаются с хорошей растворимостью в широком круге органических растворителей. Сополиариленфталиды (как и все ПАФ вообще), обладающие в субмикронных пленках металлической и полупроводниковой проводимостью, были использованы для модификации поверхности электродов в системе химического распознавания “электронный язык”, где проявили различную склонность к адсорбции лекарственных аналитов [21–23].
Реакция электрофильного замещения Фриделя–Крафтса, которую применяют для получения ПАФ поликонденсацией мономеров с разнотипными взаимодействующими (псевдомонохлорангидриды о-ароилбензойных кислот) и однотипными невзаимодействующими (псевдодихлорангидриды о-дикетокарбоновых кислот) реакционными центрами, приводит к образованию полимеров, построенных по типу “голова к хвосту” [24–26]. В синтезируемых таким способом ПАФ, а также во всех фталидсодержащих полигетероариленах, получаемых на основе фенолфталеина и его производных [27–29], фталидная группировка регулярно чередуется с ароматическими (гетероароматическими) фрагментами основной цепи (Ar) и связана с ними через свой узловой четвертичный атом углерода связью sp3–sp2. В таких ПАФ ариленфталидные фрагменты с разным конфигурационным строением, из-за свободного вращения вокруг связи sp3–sp2 конформационно не различимы, и все свойства полимеров определяются преимущественно химическим строением ароматических фрагментов основной цепи.
Недавно нами был разработан метод синтеза полиарилендифталидов (ПАДФ) – нового класса фталидсодержащих полигетероариленов [30–32]. В таких полимерах с Ar чередуется не одна изолированная фталидная группа (как в традиционных полиариленфталидах), а две смежные фталидные группы, связанные между собой через узловые четвертичные атомы углерода связью sp3–sp3, вращение вокруг которой стерически затруднено, а ее длина из-за электростатического отталкивания карбонильных и простых эфирных атомов кислорода, увеличена. По этим причинам ПАДФ в отличие от аморфных ПАФ склонны к упорядочению и кристаллизации и начинают разлагаться при температуре на 100°С ниже, чем ПАФ. Такое различие в свойствах ПАФ и ПАДФ открывает путь к созданию ариленфталид-арилендифталидных сополимеров с регулируемыми морфологической структурой, физико-механическими и термическими характеристиками.
В настоящей работе нами осуществлен синтез широкого круга сополиариленфталидов дифенилоксидного ряда с разным соотношением ариленфталидных и арилендифталидных звеньев различного конфигурационного и конформационного строения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для введения в полимерные цепи сополиариленфталидов дифталидных групп в качестве одного из сомономеров использовали 3,3'-бис-(4-феноксифенил)-3,3'-дифталид (I), который получали по методу Батта [33] и применяли в виде смеси мезо- и рацемического диастереоизомеров [34] без их предварительного разделения:

Интермономером служил псевдодихлорангидрид 4,4'-бис-(2-карбоксибензоил)дифенилоксида (II), который получали кипячением 4,4'-бис-(2-карбоксибензоил)дифенилоксида в чистом хлористом тиониле [35] (способ 1) или в смеси тионилхлорида с дихлорэтаном (способ 2):

Поликонденсацию 3,3'-бис-(4-феноксифенил)-3,3'-дифталида и дифенилоксида, взятых в разном соотношении, с дихлорангидридом 4,4'-бис-(2-карбоксибензоил)дифенилоксида осуществляли при 100, 90, 80 и 70°С в нитробензоле, используя в качестве катализатора SbCl5:

Состав и молекулярно-массовые характеристики образцов ПАФ приведены в табл. 1.
Таблица 1.
Условия получения и характеристики полимеров ПАФ-1–ПАФ-12
| Полимер | p : q | Температура синтеза, °С | Mw × 10–3 | Ð | Свойства пленок | |
|---|---|---|---|---|---|---|
| σp, МПа | εp, % | |||||
| Синтез на основе дихлорангидрида, полученного по способу 2 | ||||||
| ПАФ-1 | 1 : 0 | 70 | 34.8 | 3.7 | 30.8 | 1.19 |
| ПАФ-2 | 10 : 1 | 70 | 70.7 | 3.9 | 63.5 | 2.19 |
| ПАФ-3 | 4 : 1 | 70 | 30.0 | 3.4 | 33.4 | 1.18 |
| ПАФ-4 | 2 : 1 | 70 | 72.8 | 3.1 | 35.5 | 1.22 |
| ПАФ-5 | 1 : 1 | 70 | 99.3 | 3.6 | 46.7 | 1.51 |
| ПАФ-6 | 1 : 2 | 70 | 33.6 | 2.4 | 51.5 | 1.69 |
| ПАФ-7 | 1 : 4 | 70 | 26.8 | 2.2 | 64.7 | 2.47 |
| ПАФ-8 | 1 : 7 | 70 | 84.2 | 6.3 | 87.1 | 4.83 |
| ПАФ-9 | 1 : 10 | 70 | 33.9 | 3.6 | 90.9 | 4.05 |
| ПАФ-10 | 1 : 15 | 70 | 17.4 | 2.2 | 27.3 | 0.73 |
| ПАФ-11 | 1 : 20 | 70 | 13.1 | 2.3 | 75.2 | 5.96 |
| ПАФ-12 | 0 : 1 | 70 | 25.7 | 2.9 | 73.5 | 4.01 |
| Синтез на основе дихлорангидрида, полученного по способу 1 | ||||||
| ПАФ-1 | 1 : 0 | 80 | 27.6 | 2.5 | Хрупкая | |
| ПАФ-2 | 10 : 1 | 90 | 50.0 | 2.8 | Хрупкая | |
| ПАФ-3 | 4 : 1 | 90 | 20.0 | 1.8 | Хрупкая | |
| ПАФ-4 | 2 : 1 | 90 | 7.7 | 1.9 | Хрупкая | |
| ПАФ-5 | 1 : 1 | 90 | 30.0 | 2.3 | Хрупкая | |
| ПАФ-6 | 1 : 2 | 90 | 11.4 | 3.2 | Хрупкая | |
| ПАФ-7 | 1 : 4 | 90 | 26.0 | 2.4 | Хрупкая | |
| ПАФ-8 | 1 : 7 | 70 | 26.8 | 2.7 | 80.9 | 4.08 |
| ПАФ-8 | 1 : 7 | 80 | 80.0 | 2.9 | 75.5 | 5.05 |
| ПАФ-9 | 1 : 10 | 70 | 22.1 | 2.4 | 87.1 | 4.20 |
| ПАФ-9 | 1 : 10 | 90 | 52.0 | 6.0 | 73.3 | 4.47 |
| ПАФ-10 | 1 : 15 | 70 | 22.2 | 2.6 | 47.4 | 1.95 |
| ПАФ-11 | 1 : 20 | 70 | 16.2 | 2.3 | 26.2 | 1.15 |
| ПАФ-11 | 1 : 20 | 80 | 75.0 | 3.6 | 70.9 | 3.86 |
| ПАФ-12 | 0 : 1 | 90 | 40.0 | 5.7 | 16.9 | 1.11 |
Пробный синтез регулярно-чередующегося сополимера ПАФ-1 (p:q = 1:0) показал, что при 100°С образуется около 50% нерастворимой гель-фракции. Понижение температуры до 90°С и ниже (80 и 70°С) привело к образованию полностью растворимых образцов, растворы которых из-за присутствия частиц микрогеля опалесцировали. В наименьшей степени опалесценция характерна для образцов, синтезированных при 70°С с использованием дихлорангидрида, полученного по способу 2. При прибавлении к 2–4%-ным растворам таких полимеров в хлороформе этилового спирта в количестве 10% от объема раствора частицы микрогеля начинают коагулировать, и в течение 1 суток выпадают в осадок. Содержание микрогеля, который может быть отделен фильтрованием через мембранный фильтр, в сополимерах, полученных при этой температуре, не превышает 1–2%. В образцах, синтезированных с применением дихлорангидрида, полученного по способу 1, отделить микрогель не удалось.
По данным ЯМР 13С, макромолекулы синтезированных сополимеров построены из двух типов звеньев: p-звеньев, содержащих одиночные (α) и смежные фталидные группы, либо рацемической (β), либо мезо- (γ) конфигурации и q-звеньев, содержащих только α-фталидные группы.

На рис. 1 приведены фрагменты спектров низкомолекулярных модельных соединений и полимеров, содержащих сигналы sp3-гибридизированных атомов углерода C3 во фталидных группах всех трех типов (α, β и γ). В спектрах рацемического и мезо-диастереоизомеров 3,3'-бис-(4-феноксифенил)-3,3'-дифталида и полиарилендифталида (ПАДФ-1) [30] данные атомы резонируют, соответственно, при δС = 90.6 (3β) и 90.0 (3γ) м.д. (рис. 1).
Рис. 1.
Сигналы атомов С3 фталидных групп рацемического (1) и мезо- (2) 3,3'-бис-(4-феноксифенил)-3,3'-дифталида, а также полимеров ПАДФ-1 (3), ПАФ-12 (4) и ПАФ-1 (5).
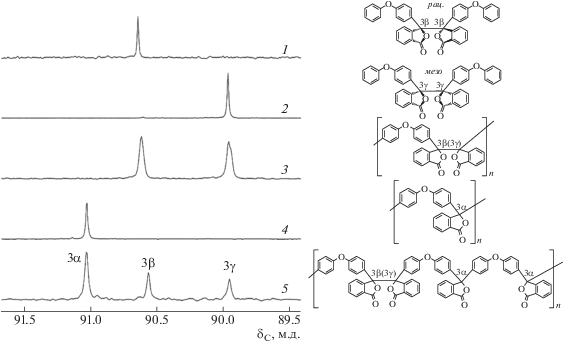
В спектре полимера ПАФ-12, содержащего в основной цепи только α-фталидные группы, в наблюдаемой области содержится единственный сигнал при δС = 91.0 м.д. (3α). В случае ПАФ-1–ПАФ-11, имеющих все типы фталидных групп, регистрируются три сигнала.
Сопоставление интенсивностей рассмотренных выше сигналов показало, что состав образующихся сополимеров не соответствует составу исходной мономерной смеси: в сополимерах содержание β- и γ-фталидных групп всегда ниже, а α-фталидных групп – выше (рис. 2). Отношение величины α/(β + γ) в сополимерах, синтезированных при 70°С, к величине α/(β + γ) в мономерных смесях не зависит от соотношения q/p и составляет ∼1.5. При повышении температуры синтеза отклонение состава сополимеров в сторону преобладания α-фталидных групп становится еще более выраженным (рис. 3).
Рис. 2.
Сигналы С3-атомов α-, β- и γ-фталидных групп сополимеров при p : q = 1 : 7 (1), 1 : 4 (2), 1 : 2 (3), 1 : 1 (4), 1 : 0.5 (5) и 1 : 0 (6).

Рис. 3.
Зависимость величины α/(β+γ) от отношения q : p в мономерных смесях (1) и соответствующих сополиариленфталидах, полученных при 70°C (2) и при 90°С (3).

Было сделано предположение о протекании побочной реакции “перефталидирования”, заключающейся в каталитическом расщеплении дифталидной группы с образованием двух фталоильных карбкатионов, которые наряду с интермономером взаимодействуют с дифенилоксидом, т.е. участвуют в полимеробразующей реакции.
Для проверки данного предположения была изучена модельная реакция 3,3'-бис-(4-феноксифенил)-3,3'-дифталида с дифенилоксидом в присутствии SbCl5. Было обнаружено, что при 90°С 3,3'-бис-(4-феноксифенил)-3,3'-дифталид в присутствии 300 мол. % пятихлористой сурьмы (по отношению к дифталиду) количественно реагирует с избытком дифенилоксида с образованием двух эквивалентов 3,3-ди-(4-феноксифенил)фталида:

В аналогичных условиях расщепление связи С3(sp3)–С3'(sp3) происходит и в полиариленди-фталиде ПАДФ-1, предположительно по следующей схеме:
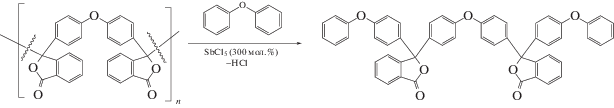
Эта реакция, не изученная ранее, будет предметом наших дальнейших исследований.
Свойства сополиариленфталидов
Все синтезированные сополимеры растворимы в хлороформе, хлористом метилене, дихлорэтане, тетрахлорэтане, хлорбензоле, ТГФ, N-метилпирролидоне, ДМФА, 1,4-диоксане, пиридине, циклогексаноне, бензиловом спирте, бензонитриле; набухают в бензоле, толуоле, ксилоле, ацетоне, ДМСО; не растворимы в уксусной кислоте, четыреххлористом углероде, ацетонитриле, этилацетате.
Состав заметно влияет на морфологию высаженных сополиариленфталидов. Сополимеры с преобладанием склонных к кристаллизации хиральных и мезо-дифталидых групп имеют пленочную морфологическую структуру (рис. 4а), а с преобладанием одиночных фталидных групп – волокнистую структуру, характерную для аморфных полиариленфталидов (рис. 4б).
Рис. 4.
Цифровые фотографии морфологической структуры сополиариленфталидов с p : q = 4 : 1 (а) и 1 : 15 (б), высажденных в метанол из 5%-ного раствора в хлороформе.

Закономерности в изменении физико-механических характеристик изученных сополиариленфталидов не обнаружены, что можно объяснить одновременным влиянием на эти характеристики не только состава сополимеров, но также их молекулярной массы и микроструктуры, которые изменяются с изменением соотношения q : p сложным образом. Сополимеры, синтезированные при 70°С, образуют пленки с прочностью на разрыв σp = 26.2–90.9 МПа и относительным удлинением εp = 1.15–5.96% (табл. 1). Образцы, полученные при 90°С и соотношении q : p ≤ 4, образуют хрупкие пленки. По всей видимости, повышение температуры синтеза приводит к увеличению доли реакции перефталидирования, которая может протекать и с образованием разветвленных структур. Ранее было показано, что формирование разветвленных структур при поликонденсации мономеров дифенилоксидного ряда происходит вследствие атаки активной концевой хлорангидридной группы на атом кислорода в основной цепи полимера с последующим появлением новых активных групп, взаимодействие которых с ароматическими фрагментами приводит к сшивке макромолекул и образованию гель-фазы [36].
Другой причиной хрупкого разрушения пленок, полученных из мономерных смесей с q : p ≤ 4, может являться высокое содержание в макромолекулах сополимеров двух смежных фталидных групп, связанных между собой простой связью, вращение вокруг которой стерически затруднено из-за сильного отталкивания электроотрицательных атомов кислорода [34]. Введение в полимерную цепь протяженных фрагментов с одиночными фталидными группами, соединенными с основной цепью связью С(sp2)–С(sp3) с низким потенциальным барьером вращения, способствует разворачиванию полимерных цепей. Сополимеры с преобладанием одиночных фталидных групп и при температуре синтеза 90°С образуют прочные пленки.
По данным динамического ТГА (табл. 2), наименьшую термостойкость (Тн.р. = 340°С в инертной среде и 290°С на воздухе) в ряду исследованных полимеров имеет ПАДФ-1, содержащий в полимерной цепи только дифталидные группы, а наибольшую – ПАФ-12 (Тн.р. = 460°С в инертной среде и 430°С на воздухе). При уменьшении содержания дифталидных групп и увеличении содержания одиночных фталидных групп наблюдается монотонное возрастание температур начала разложения сополимеров как в инертной среде, так и на воздухе. В инертной среде потеря массы на первой ступени разложения (декарбоксилирование лактонных циклов дифталидных групп) понижается от 5 до 0.5% по мере уменьшения удельного содержания дифталидных групп в сополимерах.
Таблица 2.
Термические свойства сополимеров
| Сополимер | Температура, °С | |
|---|---|---|
| начала разложения* | выгорания | |
| ПАДФ-1 | 340/290 | 820 |
| ПАФ-1 | 350/300 | 780 |
| ПАФ-2 | 350/300 | 770 |
| ПАФ-3 | 370/350 | 850 |
| ПАФ-4 | 390/350 | 870 |
| ПАФ-5 | 400/360 | 830 |
| ПАФ-6 | 410/410 | 880 |
| ПАФ-7 | 430/430 | 830 |
| ПАФ-8 | 440/430 | 790 |
| ПАФ-9 | 450/430 | 820 |
| ПАФ-10 | 450/430 | 850 |
| ПАФ-11 | 450/430 | 780 |
| ПАФ-12 | 460/430 | 780 |
Температура выгорания сополиариленфталидов при разложении на воздухе не имеет прямой зависимости от состава и изменяется в пределах 770–880°С. Термическое разложение сополимеров ПАФ-1–ПАФ-12 в инертной среде приводит к образованию коксового остатка, выход которого во всех случаях составляет ∼58%.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы
Нитробензол квалификации “х. ч.” сушили и хранили над молекулярными ситами 4A, перед применением перегоняли при пониженном (10 мм рт. ст.) давлении. Дифенилоксид (“х. ч.”) перегоняли при пониженном (10 мм рт. ст.) давлении. В работе использовали нейлоновые мембранные фильтры Supelco (диаметр 47 мм, поры 0.45 мкм).
Синтез мономеров и сополимеров
Псевдохлорангидрид 4,4'-бис-(2-карбоксибензоил)дифенилоксида (II) получали двумя способами.
Способ 1. В одногорлую колбу загружали 10 г 4,4'-бис-(2-карбоксибензоил)дифенилоксида (0.02 моля), добавляли 20 мл хлористого тионила и кипятили в течение 12 ч. Избыток тионилхлорида отгоняли сначала при атмосферном, затем при пониженном (10 мм рт. ст.) давлении. Окончательную осушку дихлорангидрида осуществляли в вакууме при 90°С в течение 6 ч.
Способ 2 аналогичен способу 1, но кипячение 4,4'-бис-(2-карбоксибензоил)дифенилоксида проводили в смеси хлористого тионила (10 мл) и дихлорэтана (10 мл).
Физико-химические константы дихлорангидрида соответствовали литературным данным [30].
Сополиариленфталиды ПАФ-1–ПАФ-12 синтезировали по следующей общей методике (в качестве примера описан синтез сополимера ПАФ-5). В подключенную к аргонной линии трехгорлую колбу, снабженную механической мешалкой и воздушным холодильником со счетчиком пузырьков, загружали 0.63565 г 3,3'-бис-(4-феноксифенил)-3,3'-дифталида (I) (1.055 ммоля), 0.17955 г дифенилоксида (1.055 ммоля), 1.06185 г дихлорангидрида (II) (2.110 ммоля) и 4.5 мл нитробензола. Реакционную смесь при перемешивании нагревали до 70–90°C и вносили 0.027 мл SbCl5 (0.21 ммоля), после чего перемешивание продолжали при постоянном токе аргона в течение 12 ч (при 70°C), или 10 ч (при 90°C). По окончании синтеза в реакционную массу добавляли сначала 2 мл ДМФА, затем 15 мл хлороформа, перемешивали и выливали в 5-кратный избыток спирта. Высаженный полимер отфильтровывали, промывали спиртом и сушили при 100°C до постоянной массы.
Полимеры ПАФ-1–ПАФ-11.
ИК-спектры, см–1 (пленка): 1776 (C=O), 1597, 1500, 1465, 1286, 1246, 1172, 1101, 1083, 1004, 994, 973, 930, 873, 833, 804, 756, 691.
Спектр ЯМР 1H, δH, м.д. (CDCl3): 6.74 (м, HAr), 6.84 (м, HAr), 6.93 (м, HAr), 7.27 (м, HAr), 7.35 (м, H7β), 7.45 (м, H7γ), 7.55 (м, HAr), 7.62–7.75 (м, HAr), 7.93 (м, H5α, 5β), 8.30 (м, H5γ).
Спектр ЯМР13С, δC, м.д.: 89.95 (C3γ), 90.55 (C3β), 91.03 (C3α), 118.23 (CAr), 118.45 (CAr), 118.58 (CAr), 118.76 (CAr), 123.98 (C5α), 124.19 (C5β), 124.97 (C5γ), 125.35 (C8α), 125.59 (C8γ), 125.68 (C8β), 125.80 (C9β), 126.11 (C9α, 9γ), 128.21 (CAr), 128.51 (CAr), 128.64 (CAr), 128.69 (CAr), 128.73 (CAr), 128.79 (CAr), 129.52 (C7α), 129.88 (C7γ), 129.94 (C7β), 131.76 (CAr), 134.35 (C6α), 134.43 (C6γ), 134.76 (C6β), 135.70 (CAr), 135.84 (CAr), 148.55 (C4β), 148.85 (C4γ), 151.87 (C4α), 156.58 (CAr), 156.81 (CAr), 156.91 (CAr), 157.03 (CAr), 168.22 (C1γ), 168.95 (C1β), 169.54 (C1α).
Полимер ПАФ-12.
ИК-спектр, см–1 (пленка): 1772 (C=O), 1597, 1500, 1465, 1286, 1245, 1171, 1101, 1084, 1014, 973, 929, 855, 756, 691.
Спектр ЯМР 1H, δH, м.д.: 6.93 (м, 4H, HAr), 7.28 (м, 4H, HAr), 7.56 (м, 2H, H6α, 8α), 7.70 (м, 1H, H7α), 7.93 (м, 1H, H5α).
Спектр ЯМР13С, δC, м.д.: 91.03 (C3α), 118.76 (CAr), 123.98 (C5α), 125.37 (C8α), 126.09 (C9α), 128.77 (CAr), 129.53 (C7α), 134.35 (C6α), 135.84 (CAr), 151.87 (C4α), 156.92 (CAr), 169.53 (C1α).
Модельная реакция расщепления 3,3'-бис-(4-феноксифенил)-3,3'-дифталида (I)
В трехгорлую колбу, снабженную механической мешалкой, воздушным холодильником со счетчиком пузырьков и подключенную к аргонной линии, загружали 0.54 г соединения I (0.9 ммоля), 4.6 г дифенилоксида (27 ммоля) и 8 мл нитробензола. Реакционную смесь при перемешивании нагревали до 90°C, вносили 0.345 мл SbCl5 (2.7 ммоля) и продолжали перемешивать при данной температуре при постоянном токе аргона. После окончания выделения хлороводорода реакционную смесь выливали в воду и отгоняли избыток дифенилоксида и нитробензола с водяным паром. Остаток сушили на воздухе, растворяли в хлороформе и отфильтровывали через мембранный фильтр, фильтрат упаривали.
Аналогичным образом проводили расщепление полимера ПАДФ-1.
Температуры плавления и ЯМР-спектры полученных 3,3-ди-(4-феноксифенил)фталида и 4,4′-бис-[3-(4-феноксифенил)-3-фталидил]дифенилоксида совпадали с приведенными в литературе [37].
Приборы и методы исследования
Спектры ЯМР 1H и ЯМР13С регистрировали на спектрометре “BrukerAvance III” (“Bruker”, Германия) при 500 и 126 МГц соответственно, в CDCl3, внутренний стандарт – CHCl3. ИК-спектры записывали на приборе “Shimadzu IR Prestige-21” (“Shimadzu”, Япония) в пленке. Молекулярную массу полимеров определяли методом гель-проникающей хроматографии с калибровкой по полистиролу на высокоэффективном жидкостном хроматографе “Shimadzu” (Япония), оснащенным тремя колонками, проточным дегазатором, дифференциальным рефрактометрическим и вискозиметрическим детекторами. Хроматографию проводили в ТГФ при 35°C и скорости потока 1 мл/мин. Термогравиметрический анализ выполняли на дериватографе “MOM Q-1000” (MOM, Венгрия) при скорости нагревания 5 град/мин на воздухе и в инертной среде. Пленки полимеров получали поливом их раствора в хлористом метилене на целлофановую подложку; после испарения растворителя пленки сушили в вакууме при повышении температуры от 60 до 80°С в течение 10 ч, затем при 120°С в течение 24 ч. Испытания по растяжению образцов пленок проводили на универсальной испытательной машине “SHIMADZU AGS-X” (“Shimadzu”, Япония). Ширина испытуемой части ∼5.0 мм, толщина от ∼0.046 мм. Расстояние между зажимами 50 мм, тип зажимов – тисочные, прорезиненные, скорость растяжения – 1 мм/мин.
Спектры ЯМР и ИК регистрировали на оборудовании Центра коллективного пользования “Химия” Уфимского института химии Уфимского федерального исследовательского центра Российской академии наук.
Работа выполнена согласно Госзаданию (регистрационные номера АААА-А20-120012090020-7 и AAAA-A20-120012090029-0).
Список литературы
Korshak V.V., Vinogradova S.V., Kuchanov S.I., Vasnev V.A. // J. Macromol. Sci., Polym. Rev. 1976. V. 14. № 1. P. 27.
Attwood T.E., Dawson P.C., Freeman J.L., Hoy L.R.J., Rose J.B., Staniland P.A. // Polymer. 1981. V. 22. P. 1096.
Penco M., Sartore L., Sciucca S.D., Landro L.D. // Int. J. Polym. Mater. 2006. V. 55. P. 1027.
Valieva I.A., Goikhman M.Y., Podeshvo I.V., Loretsyan N.L., Gofman I.V., Smyslov R.Y., Litvinova L.S., Yakimansky A.V. // Polymer Science B. 2019. V. 61. № 3. P. 302.
Hu W., You Y., Tong L., Tu L., Wang Y., Wei R., Liu X. // High. Perform. Polym. 2019. V. 31. № 6. P. 686.
Pu Z., Zheng X., Xia J., Zhong J. // Polym. Int. 2020. V. 69. P. 604.
Wang F., Hickner M., Kim Y.S., Zawodzinski T.A., McGrath J.E. // J. Membr. Sci. 2002. V. 197. P. 231.
Oroujzadeh M., Mehdipour-Ataei S., Esfandeh M. // Eur. Polym. J. 2013. V. 49. № 6. P. 1673.
Harrison W.L., Hickner M.A., Kim Y.S., McGrath J.E. // Fuel Cells. 2005. V. 5. № 2. P. 201.
Wang S., He F., Weng Q., Yuan D., Chen P., Chen X., An Z. // RSC Adv. 2020. V. 10. P. 24772.
Salazkin S.N., Shaposhnikova V.V., Machulenko L.N., Gileva N.G., Kraikin V.A., Lachinov A.N. // Polymer Science A. 2008. V. 50. № 3. P. 243.
Lachinov A.N., Vorob’eva N.V. // Phys.-Uspekhi. 2006. V. 49. № 12. P. 1223.
Vorob'eva N.V., Lachinov A.N. // Bull. Russ. Acad. Sci. Phys. 2013. V. 77. № 10. P. 1238.
Yusupov A.R., Rakhmeev R.G., Lachinov A.N., Kalimullina L.R., Nakaryakov A.S., Bunakov A.A. // Phys. Solid State. 2013. V. 55. № 7. P. 1494.
Gadiev R.M., Lachinov A.N., Galiev A.F., Kalimullina L.R., Nabiullin I.R. // JETP Lett. 2014. V. 100. № 4. P. 251.
Shalygina E.E., Kharlamoa A.M., Makarova A.V., Kaminskaya T.P., Shalygin A.N. // Phys. Solid State. 2018. V. 60. № 9. P. 1737.
Lezhnev S.K., Yusupov A.R., Galiev A.F., Kornilov V.M., Gadiev R.M., Lachinov A.N. // JETP Lett. 2019. V. 110. № 7. P. 447.
Nabiullin I.R., Gadiev R.M., Lachinov A.N. // Phys. Solid State. 2019. V. 61. № 6. P. 1122.
Yusupov A.R., Lachinov A.N., Kalimullina L.R., Gadiev R.M., Nikitina D.V. // Phys. Solid State. 2019. V. 61. № 3. P. 450.
Salikhov R.B., Lachinov A.N., Rakhmeev R.G., Gadiev R.M., Yusupov A.R., Salazkin S.N. // Meas. Tech. 2009. V. 52. № 4. P. 427.
Zil’berg R.A, Yarkaeva Yu.A., Maksyutova E.I., Sidel’nikov A.V., Maistrenko V.N. // J. Anal. Chem. 2017. V. 72. № 4. P. 402.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Y.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. // Electroanalysis. 2018. V. 30. № 4. P. 619.
Zil’berga R.A., Maistrenko V.N., Yarkaeva Yu.A., Dubrov-skii D.I. // J. Anal. Chem. 2019. V. 74. № 12. P. 1245.
Salazkin S.N. // Polymer Science B. 2004. V. 46. № 7–8. P. 203.
Vinogradova S.V., Vasnev V.A., Vygodskii Ya.S. // Russ. Chem. Rev. 1996. V. 65. № 3. P. 249.
Vinogradova S.V., Vasnev V.A. // Russ. Chem. Rev. 2004. V. 73. № 5. P. 487.
Sapozhnikov D.A., Vygodskii Ya.S. // Polymer Science B. 2015. V. 57. № 4. P. 275.
Виноградова С.В., Васнев В.А. Поликонденсационные процессы и полимеры. М.: Наука, 2000.
Бюллер К.-У. Тепло- и термостойкие полимеры / Пер. с нем. Н.В. Афанасьева, Г.М. Цейтлина. М.: Химия, 1984.
Kraikin V.A., Yangirov T.A., Fatykhov A.A., Ivanova V.P., Sedova E.A., Gileva N.G., Ionova I.A. // High. Perform. Polym. 2017. V. 29. № 6. P. 677.
Пат. 2631502 Россия. 2017.
Пат. 2634729 Россия. 2017.
Bhatt M.V., Kamath K.M., Ravindranathan M. // J. Chem. Soc. C. 1971. P. 3344.
Yangirov T.A., Fatykhov A.A., Sedova E.A., Khalilov L.M., Meshcheryakova E.S., Ivanov S.P., Salazkin S.N., Kraikin V.A. // Tetrahedron. 2019. V. 75. № 9. P. 1282.
Wolfe J.F., Stille J.K. // Macromolecules. 1976. V. 9. № 3. P. 489.
Золотухин М.Г., Скирда В.Д., Сундуков В.И., Салазкин С.Н., Седова Э.А., Миндияров Х.Г., Рафиков С.Р. // Высокомолек. соед. Б. 1987. Т. 29. № 5. С. 378.
Gileva N.G., Nosovskaya I.I., Fatykhov A.A., Salazkin S.N., Kraikin V.A. // Russ. J. Org. Chem. 2019. V. 55. № 2. P. 174.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


