Высокомолекулярные соединения (серия Б), 2021, T. 63, № 2, стр. 131-137
ВЛИЯНИЕ УСЛОВИЙ СИНТЕЗА НА ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПОЛИ-2-[(2E)-1-МЕТИЛ-2-БУТЕН-1-ИЛ]АНИЛИНА
А. Н. Андриянова a, b, *, Д. Э. Грибко a, И. Н. Муллагалиев a, Р. Б. Салихов a, А. Г. Мустафин a, b
a Башкирский государственный университет
450076 Уфа, ул. Заки Валиди, 32, Россия
b Уфимский Институт химии УФИЦ Российской академии наук
450054 Уфа, пр. Октября, 71, Россия
* E-mail: an.chem17@gmail.com
Поступила в редакцию 08.07.2020
После доработки 28.11.2020
Принята к публикации 11.12.2020
Аннотация
Синтезирован новый полимер – поли-2-(1-метилбут-2-ен-1-ил)анилин с использованием допирующих и окисляющих агентов. Рассмотрено влияние условия его получения на физико-химические свойства материалов. Исследованы морфология полимеров с помощью сканирующей электронной микроскопии, растворимость, ИК- и УФ-спектральные характеристики, также обнаружены фотолюминесцентные свойства. Установлена зависимость свойств полимера от природы допирующего агента. Показано, что применение FeCl3 как окислителя позволяет получить материал в допированном виде и с наибольшей интенсивностью люминесценции. Синтезированные полимеры были изучены в качестве активного материала в датчиках влажности.
ВВЕДЕНИЕ
Синтез новых функциональных электропроводящих полимеров привлекателен в научном и прикладном отношении из-за широкого применения их в качестве химических датчиков, топливных элементов, материалов для экранирования электромагнитного излучения, антикоррозионных покрытий [1–3]. Среди известных проводящих высокомолекулярных соединений полианилин (ПАНИ) выделяется своей высокой электропроводностью, отличной устойчивостью к окружающей среде и низкой стоимостью синтеза, что делает его перспективным объектом потенциального использования в электрохромных устройствах и светоизлучающих диодах [4, 5]. Как правило, ПАНИ получают путем окислительной полимеризации анилина под действием различных окислителей в присутствии неорганической или органической кислоты в качестве допирующего агента [6]. Однако ПАНИ отличает крайне низкая растворимость в большинстве органических растворителей, что существенно осложняет его применение. Для решения этой проблемы существует несколько подходов: во-первых, допирование ПАНИ неорганическими или органическими кислотами [7], во-вторых, полимеризация замещенных производных анилина [8], в-третьих, полимераналогичные преобразования [9] и, в-четвертых, сополимеризация анилина с соответствующими замещенными анилинами [10, 11]. Следует отметить, что производные ПАНИ с заданными характеристиками могут быть получены только путем тщательного подбора подходящих мономеров, окислителей, допирующего агента и условий проведения синтеза. В частности, морфология выделенного полимера, тесно связанная с его электропроводностью, контролируется синтезом, обработкой полимера, концентрацией и природой допирующего агента [12, 13]. Изменение условий кардинальным образом меняет физико-химические свойства образующегося полимера.
Использование замещенных мономеров анилина с последующим преобразованием их в высокомолекулярное соединение повышает растворимость полимера. Известно, что замещенные ПАНИ с алкильными, алкоксильными, полярными группами проявляют улучшенную растворимость [10, 11]. Важно, что наличие заместителя в ароматическом кольце полимера, содержащего двойную связь, позволяет в дальнейшем провести ряд модификаций, таких как полимераналогичные преобразования с формированием новых функциональных групп, вступая для этого в реакцию внутримолекулярной циклизации [14].
Целью настоящей работы является синтез нового полимера – поли-2-(1-метилбут-2-ен-1-ил)анилина с применением разных допирующих и окисляющих агентов, а также исследование влияния условия получения на физико-химические свойства полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мономер 2-(1-метилбут-2-ен-1-ил)анилин получали согласно ранее описанной методике, его ЯМР-спектры идентичны представленным ранее [10, 11].
Все полимерные образцы синтезировали по следующей методике. К раствору 1 г (6.2 ммоля) 2-(1-метилбут-2-ен-1-ил)анилина в 50 мл 0.2 моль/л водного раствора кислоты медленно добавляли раствор окислителя в 50 мл 0.2 моль/л кислоты (табл. 1) при комнатной температуре и постоянном перемешивании. Мольное соотношение мономер: окислитель для всех образцов составляло 1.0 : 1.25. Полимеризацию вели в течение 24 ч также при комнатной температуре и постоянном перемешивании. Для удаления побочных продуктов, таких как сульфат аммония, серная кислота, полимер многократно промывали дистиллированной водой и спиртом. Затем, отфильтрованный полимерный порошок сушили при 40°С в течение 3 ч. Спектральные характеристики соответствовали описанным ранее [10, 12].
Таблица 1.
Условия синтеза образцов
| Образец, № | Кислота (0.2 моль/л) | Окислитель (7.75 ммоля) | Выход, % |
|---|---|---|---|
| 1 | HCl | FeCl3 | 21 |
| 2 | H2SO4 | (NH4)2S2O8 | 62 |
| 3 | H2SO4 | FeCl3 | 29 |
| 4 | HNO3 | (NH4)2S2O8 | 74 |
| 5 | HNO3 | FeCl3 | 42 |
| 6 | HClO4 | (NH4)2S2O8 | 53 |
| 7 | HClO4 | FeCl3 | 55 |
| 8 | HCl | (NH4)2S2O8 | 72 |
ИК-спектры в виде таблеток c KBr записывали на приборе “IR-Prestige-21 Shimadzu”. УФ-спектры регистрировали на спектрофотометре “2600 Shimadzu” в растворе ДМСО, N-метилпирролидона, CHCl3 при 25°С в диапазоне длины волн от 190 до 900 нм, в кварцевой кювете толщиной 1 см. Флуоресцентный спектральный анализ осуществляли на спектрофлюорофотометре “RF-5301 PC Shimadzu” в растворе ДМСО при комнатной температуре. Квантовый выход рассчитывали по формуле:
Микроструктуру наночастиц исследовали с помощью сканирующего электронного микроскопа высокого разрешения “Tescan Mira 3 LMH” (СЭМ) при ускоряющем напряжении 10 кВ и вакууме ~10–3 Па. Термогравиметрический анализ выполняли на приборе “Netzsch STA 449 F3 Jupiter” в атмосфере азота (250 мл мин–1). Чувствительность прибора составляла 0.001 мг. Образец массой 10 мг нагревали в диапазоне от 25 до 900°С при скорости нагревания 5 град/ мин–1.
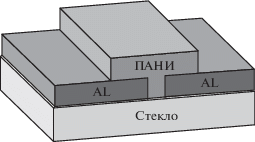
В резистивных датчиках (рис. 1) в качестве подложки использовали стекло. Так, на стеклянную пластину сверху наносили алюминиевые электроды методом термического распыления в вакуумной камере на установке “ВУП-5” толщиной ~400 нм, зазор создавали с помощью теневой маски. В область зазора между электродами в 200 мкм наносили пленку производных ПАНИ методом центрифугирования из раствора ДМФА (0.1 г/мл). Полученный слой подвергали термическому отжигу для удаления остатков растворителя путем нагревания до 110°С в течение 20–25 мин.
В экспериментах для измерений использовали блоки питания “Mastech” и “DC Power Supply HY3005D-2”, вольтметр универсальный “В7-21”, цифровой термометр гигрометр “RST Q317” для измерения температуры, амперметром служил мультиметр “APPA107N”, толщину тонких полимерных пленок контролировали путем анализа АСМ-изображений, представленных с помощью “Наноскан 3D”.
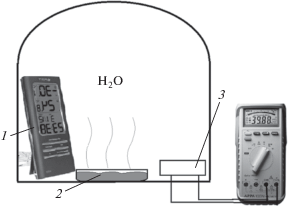
Градуировку датчиков относительной влажности воздуха осуществляли электронным гигрометром (1) в специальной камере (рис. 2) с контролируемой влажностью. В камеру помещали сосуд с водой (2), после чего при определенных значениях влажности снимали значения выходного сигнала. Скорость роста влажности составляла ~0.1% в минуту.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ИК-спектроскопия полученных производных ПАНИ
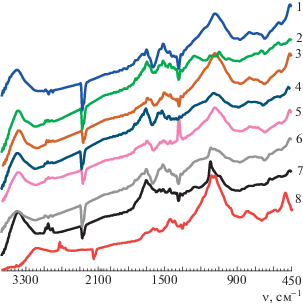
ИК-спектры синтезированных образцов представлены на рис. 3. Во всех спектрах наблюдается поглощение при 3359–3364 см–1, свидетельствующее о наличии в полимерах связи N–H. Пик поглощения в области 2925 см–1 связан с колебаниями связей С–Н ароматического кольца. Полосам при 2885 см–1 свойственна связь С–Н в алифатическом заместителе. Основные пики, присущие полимерной структуре производных ПАНИ, находятся при 1490 и 1651 см–1 и относятся к колебаниям бензоидного и хиноидного фрагментов соответственно. Максимум при 1370 см–1 характерен для связи C–N. Наличие пика при 1118 см–1 свидетельствует о допированном состоянии полимера (=N+–/–N+•–) [15]. На спектре образца 2 наблюдается пик при 1201 см–1, относящийся к колебаниям С–N•+ вторичного ароматического амина в полимере. Поглощение при 798–800 см–1 обусловлено деформационными колебаниям С–Н в плоскости 1,2,4-положения фенильного кольца основной цепи [15].
УФ-спектроскопия производных ПАНИ
На рис. 4 продемонстрированы УФ-спектры полученных образцов 1–811. Известно, что для незамещенного ПАНИ характерны несколько полос поглощения при 320 и 610 нм [16]. Максимумы поглощения соответствуют электронным π–π*- и n–π*-переходам в полимерной структуре при 320 нм (между соседними ароматическими кольцами – π-π*) и при 610 нм (в хиноидном фрагменте полимера – n–π*). Присутствие заместителей в полимерной цепи производных ПАНИ привносит два эффекта: стерический и электронный в зависимости от природы функциональной группы.
Рис. 4.
УФ-спектры синтезированных полимеров 1–8 (10–2 г/л) в растворе ДМСО (а), N-метилпирролидон (б) и CHCl3 (в).
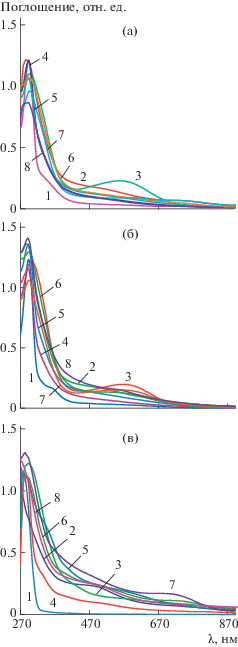
Рассматриваемые в настоящем исследовании образцы производного ПАНИ содержат в орто-положении алкенильный радикал. Благодаря большому объему, данный заместитель способствует увеличению торсионного угла между соседними ароматическими кольцами. Данный эффект сопровождается гипсохромным сдвигом в спектрах поглощения (рис. 4) относительно известного спектра незамещенного ПАНИ [15].
Спектры образцов содержат полосу поглощения в области 285–298 нм. Величина гипсохромного сдвига для всех образцов составляет 20–30 нм. Как можно заметить на рис. 4, для всех образцов наблюдается небольшой максимум в области 470 нм, наиболее интенсивный в CHCl3. Данный максимум соответствует допированному состоянию полимера, т.е. форме эмеральдиновой соли. Также в спектрах присутствует пик в области 620–630 нм (N-метилпирролидон) и 670 нм (CHCl3), характеризующий n–π* электронный переход в хиноидном фрагменте.
Варьирование условий синтеза не оказало существенного влияния на положения максимумов поглощения. Следует отметить, что интенсивность полос поглощения меняется в зависимости от используемых условий синтеза. Максимум, соответствующий допированному состоянию при 470 нм (рис. 4в), наиболее интенсивен для образца, синтезированного в HNO3 с использованием в качестве окислителя FeCl3 (образец 5). Положительное влияние этого окислителя на спектральные характеристики полимеров отмечены и для других образцов.
Таким образом, исследование спектров поглощения полимеров показало, что важные полосы поглощения наиболее отчетливо наблюдаются в растворе CHCl3. Сравнительный анализ полимеров позволяет сделать вывод, что применение в качестве окислителя FeCl3 приводит к получению материала в допированном виде и с наибольшей концентрацией хиноидных фрагментов.
Фотолюминесценция исследуемых образцов
Спектры фотолюминесценции исследуемых образцов в растворе ДМСО представлены на рис. 5. Ранее уже упоминалось о флуоресцентных свойствах ПАНИ и его производных [17–19]. Изучение люминесцентных свойств образцов показало, что интенсивность свечения изменяется в зависимости от условий синтеза, что также прежде было установлено для поли[2-(2-хлор-1-метилбут-2-ен-1-ил)анилина] [18]. Для образца 1 была найдена линейная зависимость интенсивности фотолюминесценции от концентрации образца, указывающая на то, что люминесцентное излучение обусловлено полимером. Варьирование условий синтеза показало, что использование FeCl3 как окислителя приводит к бόльшей интенсивности люминесценции, а максимальное значение наблюдается для образца, полученного в HNO3. Отличительной чертой производных ПАНИ можно назвать увеличение интенсивности фотолюминесценции с ростом объема заместителя и со снижением степени допирования, что было продемонстрировано в работе [19] на примере нескольких соединений – ПАНИ, поли-о-толуидин, поли-о-анизидин.
Рис. 5.
а – Спектры люминесценции синтезированных полимеров 1–8 в растворе ДМСО (10–2 г/л); б – зависимость интенсивности люминесценции от концентрации 1.25 × 10–3–10–2 г/л образца 1, на вставке – линейная корреляция интенсивности люминесценции от концентрации полимера.
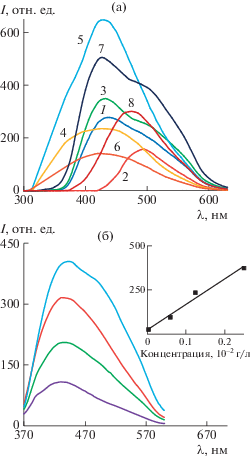
Квантовый выход исследуемых образцов был рассчитан относительно антрацена [20]. Наибольший квантовый выход отмечен для образцов 5, 6, 8 (табл. 2). Это показывает, что синтезированные полимеры являются хорошими излучателями света. Таким образом, введение объемного заместителя в ароматическое кольцо полимерной цепи и варьирование условий синтеза производного ПАНИ приводит к увеличению интенсивности и квантового выхода люминесценции, что позволяет получить материалы с практически важными свойствами.
Термогравиметрические исследования производных ПАНИ
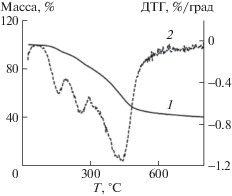
Исследование термической стабильности было выполнено для образца 8 при скорости нагревания 5 град/мин-1 (рис. 6). Установлено, что деструкция полимера протекает в несколько этапов: на первой стадии ~20°С происходит потеря влаги, растворителя и допирующего агента, на втором этапе ~210°С имеет место разрыв связи С–С между основной полимерной цепью и заместителем, а на третьем этапе ~400°С – собственно деструкция основной полимерной цепи [10, 12, 13].
Морфология синтезированных производных ПАНИ
Характеристики производных ПАНИ, такие как морфология и электропроводность, зависят от условий синтеза [1, 2, 10, 21]. Эта особенность позволяет путем варьирования параметров синтеза получать перспективные полимеры для различных областей техники.
Изучение микроструктуры наночастиц проводилось с помощью высокоразрешающего растрового электронного микроскопа (рис. 7). Морфология полученных образцов значительно отличается от структуры ПАНИ [21]. ПАНИ в классическом представлении обладает фибриллярной структурой, подобно сети. Для производных ПАНИ с алкильными заместителями характерно образование глобулярной надмолекулярной структуры с четко разделенными друг от друга сферами [10, 21]. Исследуемые образцы 1–8 в процессе синтеза сформировали неоднородную иерархическую надмолекулярную структуру. Такое отличие от ПАНИ, вероятно, обусловлено присутствием заместителя в ароматическом кольце полимерной цепи и варьированием условий синтеза.
Использование HClO4 и HNO3 способствует формированию наиболее мелкодисперсной структуры, в то время как использование H2SO4 и HCl укрупняет образованные агломераты. Таким образом, надмолекулярная структура производных ПАНИ значительным образом зависит от природы заместителя и допирующего агента.
Растворимость синтезированных производных ПАНИ
Известно, что главным недостатком ПАНИ является его плохая растворимость в распространенных органических растворителях [2, 10, 11]. Однако введение заместителя в ароматическое кольцо полимера привело к значительному возрастанию его растворимости в ДМСО, N-метилпирролидоне и CHCl3. Ранее уже сообщалось о высокой растворимости поли-2-(1-метилбут-2-ен-1-ил)анилин [10]. Таким образом, можно сделать вывод, что введение функциональной группы в ароматическое кольцо полимера положительно влияет на растворимость. Это обусловлено стерическим эффектом алкильного заместителя, что приводит к увеличению гибкости полимера и, как следствие, росту растворимости. Стоит отметить, что природа допирующего агента и окислителя не оказала существенного влияния на растворимость синтезированных образцов.
Сенсорные свойства производных ПАНИ
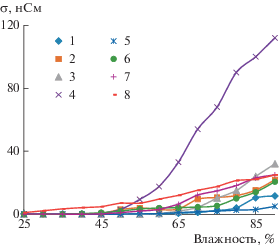
На рис. 8 представлены зависимости проводимости σ от влажности для резистивных датчиков на основе тонких пленок производных ПАНИ.
Сильнее всего (до 120 нСм) меняется проводимость в образце полимера, допированного HNO3 в присутствии окислителя (NH4)2S2O8. Гораздо меньшую проводимость имеет образец, синтезированный в серной кислоте с участием хлорида железа(III). Чуть ниже (35 нСм) проводимость образцов в HCl (окислитель (NH4)2S2O8) и HClO4 (окислитель FeCl3). Растет проводимость от 0.2 до 25 полученных образцов в H2SO4 и HClO4 (окислитель (NH4)2S2O8). Самую низкую проводимость имеет образец, допированный в азотной кислоте с участием хлорида железа(III).
Предполагается, что рост электропроводности полимерных пленок может быть связан с образованием комплекса с переносом заряда при участии фрагментов полимерной цепи и ионов водорода или гидроксильной группы [22]. Таким эффектом можно воспользоваться при создании химических сенсоров, например датчиков влажности.
Следовательно, синтезированные производные ПАНИ могут применяться в качестве активного материала в резистивных датчиках влажности, в которых чувствительность можно регулировать путем выбора подходящего допирующего агента.
ЗАКЛЮЧЕНИЕ
Результаты исследования демонстрируют значительное влияние условий синтеза на оптические и морфологические свойства исследуемых полимеров. Сравнительный анализ полимеров показал, что применение в качестве окислителя FeCl3 позволяет получить материал в допированном виде и с наибольшей концентрацией хиноидных фрагментов. Также использование FeCl3 в синтезе полимеров способствует увеличению квантового выхода люминесценции, а максимальное значение наблюдается для образца, полученного в HNO3. В процессе изучения надмолекулярной структуры полимеров установлено, что синтез в HClO4 и HNO3 способствует формированию наиболее мелкодисперсной структуры, в то время как полимеризация в H2SO4 и HCl укрупняет образованные агломераты. Исследование полимеров в датчиках влажности на основе тонкопленочных резистивных структур показало, что чувствительность производных ПАНИ можно регулировать путем выбора подходящего допирующего агента.
Таким образом, изученные физико-химические свойства представленного в настоящей работе ряда полимеров в значительной мере зависят от природы допирующего агента и могут контролироваться путем точного подбора противоиона.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта (код проекта 19-33-90147\19), а также по теме Госзадания АААА-А19-119020890014-7.
Список литературы
Inzelt G. // Conducting Polymers: a New Era in Electrochemistry. New York: Springer Science & Business Media, 2012.
Long Y.Z., Li M.M., Gu C.G., Wan M.X., Duvail J.L., Liu Z.W., Fan Z.Y. // Prog. Polym. Sci. 2011. V. 36. P. 1415.
Salikhov R.B., Biglova Y.N., Yumaguzin Y.M., Salikhov T.R., Miftakhov M.S., Mustafin A.G. // Technical Phys. Lett. 2013. V. 39. № 10. P. 854.
Ciric-Marjanovic G. // Synth. Met. 2013. V. 177. P. 1.
Bhadra S., Khastgir D., Singha N.K., Lee J.H. // Prog. Polym. Sci. 2009. V. 34. P. 783.
Genies E.M., Boyle A., Lapkowski M., Tsintavis C. // Synthetic Metals. 1990. V. 36. № 2. P. 139.
Shakoor A., Rizvi T.Z., Sulaiman M., Nasir M., Ishtiaq M. // J. Mater. Sci., Mater. Electron. 2010. V. 21. P. 603.
Ortega E., Armijo F., Jessop I., Del Valle M.A., Díaz F.R. // J. Chil. Chem. Soc. 2013. V. 58. № 4. P. 1959.
Barbero C., Salavagione H.J., Acevedo D.F., Grumelli D.E., Garay F., Planes G.A., Miras M.C. // Electrochim. Acta. 2004. V. 49. № 22–23. P. 3671.
Andriianova A.N., Shigapova A.R., Biglova Y.N., Salikhov R., Abdrakhmanov I.B., Mustafin A.G. // Chin. J. Polym. Sci. 2019. V. 37. P. 774.
Абдрахманов И.Б., Мустафин А.Г., Шарафутдинов В.М. Перегруппировка Кляйзена в ряду ароматических аминов. Уфа: Гилем, Башк. энцикл., 2014.
Biglova Yu., Salikhov R., Abdrakhmanov I., Salikhov T., Safargalin I., Mustafin A. // Phys. Solid State. 2017. V. 59. P. 1228.
Andriianova A.N., Biglova Yu.N., Mustafin A.G. // RSC Advances. 2020. V. 10. P. 7468.
Mustafin A.G., Latypova L.R., Andriianova A.N., Salikhov Sh.M., Sattarova A.F., Mullagaliev I.N., Salikhov R.B., Abdrakhmanov I.B. // Macromolecules. 2020 (in print).
Quillard S., Louarn G., Buisson J.P., Boyer M., Lapkowski M., Pron A. // Synth. Met. 1997. V. 84. P. 805.
Wang P., Tan K.L., Zhang F., Kang E.T., Neoh K.G. // Chem. Mater. 2001. V. 13. P. 581.
Andriianova A.N., Mustafin A.G., Abdrakhmanov I.B. // Chem. Select. 2019. V. 4. P. 11307.
Latypova L.R., Andriianova A.N., Salikhov S.M., Mullagaliev I.N., Salikhov R.B., Abdrakhmanov I.B., Mustafin A.G. // Polym. Int. 2020. V. 69. P. 804.
Петров И.С., Андриянова А.Н., Садыков Т.Т., Мустафин А.Г. // Вестн. Башкирского ун-та 2020. № 2. С. 272.
Zimmermanna C., Mohrb M., Zipseb H., Eichbergera R., Schnabela W. // J. Photochem. Photobiol. A. 1999. V. 125. P. 47.
Tran H.D., D’Arcy J.M., Wang Y., Beltramo P.J., Strong V.A., Kaner R.B. // J. Mater. Chem. 2011. V. 21. № 11. P. 3534.
Salikhov R.B., Lachinov A.N., Rakhmeev R.G., Gadiev R.M., Yusupov A.R., Salazkin S.N. // Measurement Techniques. 2009. V. 52. № 4. P. 427.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)