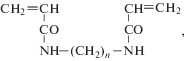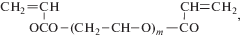Высокомолекулярные соединения (серия Б), 2021, T. 63, № 4, стр. 271-274
СТРУКТУРА ГИДРОГЕЛЕЙ И АКТИВНОСТЬ ИММОБИЛИЗОВАННЫХ В НИХ БЕЛКОВ
И. Л. Валуев a, *, Л. В. Ванчугова a, М. Ю. Горшкова a, Н. А. Сивов a, Л. И. Валуев a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
* E-mail: ivaluev@ips.ac.ru
Поступила в редакцию 31.03.2021
После доработки 30.04.2021
Принята к публикации 13.05.2021
Аннотация
Изучено влияние химического строения сшивающих агентов на активность белков в гидрогелях, полученных сополимеризацией акриламида, сшивающего агента и ненасыщенного производного белка. Показано, что взаимодействие звеньев гидрофобного сшивающего агента между собой, возрастающее с увеличением длины алифатического участка между двойными связями сшивателя, приводит к дополнительному “гидрофобному сшиванию” макромолекул и снижению активности иммобилизованного белка.
Интерес к полимерным гидрогелям с иммобилизованными белками обусловлен в первую очередь их уникальными возможностями для решения ряда прикладных задач по созданию высокоактивных каталитических систем и аффинных сорбентов, в том числе биосовместимых гемосорбентов для избирательного извлечения из крови токсичных соединений. В работах, посвященных решению подобных задач, сами гидрогели обычно рассматриваются как инертные носители, основная функция которых заключается в переводе белка в нерастворимое состояние [1–5]. Вместе с тем имеются данные о зависимости активности иммобилизованных белков от структуры гидрогелей, например от размеров пор в гидрогелях или от характера распределения пор по размерам [6]. Способы регулирования структуры, как правило, сводятся к варьированию концентрации мономера и сшивающего агента или к изменению условий полимеризации: природы растворителя, типа и количества инициатора, температуры и т.д., например, к проведению полимеризации в присутствии передатчика цепи или по механизму псевдоживой радикальной полимеризации [7].
Цель настоящей работы – выяснение зависимости активности иммобилизованных белков от строения сшивающего агента, используемого при получении гидрогелей сополимеризацией ненасыщенного производного белка (макромономера) с акриламидом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали акриламид, сшивающие агенты, персульфат аммония (“ДиаэМ”, Россия), N,N,N',N'-тетраметилэтилендиамин, трипсин, панкреатический ингибитор трипсина, N-α-бензоил-D,L-аргинин-п-нитроанилид (“Serva”, США), ингибитор трипсина из яиц утки (“Белмедпрепараты”, Беларусь). Сшивающими агентами служили бисакриламиды формулы
где n = 1 (БИС-1), 2 (БИС-2), 3 (БИС-3), 6 (БИС-6),или диакрилаты этиленгликоля формулы
где m = 1 (ДА-1), 2 (ДА-2), 3 (ДА-3), 4 (ДА-4).Ненасыщенные производные белков (макромономеры) синтезировали реакцией хлорангидрида акриловой кислоты с аминогруппами белка. Поскольку одна из аминогрупп остатков лизина в ингибиторах входит в состав их реактивного центра [8], для ее защиты от дезактивирующего действия хлорангидрида ингибитор предварительно связывали в комплекс с нативным трипсином. Константа диссоциации комплекса равна 10–11 М [9]. Комплекс ацилировали по обычной методике при рН 8.0, а затем для диссоциции комплекса раствор подкисляли соляной кислотой до рН 2.0. Разделение ацилированных трипсина и ингибитора проводили методом гель-хроматографии на колонке с Сефадексом G-50. Биологическая активность полученных макромономеров белков была равна активности нативных белков.
Полиакриламидные гидрогели получали полимеризацией при комнатной температуре в водном растворе смеси, содержащей акриламид, сшивающий агент и макромономер белка, под действием окислительно-восстановительной системы персульфат аммония – N,N,N',N'-тетраметилэтилендиамин (0.0044-0.22 моль/л). Раствор вакуумировали для удаления растворенного кислорода до давления 10–15 мм рт.ст. и выдерживали при комнатной температуре в течение 1–2 ч. Полученный гидрогель промывали бидистиллированной водой до полного удаления непрореагировавших соединений. Контроль осуществляли измерением показателя преломления промывных вод. Конверсия мономеров, оцененная гравиметрически, составляла 93–96%.
Концентрацию иммобилизованного в гидрогеле белка находили исходя из разницы его количества в исходном растворе и в промывных водах. Количество белка определяли измерением оптической плотности раствора при 280 нм на приборе “Hitachi-3410” (Япония), используя предварительно построенную калибровочную зависимость.
Степень набухания гидрогелей рассчитывали по формуле Sr = m1/m2 – 1, где m1 и m2 – масса равновесно набухшего и лиофильно высушенного гидрогеля соответственно.
Активность иммобилизованного трипсина оценивали по скорости гидролиза низкомолекулярного субстрата – N-α-бензоил-D,L-аргинин-п-нитроанилид [10] или по способности трипсина образовывать комплексы с панкреатическим или яичным ингибитором трипсина, а активность иммобилизованного ингибитора – по его способности образовывать комплексы с трипсином.
Для определения емкости гидрогелей по ингибитору 5 г геля инкубировали с 10 мл раствора 40 мг ингибитора в 0.05 М трис-НСl буфере, рН 8.0, содержащем 0.5 M NaCl, при перемешивании до установления постоянного значения оптической плотности раствора ингибитора при 280 нм (обычно не более 2 ч). Связавшийся ингибитор элюировали 0.2 М КСl, рН 2.0. Концентрацию выделившегося ингибитора находили спектрофотометрически.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
К одному из основных параметров, характеризующих гидрогели, относится равновесная степень набухания гидрогелей воде, определяемая в основном составом исходной полимеризующейся смеси. С повышением концентрации сшивающего агента или с увеличением суммарной концентрации мономеров равновесная степень набухания уменьшается. Последнее в значительной степени связано с тем, что при низкой суммарной концентрации мономеров часть сшивающего агента используется на неэффективное внутримолекулярное сшивание, а не на сшивание макромолекул между собой [11].
В работе [12] было предположено, что увеличение расстояния между связями С=С в молекуле сшивающего агента должно приводить к изменению плотности сетки сшитого полимера и вызывать рост степени набухания гидрогеля. Вместе с тем, в работе [13] было показано, что при использовании сшивателей с гидрофобным алифатическим участком между двойными связями увеличение длины этого участка изменяет гидрофобно-гидрофильный баланс полимеризующейся системы и существенно влияет на процесс формирования надмолекулярной структуры гидрогелей. Можно предположить, что эти изменения, как и любые другие структурные изменения в гидрогелях, могут определять и активность связанного с полимером биологически активного вещества.
Для проверки данного предположения реакцией радикальной сополимеризации акриламида со сшивающими агентами различного строения (гидрофобными бисакриламидами или гидрофильными диакрилатами этиленгликоля) и макромономером панкреатического ингибитора трипсина или трипсина были синтезированы гидрогели с различным содержанием белка и изучена активность этих белков.
В табл. 1 приведены свойства гидрогелей, полученных сополимеризацией акриламида с макромономером панкреатического ингибитора трипсина в присутствии различных сшивателей.
Таблица 1.
Свойства гидрогелей, полученных сополимеризацией 1.8 моль/л акриламида, 0.03 моль/л сшивающего агента и 0.0015 моль/л макромономера иммобилизованного ингибитора трипсина
| Сшиватель | Sr, г воды/г полимера (±0.6) | [Иммобилизованный ингибитор трипсина], мг/г геля ( ±0.6) | Емкость, моль трипсина/моль иммобилизованного ингибитора трипсина (±0.02) |
|---|---|---|---|
| ДА-1 | 13.4 | 4.1 | 0.60 |
| ДА-2 | 16.3 | 3.9 | 0.63 |
| ДА-3 | 17.9 | 2.9 | 0.70 |
| ДА-4 | 21.2 | 2.5 | 0.73 |
| БИС-1 | 11.8 | 4.2 | 0.66 |
| БИС-2 | 11.2 | 4.3 | 0.60 |
| БИС-3 | 8.9 | 6.3 | 0.57 |
| БИС-6 | 9.0 | 6.2 | 0.55 |
| БИС-1* | 9.1 | 5.2 | 0.70 |
Видно, что если сшивающими агентами служили диакрилаты этиленгликоля, степень набухания гидрогелей равномерно повышается с увеличением длины гидрофильного участка между двойными связями сшивателя. Это сопровождается снижением концентрации иммобилизованного ингибитора трипсина, что приводит к повышению доступности его макромолекул для достаточно высокомолекулярного трипсина и увеличению измеряемой активности ингибитора. Активность иммобилизованного панкреатического ингибитора трипсина составляет 60–70% от активности нативного ингибитора.
Иная картина наблюдается при использовании сшивающих агентов с гидрофобной развязкой между двойными связями. Увеличение числа метиленовых групп повышает гидрофобность макромолекул сополимера и усиливает их взаимодействия между собой, что способствует дополнительному “гидрофобному сшиванию” гидрогелей и уменьшению их степени набухания. Экспериментально наблюдаемое при этом падение активности иммобилизованного панкреатического ингибитора трипсина обусловлено, вероятно, сближением его молекул и возникающими стерическими препятствиями для их взаимодействия с трипсином. Характер такого сближения определяется природой сшивающего агента. Гидрогели, полученные в присутствии 0.05 моль/л БИС-1 и 0.03 моль/л БИС-6, имеют близкие степени набухания, но существенную разную емкость по трипсину – 0.70 и 0.55 моль трипсина/моль иммобилизованного панкреатического ингибитора трипсина соответственно. Это означает, что “гидрофобное сшивание” вносит дополнительные трудности для взаимодействия иммобилизованного панкреатического ингибитора трипсина с трипсином именно на стадии взаимодействия, а не в процессе диффузии трипсина в объеме гидрогеля. Все синтезированные гидрогели абсолютно прозрачны даже для такого высокомолекулярного белка, как сывороточный альбумин с ММ 65000.
Стерические препятствия тем больше, чем выше концентрация иммобилизованного панкреатического ингибитора трипсина (табл. 2). Видно, что рост концентрации макромономера в исходной мономерной смеси при использовании обоих типов сшивателей естественно приводит к увеличению содержания иммобилизованного панкреатического ингибитора трипсина в гидрогеле и слегка повышает степень набухания гидрогелей, что характерно для реакции сополимеризации с участием макромономеров [14].
Таблица 2.
Зависимость свойств гидрогелей, полученных сополимеризацией 1.8 моль/л акриламида и 0.03 моль/л сшивающего агента, от концентрации макромономера
| Концентрация макромономера иммобилизованного ингибитора трипсина в исходной смеси, моль/л | Sr, г воды/г полимера (±0.6) | [Иммобилизованный ингибитор трипсина], мг/г геля (±0.3) | Емкость, моль трипсина/моль иммобилизованного ингибитора трипсина (±0.02) |
|---|---|---|---|
| 0.0005 | 8.2/17.6 | 2.1/1.0 | 0.68/0.76 |
| 0.0015 | 8.9/17.9 | 6.3/2.9 | 0.57/0.70 |
| 0.0030 | 9.7/18.3 | 8.6/5.6 | 0.54/0.79 |
| 0.0035 | 9.8/19.0 | 10.7/5.9 | 0.50/0.74 |
Что касается активности иммобилизованного ингибитора, то и в данном случае наличие дополнительного “гидрофобного сшивания” в гидрогелях, полученых в присутствии БИС-3, ограничивает доступность молекул иммобилизованного панкреатического ингибитора трипсина для трипсина и снижает емкость гидрогеля по этому ферменту.
Особенности гидрогелей, полученных в присутствии гидрофобных сшивающих агентов, проявляются только в отношении связывающей способности иммобилизованных белков, но не их каталитической активности. В табл. 3 приведена зависимость активности имм. белка, в данном случае трипсина, от ММ субстрата. Видно, что каталитическая активность иммобилизованного трипсина по отношению к низкомолекулярному субстрату практически не зависит от природы сшивающего агента и степени набухания гидрогеля. Даже повышение концентрации иммобилизованного трипсина не создает стерических препятствий для такой реакции. Стерические препятствия проявляются только при использовании высокомолекулярных субстратов. Причем, чем выше ММ субстрата, тем ниже измеряемая активность иммобилизованного трипсина. И в этом случае проявляется эффект дополнительного “гидрофобного сшивания”. Наблюдаемое снижение активности иммобилизованного трипсина по отношению к высокомолекулярным субстратам при близких степенях набухания больше в гидрогелях, полученных в присутствии гидрофобных сшивателей.
Таблица 3.
Свойства гидрогелей, полученных сополимеризацией 1.8 моль/л акриламида, 0.03 моль/л сшивающего агента и 0.0004 моль/л макромономера трипсина
| Сшиватель | Sr, г воды/г полимера (±0.6) | [Трипсин]имм, мг/г геля (±0.6) | Активность, % от исх.(±4%) по отношению к | ||
|---|---|---|---|---|---|
| БАПА | ПИТ | ЯИТ | |||
| ДА-1 | 14.0 | 4.3 | 84 | 76 | 66 |
| ДА-2 | 15.7 | 3.9 | 77 | 74 | 70 |
| ДА-3 | 18.1 | 2.4 | 82 | 73 | 63 |
| ДА-4 | 22.4 | 2.6 | 79 | 75 | 68 |
| БИС-1 | 12.4 | 5.1 | 84 | 78 | 70 |
| БИС-2 | 11.6 | 5.0 | 79 | 70 | 67 |
| БИС-3 | 9.3 | 6.3 | 78 | 63 | 50 |
| БИС-6 | 8.9 | 6.4 | 80 | 57 | 51 |
| БИС-1* | 9.0 | 6.1 | 82 | 77 | 68 |
Таким образом, полученные результаты свидетельствуют о том, что химическое строение сшивающего агента сильно влияет на процесс формирования надмолекулярной структуры гидрогелей при сополимеризации акриламида и макромономера белка и определяет активность иммобилизованного белка по отношению к высокомомолекулярным субстратам. Существенная роль при этом принадлежит нековалентному, гидрофобному сшиванию макромолекул. Обнаруженные закономерности использованы для повышения эффективности действия нашедшего клиническое применение гемосорбента “Овосорб”, гидрогелевого препарата “Рансулин” для перорального введения инсулина и при получении высокоочищенных и стабильных белковых препаратов.
Работа выполнена в рамках Госзадания ИНХС РАН.
Список литературы
Angsantikul P., Mitragotri A. // Trends Pharmacol. Sci. 2020. V. 41. № 10. P. 681.
Wang T., Qu G., Wang C., Cheng Y., Shang J., Zheng J., Feng Z., Chen Q., He N. // Langmuir. 2019. V. 35. № 43. P. 13999.
Diederich V.E., Studer P., Kern A., Lattuada M., Storti G., Sharma R.I., Snedeker J.G., Morbidelli M. // Biotechnol. Bioeng. 2013. V. 110. № 5. P. 1508.
Nalampang K., Panjakha R., Molloy R., Tighe B.J. // J. Biomater. Sci., Polym. Ed. 2013. V. 24. № 11. P. 1291.
Schoener C.A., Hutson H.N., Peppas N.A. // J. Biomed. Mater. Res. 2013. V. 101. № 8. P. 2229.
Valuev L.I., Valuev I.L., Vanchugova L.V., Obydennova I.L. // Polymer Science B. 2015. V. 57. № 5. P. 456.
Vanchugova L.V., Valuev L.I., Valuev I.L., Talyzenkov Yu.A. // Polymer Science B. 2013. V. 55. № 1–2. P. 77.
Chauvet J., Acher R. // J. Biol. Chem. 1967. V. 242. P. 4274.
Мосолов В.В. Протеолитические ферменты. М.: Наука, 1971.
Erlanger D.F., Kokowski N., Cohen W. // Arch. Biochem. Biophys. 1961.
Cohen Y., Ramon O., Kopelman I.J., Mizrah S.J. // Polym. Sci., Polym. Phys. 1992. V. 30. № 12. P. 1055.
Rolfes H., Stepto R.F.T. // Makromol. Chem., Theory Simul. 1992. V. 1. № 2. P. 969.
Валуев Л.И., Чупов В.В., Сытов Г.А., Шаназарова И.М., Кислая Л.Н., Синани В.А., Платэ Н.А. // Высокомолек. соед. А. 1995. Т. 37. № 5. С. 787.
Платэ Н.А., Валуев Л.И., Синани В.А., Чупов В.В. // Биотехнология. 1987. Т. 3. № 2. С. 173.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)