Высокомолекулярные соединения (серия Б), 2021, T. 63, № 5, стр. 317-325
ПОЛИЭЛЕКТРОЛИТЫ И ПОЛИКОМПЛЕКСЫ ДЛЯ СТАБИЛИЗАЦИИ ПЕСЧАНЫХ ГРУНТОВ
О. А. Новоскольцева a, *, И. Г. Панова a, Н. Г. Лойко b, Ю. А. Николаев b, Е. А. Литманович a, А. А. Ярославов a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
119991 Москва, Ленинские горы, Россия
b Федеральное государственное учреждение “Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук”
119071 Москва, Ленинский пр., 33, Россия
* E-mail: nsn07@yandex.ru
Поступила в редакцию 19.04.2021
После доработки 07.06.2021
Принята к публикации 21.06.2021
Аннотация
Исследовано взаимодействие сополимера акриловой кислоты и акриламида с мольным соотношением мономерных звеньев 75 : 25 и поли(N,N′-диаллил-N,N′-диметиламмоний хлорида) в водном растворе. Взаимодействие сопровождается образованием поликомплекса, стабилизированного множественными солевыми связями между противоположно заряженными группами обоих полиэлектролитов. Нестехиометричный поликомплекс с десятикратным избытком анионных групп присутствует в растворе в виде частиц с диаметром около 300 нм, которые сохраняют агрегативную устойчивость в течение 30 суток. Нанесение водных растворов индивидуальных полимеров и нестехиометричного поликомплекса на поверхность песка с размером частиц 0.15 ± 0.05 мм сопряжено с образованием композитных полимерно-песчаных покрытий. Наибольшей механической прочностью обладают покрытия с участием анионного сополимера и поликомплекса. Для покрытия из песка и поликомплекса потеря массы при обработке водой составляет 10%, это ниже, чем при использовании традиционного стабилизатора почвы полиакриламида. Поликомплекс в концентрации до 0.33 мас.% не проявляет токсичности по отношению к микроорганизмам, указывая тем самым на перспективность применения отрицательно заряженного поликомплекса для получения водостойких защитных покрытий на поверхности песчаных почв.
ВВЕДЕНИЕ
Эрозия почв – деструкция и деградация поверхностного почвенного слоя – представляет собой глобальную проблему современности [1–3]. Для минимизации эрозионных процессов предложено использовать водные рецептуры на основе коммерчески доступных синтетических полиэлектролитов [4–11]. Мировым стандартом для решения подобных задач считается полиакриламид (ПАМ); под этим термином обычно понимают сополимеры с разным соотношением акриламида и соли акриловой кислоты [4, 10]. Наряду с ПАМ хорошие стабилизирующие свойства демонстрируют интерполиэлектролитные комплексы (ИПЭК) – продукты взаимодействия двух противоположно заряженных полиэлектролитов, катионного и анионного [11–16]. В зависимости от заряд-зарядового соотношения компонентов могут быть получены нерастворимые в воде стехиометричные поликомплексы и нестехиометричные, несущие избыточный положительный либо отрицательный заряд (“катионные” и “анионные” поликомплексы соответственно), которые растворимы в воде и водно-солевых растворах [17–19]. Первыми в качестве структурообразователей были использованы стехиометричные комплексы на основе гидролизованного ПАН и поли(N,N′-диаллил-N,N′-диметиламмоний хлорида) (ПДАДМАХ) [11]. Позже были предложены поликомплексы на основе других пар полиэлектролитов, синтетических и природных [11–16].
Нанесение водных рецептур ПАМ и ИПЭК на поверхность почвы способствует формированию полимерно-почвенных покрытий (корок), эффективно защищающих почву от ветровой и водной эрозии [4, 5, 8, 10–16]. Противоэрозионная устойчивость покрытий с участием ПАМ объясняется множественными водородными, электростатическими и вандерваальсовыми связями, образуемыми звеньями полимера с комплементарными областями на поверхности почвенных частиц [10], что приводит к “склеиванию” частиц в более крупные агрегаты с повышенным сопротивлением внешним воздействиям. Те же факторы обеспечивают механическую прочность покрытий, в которых роль связующего выполняют поликомплексы [11–16]; дополнительный вклад в стабилизацию корок вносят гидрофобные взаимодействия почвенных частиц и фрагментов (блоков) ИПЭК с взаимно нейтрализованными зарядами [11].
Гидролизованный ПАН представляет собой сополимер, в составе которого содержатся звенья акриламида и акриловой кислоты, способные участвовать в формировании водородных и ионных связей:

Поэтому он также может связываться с частицами почвы, формируя на ее поверхности защитные покрытия. Между тем, структурообразующие свойства у гидролизованного ПАН исследованы существенно меньше, чем у ПАМ и ИПЭК. Возможно, причина такого положения дел состоит в том, что коммерческие образцы гидролизованного ПАН представляют собой сополимеры с разным соотношением звеньев акриламида и акриловой кислоты [20], следствием чего является невоспроизводимость свойств полимера и связанные с ней трудности контроля качества полимерно-почвенных покрытий.
Гидролизованный ПАН может быть использован в составе поликомплекса с катионным полимером. Такой подход описан в основном в патентной литературе [21, 22]. ИПЭК, включающий гидрофобные блоки из взаимно нейтрализованных фрагментов анионного и катионного полимеров и разобщенные полимерные звенья, связывается с частицами почвы, формируя прочные полимерно-почвенные покрытия. В качестве наносимой рецептуры обычно выступали эквимольные водные растворы обоих полимеров, которые получали в присутствии низкомолекулярной соли в высокой концентрации (до 10 мас. %) [22]. В таких условиях образование нерастворимого стехиометричного ИПЭК было подавлено, что обеспечивало гомогенность наносимого раствора. После нанесения рецептуры на поверхность почвы и последующей обработки водой формировалась композитная корка из полимеров и почвенных частиц. Неприятным побочным эффектом этого метода было засоление почвы, которое особенно нежелательно для земель сельскохозяйственного назначения.
Нестехиометричные ИПЭК с избытком анионного гидролизованного ПАН образуются в растворах с невысокой концентрацией соли. Гидрофобные блоки в таких поликомплексах придают дополнительную стабильность композитным коркам, а полученные рецептуры не оказывают отрицательного воздействия на водно-солевой баланс почвы.
Настоящая работ посвящена определению количественных характеристик покрытий, полученных нанесением водного раствора гидролизованного ПАН на песок – основной компонент большинства видов почв. Проанализированы молекулярные характеристики гидролизованного ПАН и физико-химические свойства его водных растворов, описано образование отрицательно заряженных нестехиометричных ИПЭК с участием гидролизованного ПАН и катионного ПДАДМАХ, агрегативная устойчивость данных ИПЭК в водно-солевом растворе, механическая прочность и влагостойкость корок, образующихся после нанесения полимерных рецептур на поверхность песка, а также безопасность полимеров и ИПЭК по отношению к микроорганизмам, бактериям и дрожжам. Также в работе сравнивается стабилизирующее поведение гидролизованный ПАН/ИПЭК с поведением традиционного структурообразователя ПАМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидролизованный ПАН фирмы “Бурхимснаб” (Россия) растворяли в би-дистиллированной воде. Полученный водный раствор гидролизованного ПАН с концентрацией 5 мас. % очищали проточным диализом против би-дистиллированной воды в течение недели и лиофильно сушили. ПДАДМАХ с Mw от 2 × 105 до 3.5 × 105, ПАМ с Mw = 5.2 × 105, содержащий ~80 мас. % акриламидных звеньев, гидроксид натрия, хлорид натрия, моногидрат дигидрофосфата натрия и бромид калия – все реактивы производства фирмы “Sigma-Aldrich”, (США), а также полистиролсульфонат натрия (ПСС) с Mw = 1 × 105 фирмы “Serva” (Германия), ацетон и соляную кислоту фирмы “Химмед” (Россия) использовали без дополнительной очистки.
Концентрацию анионных групп гидролизованного ПАН и ПAM определяли обратным потенциометрическим титрованием полимеров гидроксидом натрия в смеси вода–ацетон с объемным соотношением компонентов 1 : 1. Концентрацию анионных групп ПСС измеряли спектрофотометрически при λ = 260 нм, принимая мольный коэффициент экстинкции равным ε = 290 л/(моль см). Концентрацию катионных групп ПДАДМАХ устанавливали методом турбидиметрического титрования при λ = 500 нм, используя ПСС в известной концентрации в качестве анионного титранта [23]. Концентрацию полимеров выражали в виде количества молей ионных групп в литре раствора: анионных для гидролизованного ПАН, ПАМ и ПСС, катионных для ПДАДМАХ.
Оптическую плотность растворов измеряли на спектрофотометре “Shimadzu UV-1240 mini” (Япония) в кварцевых кюветах с длиной оптического пути 1 см.
Измерения pH растворов и потенциометрическое титрование проводили на pH-метре “Corning 340” (США), снабженном комбинированным стеклянным pH-электродом и встроенным датчиком температуры. Точность измерений составляла ±0.002 ед. рН.
Инфракрасные спектры образцов регистрировали на ИК-спектрофотометре “Specord M-80” фирмы “Carl Zeiss Jena” (Германия) в режиме измерения пропускания.
Средний гидродинамический диаметр частиц определяли методом динамического светорассеяния при фиксированном угле рассеяния 90° в термостатической ячейке на приборе “Brookhaven Zeta Plus” (США). Диаметр рассчитывали с помощью программного обеспечения DynaLS. Электрофоретическую подвижность (ЭФП) частиц измеряли методом лазерного микроэлектрофореза в термостатируемой ячейке на приборе “Brookhaven Zeta Plus” (США), используя встроенное программное обеспечение. Все измерения проводили при температуре 25°С.
Инкремент показателя преломления растворов определяли на дифференциальном лазерном рефрактометре “Optilab T-Rex” фирмы “Wyatt Technology” (США), данные обрабатывали при помощи программы Astra 6.0.5. Точность измерений 0.4–1.1%. Инкремент показателя преломления раствора гипана в 0.1 моль/л NaCl составил 0.152 ± 0.002 см3/г.
Измерения методом статического светорассеяния осуществляли на гониометре “FlexCor” фирмы “PhotoCor Complex” (Россия), оснащенном гелий-неоновым лазером с мощностью 10 мВт и кросскорреляционной системой счета фотонов [24]. Данные обрабатывали в программе LSD. Все измерения проводили при длине волны 633 нм и температуре 25°С.
Воду очищали двойной перегонкой с последующим пропусканием через систему Milli-Q® фирмы “Millipore”, включающую ионообменные, адсорбционные колонки для глубокой очистки от органических примесей и фильтры для удаления крупных частиц. Очищенная таким образом вода имела удельную электропроводность 0.6 мкСм/см. Растворы полимеров и поликомплексы готовили в 10–2 моль/л фосфатном буфере с pH 7.
Мелкозернистый кварцевый песок c размером частиц 0.1–0.2 мм фирмы “OPT-6” (Россия) перед экспериментами многократно промывали би-дистиллированной водой.
Образцы с защитным полимерно-песчаным слоем на поверхности готовили следующим образом. В пластиковые контейнеры помещали 60 г кварцевого песка; толщина слоя песка составляла 5 см, площадь поверхности образца 20 см2. С помощью пульверизатора на поверхность наносили 10–2 моль/л фосфатный буферный раствор с pH 7 или 1 мас. % растворы полимеров в фосфатном буферном растворе с нормой расхода 1.5 л/м2. Образцы сушили до постоянной массы на воздухе при комнатной температуре и относительной влажности 30% в течение недели.
Механическую прочность полимерно-песчаных покрытий измеряли пенетрационным методом (погружением конуса) с использованием конического пластометра Ребиндера [25].
Для противоэрозионных экспериментов в чашку Петри вносили 100 г кварцевого песка; толщина слоя песка составляла 1 см, площадь поверхности образца 80 см2. На песок равномерно наносили 8 мл 10–2 моль/л фосфатного буферного раствора или 1 мас. % раствора полимера в фосфатном буфере с нормой расхода 1.5 л/м2 и сушили на воздухе до постоянной массы.
Для оценки водостойкости песка его обрабатывали водой из пульверизатора в импульсном режиме на протяжении 10 мин. Чашки Петри помещали под углом 45°, потоки воды направляли на них горизонтально; общий объем нанесенной воды составлял 200 мл. Образцы взвешивали после обработки и последующей сушки, затем рассчитывали потерю массы образца.
Антимикробную активность полимеров оценивали по стандартной методике определения минимальной ингибирующей концентрации [26]. В стеклянные пробирки вносили 2 мл среды М9 для роста микроорганизмов с глюкозой [27]. Затем добавляли раствор полимеров, варьируя их конечную концентрацию в среде. Максимальная концентрация добавленного полимера составляла 0.33 мас. % или (2–3) × 10–2 моль/л ионных групп полимера. Потом в пробирки добавляли по 50 мкл культур микроорганизмов (грамотрицательных бактерий Pseudomonas fluorescens 4.8.1, грамположительных бактерий Staphylococcus aureus 209P или дрожжей Yarrowia lipolytica 367-2) возрастом 24 ч, что соответствует стационарной фазе роста микроорганизмов, выращенных на среде М9 с глюкозой. Пробирки помещали на орбитальную качалку (100 об/мин) и инкубировали при температуре 28°С в течение 2 суток. Рост культур оценивали визуально по возрастанию мутности растворов. Наименьшую концентрацию препарата, при которой не наблюдали роста тест-культур, принимали за минимальную ингибирующую концентрацию.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
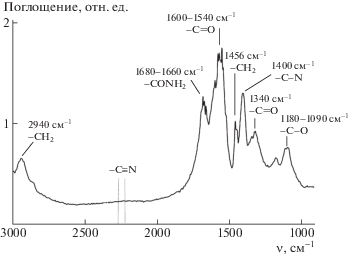
Химический состав коммерческого образца гидролизованного ПАН был определен методами ИК-спектроскопии и обратного потенциометрического титрования. В ИК-спектре диализованного и лиофильно высушенного образца гидролизованного ПАН (рис. 1) наблюдались полосы поглощения, характерные для карбоновых кислот и их солей (1600–1540 см–1, 1340 см–1, 1180–1090 см–1), а также для амидов (1680–1660 см–1, 1400 см–1), и отсутствовали полосы поглощения, соответствующие валентным колебаниям нитрильной группы (2260–2215 см–1) [28, 29]. Это свидетельствует о 100%-ной степени гидролиза исходного ПАН и превращении нитрильных групп в полимере в амидные и карбоксильные [29].
Количество звеньев акриловой кислоты в гидролизованном ПАН установлены методом обратного потенциометрического титрования в смеси вода–ацетон, при этом карбоксилатные группы полимера были переведены предварительно в недиссоциированную (протонированную) форму добавлением избыточного количества 1 М HCl. На кривой титрования (рис. 2) отчетливо выделяются два скачка, соответствующие титрованию избыточной HCl при объеме титранта V = V1 и титрованию карбоксильных групп гидролизованного ПАН при V = V2. Определенная из кривой титрования концентрация карбоксильных групп в 0.5 мас.% растворе гидролизованного ПАН составила 0.036 моль/л.
Рис. 2.
Кривая обратного потенциометрического титрования 0.5 мас. % раствора гидролизованного ПАН в смеси вода–ацетон (1 : 1). Объем титранта (0.1 моль/л NaOH) V = V1 соответствует титрованию избыточной соляной кислоты, V = V2 – титрованию карбоксильных групп полимера.

При нагревании лиофилизированного гидролизованного ПАН в сушильном шкафу при 120°С прослеживалась 10%-ная потеря массы, которая, очевидно, связана с присутствием в образце воды, ассоциированной с гидрофильными звеньями сополимера.
С учетом потери массы гидролизованного ПАН при нагревании и измеренной в ходе обратного титрования концентрации карбоксильных групп было определено мольное соотношение карбоксильных (–СООН) и амидных (–СОNН2) групп в сополимере, равное 75 : 25.
По данным статического светорассеяния молекулярная масса гидролизованного ПАН составила Mw = 3 × 105, что эквивалентно степени полимеризации Pw = 3300.
Анионные звенья акриловой кислоты в составе гидролизованного ПАН определяют его полиэлектролитное поведение, в частности способность к образованию интерполиэлектролитных комплексов с катионным полимером в водном растворе [17, 18, 30, 31]. Формирование ИПЭК с участием гидролизованного ПАН и катионного ПДАДМАХ изучалось в 10–2 моль/л фосфатном буферном растворе при pH 7.
Добавление раствора ПДАДМАХ к раствору гидролизованного ПАН вызывает прогрессивное увеличение мутности системы (рис. 3а), что отражает формирование комплекса ПДАДМАХ–гидролизованный ПАН. При мольном соотношении ионных групп ПДАДМАХ и гидролизованного ПАН Q = 0.8 мутность системы достигает максимального значения. В области Q ≤ 0.1 в системе образуются частицы с диаметром ~300 нм, которые сохраняют коллоидную устойчивость, по крайней мере, в течение 30 суток. Стабильность дисперсии таких частиц устанавливается высоким отрицательным зарядом частиц, создаваемым избытком “лиофилизирующего” полимера гидролизованного ПАН, как это следует из зависимости ЭФП-частиц ИПЭК от Q (рис. 3б). Увеличение концентрации ПДАДМАХ в системе сопровождается уменьшением заряда частиц и полной нейтрализацией при Q = 0.8. При избытке ПДАДМАХ в системе образуются частицы ИПЭК с поверхностным положительным зарядом. Таким образом, кривая мутности раствора хорошо коррелирует с кривой ЭФП, показывая взаимосвязь коллоидной стабильности частиц ИПЭК с абсолютной величиной их поверхностного заряда.
Рис. 3.
Относительная оптическая плотность раствора A/Amax при λ = 500 нм (а) и ЭФП частиц комплекса ПДАДМАХ–гидролизованный ПАН (б) в зависимости от мольного соотношения ПДАДМАХ и гидролизованный ПАН Q. [Гидролизованный ПАН] = = 4 ×10–3 моль/л, 10–2 моль/л фосфатный буфер с pH 7.

Образование поликомплексов обусловлено возникновением кооперативной системы солевых связей между противоположно заряженными карбоксилатными группами гидролизованного ПАН и четвертичными аминогруппами ПДАДМАХ [17, 30]. Представлена элементарная стадия такой кооперативной реакции соединения:

Применительно к цели настоящей работы наибольший интерес представляла агрегативно стабильная рецептура с участием нестехиометричного ИПЭК. Строение частиц такого поликомплекса можно представить, опираясь на результаты многочисленных исследований поликомплексных систем [17–19, 30]. При близких молекулярных массах обоих компонентов, что справедливо для использованных ПДАДМАХ и гидролизованного ПАН, частица ИПЭК состава Q = 0.1 состоит из нескольких макромолекул гидролизованного ПАН и одной или двух макромолекул ПДАДМАХ. Такая частица в 10–2 моль/л фосфатном буферном растворе имеет размер ~300 нм, ее агрегативная устойчивость обеспечивается избыточным отрицательным зарядом гидролизованного ПАН. Большой размер частиц ИПЭК и их компактная структура (результат “гидрофобного поджатия” взаимно нейтрализованных блоков) вызывают рассеяние света, что выражается в появлении мутности раствора нестехиометричного ИПЭК с Q = 0.1.
Электростатическая природа комплексообразования отражается на поведении ИПЭК в водно-солевых растворах [17–19, 31]. Выше было изложено то, что водные растворы комплекса ПДАДМАХ– гидролизованный ПАН с Q ≤ 0.1 и концентрацией соли 10–2 моль/л сохраняют стабильность в течение длительного времени. Повышение концентрации соли NaCl в растворе поликомплекса приводит вначале к экранированию заряда частиц ИПЭК зарядами малых противоионов и агрегации частиц, а затем к диссоциации ИПЭК на исходные компоненты – катионный и анионный полимеры и просветлению раствора. Максимальная мутность, отвечающая появлению частиц наибольшего размера, достигается в 0.3 моль/л растворе NaCl, просветление раствора (диссоциация ИПЭК) наблюдается при [NaCl] = = 0.46 моль/л.
В качестве субстратов для исследования свойств полимерных покрытий использовался кварцевый песок c размером зерен 0.1–0.2 мм. Покрытия были получены с помощью нанесения фиксированного количества растворителя (контроль) или водно-солевого раствора полимера или ИПЭК на поверхность песка.
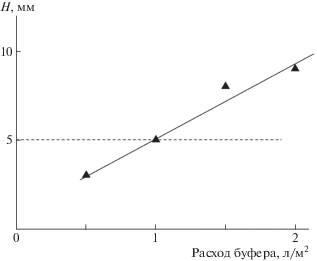
Предварительно был определен объем растворителя (10–2 моль/л фосфатного буферного раствора с pH 7) для равномерной пропитки субстрата на глубину 5 мм. Такая глубина позволяет получить покрытие (полимерно-песчаную корку), обладающее защитными противоэрозионными свойствами [11]. Так, песок помещался в прозрачный пластиковый стакан с диаметром 5 см, проникновение буферного раствора в слой песка оценивалось визуально по изменению цвета песка с белого на светло-коричневый. На рис. 4 приведена зависимость глубины проникновения буферного раствора H от количества нанесенного раствора, нормированного на площадь поверхности песка. Глубина проникновения линейно возрастает с количеством нанесенного растворителя; оптимальная глубина пропитки 5 мм достигалась при норме расхода растворителя 1 л/м2.
Рис. 4.
Зависимость глубины проникновения H 10–2 моль/л фосфатного буферного раствора с pH 7 от количества раствора, нанесенного на песок. Масса песка 60 г, площадь поверхности песка 2 × 10–3 м2.
Аналогичные эксперименты были проведены с 1 мас. % водными растворами индивидуальных полимеров, гидролизованного ПАН и ПДАДМАХ, и 1 мас.% агрегативно устойчивым водным раствором “анионного” комплекса ПДАДМАХ– гидролизованный ПАН с Q = 0.1. Во всех случаях норма расхода раствора для получения оптимальной пропитки возрастала до 1.5 л/м2. Причиной этого стала повышенная по сравнению с вязкостью растворителя вязкость полимерного раствора, которая затрудняла диффузию полимерного раствора в поры субстрата.
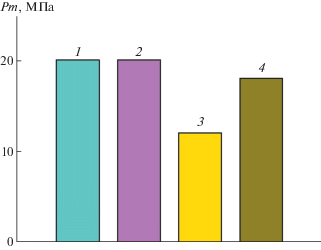
Защитные покрытия получали путем разбрызгивания 1 мас. % водно-солевых полимерных рецептур по поверхности песка. Обработка песка рецептурами с последующей сушкой образцов приводила к формированию сплошных полимерно-песчаных покрытий (корок). Механическая прочность Pm покрытий была определена пенетрационным методом на пластометре Ребиндера (рис. 5). Наибольшую механическую прочность продемонстрировали покрытия с участием гидролизованного ПАН и его аналога – ПАМ (20 МПа). Им заметно уступали покрытия с участием ПДАДМАХ (12 МПа). Покрытия из “анионного” ИПЭК с Q = 0.1, в котором только 10 мол. % карбоксильных групп гидролизованного ПАН были нейтрализованы ПДАДМАХ, обладали той же прочностью, что и покрытия с участием гидролизованного ПАН (18 МПа). Таким образом, прочность покрытий из гидролизованного ПАН и гидролизованного ПАН, который модифицирован катионным полимером ПДАДМАХ, оказалась сопоставимой с прочностью покрытия, формируемого традиционным структурообразователем–кондиционером ПАМ. Прочность покрытия, полученного в контрольном эксперименте, в котором поверхность песка была обработана растворителем – фосфатным буферным раствором, была минимальной и близкой к прочности неструктурированного песка.
Рис. 5.
Пенетрационная прочность Pm полимерно-песчаных покрытий на основе гидролизованного ПАН (1), ПАМ (2), ПДАДМАХ (3) и ИПЭК с Q = 0.1 (4).
На территории Российской Федерации основной экологический урон наносит водная эрозия [3, 32], в Центральном федеральном округе на ее долю приходится ~48% потерь [32]; похожая картина наблюдается и в других странах [1]. Поэтому понятный интерес вызывает анализ стабильности описанных выше покрытий из песка и полимерных рецептур по отношению к водной эрозии.
Водостойкость покрытий отражена в табл. 1. В контрольном эксперименте обработка буферным водным раствором сопровождалась вымыванием 65 ± 5% песка из чашки Петри (№ 1). Обработка песка водными растворами индивидуальных полимеров гидролизованного ПАН, ПДАДМАХ и ПАМ привела к образованию покрытий с примерно одинаковой влагостойкостью: после дождевания они теряли 50–60% песка (№ 2, 3 и 4 соответственно). Модификация гидролизованного ПАН катионным ПДАДМАХ и обработка песка полученным ИПЭК (Q = 0.1) позволила заметно повысить сопротивляемость покрытий по отношению к воде: после дождевания они теряли только 10 ± 1% субстрата (№ 5).
Таблица 1.
Устойчивость полимерных покрытий к водной эрозии
| №, п/п | Рецептура | Количество вымытого песка, % | Фото покрытия после обработки водой |
|---|---|---|---|
| 1 | Фосфатный буфер, 10–2 моль/л, pH 7 | 65 ± 5 |  |
| 2 | Гидролизованный ПАН | 50 ± 5 |  |
| 3 | ПДАДМАХ | 60 ± 5 |  |
| 4 | ПАМ | 50 ± 5 |  |
| 5 | ИПЭК ПДАДМАХ–гидролизованный ПАН с Q = 0.1 | 10 ± 1 |  |
Биологическая активность полимерных рецептур, представляющая интерес с точки зрения прогнозирования их возможного воздействия на жизнедеятельность почвенной микрофлоры, была оценена с использованием стандартной методики определения минимальной ингибирующей концентрации в отношении тестовых микроорганизмов: грамотрицательных бактерий Pseudomonas fluorescens, грамположительных неспорообразующих бактерий Staphylococcus aureus и дрожжей Yarrowia lipolytica. Результаты проведенных исследований представлены в табл. 2. Анионный гидролизованный ПАН и поликомплекс ПДАДМАХ–гидролизованный ПАН с Q = 0.1 в максимальной испытанной концентрации 0.33 мас. % не подавляли рост микроорганизмов, в то время как катионный ПДАДМАХ уже при небольших значениях концентрации ингибировал их рост. Значения минимальной ингибирующей концентрации для ПДАДМАХ составили: 0.001 мас. % для Pseudomonas fluorescens и 0.0005 мас. % для Staphylococcus aureus и Yarrowia lipolytica.
Таблица 2.
Результаты определения минимальной ингибирующей концентрации полимерных рецептур в отношении тест-объектов
| №, п/п | Рецептура | Минимальная ингибирующая концентрация, мас. % | ||
|---|---|---|---|---|
| Pseudomonas fluorescens | Staphylococcus aureus 209P | Yarrowia lipolytica 367-2 | ||
| 1 | Гидролизованный ПАН | >0.33 | >0.33 | >0.33 |
| 2 | ПДАДМАХ | 0.001 | 0.0005 | 0.0005 |
| 3 | ИПЭК ПДАДМАХ–гидролизованный ПАН с Q = 0.1 | >0.33 | >0.33 | >0.33 |
ЗАКЛЮЧЕНИЕ
Развитие эрозионных процессов в почве можно замедлить, создавая на ее поверхности покрытие из почвенных частиц и полиэлектролитов. Использованный в работе коммерческий гидролизованный ПАН представляет собой сополимер акриловой кислоты и акриламида с мольным соотношением мономеров 75 : 25. Гидролизованный ПАН образует ИПЭК с ПДАДМАХ; ИПЭК с десятикратным избытком анионных групп присутствует в водном растворе в виде частиц диаметром ~300 нм, которые сохраняют коллоидную устойчивость, по крайней мере, в течение 30 суток. Гидролизованный ПАН формирует механически прочные покрытия на поверхности песка, которые, однако, размываются водой, причем потери песка составляют 50%. Покрытия из песка и ИПЭК ПДАДМАХ–гидролизованный ПАН обладают той же прочностью, что и покрытия с участием гидролизованного ПАН, но отличаются заметно бόльшей водостойкостью: потери песка при обработке водой сокращаются до 10%. По этому показателю поликомплекс превосходит традиционный стабилизатор почвы полиакриламид. Эксперименты с грамотрицательными и грамположительными бактериями и дрожжевыми клетками показали, что поликомплекс ПДАДМАХ–гидролизованный ПАН в концентрации до 0.33 мас. % не подавляет рост микроорганизмов. Полученные результаты указывают на перспективность использования гидролизованного ПАН и “анионных” ИПЭК на его основе для структурирования песчаных почв.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 18-29-25017).
Список литературы
Borrelli P., Robinson D.A., Fleischer L.R., Lugato E., Ballabio C., Alewell C., Meusburger K., Modugno S., Schütt B., Ferro V., Bagarello V., Van Oost K., Montanarella L., Panagos P. // Nat. Commun. 2017. V. 8. № 1. P. 1.
Wuepper D., Borrelli P., Finger R. // Nat. Sustain. 2020. V. 3. P. 51.
Tsymbarovich P., Kust G., Kumani M., Golosov V., Andreeva O. // Int. Soil Water Conserv. Res. 2020. V. 8. № 4. P. 418.
Orts W.J., Roa-Espinosa A., Sojka R.E., Glenn G.M., Imam S.H., Erlacher K., Pedersen J.S. // J. Mater. Civ. Eng. 2007. V. 19. № 1. P. 58.
Lee S.S., Chang S.X., Chang Y.Y., Ok Y.S. // Springerplus. 2013. V. 2. № 1. P. 1.
Song Z., Liu J., Bai Y., Wei J., Li D., Wang Q., Chen Z., Kanungo D.P., Qian W. // Appl. Sci. 2019. V. 9. № 1. P. 208.
Arasan S., Işik F., Akbulut R.K., Zaimoğlu A.S., Nasirpur O. // Periodica Polytechnica: Civil Eng. 2015. V. 59. № 3. P. 405.
Yakupoglu T., Rodrigo-Comino J., Cerdà A. // Agronomy. 2019. V. 9. № 6. P. 276.
Rabiee A., Ershad-Langroudi A., Zeynali M.E. // Rev. Chem. Eng. 2015. V. 31. № 3. P. 239.
Guezennec A.-G., Michel C., Bru K., Touzé S., Desroche N., Mnif I., Motelica-Heino M. // Environ. Sci. Pollut. Res. 2015. V. 22. № 9. P. 6390.
Zezin A.B., Mikheikin S.V., Rogacheva V.B., Zanso-khova M.F., Sybachin A.V., Yaroslavov A.A. // Adv. Colloid Int. Sci. 2015. V. 226. P. 17.
Panova I., Drobyazko A., Spiridonov V., Sybachin A., Kydralieva K., Jorobekova S., Yaroslavov A. // Land Degrad. Dev. 2019. V. 30. № 3. P. 337.
Panova I.G., Khaydapova D.D., Ilyasov L.O., Umarova A.B., Yaroslavov A.A. // Colloids Surf. A. 2020. V. 590. P. 124504.
Panova I.G., Demidov V.V., Shulga P.S., Ilyasov L.O., Butilkina M.A., Yaroslavov A.A. // Land Degrad. Dev. 2021. V. 32. № 2. P. 1022.
Panova I.G., Ilyasov L.O., Khaydapova D.D., Bashina A.S., Smagin A.V., Ogawa K., Adachi Y., Yaroslavov A.A. // Colloids Surf. A. 2021. V. 610. P. 125635.
Klivenko A., Orazzhanova L., Mussabayeva B., Yelemessova G., Kassymova Z. // Polym. Adv. Technol. 2020. V. 31. № 12. P. 3292.
Kabanov V.A. // Russ. Chem. Rev. 2005. V. 74. № 1. P. 3.
Izumrudov V.A. // Russ. Chem. Rev. 2008. V. 77. № 4. P. 381.
Van der Gucht J., Spruijt E., Lemmers M., Stuart M.A.C. // J. Colloid Int. Sci. 2011. V. 361. № 2. P. 407.
Рустамов И.Р., Гребенева Т.А., Коледенков А.А., Дятлов В.А. // Усп. химии хим. технологии. 2011. Т. 25. № 3 (119). С. 28.
Пат. SU1685960A1 СССР. 1989 // Государственный комитет по изобретениям и открытиям при ГКНТ СССР. 1991.
Пат. SU1507771A1 СССР. 1986 // Государственный комитет по изобретениям и открытиям при ГКНТ СССР. 1989.
Kabanov V.A., Zezin A.B., Mustafaev M.I., Kasaikin V.A. // Polymeric Amines and Ammonium Salts / Ed. by E.J. Goethals. New York; Oxford: Pergamon Press, 1980. P. 173.
Litmanovich E.A., Kotova E.V., Efremov V.V. // Colloid Polym. Sci. 2019. V. 297. № 3. P. 371.
Khaidapova D.D., Pestonova E.A. // Eurasian Soil Sci. 2007. V. 40. № 11. P. 1187.
Andrews J.M. // J. Antimicrob. Chemotherapy. 2001. V. 48. № 1. P. 5.
Elbing K.L., Brent R. // Curr. Protoc. Mol. Biol. 2019. V. 125. № 1. P. e83.
Смит А. Прикладная ИК-спектроскопия / Пер. с англ. Б.Н. Тарасевича. M.: Мир, 1982.
Ходжаева В.Л., Заикин В.Г., Аракелян Г.Г., Клейнер В.И., Кренцель Б.A. // Высокомолек. соед. A. 1990. Т. 32. № 11. С. 2290.
Mende M., Petzold G., Buchhammer H.M. // Colloid Polym. Sci. 2002. V. 280. № 4. P. 342.
Novoskoltseva O.A., Chernikova E.V., Rogacheva V.B., Zezin A.B. // Polymer Science B. 2015. V. 57. № 2. P. 132.
Sorokin A., Bryzzhev A., Strokov A., Mirzabaev A., Johnson T., Kiselev S.V. // Economics of Land Degradation and Improvement – a Global Assessment for Sustainable Development / Eds by E. Nkonya, A. Mirzabaev, J. von Braun. Cham: Springer, 2016. P. 541.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)