Высокомолекулярные соединения (серия Б), 2021, T. 63, № 6, стр. 365-382
ФУНКЦИОНАЛИЗАЦИЯ АЛЬГИНАТА ДЛЯ МИКРОИНКАПСУЛЯЦИИ ИНСУЛИН-ПРОДУЦИРУЮЩИХ КЛЕТОК
Н. А. Леньшина a, *, А. Н. Конев a, М. А. Батенькин a, П. С. Бардина b, Е. И. Черкасова b, c, А. В. Кашина b, Е. В. Загайнова b, c, В. Е. Загайнов b, d, С. А. Чесноков a
a Институт металлоорганической химии им. Г.А. Разуваева Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
b Приволжский исследовательский медицинский университет Министерства здравоохранения Российской Федерации
603005 Нижний Новгород, пл. Минина и Пожарского, 10/1, Россия
c Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23, Россия
d ФБУЗ Приволжский окружной медицинский центр ФМБА России
603109 Нижний Новгород, ул. Ильинская,14, Россия
* E-mail: lennin@iomc.ras.ru
Поступила в редакцию 30.04.2021
После доработки 01.07.2021
Принята к публикации 31.08.2021
Аннотация
Альгинат является одним из самых часто применяемых и хорошо изученных полисахаридов естественного происхождения для инкапсуляции биологических объектов. Альгинатные гидрогели обладают хорошей биосовместимостью и часто применяется для создания оболочек вокруг островков Лангерганса поджелудочной железы с целью получения стабильных трансплантатов для достижения долгосрочной нормогликемии и профилактики фатальных гипогликемий при абсолютных инсулин-дефицитных заболеваниях. Однако существует проблема отторжения и гибели инкапсулированного трансплантата вследствие иммунного ответа. Одним из направлений исследований по снижению отторжения и увеличению совместимости и стабильности альгинатной оболочки является химическая модификация альгината. На данный момент получено большое количество химически функционализированных альгинатов для различных целей. Это дает возможность для изучения взаимосвязи между характером модификации и свойствами модифицированных альгинатов. В обзоре рассмотрены способы и закономерности химической модификации альгината натрия для целей микроинкапсуляции инсулин-продуцирующих клеток.
ВВЕДЕНИЕ
Трансплантация островков Лангерганса поджелудочной железы, способных выделять инсулин непосредственно в кровь в ответ на повышение уровня глюкозы, – эффективный и перспективный подход к лечению сахарного диабета первого типа и иных инсулин-дефицитных состояний. Этот подход в перспективе может позволить полностью освободить больного от необходимости пожизненных инъекций эндогенного инсулина, которые сейчас являются стандартом лечения [1–3]. Новейшие технологии доставки инсулина, такие как системы замкнутого цикла с непрерывным мониторингом уровня глюкозы и болюсной (непрерывной) инфузией как инсулина, так и глюкагона мало распространены из-за высоких затрат на закупку оборудования и замену сенсора, разрастания рубцовой ткани из-за многократных пункций микроиглами и преждевременный отказ сенсора [4]. Тем более искусственные системы не гарантируют полный гликемический контроль [5]. Трансплантация поджелудочной железы служит единственным патогенетическим методом лечения инсулин-дефицитных заболеваний и существенно улучшает качество жизни пациента [6]. Трансплантация органокомплекса поджелудочной железы и двенадцатиперстной кишки связана со значительным риском развития серьезных осложнений, таких как панкреатит, кровотечение, гуморальные и клеточные варианты отторжения. Кроме того, существующий дефицит органов ограничивает доступность операции [7]. Менее инвазивная альтернатива – трансплантация островков Лангерганса поджелудочной железы [8]. На данный момент наиболее прогрессивные клинические методики аллогенной трансплантации островков поджелудочной железы позволяют достигать инсулин-независимости почти у 50% реципиентов через пять лет после трансплантации [9]. Достижение инсулин-независимости не является основной целью трансплантации, главное – профилактика фатальных гипогликемий, основной причины смерти пациентов с сахарным диабетом первого типа. Недостатком этого метода является необходимость применения иммуносупрессерной терапии, что ведет к снижению качества жизни пациента, увеличению риска инфекционных, онкологических, сердечно-сосудистых и метаболических заболеваний. Последствия долгосрочной иммуносупрессии могут во многом нивелировать плюсы использования трансплантата, что в совокупности с проблемой нехватки доноров делает широкое применение такого метода практически невозможным [10–12]. Инкапсуляция трансплантируемых клеток в пористые полимерные оболочки, защищающие трансплантированные клетки путем их физической изоляции от иммунных клеточных реакций организма, может позволить полностью отказаться от системной иммуносупрессии и значительно увеличить срок жизни клеток в организме реципиента. При этом полимерная оболочка для инкапсуляции должна удовлетворять следующим критериям [13, 14]: пропускать инсулин в кровь, а кислород, глюкозу и т.п. к клеткам; не пропускать лейкоциты, фагоциты; быть совместимой как с инкапсулированными клетками, так и с организмом реципиента, чтобы не вызывать иммунологическую и фиброзную реакции; не подвергаться биодеградации в течение длительного периода времени (5–10 лет); иметь гладкую топографию без шероховатой поверхности; желательно стимулировать рост сосудов вокруг капсулы (для лучшего снабжения инкапсулированных клеток питанием и быстрого “отвода”выделяемого инсулина).
Необходимость обеспечения максимальной выживаемости и сохранения нормальной жизнедеятельности клеток также накладывают ограничения на условия проведения процедуры инкапсуляции, такие как исключение применения органических растворителей; проведение процедуры в водном растворе, изотоничном относительно цитозоля клеток (в среде физиологического раствора в присутствии фосфатного буфера); поддержание pH между 7.2 и 7.5; поддержание температуры от комнатной до 40°С (в идеале – при 37°С в атмосфере насыщенного водяными парами 5% углекислого газа); для равномерного распределения клеток или островков и предотвращения седиментации раствор должен быстро образовывать гель.
Все это существенно сужает круг предполагаемых для использования материалов. Приведенным условиям хорошо соответствуют полимерные гидрогели. Многие водорастворимые природные полимеры, такие как агароза, хитозан, целлюлоза и коллаген, показывают неплохие результаты при инкапсуляции клеток [15]. Из синтетических полимеров в основном используются полиэтиленгликоль и его производные. Однако наиболее популярным полимером для инкапсуляции клеток является альгинат натрия [16–18], способный в присутствии поливалентных ионов быстро образовывать гидрогели при нейтральном pH и умеренных температурах. Свойства альгинатных капсул зависят от многих факторов: строения и чистоты альгината, типа сшивающего катиона, концентрации альгината и сшивающего катиона, размера капсул и т.д. Это означает, что в теории получить стабильные альгинатные капсулы, способные минимизировать фиброз и продлить срок жизни инкапсулированных клеток, можно за счет тщательного подбора реагентов и условий инкапсуляции. Однако даже в случае наилучшего выбора композиции и параметров не исключается дестабилизация капсул за счет вымывания катионов в физиологических условиях хелатирующими соединениями, такими как фосфаты, и замену их ионами натрия. Одним из первых и наиболее изученных подходов для повышения стабильности альгинатных микрокапсул является покрытие их полиаминокислотами, такими как поли-L-лизин, поли-L-орнитин и поли-L-гуанидин [19–23]. Это положительно сказывается на механических свойствах гидрогелей и увеличивает стабильность капсул, но может in vivo приводить к активации воспалительных цитокинов и увеличению фиброза [24]. Ниже показана покрытая слоем полиаминокислоты альгинатная капсула с клетками.
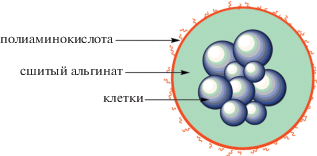
Несмотря на существенные достижения в стратегии использования альгината для инкапсуляции инсулин-продуцирующих клеток, при переходе к стадии клинических испытаний исследования часто терпят неудачу из-за смерти трансплантата вследствие иммунного ответа организма реципиента на инородное тело и разрушения капсулы. До сих пор не разработано универсальной методики, позволяющей инкапсулированным клеткам хорошо приживаться и долго функционировать в организме реципиента без применения системной иммуносупрессии.
В настоящее время одним из многообещающих подходов к увеличению стабильности и совместимости альгинатных капсул является химическая модификация альгината. Данный обзор сфокусирован на описании химически модифицированных альгинатов, по которым имеются данные об их использовании для микроинкапсуляции инсулин-продуцирующих клеток.
НЕМОДИФИЦИРОВАННЫЙ АЛЬГИНАТ: СТРОЕНИЕ, МЕТОДЫ МИКРОИНКАПСУЛЯЦИИ
Альгинат натрия (I) представляет собой натриевую соль альгиновой кислоты – гетерополимера двух уроновых кислот β-D-маннуроновой кислоты (М) и ее эпимера α-L-гулуроновой (Г), соединенных гликозидными связями. Структура альгината натрия и сшивание альгината в присутствии двух- и более валентных катионов металлов приведена ниже.
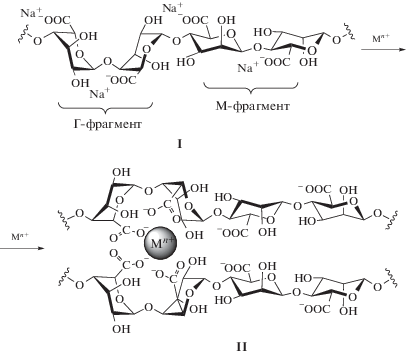
Фрагменты β-D-маннуроновой и α-L-гулуроновой кислот формируют в полимерной молекуле гомополимерные фрагменты, так называемые М- и Г-блоки, и гетерофрагменты – МГ-блоки. Соотношения кислот в молекуле варьируется в зависимости от конкретного вида водорослей и может быть изменено при помощи обработки энзимами [25, 26]. Альгинат легко и быстро, но в то же время мягко (безвредно для клеток), образует гидрогели (II) с двухвалентными катионами (Ca2+, Ba2+) в физиологических условиях, имеет низкую стоимость и токсичность [16, 27, 28].
Свойства формирующихся из альгината капсул, в том числе проницаемость, зависят от многих факторов: степени сшивки, максимально возможная величина которой определяется строением альгината; соотношением и последовательным расположением М- и Г-блоков [29–31], а также молекулярной массой [32]. Было показано, что гелеобразование происходит в основном за счет связывания двухвалентных катионов с Г-блоками альгината [33–36]. Альгинат натрия способен образовывать гели c различными поливалентными катионами металлов [37–39]. Природа сшивающего катиона влияет на свойства полученных гидрогелей [40, 41]. Для инкапсуляции клеток в основном используют гидрогели, сшитые ионами Ca2+, реже применяют ионы Ba2+, поскольку их использование сильно ограничивается потенциальной токсичностью, создающей риск отравления при вымывании ионов в физиологических условиях [42]. Для альгинатных гелей с высоким содержанием Г-фрагментов стабильность размеров и прочность геля возрастают при переходе от ионов Ca2+ к ионам Ba2+. Использование Ba2+ уменьшает размер сшитых капсул и снижает их проницаемость. Применение ионов Sr2+ приводит к образованию гелей с промежуточными характеристиками. Для альгината с высоким содержанием М-фрагментов было показано противоположное: капсулы, полученные с использованием ионов Ba2+ и Sr2+ были крупнее капсул альгината кальция и имели тенденцию к большему набуханию, что также приводило к увеличению проницаемости. Исследования показали, что различные блоки в альгинате связывают ионы в разной степени. Так, ионы Ca2+ связываются только с Г- и МГ-блоками, ионы Ba2+ с Г- и в меньшей степени М-блоками, и ионы Sr2+ с Г-блоками [16, 43, 44]. Также показано, что более стабильные капсулы, сшитые ионами кальция, могут быть получены путем ферментативной модификации альгината, после которой он содержит только Г- и МГ-блоки [29]. Стабильности капсул также способствует сшивка альгината раствором ионов кальция с добавкой ионов бария. Полученные таким образом капсулы способны обеспечивать защиту от иммунных реакций инкапсулированных островков Лангерганса человека при трансплантации больным диабетом мышам на срок до 220 дней при достижении нормогликемии в среднем на 134 дня [30]. Данные о влиянии соотношения Г- и М-фрагментов на биосовместимость капсулы противоречивы [45–50]. На степень сшивки также влияют такие факторы как pH раствора [51], концентрации альгината и сшивающего катиона [52].
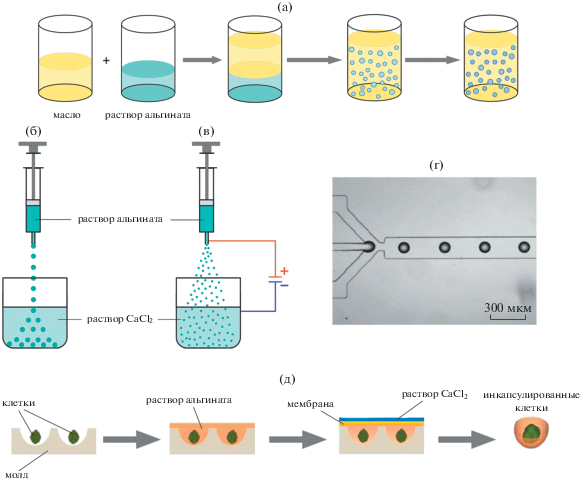
Исходя из размеров получающихся капсул выделяют макро-, микро- и наноинкапсуляцию [53, 54]. Микроинкапсуляция обычно представлена получением шарообразных капсул с диаметром от пары миллиметров до десятков микрометров (в случае клеток) [55]. Для целей иммуноизоляции клеток микроинкапсуляция наиболее распространена из-за оптимального соотношения объема капсулы к поверхности, которое обеспечивает быстрый обмен инсулином, кислородом и питательными веществами [56, 57]. Процесс микроинкапсуляции в общем виде включает в себя две стадии: 1 – генерация капель водного раствора смеси альгината и клеток, 2 – сшивание капель двухвалентными ионами с образованием капсул геля, ключевой стадией является получение капель альгинатного раствора. Методы микроинкапсуляции в основном классифицируются по способу их формирования. Для микроинкапсуляции клеток было разработано несколько методов [58, 59], включая получение эмульсий (рис. 1а) [60]; экструзию раствора альгината (рис. 1б) [61, 62]; электрораспыление (рис. 1в) [63, 64]; применение микрофлюидных устройств (рис. 1г) [65, 66]; микромолдинг (рис. 1д) [67, 68], в том числе с использованием полученных литографией молдов [69, 70].
Самый простой по техническому исполнению – эмульсионный метод. Его преимуществами являются низкая стоимость оборудования и простое масштабирование. Однако этот метод имеет недостатки, такие как высокая вариабельность размеров капсул, возможность повреждения капсул на границе раздела фаз [72], снижение выживаемости клеток из-за их контакта с органической фазой. По этим причинам эмульсионный метод сравнительно редко используется для микроинкапсуляции клеток, как и метод микромолдинга, который не позволяет сформировать сферические частицы, имеет сложности с осуществлением контроля над равномерностью сшивания и извлечением частиц геля из формы. Для дальнейшей трансплантации важно узкое распределение капсул по размерам и их воспроизводимость. Данным критериям хорошо соответствуют методы электрораспыления и микрофлюидики. Наиболее часто используемый метод микроинкапсуляции клеток – электрораспыление [73], в котором выброс капли из наконечника металлического капилляра осуществляется под действием электрического поля, при этом происходит перераспределение заряда в растворе и при достаточно сильном приложенном поле образуется струя, которая далее разлетается на мелкие капли [74]. Перспективным методом инкапсуляции инсулин-продуцирующих клеток считается использование микрофлюидных устройств, позволяющих достигать высокого уровня стандартизации условий инкапсуляции [75–79].
МОДИФИЦИРОВАННЫЙ АЛЬГИНАТ
В литературе описано много способов химической модификации альгината для различных целей [80–84]. Их можно условно разделить на два типа: модификация альгината без дополнительной сшивки и с целью осуществления дополнительной сшивки. Модификации альгината, не предполагающие дополнительной сшивки, в основном нацелены на снижение степени иммунного ответа: предотвращение образования фиброзной ткани вокруг капсулы и снижение воспалительных процессов. Модификация альгината фрагментами, обеспечивающими дополнительную сшивку, главным образом способствуют повышению стабильности капсулы за счет увеличения времени биодеградации. Большинство модификаций осуществляется по карбоксильной группе карбодиимидным методом с использованием водорастворимого карбодиимида 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) в комбинации с N-гидроксисукцинимидом (NHS) [80, 81].
Модификация без дополнительной сшивки
Группа исследователей [85] составила библиотеку сшитых ионом бария гидрогелей на основе 774 синтезированных производных низкомолекулярного (${{M}_{{v}}}$ ~ 25 × 103) альгината натрия с высоким содержанием фрагментов гулуроновой кислоты (>60%) [85]. Общая схема синтеза производных альгината натрия представлена ниже.
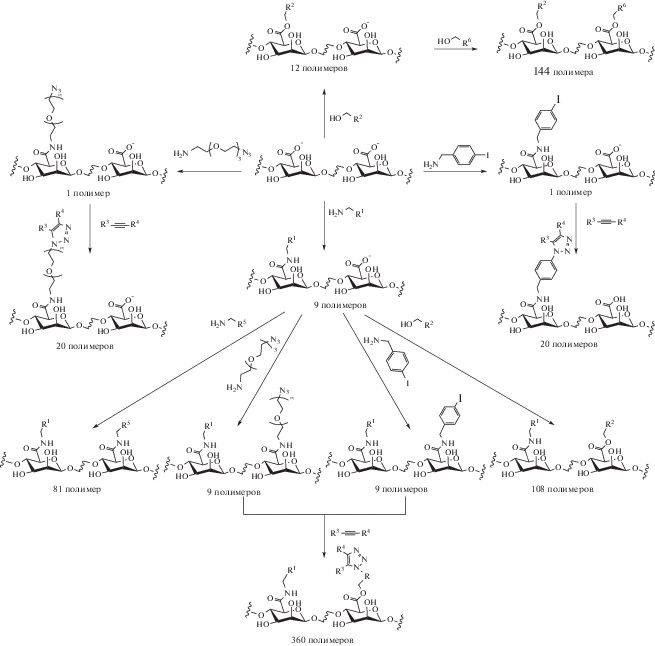
Были получены альгинатные производные, содержащие амино-, алкокси-, алькинильную или азидную группы. В ходе исследований показано, что 634 модифицированных альгината способны к гелеобразованию в присутствии двухвалентных катионов. Полученные с применением ионов бария гидрогели оценивали in vivo на иммунокомпетентных мышах линии C57BL/6J при подкожной имплантации. Анализ уровня острого воспаления проводили с помощью визуализирующего агента, который дает повышенную флуоресценцию в ответ на увеличение активности катепсина – маркера активации иммунных клеток. Двести функционализированных альгинатных гидрогелей продемонстрировали уровни флуоресценции ниже, чем у исходного немодифицированного альгинатного геля. Из них для 16 наиболее эффективных полимеров и еще 53 их структурных аналогов были получены микрокапсулы альгината бария диаметром от 300 до 350 мкм (размер, при котором альгинат индуцирует наиболее сильную реакцию на инородное тело [86]), и исследована степень образования на них фиброзной ткани по истечению 28 дней после внутрибрюшинной имплантации мышам линии C57BL/6J. Из протестированных полимеров авторы выделили три гидрогеля, для которых характерно наименьшее образование фиброза: III (степень функционализации 14.7% (в расчете на количество карбоксильных групп)), IV (степень функционализации 24.9%) и V (степень функционализации 15.1%):
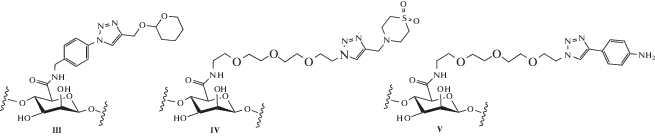
Эти гидрогели также продемонстрировали меньшую степень обрастания капсул фиброзной тканью после 6 месяцев трансплантации нечеловекообразным приматам по сравнению с исходным альгинатом.
Методом конфокальной рамановской спектроскопии было изучено распределение функциональных групп в микрокапсуле. При этом оказалось, что для III и IV интенсивность сигналов от функциональных групп выше на поверхности микрокапсулы, чем в ее ядре. Капсулы из альгината V имели равномерное распределение сигнала по всему поперечному сечению, но модификация на поверхности также присутствовала. Все три полимера являются производными триазола, что позволило авторам высказать предположение о том, что данный класс молекул может смягчать реакцию организма на инородное тело за счет ингибирования активации иммунных клеток на поверхности материалов и нарушения, таким образом, фиброзных процессов.
Лучшие результаты по снижению воспаления и фиброза показали гидрогели из производного IV, для которого и проводили дальнейшие исследования по инкапсуляции инсулин-продуцирующих клеток. Смесь производного IV с немодифицированным альгинатом в соотношении 87 : 13 по массе применяли для инкапсуляции β-клеток, полученных из стволовых клеток человека [87]. В соответствии с раннее опубликованными результатами для инкапсулированных в немодифицированный альгинатный гель островков Лангерганса крыс [86], в работе использовали сферические капсулы диаметром 1.5 мм. Полученные капсулы имели гетерогенную структуру с размерами пор в диапазоне от <1 мкм до 1–3 мкм, что позволяет предотвратить проникновение клеток и крупных белков. Инкапсулированные клетки трансплантировали во внутрибрюшинное пространство иммунокомпетентных мышей линии C57BL/6J с индуцированным диабетом первого типа. Показано, что такие трансплантаты индуцировали гликемическую коррекцию без какой-либо иммуносупрессии вплоть до их удаления через 174 дня после трансплантации. Извлеченные трансплантаты содержали жизнеспособные инсулин-продуцирующие клетки. Полученные результаты представляют собой первый пример долгосрочной гликемической коррекции на примере иммунокомпетентной модели животных с индуцированным диабетом первого типа с использованием β-клеток человека.
После этого производное IV было также протестировано как полимер для инкапсуляции аллогенных островков Лангерганса поджелудочной железы на модели нечеловекообразных приматов [88]. Исследования проводили на макаках циномолгус. Капсулы с островками поджелудочной железы макак получали с использованием смеси производного IV и немодифицированного альгината в соотношении 79.5 : 20.5 по массе. Для сшивания геля применяли ионы бария. Полученные микрокапсулы трансплантировали в сальниковую сумку макак. Использование капсулы из химически модифицированного альгината IV в сочетании с минимально инвазивной техникой трансплантации в сальниковую сумку обеспечивало жизнеспособность и чувствительность к глюкозе инкапсулированных аллогенных островков в течение 4 месяцев без применения иммуносупрессивной терапии. При извлечении через 1 месяц и 4 месяца после трансплантации на капсулах, полученных с использованием IV, не наблюдалось паракапсулярного фиброзного разрастания у 6 из 7 животных. Средняя выживаемость инкапсулированных островковых клеток составила 93.5% через 1 месяц и 90.0% через 4 месяца после трансплантации.
На основании данных о способности цвиттер-ионных полимеров снижать неспецифическую адсорбцию белка и других компонентов сыворотки и плазмы крови [89, 90] и препятствовать образованию фиброзной капсулы на поверхности гидрогелевого импланта [91] авторы [92] осуществили модификацию альгината натрия цвиттер-ионными фрагментами. В работе были синтезированы сульфобетаиновые (VI) и карбоксибетаиновые (VII) производные альгинатов натрия с разной ММ (25 × 103, (75–220) × 103, (200–300) × 103) и содержанием фрагментов гулуроновой кислоты >60%. Степень функционализации относительно исходного альгината составила 30.5% для производного VI и 24.7% производного VII.

На сшитых ионом бария пустых капсулах размером 500–700 мкм было показано, что модифицированные гидрогели существенно снижают чрезмерное обрастание клетками микрокапсул альгината по сравнению с немодифицированными альгинатами у мышей линии C57BL/6J (внутрибрюшинная имплантация, извлечение через 14, 100 и 180 дней), собаках породы бигль (внутрибрюшинная имплантация, извлечение через 45 и 90 дней), геттингенских мини-пигов (имплантация в сальниковую сумку, извлечение через 1 месяц). При этом лучшие результаты показали модифицированные сульфобетаиновыми фрагментами гидрогели VI. После чего инкапсулированные в этот гидрогель островки поджелудочной железы крыс (размер капсул 800–1000 мкм) были трансплантированы иммунокомпетентным мышам линии C57BL/6J с индуцированным диабетом первого типа. Микрокапсулы из модифицированного альгината обеспечивали значительно лучший долгосрочный контроль гликемии, вплоть до 200 дней по сравнению с максимум 100 днями для немодифицированных капсул. Характеристика извлеченных микрокапсул и островков подтверждает способность к уменьшению фиброза при использовании модифицированных альгинатных микрокапсул. Извлеченные через 200 дней после трансплантации инкапсулированные в модифицированный альгинат островки были способны вырабатывать инсулин. Извлеченные микрокапсулы также практически не имели на поверхности клеточного разрастания и фиброза. Авторы статьи утверждают, что по сравнению с вышеописанным подходом (схема синтеза производных альгината натрия), модификация цвиттер-ионными фрагментами представляет собой гораздо более простую и менее дорогую стратегию для проектирования и разработки супербиосовместимых альгинатов.
Модификация альгината фрагментами соединений, используемых в совместной инкапсуляции. Совместная инкапсуляция островков поджелудочной железы с противовоспалительными и иммуносупрессивными препаратами, в том числе кетопрофеном [93], способствует смягчению иммунного ответа организма реципиента и снижению степени перикапсулярного фиброзного разрастания после трансплантации за счет высвобождения препарата [94–96]. На примере функционализированного кетопрофеном альгината было показано, что использование ковалентного связывания препарата и выделение его в процессе гидролиза связи в физиологических условиях при инкапсуляции инсулин-продуцирующих клеток может сделать такой эффект более долгосрочным [97]. Для этого были синтезированы производные альгината, содержащие кетопрофен, соединенный с гидроксильными группами альгината через ПЭГ-содержащий мостик посредством сложноэфирной или амидной связей:

За счет изменения соотношения ПЭГ-содержащего производного кетопрофена и альгината в реакции были получены производные со степенью функционализации 7 и 20%. Сшитые ионами кальция пустые капсулы, функционализированные кетопрофеном через сложноэфирную связь (диаметр 500–600 мкм), in vitro при физиологическом рН (7.4) показали постоянное высвобождение лекарственного средства в течение двух недель без эффекта взрывного высвобождения кетопрофена в течение первых часов после образования капсул. При тех же условиях для кетопрофенового производного с амидной связью в течение двух недель высвобождались только следы препарата из-за гораздо более медленной скорости гидролиза амидной связи. Через 14 дней оба типа пустых альгинатных капсул все еще выделяли кетопрофен. Содержащие β-клетки поджелудочной железы линии MIN6 капсулы, полученные из кетопрофенового производного со сложноэфирной связью, in vitro выделяли кетопрофен в более высоких концентрациях в течение первых 7 дней по сравнению с пустыми капсулами, что может быть связано с присутствием гидролитических ферментов сложноэфирной связи в клеточном содержимом. В целом ковалентное связывание альгината с кетопрофеном обеспечивает более длительное высвобождение лекарственного средства, контролируемое скоростью гидролиза химической связи. Для проведения in vivo тестов пустые капсулы и капсулы, содержащие клетки MIN6, трансплантировали иммунокомпетентным мышам либо в брюшную полость, либо под почечную капсулу с последующим извлечением через 30 дней. Сравнение с капсулами из немодифицированного альгината, трансплантированными в тех же условиях, продемонстрировало явное снижение степени перикапсулярного фиброзного разрастания для капсул, функционализированных кетопрофеном. Воздействие было более выраженным, когда лекарственное средство было ковалентно соединено с помощью сложноэфирной связи, что позволяло достигать более высокой концентрации противовоспалительного препарата в месте трансплантации. Извлеченные инкапсулированные клетки были способны продуцировать инсулин.
Помимо работ, нацеленных на уменьшение степени обрастания капсул нежелательной фиброзной тканью, имеются исследования факторов, способствующих образованию вокруг капсулы сетки мелких сосудов, облегчающей снабжение инкапсулированных клеток кислородом и питательными веществами. Для инициирования васкуляризации и ангиогенеза при трансплантации применяются хорошо известный белок – фактор роста эндотелия сосудов (VEGF). Авторы [98] осуществили присоединение VEGF к альгинату (Mw = 250 × 103) и сравнили влияние VEGF, химически связанного с альгинатом (IX), и совместно инкапсулированного свободного VEGF на ангиогенез и жизнеспособность инкапсулированных островков поджелудочной железы мышей при аллогенной трансплантации:

Для инкапсуляции использовали 1.4 мас. %-ный раствор альгината IX с содержанием химически связанного VEGF 100 нг/мл – максимальное содержание VEGF, которое не сказывалось отрицательно на свойствах гидрогелей. Полученные из модифицированных альгинатов гидрогели при содержании VEGF больше 200–250 нг/мл для 1.4 мас. %-ного раствора демонстрировали резкое ухудшение механических свойств, и не могли образовывать достаточно плотно сшитый и сохраняющий форму гидрогель, который был бы пригоден для трансплантации. Химическое связывание предотвращает быстрое высвобождение VEGF и позволяет локально стимулировать васкуляризацию. В условиях in vitro для модифицированного альгинатного гидрогеля свободный VEGF не обнаруживался через 1 день и высвобождался только на 30% через один месяц за счет медленного гидролиза связи. Высвобождение 90% несвязанного VEGF из альгинатного гидрогеля наблюдалось в течение 24 ч. Диски геля полимера IX, не содержащие островков, толщиной 1 мм и диаметром 5 мм трансплантировали подкожно мышам линии C57BL/6. Извлеченные через 1 месяц трансплантаты были покрыты кровеносными сосудами разного размера, с рассчитанной плотностью 13.87 сосуда на 0.1 мм2, что больше содержания сосудов в соседней нормальной ткани. Для контрольных альгинатного геля и альгинатного геля со свободным VEGF в той же концентрации рассчитанная плотностью составила 1.66 и 0.47 сосуда на 0.1 мм2 соответственно. Далее инкапсулированные в эти три гидрогеля островки поджелудочной железы здоровых мышей линии C57BL/6 трансплантировали подкожно иммунокомпетентным мышам линии C57BL/6 с индуцированным диабетом первого типа. Нормогликемия достигалась на период около 45 дней для модифицированного альгината и до 15 дней для обоих контрольных гелей.
Извлечение островков поджелудочной железы из организма донора связано с разрушением их взаимодействий с внеклеточным матриксом [9]. Добавление белков внеклеточного матрикса способствует выживанию и нормальному функционированию инсулин-продуцирующих клеток [99–101]. На данный момент известны основные аминокислотные последовательности, которые встречаются во многих белках межклеточного матрикса и отвечают за адгезию клеток к нему, например, распространенная последовательность из L-аргинина, глицина и L-аспарагиновой кислот – так называемый RGD-фрагмент. Совместная инкапсуляция аргинилглициласпарагиновой кислоты (RGD-пептида) – трипептида, соответствующего RGD-фрагменту [101], положительно сказывается на выживаемости и функционировании островков поджелудочной железы человека. Авторы работы [102] осуществили модификацию альгината натрия ((75–200) × 103, содержание фрагментов гулуроновой кислоты ~68%) RGD-пептидом.
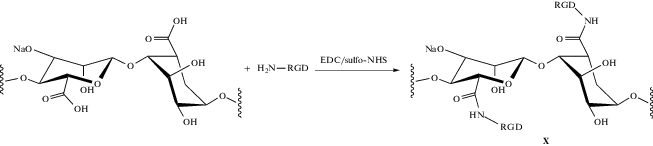
Синтезированное производное X использовали для инкапсуляции β-клеток островков поджелудочной железы линии INS-1E. Для этого брали 2%-ный раствор альгината с содержанием химически связанного пептида 200 мкмоль/л. Полученные микросферы с клетками (средний диаметр 1270 мкм) были трансплантированы в подкожное пространство, расположенное на шее, крысам Гото–Какидзаки с диабетом второго типа и извлечены через 21 день.
Инкапсулированные клетки обеспечивали улучшение гликемического профиля у больных диабетом крыс в течение всего времени эксперимента. После извлечения на капсулах наблюдалась тонкая мембрана коллагена, окружающая трансплантированные гидрогели. Эта мембрана оказалась хорошо васкуляризованной и имела множество микрососудов. Трансплантированные β-клетки после извлечения дают положительное окрашивание на инсулин, что указывает на их жизнеспособность и функциональную активность. В отличие от результатов, полученных in vitro, in vivo клетки INS-1E не образовывали псевдоостровковые сфероиды при трансплантации крысам: только несколько агломератов INS-1E были обнаружены внутри извлеченных капсул.
Альгинаты, функционализированные RGD-пептидом, также были получены с использованием эффективной двухстадийной процедуры, в которой альгинат окисляется м-периодатом натрия и затем функционализируется пептидом посредством восстановительного аминирования с использованием нетоксичного восстанавливающего агента 2-пиколин-боранового комплекса (pic-BH3) [103]. Данная процедура позволяет увеличить степень функционализации пептидами и не приводит к связыванию N-ацилмочевины с альгинатным скелетом и образованию производных мочевины [104]. По этой методике были синтезированы и альгинаты, функционализированные пептидами LRE, YIGSR, PDGEA и PDSGR (XI), также отвечающими за адгезию клеток к межклеточному матриксу:

В работе исследованы альгинаты со степенью функционализации до 8%, позволяющие получить сферические микрокапсулы. На инкапсулированных островках поджелудочной железы свиней in vitro показано, что только RGD-функционализированный альгинат повышает выживаемость и способность к стимулированной глюкозой секреции инсулина.
Модификация с целью обеспечения дополнительной сшивки
Капсулы с инсулин-продуцирующими клетками относятся к трансплантатам, предполагающим долгий срок использования. В данном случае относительно быстрая биодеградация оболочки, необходимая в случае замещения имплантата восстанавливающейся тканью организма в регенеративной медицине, приводит к нарушению защиты трансплантированных клеток и их гибели. Было замечено, что добавление ковалентной сшивки к ионной делает альгинатные гели более стабильными и может улучшать их механические свойства [105, 106]. Создать ковалентную сшивку в альгинатных гелях можно несколькими способами [107–110]. Один из них – проведение фотоинициируемой полимеризации специально введенных групп за счет функционализации исходного материала капсулы [111, 112], добавления полимеризационноспособных мономеров [113, 114] или сочетание этих двух подходов [115]. Первый подход в основном представлен работами с использованием метакрилированного альгината натрия [116, 117]. В литературе описано несколько методик введения метакриловых фрагментов в альгинат и проведения последующей фотополимеризации при инкапсуляции клеток [118, 119]. Применительно к инкапсуляции инсулин-продуцирующих клеток описан способ получения метакрилированного альгината XII реакцией с гидрохлоридом 2-аминоэтилметакрилата альгината и использования полученного полимера для инкапсуляции β-клеток линии MIN6 [120]:

Метакрилированные производные альгината XII были получены со степенью функционализации 0.31, 1.12, 2.19, 3.95 и 5.55%. Капсулы с использованием XII со средним диаметром 2560 мкм и 1350 мкм получали экструзией капли в сшивающий раствор хлорида кальция и последующим облучением ультрафиолетом в течение 15 мин в присутствии фотоинициатора Иргакура 1173 In vitro двойное сшивание приводило к улучшению стабильности капсул без какого-либо разрушения даже при самой низкой степени метакрилирования (0.31%), по сравнению с немодифицированным альгинатом, демонстрирующим быструю деструкцию капсул. Базовый уровень секреции инсулина для инкапсулированных клеток линии MIN6 in vitro был выше для капсул со степенью метакрилирования 1.12%, однако различия между группами не были статистически значимыми. Выживаемость клеток составила более 95% через 10 дней после инкапсуляции для всех альгинатов. Для исследования стабильности метакрилированого гидрогеля in vivo пустые капсулы из метакрилированного альгината (1.12%) имплантировали в сальниковую сумку крыс Sprague Dawley совместно с локальной инъекцией 5 мкг липополисахарида для стимуляции сильного воспалительного ответа. Трансплантаты извлекали через 1 и 3 недели и подвергали гистологическому анализу. Через 1 неделю наблюдалось значительное воспаление и разрушение большей части неметакрилированных альгинатных микрокапсул, тогда как метакрилированные капсулы оставались неповрежденными. Капсулы с двойным сшиванием были стабильными в течение 3 недель.
Для инкапсуляции клеток линии MIN6 использовали альгинатные гидрогели с дополнительной ковалентной сшивкой за счет дисульфидных связей [121] – типа ковалентной сшивки, который чаще используют в исследованиях по таргетной доставке лекарств [122, 123]. Были получены производные альгината натрия, содержащие тиольные (XIII) (степень функционализации 5.2–13.0%) или 1,2-дитиолановые (XIV) (степень функционализации 6.7–21.0%) функциональные группы:

Получение капсул с двойной сшивкой из этих полимеров не требует введения фотоинициаторов. Капсулы формируются за счет быстрого ионного гелеобразования, а затем происходит медленное ковалентное сшивание. По сравнению с немодифицированными альгинатами гели с дисульфидным мостиком обладают улучшенными механическими свойствами, в частности, они лучше восстанавливали форму после нескольких сжатий. Для капсул диаметром 500 мкм средняя выживаемость клеток in vitro составила 70% через 15 дней, при этом инкапсуляция в оба геля in vitro не влияет на способность клеток выделять инсулин в ответ на стимуляцию глюкозой. Для гидрогелей с XIV (мостик ПЭГ с n = 44) наблюдалась деградация в среде свободных клеток через 10 дней. Пустые капсулы с диаметром ~ 1000 мкм имплантировали мышам в брюшину и извлекали через 30 дней, при этом не было обнаружено никаких признаков воспаления, образования соединительной ткани или фиброза (но нет информации об их целостности).
Существует направление исследований по увеличению стабильности альгинатных гидрогелей за счет полной замены ионных сшивающих связей на ковалентные, в том числе и с использованием сшивки между катехольными фрагментами [124, 125]. В исследовании [126] впервые была осуществлена инкапсуляция островковых клеток поджелудочной железы мыши в гидрогель из катехолсодержащего альгината (XV), сшитый только за счет димеризации катехольных фрагментов:
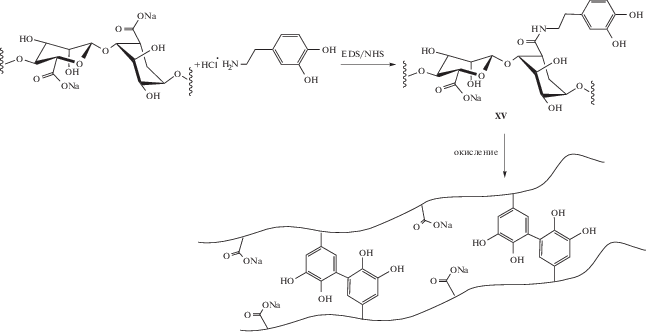
Полученные таким образом капсулы ex vivo не цитотоксичны для островковых клеток в течение длительного периода. Однако было замечено, что инкапсуляция в катехолсодержащий альгинат заметно снижает стимулированную глюкозой секрецию инсулина. В итоге авторами был сделан вывод о нецелесообразности применения катехола как сшивающего фрагмента для гелеобразования альгината при инкапсуляции островковых клеток и их трансплантации. Увеличение адгезионной способности гидрогеля за счет введения катехольных фрагментов может приводить к образованию прочных связей между поверхностью геля и клеточной мембраной [127]. На этом основании авторы предположили, что снижение секреции инсулина инкапсулированными в катехолсодержащей гель клетками может быть связано с нарушениями в работе мембранных белков островковых клеток, таких как транспортеры глюкозы, а также ионных каналов.
Простым и красивым способом снижения степени биодеградации является включение в материал химических сшивок, образованных за счет так называемых биоортогональных реакций – химических реакций, протекание которых внутри живых систем никак не сказывается на проходящих в них биохимических процессах и никак не влияют на их жизнедеятельность. Эти реакции не встречаются в живых системах, потому что в живых организмах отсутствуют ферменты, специализирующиеся на разрушении образующихся таким образом связей. По этой причине биоортогональные реакции часто используются для увеличения совместимости имплантируемых материалов и придания им стабильности за счет предотвращения деградации в организме. K.M. Gatta’s-Asfura и соавторы [128] синтезировали азидсодержащий альгинат (XVI) (Mw = = (200–300) × 103, содержание гулуроновых фрагментов >60%) и использовали его для получения альгинатных гидрогелей с дополнительной ковалентной сшивкой биоортогональным лигированием по Штаудингеру:

Степень функционализации азидом варьировали от 3 до 13%. Функционализированный полимер способен к гелеобразованию в присутствии катионов Ca2+ или Ba2+. Вместе с тем функционализация приводит к снижению взаимодействия с ионами кальция. Так, сшитые Ca2+ гранулы функционализированного альгината растворяются в течение 2 ч при комнатной температуре при инкубации в натрий-фосфатном буфере, не содержащим Ca2+, в то время как стандартные гранулы альгината, сшитые Ca2+, в тех же условиях не растворяются до >20 ч. Кроме того, оба сшитых Ba2+ альгината гидрогеля оставались стабильными в течение нескольких недель при инкубации в натрий-фосфатном буфере, не содержащем ионов Ba2+ или Ca2+. В исследованиях использовали азидсодержащий альгинат со степенью функционализации 11%. Для ковалентной сшивки азидсодержащего альгината использовали несколько кросслинкеров [129]:
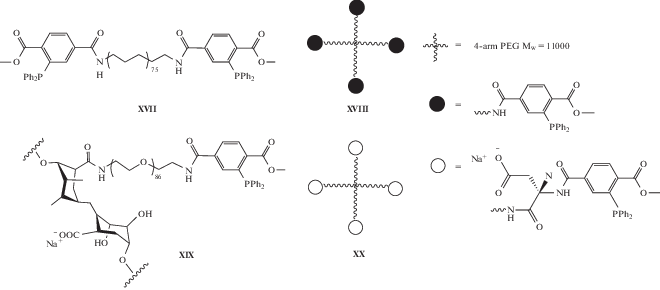
Были изготовлены две группы гидрогелей (диаметр капсул около 2.6 мм): альгинатный гель, сшитый ионами Ca2+ или Ba2+, и альгинатный гель, сшитый ионами (Ca2+ или Ba2+) и лигированием по Штаудингеру. Степень протекания реакции лигирования ~70% за 7 ч для всех кросслинкеров. Все исследованные гидрогели демонстрировали лучшую выживаемость и пролиферацию клеток по сравнению с немодифицированным альгинатом.
По результатам исследований авторы позиционируют кросслинкер XIX на основе альгината как самый перспективный из-за его способности хорошо смешиваться с азид-функционализированным альгинатом и образования ковалентной сшивки без предварительной инкубации, а также умеренной пролиферации клеток в полученных с его использованием капсулах.
В вышедшей в том же году, что и работа [129], публикации [130] описывается исследование влияния инкапсуляции в альгинатный гель, сшитый с использованием кросслинкера XVII, на выживаемость и жизнедеятельность клеток MIN6, крысиных и человеческих островков поджелудочной железы in vitro. Выживаемость всех трех инкапсулятов сопоставима с контрольными образцами из немодифиицрованного альгината. Однако для клеток MIN6 на седьмой день наблюдалась статистически значимая разница в метаболической активности. Для инкапсулированных островков не отмечалось существенной разницы в уровне секреции инсулина во всех группах. Пустые капсулы с двойной сшивкой менее склонны к набуханию и в отличие от контрольных капсул не растворяются при выдерживании в растворе этилендиаминтетрауксусной кислоты. В дальнейшем авторы использовали этот подход для получения тонкого трехслойного покрытия [131] и четырехслойного покрытия [132] для инкапсуляции островков.
ЗАКЛЮЧЕНИЕ
Несмотря на существенные ограничения при проведении реакций с альгинатом натрия из-за его нерастворимости в органических растворителях и кислых водных растворах, на данный момент разработан ряд методик, позволяющих получать разнообразные функционализированные альгинаты. Модификации альгината для целей микроинкапсуляции инсулин-продуцирующих клеток проводятся в основном по карбоксильной группе. На данный момент в литературе имеется не так много работ, посвященных инкапсуляции инсулин-продуцирующих клеток в функционализированные альгинатные гели. Из-за ограниченного количества публикаций по доклиническим исследованиям и отсутствия опубликованных работ с результатами клиническими испытаниями препаратов не установлено пока однозначного понимания взаимосвязи между характером модификации альгината и ее влиянием на активность инкапсулированных клеток in vivo и часто неизвестен иммунный ответ организма реципиента после трансплантации. Однако из имеющихся данных следует, что правильно подобранная химическая модификация альгината способна положительно влиять на способность капсулы из альгинатного геля препятствовать фиброзному обрастанию, снижать влияние иммунного ответа на капсулу, а также позволяет увеличивать ее стабильность и время биодеградации относительно капсул из немодифицированного альгината. Дальнейшие исследования в этом направлении могут способствовать устранению барьеров, которые в настоящее время ограничивают широкое применение трансплантации инкапсулированных аллогенных инсулин-продуцирующих клеток для лечения сахарного диабета первого типа.
Работа выполнена при финансовой поддержке Министерства здравоохранения Российской Федерации (Государственное задание АААА-А20-120022590096-6 по теме “Создание технологии инкапсуляции островков поджелудочной железы для компенсации абсолютных инсулин-дефицитных состояний”).
Список литературы
Ballinger W.F., Lacy P.E. // Society University Surgeons. 1972. V. 72. № 2. P. 175.
Fan M.Y., Lum W.R.Z.P., Fu X.W., Levesque L., Tai I.T., Sun A.M. // Diabetes. 1990. V. 39. № 5. P. 192.
Altman J.J., Houlbert A., Callard P., McMillan P., Solomon B.A., Rosen J., Galetti P.M. // Diabetes. 1986. V. 35. V. 6. P. 625.
Bekiari E., Kitsios K., Thabit H. // BMJ. 2018. V. 361. P. k131.
Jacobs P.G., El Youssef J., Reddy R. // Diabetes Obes. Metab. 2016. V. 18. № 11. P. 1110.
Gruessner A.C., Gruessner R.W. // Curr. Opin. Organ. Transplant. 2016. V. 21. № 4. P. 377.
Kim J., Kang K., Drogemuller C.J., Wallace G.G., Coates P.T. // Curr. Diab. Rep. 2019. V. 19. № 8. P. 53.
Vantyghem M.-C., de Koning E.J.P., Pattou F., Rickels M.R. // The Lancet. 2019. V. 394. № 10205. P. 1274.
Pepper A.R., Bruni A., Shapiro A.M.J. // Curr. Opin. Organ. Transplant. 2018. V. 23. № 4. P. 428.
Desai N.M., Goss J.A., Deng S., Wolf B.A., Markmann E., Palanjian M., Shock A.P., Feliciano S., Brunicardi F.C., Barker C.F., Naji A., Markmann J.F. // Transplantation. 2003. V. 76. № 11. P. 1623.
Zhang N., Su D., Qu S., Tse T., Bottino R., Balamurugan A.N., Xu J., Bromberg J.S., Dong H.H. // Diabetes. 2006. V. 55. P. 2429.
Salama A.D., Womer K.L., Sayegh M.H. // J. Immunol. 2007. V. 178. № 9. P. 5419.
Strand B.L., Coron A.E., Skjak-Braek G. // Stem Cells Transl. Med. 2017. V. 6. P. 1053.
Transplantation, Bioengineering, and Regeneration of the Endocrine Pancreas / Ed. by G. Orlando, L. Piemonti, C. Ricordi, R.J. Stratta, R.W.G. Gruessner. Cambridge: Acad. Press, 2020.
Hu S., de Vos P. // Front. Bioeng. Biotechnol. 2019. V. 7. P. 134.
Lee K.Y., Mooney D.J. // Prog. Polym. Sci. 2012. V. 37. P. 106.
Kearney C.J., Mooney D.J. // Nat. Mater. 2013. V. 12. P. 1004.
Polysaccharide Carriers for Drug Delivery / Ed. by S. Maiti, S. Jana. Cambridge: Woodhead Publ., 2019.
Rockstad A.M., Brekke O.L., Steinkjer B., Ryan L., Kollarikova G., Strand B.L., Skjak-Braek G., Lambris J.D., Lacik I., Mollnes T.E., Espevika T. // Biomaterials. 2013. V. 34. P. 621.
Safley S.A., Cui H., Cauffiel S., Tucker-Burden C., Weber C.J. // J. Diabetes Sci. Technol. 2008. V. 2. P. 760.
Kollmer M., Appel A.A., Somo S.I., Brey E.M. // Tissue Eng. B. 2015. V. 22. P. 34.
Mooranian A., Negrulj R., Arfuso F., Al-Salami H. // Artif. Cells Nanomed. Biotechnol. 2016. V. 44. P. 194.
Kleinberger R.M., Burke N.A., Zhou C., Stover H.D. // J. Biomater. Sci. Polym. Ed. 2016. V. 27. P. 351.
Strand B.L., Ryan L., In’t Veld P., Kulseng B., Rokstad A.M., Skjåk-Bræk G., Espevik T. // Cell Transplant. 2001. V. 10. P. 263.
Carbohydrate Biotechnology Protocols / Ed. by C. Bucke. Totowa: Humana Press, 1999.
Alginates: Biology and Applications / Ed. by B.H.A. Rehm. Berlin; Heidelberg: Springer, 2009.
Otterlei M., Østgaard K., Skjåk-Bræk G., Smidsrød O., Soon-Shiong P., Espevik T. // J. Immunother. 1991. V. 10. P. 286.
Pervaiz M., Ahmad I., Yousaf M., Kirn, S., Munawar A., Saeed Z., Adnan A., Gulzar T., Kamal T., Ahmad A., Rashidal A. // Spectrochim. Acta A. 2019. V. 206. P. 642.
Morch Y.A., Donati I., Strand B.L. // Biomacromolecules. 2007. V. 8. P. 2809.
Qi M., Mørch Y., Lacík I., Formo K., Marchese E., Wang Y., Danielson K.K., Kinzer K., Wang S., Barbaro B., Kolláriková G., Chorvát Jr D., Hunkeler D., Skjåk-Bræk G., Oberholzer J., Strand B.L. // Xenotransplantation. 2012. V. 19. P. 355.
Drury J.L., Dennis R.G., Mooney D.J. // Biomaterials. 2004. V. 25. P. 3187.
Martinsen A., Skjak-Braek G., Smidrsod O. // Biotechnol. Bioeng. 1989. V. 33. P. 79.
Emmerichs N., Wingender J., Flemming H.-C., Mayer C. // Int. J. Biol. Macromol. 2004. V. 34. P. 73.
Braccini I., Pérez S. // Biomacromolecules. 2001. V. 2. P. 1089.
Sikorski P., Mo F., Skjåk-Bræk G., Stokke B.T. // Biomacromolecules. 2007. V. 8. P. 2098.
Hecht H., Srebnik S. // Biomacromolecules. 2016. V. 17. № 6. P. 2160.
Dodero A., Pianella L., Vicini S., Alloisio M., Ottonelli M., Castellano M. // Eur. Polym. J. 2019. V. 118. P. 586.
Iskandar L., Rojo L., Di Silvio L., Deb S. // J. Biomater. Appl. 2019. V. 34. № 4. P. 573.
Rodrigues R.J., Lagoa R. // J. Carbohydr. Chem. 2006. V. 25. № 2-3. P. 219.
Harper B.A., Barbut S., Lim L.-T., Marcone M.F. // J. Food Sci. 2014. V. 79. № 4. P. E562.
Urbanova M., Pavelkova M., Czernek J., Kubova K., Vyslouzil J., Pechova A., Molinkova D., Vyslouzil J., Vetchy D., Brus J. // Biomacromolecules. 2019. V. 20. № 11. P. 4158.
Mørch Y.A., Qi M., Gundersen P.O.M., Formo K., Lacik I., Skjåk-Bræk G., Oberholzer J., Strand B.L. // J. Biomed. Mater. Res. A. 2012. V. 100A. P. 2939.
Mørch Y.A., Donati I., Strand B. L., Skjåk-Bræk G. // Biomacromolecules. 2006. V. 7. № 5. P. 1471.
Haug A., Smidsrod O. // Acta Chem. Scand. 1970. V. 24. P. 843.
Vériter S., Mergen J., Goebbels R.M., Aouassar N., Grégoire C., Jordan B., Levêque P., Gallez B., Gianello P., Dufrane D. // Tissue Eng. A. 2010. V. 16. № 5. P. 1503.
Tam S.K., Dusseault J., Bilodeau S., Langlois G., Hallé J.P., Yahia L.H. // J. Biomed. Mater. Res. A. 2011. V. 98. № 1. P. 40.
Otterlei M., Ostgaard K., Skjakbraek G., Smidsrod O., Soonshiong P., Espevik T. // J. Immunother. 1991. V. 10. P. 286.
Zimmermann U., Klock G., Federlin K., Haning K., Kowaslski M., Bretzel R.G., Horcher A., Entenmann H., Siebers U., Zekorn T. // Electrophoresis. 1992. V. 13. P. 269.
Orive G., Ponce S., Hernandez R.M., Gascon A.R., Igartua M., Pedraz J.L. // Biomaterials. 2002. V. 23. P. 3825.
Heiligenstein S., Cucchiarini M., Laschke M.W., Bohle R.M., Kohn D., Menger M.D., Madry H. // Tissue Eng. Part C: Methods. 2011. V. 17. № 8. P. 829.
Chuang J.-J., Huang Y.-Y., Lo S.-H., Hsu T.-F., Huang W.-Y., Huang S.-L., Lin Y.-S. // Int. J. Polym. Sci. 2017. V. 2017. Article ID 3902704.
Правдюк А.И., Петренко Ю.А., Волкова Н.А., Петренко А.Ю. // Биотехнология. 2010. № 3. С. 62.
Chang T.M.S. // Artificial Cells, Blood Substitutes, and Biotechnology. 2004. V. 32. № 1. P. 1.
Hwang P.T.J., Shah D.K., Garcia J.A., Bae C.Y., Lim D.-J., Huiszoon R.C., Alexander G.C., Jun H.-W. // Nano Converg. 2016. V. 3. Article № 28.
Lopez-Mendez T.B., Santos-Vizcaino E., Pedraz J.L., Hernandez R.M., Orive G. // Drug Discov. Today. 2021. V. 26. № 3. P. 852.
Current Trends and Future Developments on (Bio-) Membranes: Membrane Desalination Systems: the Next Generation / Ed. by A. Basile, E. Curcio. Amsterdam; Oxford; Cambridge: Elsevier, 2018.
Murua A., Portero A., Orive G., Hernández R.M., de Castro M., Pedraz J.L. // J. Control. Release. 2008. V. 132. № 2. P. 76.
Cell Microencapsulation / Ed. by E.C. Opara. Springer New York, 2017.
Steele J.A.M., Halle J.-P., Poncelet D., Neufeld R.J. // Adv. Drug Deliv. Rev. 2014. V. 67–68. P. 74.
Hoesli C.A., Kiang R.L., Mocinecova D., Donald-Hague C., Lacík I., Kieffer T.J., Piret J.M. // J. Biomed. Mater. Res. B. 2012. V. 100. P. 1017.
Farias C., Lyman R., Hemingway C., Chau H., Mahacek A., Bouzos E., Mobed-Miremadi M. // Bioengineering. 2018. V. 5. P. 59.
Silva M.P., Tulini F.L., Martins E., Penning M., Fávaro-Trindade C.S., Poncelet D. // LWT. 2018. V. 89. P. 392.
Yang D., Wu W., Wang S. // Int. J. Polym. Mater. 2018. V. 67. № 18. P. 1087.
Boda S.K., Li X., Xie J. // J. Aerosol Sci. 2018. V. 125. P. 164.
Headen D., García J., García A. // Microsyst. Nanoeng. 2018. V. 4. P. 17076.
Rossow T., Lienemann P.S., Mooney D.J. // Macromol. Chem. Phys. 2017. V. 218. № 2. P. 1600380.
Lee B.R., Hwang J.W., Choi Y.Y., Wong S.F., Hwang Y.H., Lee D.Y., Lee S.-H. // Biomaterials. 2012. V. 33. № 3. P. 837.
Lee K.H., Kim S.-H., Ryoo J.H., Wong S.F., Lee S.-H. // Lab Chip. 2011. V. 11. P. 1168.
Choe G., Park J., Park H., Lee J.Y. // Polymers. 2018. V. 10. № 9. P. 997.
Kang A.R., Park J.S., Ju J., Jeong G.S., Lee S.-H. // Biomaterials. 2014. V. 35. № 9. P. 2651.
Zhang H., Tumarkin E., Peerani R., Nie Z., Sullan R.M.A., Walker G.C., Kumacheva E. // J. Am. Chem. Soc. 2006. V. 128. № 37. P. 12205.
Ekerdt B.L., Fuentes C.M., Lei Y., Adil M.M., Ramasubramanian A., Segalman R.A., Schaffer D.V. // Adv. Healthc. Mater. 2018. V. 7. P. 1800225.
Nikoo A.M., Kadkhodaee R., Ghorani B., Razzaq H., Tucker N. // J. Microencapsul. 2016. V. 33. № 7. P. 605.
Rutkowski S., Si T., Gai M., Frueh J., He Q. // RSC Adv. 2018. V. 8. P. 24243.
Opara E.C., Mirmalek-Sani S.-H., Khanna O., Moya M.L., Brey E.M. // J. Investig. Med. 2010. V. 58. № 7. P. 831.
Tendulkar S., Mirmalek-Sani S.-H., Childers C., Saul J., Opara E., Ramasubramanian M. // Biomed. Microdevices. 2012. V. 14. № 3. P. 461.
Liu H.-T., Wang H., Wei W.-B., Liu H., Jiang L., Qin J.-H. // Small. 2018. V. 14. P. 1801095.
Chen W., Lisowski M., Khalil G., Sweet I.R., Shen A.Q. // PLoS One. 2012. V. 7. № 3. P. e33070.
Wiedemeier S., Ehrhart F., Mettler E., Gastrock G., Forst T., Weber M.M., Zimmermann H., Metze J. // Eng. Life Sci. 2011. V. 11. № 2. P. 165.
Yang J.-S., Xie Y.-J., He W. // Carbohydr. Polym. 2011. V. 84. № 1. P. 33.
Pawar S.N., Edgar K.J. // Biomaterials. 2012. V. 33. № 11. P. 3279.
Banks S.R., Enck K., Wright M., Opara E. C., Welker M.E. // J. Agric. Food Chem. 2019. V. 67. № 37. P. 10481.
Benettayeb A., Guibal E., Morsli A., Kessas R. // Chem. Eng. J. 2017. V. 316. P. 704.
García-Astrain C., Avérous L. // Carbohydr. Polymers. 2018. V. 190. P. 271.
Vegas A.J., Veiseh O., Doloff J.C., Ma M., Tam H.H., Bratlie K., Li J., Bader A.R., Langan E., Olejnik K., Fenton P., Kang J.W., Hollister-Locke J., Bochenek M.A., Chiu A., Siebert S., Tang K., Jhunjhunwala S., Aresta-Dasilva S., Dholakia N., Thakrar R., Vietti T., Chen M., Cohen J., Siniakowicz K., Qi M., McGarrigle J., Graham A.C., Lyle S., Harlan D.M., Greiner D.L., Oberholzer J., Weir G.C., Langer R., Anderson D.G. // Nat. Biotechnol. 2016. V. 34. № 3. P. 345.
Veiseh O., Doloff J.C., Ma M., Vegas A.J., Hei Tam H., Bader A.R., Li J., Langan E., Wyckoff J., Loo W.S., Jhunjhunwala S., Chiu A., Siebert S., Tang K., Hollister-Lock J., Aresta-Dasilva S., Bochenek M., Mendoza-Elias J., Wang Y., Qi M., Lavin D.M., Chen M., Dholakia N., Thakrar R., Lacík I., Weir G.C., Oberholzer J., Greiner D.L., Langer R., Anderson D.G. // Nat. Mater. 2015. V. 14. P. 643.
Vegas A.J., Veiseh O., Gürtler M., Millman J.R., Pagliuca F.W., Bader A.R., Doloff J.C., Li J., Chen M., Olejnik K., Hei Tam H., Jhunjhunwala S., Langan E., Aresta-Dasilva S., Gandham S., McGarrigle J.J., Bochenek M.A., Hollister-Lock J., Oberholzer J., Greiner D.L., Weir G.C., Melton D.A., Langer R., Anderson D.G. // Nat. med. 2016. V. 22. № 3. P. 306.
Bochenek M.A., Veiseh O., Vegas A.J., McGarrigle J.J., Qi M., Marchese E., Omami M., Doloff J.C., Mendoza-Elias J., Nourmohammadzadeh M., Khan A., Yeh C.-C., Xing Y., Isa D., Ghani S., Li J., Landry C., Bader A.R., Olejnik K., Chen M., Hollister-Lock J., Wang Y., Greiner D.L., Wei G.C., Løkensgard Strand B., Rokstad A.M.A., Lacik I., Langer R., Anderson D.G., Oberholzer J. // Nat. Biomed. Eng. 2018. V. 2. P. 810.
Jiang S., Cao Z. // Adv. Mater. 2010. V. 22. P. 920.
Ladd J., Zhang Z., Chen S., Hower J. C., Jiang S. // Biomacromolecules. 2008. V. 9. P. 1357.
Zhang L., Cao Z., Bai T., Carr L., Ella-Menye J.-R., Irvin C., Ratner B.D., Jiang S. // Nat. Biotechnol. 2013. V. 31. P. 553.
Liu Q., Chiu A., Wang L.-H., An D., Zhong M., Smink A.M., de Haan B.J., de Vos P., Keane K., Vegge A., Chen E.Y., Song W., Liu W.F., Flanders J., Rescan C., Groth Grunnet L., Wang X., Ma M. // Nat. Commun. 2019. V. 10. P. 5262.
Ricci M., Blasi P., Giovagnoli S., Rossi C., Macchiarulo G., Luca G., Basta G., Calafiore R. // J. Control. Release. 2005. V. 107. № 3. P. 395.
Azadi S.A., Vasheghani-Farahani E., Hashemi-Najafbabadi S., Godini A. // Prog. Biomater. 2016. V. 5. P. 101.
Dang T., Thai A.V., Cohen J., Slosberg J.E., Siniakowicz K., Doloff J.C., Ma M., Hollister-Lock J., Tang K.M., Gu Z., Cheng H., Weir G.C., Langer R., Anderson D.G. // Biomaterials. 2013. V. 34. № 23. P. 5792.
Park H.-S., Kim J.-W., Lee S.-H., Yang H. K., Ham D.-S., Sun C.-L., Hong T.H., Khang G., Park C.-G., Yoon K.-H. // J. Tissue Eng. Regen. Med. 2017. V. 11. P. 1274.
Noverraz F., Montanari E., Pimenta J., Szabo L., Ortiz D., Gonelle-Gispert C., Buhler L.H., Gerber-Lemaire S. // Bioconjugate Chem. 2018. V. 29. № 6. P. 1932.
Yin N., Han Y., Xu H., Gao Y., Yi T., Yao J., Dong L., Cheng D., Chen Z. // Mater. Sci. Eng. C. 2016. V. 59. P. 958.
Townsend S.E., Gannon M. // Endocrinology. 2019. V. 160. № 8. P. 1885.
Daoud J., Petropavlovskaia M., Rosenberg L., Tabrizian M. // Biomaterials. 2010. V. 31. № 7. P. 1676.
Llacua A., de Haan B.J., Smink S.A., de Vos P. // J. Biomed. Mater. Res. A. 2016. V. 104. № 7. P. 1788.
Crisóstomo J., Pereira A.M., Bidarra S.J., Gonçalves A.C., Granja P.L., Coelho J.F.J., Barrias C.C., Seiça R. // J. Appl. Biomater. Func. 2019. V. 17. № 4. P. 2280800019848923.
Medina J.D., Alexander M., Hunckler M.D., Fernández-Yagüe M.A., Coronel M.M., Smink A.M., Lakey J.R., de Vos P., García A.J. // Adv. Healthcare Mater. 2020. V. 9. № 9. P. 2000102.
Sandvig I., Karstensen K., Rokstad A.M., Aachmann F.L., Formo K., Sandvig A., Skjåk-Bræk G., Løkensgard Strand B. // J. Biomed. Mater. Res. A. 2015. V. 103. № 3. P. 896.
Birnbaum S., Pendleton R., Larsson P.-O., Mosbach K. // Biotechnol. Lett. 1981. V. 3. P. 393.
Lee K.Y., Rowley J.A., Eiselt P., Moy E.M., Bouhadir K.H., Mooney D.J. // Macromolecules. 2000. V. 33. № 11. P. 4291.
Nataraj D., Reddy N. // Int. J. Chem. Res. 2020. V. 4. № 1. P. 1.
Kim E., Kim M.H., Song J.H., Kang C., Park W.H. // Int. J. Biol. Macromol. 2020. V. 154. P. 989.
Sánchez-Morán H., Ahmadi A., Vogler B., Roh K.H. // Biomacromolecules. 2019. V. 20. № 12. P. 4419.
Moody C.T., Palvai S., Brudno Y. // Acta Biomater. 2020. V. 112. P. 112.
Coates E.E., Riggin C.N., Fisher J.P. // J. Biomed. Mater. Res. A. 2013. V. 101. № 7. P. 1962.
Mignon A., Devisscher D., Graulus G.J., Stubbe B., Martins J., Dubruel P., De Beliea N., Van Vlierberghe S. // Carbohydr. Polymers. 2017. V. 155. P. 448.
Zhou Q., Kang H., Bielec M., Wu X., Cheng Q., Wei W., Dai H. // Carbohydr. Polymers. 2018. V. 197. P. 292.
Zhao D., Tie C., Cheng B., Yang S., Wang X., Sun Z., Yinc M., Zhud H., Yin M. // Polym. Degrad. Stab. 2020. V. 179. P. 109297.
Zhao J., Zhao X., Guo, Ma P.X. // Biomacromolecules. 2014. V. 15. № 9. P. 3246.
Gao Y., Jin X. // Marine drugs. 2019. V. 17. № 10. P. 557.
Araiza-Verduzco F., Rodríguez-Velázquez E., Cruz H., Rivero I.A., Acosta-Martínez D.R., Pina-Luis G., Alatorre-Meda M. // Materials. 2020. V. 13. № 3. P. 534.
Rouillard A.D., Berglund C.M., Lee J.Y., Polacheck W.J., Tsui Y., Bonassar L.J., Kirby B.J. // Tissue Eng. C. 2011. V. 17. № 2. P. 173.
Mu C., Sakai S., Ijima H., Kawakami K. // J. Biosci. Bioeng. 2010. V. 109. № 6. P. 618.
Somo S.I., Langert K., Yang C.-Y., Vaicik M.K., Ibarra V., Appel A.A., Akar B., Cheng M.-H., Brey E.M. // Acta Biomater. 2018. V. 65. P. 53.
Passemard S., Szabó L., Noverraz F., Montanari E., Gonelle-Gispert C., Bühler L., Wandrey C., Gerber-Lemaire S. // Biomacromolecules. 2017. V. 18. № 9. P. 2747.
Ayub A.D., Chiu H., Mat Yusuf S.N.A., Abd Kadir E., Ngalim S.H., Lim V. // Artif. Cell. Nanomed. B. 2019. V. 47. № 1. P. 353.
Bioadhesives in Drug Delivery / Ed. by K.L. Mittal, I.S. Bakshi, J.K. Narang. Wiley-Scrivener, 2020.
Lee C., Shin J., Lee J.S., Byun E., Ryu J.H., Um S.H., Kim D.-I., Lee H., Cho S.-W. // Biomacromolecules. 2013. V. 14. № 6. P. 2004.
Hong S.H., Shin M., Lee J., Ryu J.H., Lee S., Yang J.W., Kim W.D., Lee H. // Adv. Healthc. Mater. 2016. V. 5. № 1. P. 75.
Kim Y.-S., Cho S.-W., Ko B., Shin J., Ahn C.W. // Diabetes Metab. J. 2018. V. 42. P. 164.
Hou J., Li C., Guan Y., Zhang Y., Zhu X.X. // Polym. Chem. 2015. V. 6. P. 2204.
Gatta’s-Asfura K.M., Stabler C.L. // Biomacromolecules. 2009. V. 10. № 11. P. 3123.
Hall K.K., Gattas-Asfura K.M., Stabler C.L. // Acta Biomater. 2011. V. 7. P. 614.
Gatta’s-Asfura K.M., Fraker C.A., Stabler C.L. // J. Biomed. Mater. Res. A. 2011. V. 99. № 1. P. 47.
Gattas-Asfura K.M., Stabler C.L. // ACS Appl. Mater. Interfaces. 2013. V. 5. № 20. P. 9964.
Gattás-Asfura K.M., Abuid N.J., Labrada I., Stabler C.L. // ACS Biomater. Sci. Eng. 2020. V. 6. № 5. P. 2641.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)