Высокомолекулярные соединения (серия Б), 2022, T. 64, № 1, стр. 60-70
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НАНОКОМПОЗИТОВ НА ОСНОВЕ НАТРИЙ-КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ И НАНОЧАСТИЦ СЕЛЕНА
Х. Э. Юнусов a, *, А. А. Сарымсаков a, Ф. М. Туракулов a
a Институт химии и физики полимеров Академии наук Республики Узбекистан
700128 Ташкент, ул. А. Кадыри 7б, Узбекистан
* E-mail: haydar-yunusov@rambler.ru
Поступила в редакцию 07.09.2021
После доработки 18.11.2021
Принята к публикации 01.12.2021
- EDN: RECGUD
- DOI: 10.31857/S2308113922010089
Аннотация
В водных растворах натрий-карбоксиметилцеллюлозы со степенью замещения 0.97 и степенью полимеризации 810 синтезированы стабилизированные наночастицы селена посредством взаимодействия селенита натрия с аскорбиновой кислотой. Изучены структура, физико-химические свойства растворов натрий-карбоксиметилцеллюлозы, содержащих стабилизированные наночастицы селена. Методом ИК-фурье-спектроскопии выявлено образование металлокомплексов за счет донорно-акцепторных взаимодействий между карбоксиметильными группами натрий-карбоксиметилцеллюлозы и наночастицами селена. Методами атомно-силовой микроскопии, УФ-спектроскопии, динамического рассеяния света определены размер и форма наночастиц селена, присутствующих в структуре натрий-карбоксиметилцеллюлозы. Установлено, что размер и форма наночастиц селена зависит от условий реакции восстановления и концентрации соли селенита натрия в растворах натрий-карбоксиметилцеллюлозы.
ВВЕДЕНИЕ
К актуальным вопросам современной химии полимеров относится создание нового поколения оригинальных наноструктурированных полимерных препаратов и медицинских изделий [1, 2]. В последние годы возрастает интерес к микроэлементу селену, который входит в состав антиоксидантной системы защиты организма. В отличие от селенит-ионов (${\text{SeO}}_{3}^{{2 - }}$) наночастицы селена (Se0) менее токсичны обладают повышенной биосовместимостью с организмом человека, предотвращают или приостанавливают развитие злокачественных опухолей. Полимерные формы препаратов на основе наночастиц селена в отличие от известных противоопухолевых препаратов способны оказывать пролонгированное действие [3].
Наночастицы селена могут быть получены путем восстановления раствора селенита натрия аскорбиновой кислотой и другими восстановителями в присутствии полисахаридов, таких как хитозан, глюкоманнан, целлюлоза, натрий-карбоксиметилцеллюлоза (Na-КМЦ) и другие. [4]. Хитозан и Na-КМЦ являются положительно и отрицательно заряженными, биоразлагаемыми, неиммуногенными, нетоксичными, чувствительными к рН полимерами и служат подходящими компонентами для перорального введения в составе широкого спектра биомедицинских и пищевых добавок [5]. Полисахариды и их производные широко применяются в фармацевтической промышленности в качестве систем доставок лекарств [6]. В молекулярной структуре полисахаридов реакционноспособные аминные, гидроксильные или карбоксильные группы оказывают существенное влияние на формирование, стабилизацию и рост наночастиц Se [7].
Синтезированы наночастицы Se размером 50–150 нм в матрице Na-КМЦ методом химического восстановления селенита натрия аскорбиновой кислотой в водных растворах и изучены их физико-химические и антибактериальные свойства. Установлено, что Na-КМЦ, содержащая наночастицы селена, имеет высокие антибактериальные свойства по отношению к грамотрицательным и грамположительным штаммам, которые были выделены из раневой поверхности [8]. Комплексы соединений наночастиц Se с низким содержанием селена значительно улучшают биосовместимость наночастиц селена и облегчают экспрессию селенопротеинов. Другим примером химического синтеза наночастиц Se является ионный синтез, индуцированный жидкостью, с селеносульфатом натрия в присутствии стабилизатора поливинилового спирта, который способствует получению сферических наночастиц Se размером 76–150 нм [9].
Изучены процессы формирования наночастиц селена при восстановлении ионов селенита натрия аскорбиновой кислотой в отсутствие и присутствии поливинилпирролидона и показано, что в отсутствие стабилизатора образуются агрегативно неустойчивые наночастицы селена размером 170 нм и выше. В случае использования поливинилпирролидона были синтезированы стабильные наночастицы селена размером 6–57 нм [10].
Цель настоящей работы – исследование формирования стабилизированных наночастиц Se в растворах Na-КМЦ, а также изучение их структуры и физико-химических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Полимерной матрицей служили промышленные образцы Na-КМЦ со степенью замещения 0.75–0.95 и степенью полимеризации 400–800, получаемые из хлопковой целлюлозы, после очистки от сопутствующих неорганических и органических примесей. Для формирования наночастиц селена в растворах Na-КМЦ использовали водные растворы селенита натрия (Na2SeO3), различной концентрации.
Также были использованы 2%-ные водные растворы очищенных образцов Na-КМЦ с разной степенью замещения и степенью полимеризации. Гелевую фракцию из растворов Na-КМЦ удаляли посредством их центрифугирования на лабораторной центрифуге MLW-T23 (Венгрия) при скорости 7000 об/мин в течение 20 мин. Композиции получали следующим способом: в растворы Na-КМЦ при интенсивном механическом перемешивании (1800 об/мин) добавляли расчетные количества 0.1–0.001 М водного раствора соли селенита натрия. Перемешивание осуществляли при 25°С в течение 50 мин до получения однородного раствора.
Химическое восстановление ионов селена в структуре Na-КМЦ до наночастиц проводили при 50°С, добавляя разное количество 0.01 М водного раствора аскорбиновой кислоты (C6H8O6). Для получения дисперсий наночастиц селена в процессе реакции восстановления использовали ультразвуковое диспергирование раствора на диспергаторе марки УЗДН-1, У-4,2 (Россия).
Оптические спектры поглощения растворов снимали на приборе “Specord М210” (Германия) в диапазоне длины волн от 200 до 900 нм. Длина оптического пути составляла 10 мм.
Взаимодействие ионов селенита натрия с функциональными группами Na-КМЦ изучали методом ИК-фурье-спектроскопии на спектрометре “Inventio-S” (“Bruker”, Германия). Морфологию поверхностных слоев нанометаллополимеров в пленках, отлитых из растворов Na-КМЦ, ${\text{SeO}}_{3}^{{2 - }}$/КМЦ– и Se0КМЦ, исследовали с помощью атомно-силового микроскопа “Agilent 5500” (“Agilent”, USA). Измерения проводили в контактном режиме в атмосферных условиях с использованием кремниевых контилеверов NSG 01. Средний размер наночастиц селена и коэффициент вариации определяли путем обработки соответствующих микрофотографий поверхности пленок по программе MathCad. Гистограммы распределения наночастиц получали по высоте наночастиц в виде интегральных и дифференциальных кривых распределения.
Рентгенографические исследования образцов выполняли на рентгеновском дифрактометре ДРОН - 3М с монохроматизированным CuKα-излучением при 22 кВ и силе тока 10 мА. Образцы исследовали в виде таблеток. Съемку проводили в интервале 2θ = 2°–52°.
Степень кристалличности χ рассчитывали по оценке интенсивности максимального пика и по формуле [11]
где Ik и Ia – интенсивность кристаллического рефлекса и аморфного рассеяния соответственно, K – поправочный коэффициент.Размер кристаллитов определяли по формуле Шеррера [12]
Здесь L – эффективный размер кристаллита (Å); λ = 1.5418 Å – длина волны; 2θ – брэгговский угол (град); k = 0.9 – коэффициент, зависящий от формы кристаллита; β – ширина полувысоты пика (град).Средний размер наночастиц селена (Se0) в полимерной матрице определяли методом динамического светорассеяния на приборе “ZETASIZER Nano ZS” (Великобритания), коэффициент вариации определяли путем математического анализа соответствующих микрофотографий в программе MathCad.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящее время идентифицирован аморфный наноселен, имеющий красную окраску, а также три его кристаллические формы: тригональный [13], α-,β-,γ-моноклинный и ромбоэдрический [14]. Аморфный селен представляет собой неорганический полимер с ковалентно-связанными цепями [15].
Для получения наночастиц селена широко используемым способом является химическое восстановление селенита натрия аскорбиновой кислотой в полимерных матрицах, позволяющих управлять размером и формой формирующихся наночастиц.
Растворимость и степень чистоты Na-КМЦ служат одним из важнейших физико-химических параметров, определяющих возможность их переработки в препараты и изделия медицинского назначения.
Нами исследован состав растворимых и нерастворимых фракций очищенных образцов Na-КМЦ различной степени замещения и степени полимеризации в воде (табл. 1). Как видно, с увеличением степени замещения доля растворимой фракции Na-КМЦ в воде возрастает, что можно объяснить уменьшением интенсивности водородных связей между макромолекулами Na-КМЦ [16].
Таблица 1.
Влияние степени замещения (СЗ) и степени полимеризации (СП) Na-КМЦ на количество и состав растворимых и нерастворимых фракций в воде
| Очищенные образцы Na-КМЦ | Образцы Na-КМЦ после центрифугирования | ||||||
|---|---|---|---|---|---|---|---|
| СЗ | СП | растворимая фракция, % | СЗ | СП | гелевая фракция, % | СЗ | СП |
| 0.75 | 210 | 95.6 | 0.78 | 200 | 4.8 | 0.12 | 260 |
| 0.75 | 400 | 92.8 | 0.79 | 410 | 7.2 | 0.21 | 460 |
| 0.86 | 520 | 97.6 | 0.87 | 650 | 2.4 | 0.14 | 690 |
| 0.86 | 600 | 96.3 | 0.88 | 620 | 3.7 | 0.12 | 740 |
| 0.95 | 800 | 98.5 | 0.97 | 810 | 1.5 | 0.15 | 880 |
Установлено что с увеличением значения степени замещения доля растворимой фракции Na-КМЦ в воде растет, а содержание нерастворимой гелевой фракции уменьшается. Также выявлено, что с повышением степени полимеризации при одинаковых значениях степени замещения содержание гелевой фракции увеличивается [16]. При этом состав и свойства растворимых и нерастворимых фракций Na-КМЦ зависят от значений степени замещения и степени полимеризации Na-КМЦ.
Дальнейшие исследования были посвящены формированию и стабилизации ионов и наночастиц селена в полимерных подложках Na-КМЦ и изучению их физико-химических свойств.
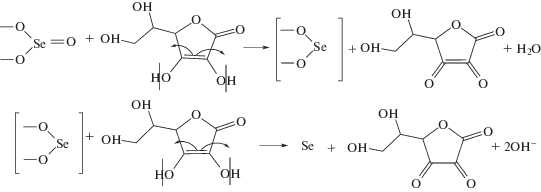
Для синтеза стабильных наночастиц селена в качестве реакционной среды был выбран раствор очищенного образца Na-КМЦ со степенью полимеризации 810 и степенью замещения 0.97. Селенсодержащие наноструктуры получали восстановлением селенита натрия аскорбиновой кислотой в присутствии раствора очищенной Na-КМЦ. Соотношение селенит натрия : аскорбиновая кислота составляет 1 : 2, температура 50°С. При восстановлении селенита натрия аскорбиновой кислотой в присутствии водного раствора карбоксиметилцеллюлозы наблюдалось изменение окраски коллоидного раствора от желтовато-оранжевого до красно-оранжевого. Известно [17, 18], что образование наночастиц селена с разными размерами и формой вызывают изменения окраски растворов. Восстановление селенита натрия аскорбиной кислотой (C6H8O6) в водных растворах Na-КМЦ протекает согласно уравнению реакции, приводящей к образованию Se0 (в виде красно-оранжевого раствора) и дегидро-аскорбиновой кислоты [19]:
Схематическое изображение процесса восстановления Se(IV) до наночастиц Se0 и их стабилизации Na-КМЦ представлено ниже.
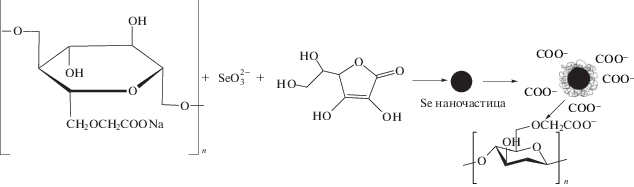
Однородность формирующихся наночастиц по размерам достигается благодаря тому, что макромолекулы Na-КМЦ, обволакивая наночастицы селена, создают вокруг них заряженную оболочку, препятствующую их агломерации за счет сил электростатического отталкивания.
В водном растворе под воздействием механического перемешивания, при температуре 25°С Na2SeO3 диссоцирует на катионы Na+ и анионы ${\text{SeO}}_{3}^{{2 - }}$, а соли Na-КМЦ – на катионы Na+ и анионы КМЦ-СОО– соответственно.
В процессе восстановления Na2SeO3 в присутствии аскорбиновой кислоты анионы ${\text{SeO}}_{3}^{{2 - }}$ в водных растворах под воздействием ультразвукового диспергирования восстанавливаются до наноразмерного металлического состояния (Se0), и аскорбиновая кислота окисляется до диаскорбиновой кислоты (вторая реакция). При этом ультразвуковое диспергирование способствует формированию наночастиц Se меньшего размера.
В процессе формирования наночастиц селена отрицательно заряженные карбоксиметильные группы (–СН3СОО–) взаимодействуют с металлической формой наноселена за счет донорно-акцепторных взаимодействий, образуя металлокомплексы. Предполагаемая схема комплексообразования наночастиц селена с Na-КМЦ приведена ниже.
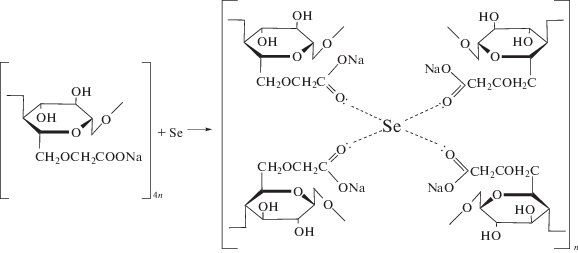
Для подтверждения данного предположения методом ИК-фурье-спектроскопии были проведены исследования пленок Na-КМЦ, Se4+КМЦ–, Se0КМЦ.
Спектры иммобилизованных наночастиц селена отличаются широкими полосами поглощения в области частот валентных колебаний ОН-групп 3400–2800 см–1, 3336.55 см–1, которые характеризуют энергетически неравноценные водородные связи. В области валентных колебаний связей С–Н на спектрах имеются максимумы при 2870.08 см–1, соответствующие асимметричным колебаниям метиленовой группы Na-КМЦ (рис. 1, кривая 1).
Рис. 1.
ИК-фурье-спектры образцов пленок Na-КМЦ (1), Se4+КМЦ (2) и Se0КМЦ (3). Цветные рисунки можно посмотреть в электронной версии.
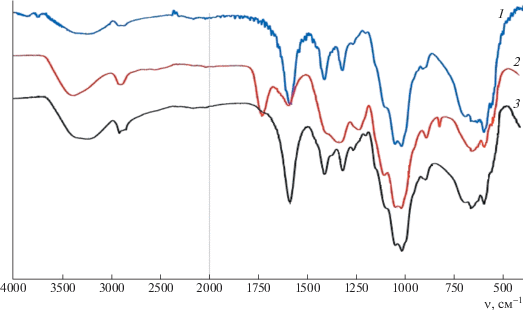
Полосы поглощения в области 800–1420 см–1 характеризуют плоскостные деформационные колебания гидроксильных групп Na-КМЦ.
Как видно на рис. 1 (кривая 1), образцы очищенной Na-КМЦ со степенью замещения 0.97 и рН 8.25 имеют полосу поглощения при 1595.13 см–1, относящуюся к карбоксиметилату анионных групп.
При добавлении в раствор очищенной Na-КМЦ со степенью замещения 0.97 и степенью полимеризации 810 растворов селенита натрия рН растворов уменьшается от 8.25 до 7.5. При этом интенсивность полос поглощения при 1589.34 см–1 уменьшается в два раза с появлением новой полосы поглощения при 1732.08 см–1 (рис. 1, кривая 2) за счет формирования комплексов малодиссоцируемой соли Na-КМЦ с ионами селена. Формирование новой полосы поглощения при 1732.08 см–1 характеризует слабодиссоцируемую кислоту Н-КМЦ.
При восстановлении ионов селена до наночастиц в присутствии аскорбиновой кислоты в растворе очищенной Na-КМЦ интенсивность полос поглощения при 1589.34 см–1 увеличивается в два раза (рис. 1, кривая 3), что объясняется расходом аскорбиновой кислоты в реакции восстановления.
Топографию поверхности тонких пленок Na-КМЦ, содержащих стабилизированные наночастицы селена, полученных из водных растворов Na-КМЦ, содержащих наночастицы селена, изучали методом ACM. Полученные данные представлены на рис. 2. На микрофотографиях видно, что при низких концентрациях (0.12%) Na2SeO3 образуются сферические монодисперсные наночастицы селена (рис. 2а) размером 8–25 нм. Наблюдается достаточно узкое распределение частиц по размерам, которое имеет нормальный гауссовый характер. Преобладающий размер частиц равен 20 нм, минимальный размер частиц селена 8 нм, а максимальный – 25 нм. (рис. 2а, гистограммы). С повышением концентрации cеленита натрия до 0.3% в растворах Na-КМЦ увеличиваются размер и число сферических наночастиц до 9–42 нм (рис. 2б). На гистограмме разброс по размерам наночастиц селена небольшой. Распределение также имеет гауссовый характер, преобладающий размер наночастиц равен 27 нм, минимальный размер наночастиц селена 9 нм, а максимальный – 42 нм (рис. 2б, гистограммы).
Рис. 2.
АСМ-снимки и гистограммы распределения наночастиц селена по размерам на пленках Se0КМЦ. а: сферические монодисперсные наночастицы селена размером 8–25 нм (мольное соотношение Na-КМЦ : Na2SeO3 (0.08 : : (2 × 10–5) 0.12% Na2SeO3); б: сферические монодисперсные наночастицы селена размером 9–42 нм (мольное соотношение Na-КМЦ : Na2SeO3 (0.08 : (5 × 10–5) 0.3% Na2SeO3); в: тригональные наночастицы селена с размером по длине 12–60 нм и толщине 4–28 нм (мольное соотношение Na-КМЦ : Na2SeO3 (0.08 : (3 × 10–4) 1.7% Na2SeO3).
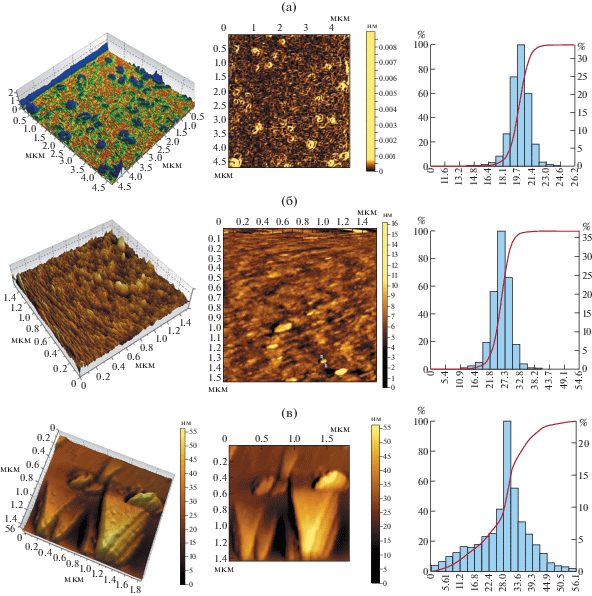
При дальнейщем увеличении концентрации селенита натрия до 1.7% в растворах Na-КМЦ формирующиеся сферические наночастицы селена приобретают тригональные формы, и их размер достигает 4–28 нм по толщине и 12–60 нм по длине (рис. 2в).
В гистограмме (рис. 2б) разброс по размерам наночастиц селена большой. Распределение имеет асимметричное распределение, и преобладающий размер частиц равен 30 нм, минимальный размер частиц селена 12 нм, а максимальный 60 нм (рис. 2в, гистограммы).
Для подтверждения результатов АСМ проведены исследования образцов растворов Na-КМЦ, КМЦ+Na2SeО3 и Se0КМЦ с помощью УФ-спектроскопии.
На рис. 3 представлены спектры поглощения Na-КМЦ, КМЦ+Na2SeО3 и Se0КМЦ в области длины волн 200–600 нм.
Рис. 3.
Спектры поглощения и растворов Na-КМЦ (1), КМЦ + Na2SeО3 (2), Se0КМЦ (3) и Se0 + Н2О (4), содержащих 0.00474% Na2SeО3.
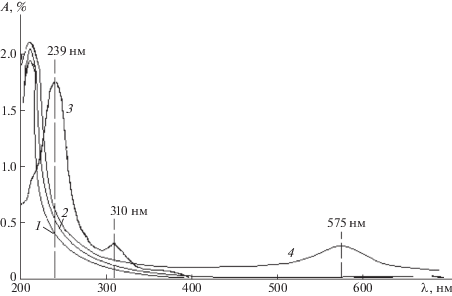
В отсутствие стабилизатора Na-КМЦ при восстановлении селенита натрия аскорбиновой кислотой происходит медленное изменение окраски коллоидного раствора от желтовато-оранжевой до красно-оранжевой. При этом на УФ-спектре наблюдается сдвиг полосы поглощения наночастиц селена λmax от 400 до 575 нм, что свидетельствует о росте их размеров до микронных величин с последующим их осаждением [20]. Через 60 мин происходит агрегация частиц с образованием осадка селена красного цвета [21] (рис. 3, кривая 4).
При восстановлении селенита натрия аскорбиновой кислотой в присутствии стабилизатора Na-КМЦ в УФ-спектрах образцов детектируются максимумы поглощения при λmax 239 и 310 нм, относящиеся к наночастицам селена с диаметром 8–25 нм (рис. 3, кривая 3).
Показано, что исходные растворы Na-КМЦ и КМЦ + Na2SeО3, являются оптически прозрачными в диапазоне 230–900 нм (рис. 3, спектр 2). Следует отметить, что в ходе реакции окраска раствора изменяется от желтовато-оранжевой до красно-оранжевой, что связано, по-видимому, с увеличением размеров образующихся наночастиц селена в растворе Na-КМЦ.
Максимум полосы поглощения растворов Na-КМЦ и Na-КМЦ + Na2SeО3 наблюдается при длине волны 210 нм (рис. 3, спектр 2). Вероятно, эти полосы поглощения относятся к чистой Na-КМЦ. Из литературных данных известно [22], что максимум полосы поглощения аморфного наноселена расположен в области 230–420 нм, поэтому при измерении оптической плотности раствора наночастиц селена с Na-КМЦ в качестве сравнения использовали раствор чистой Na-КМЦ. Интенсивный максимум поглощения нанокомпозита наблюдался при длине волны λ = = 239 и 310 нм, что по-видимому характеризует иммобилизацию наночастиц селена на макромолекулы Na-КМЦ [23].
Методом УФ-спектроскопии было определено содержание наночастиц селена в растворе Na-КМЦ в процессе химического восстановления Na2SeО3 с концентрацией от 0.00079 до 0.0316%. Полученные результаты представлены на рис. 4.
Рис. 4.
УФ-спектры поглощения растворов Na-КМЦ (1) и растворов Na-КМЦ, содержащих 0.00474% Na2SeО3 (2), 0.00079% Se0 (3), 0.00158% Se0 (4), 0.00237% Se0 (5), 0.00316% Se0 (6), 0.00632% Se0 (7), 0.00948% Se0 (8), 0.0126% Se0 (9), 0.0158% Se0 (10), 0.0237% Se0 (11) и 0.0316% Se0 (12). λmax = 266 нм, D = 2.02 (3); λmax = 268 нм, D = 2.90 (4); λmax = 266 нм, D = 2.36 (5); λmax = 274 нм, D = 0.86 (6); λmax = 274 нм, D = 0.86 (7); λmax = 274 нм, D = 0.85 (8); λmax = 274 нм, D = 1.07 (9); λmax = 274 нм, D = 0.94 (10); λmax = 274 нм, D = 1.01 (11); λmax = 282 нм, D = 1.66 (12). Концентрацию наночастиц селена рассчитывали теоретически по отношению к Na2SeО3.
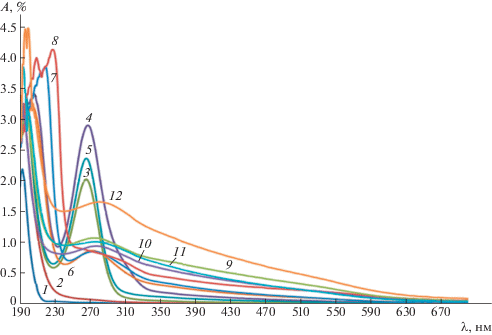
При химическом восстановлении селенита натрия аскорбиновой кислотой в присутствии стабилизатора Na-КМЦ в УФ-спектрах наблюдается максимум в области 265–285 нм, подтверждающий образование наночастиц селена.
Аскорбиновая кислота имеет максимум поглощения при 245 нм, оксид селена (IV)–205 нм [24, 25].
При содержании в растворе Na-КМЦ 0.00079% наночастиц селена (рис. 4, спектр 3) в спектре появляется максимум при λ = 266 нм (D = = 2.02), который указывает на формирование кластеров частиц Se8, а в растворах Na-КМЦ, содержащих 0.00158% наночастиц селена (рис. 4, спектр 4) в спектре резко возрастает интенсивность полосы поглощения с максимумом при λ = = 268 нм (D = 2.90), который может быть отнесен к большему количеству наночастицам селена с размером 8–25 нм [26].
С повышением концентрации селенита натрия до 0.00237% в растворах, подвергнутых химическому восстановлению, уменьшается интенсивность полос поглощения с максимумом при λ = 266 нм (D = 2.36) (рис. 4, спектр 5) что объясняется уменьшением количества наночастиц селена с размером 9–42 нм.
При дальнейшем увеличении содержания наночастиц селена в растворах Na-КМЦ до 0.0237% в спектрах наблюдается уменьшение интенсивности и расширение полосы поглощения, а также сдвиги максимумов при λ = 274 нм (D = 0.86) (рис. 4, спектры 6–11).
По-видимому, это связано с увеличением размеров наночастиц и уменьшением их количества в полимерной матрице. Дальнейшее повышение концентрации наночастиц селена до 0.0316% в спектрах приводит к появлению новой полосы поглощения в области λ = 282 нм (D = 1.66) (рис. 4, спектр 12). Появление новой полосы поглощение при увеличении концентрации наночастиц селена, объясняется, вероятно, изменением формы наночастиц.
В работе проведен рентгеноструктурный анализ пленок Na-КМЦ, содержащих стабилизированные наночастицы селена.
Образцы были выбраны из числа пленок Na-КМЦ, содержащих стабилизированные наночастицы селена размером 9–42 нм синтезированных при мольном соотношении Na-КМЦ : : Na2SeO3 (0.08 : (5 × 10–5)) и концентрации селенита натрия 0.3% Na2SeO3, в которых методом АСМ определены размеры наночастиц.
Рентгенографические исследования (рис. 5) показали, что Na-КМЦ имеет аморфную структуру и дает аморфное гало при 2θ = 21.6°, а Na-КМЦ, содержащая ионы селена, также имеет аморфную структуру с наименьшей интенсивностью аморфного гало в той же области. В дифрактограмме полимерного нанокомпозита Na-КМЦ с восстановленными наночастицами селена выявлены две фазы: фаза Na-КМЦ при углах дифракции 2θ = = 21.6° в аморфной области и фаза металлического селена.
Рис. 5.
Дифрактограмма Na-КМЦ (1), Na-КМЦ, содержащей селенит натрия (2) и Na-КМЦ, содержащей стабилизированные наночастицы селена (3). Мольное соотношение Na-КМЦ : Na2SeO3 0.08 : (5 × 10–5), концентрации селенита натрия 0.3%.
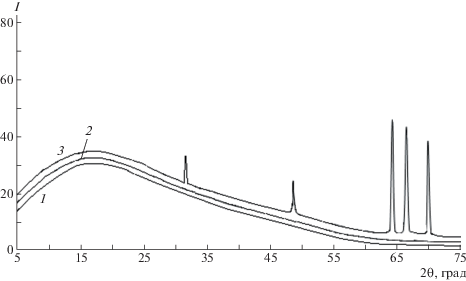
Селен с моноклинной кристаллической решеткой, имеющей а = 9.01 Å, b = 8.99 Å, c = 11.5 Å и угол β = 91.3° дает кристаллические рефлексы в углах 2θ = 31.5°, 48.5°, 64.6°, 67° и 70.5°, относящимся к плоскостям отражения (101), (200), (120), (211) и (113).
Величины кристаллитов селена были рассчитаны по уширению пиков. Известно, что ширина рентгеновских дифракционных линий зависит от размеров кристаллитов или областей когерентного рассеяния. Чем выше размер этих областей, тем уже отражение на дифрактограмме. По формуле Шерера по уширению каждой линии определены эффективные размеры кристаллитов. Результаты расчетов показали, что эффективные размеры кристаллов селена, находящихся в матрице Na-КМЦ, составляют 15 нм.
Кристаллические рефлексы в углах 2θ = 31.5°, 48.5°, 64.6°, 67° и 70.5° относящиеся к кристаллитам селена четко выражены и имеют эффективный размер 20 нм (рис. 5). На основе рентгенографических исследований были рассчитаны размеры наночастиц селен в полимерной матрице. Наночастицы селена в полимерной матрице Na-КМЦ имеют наноразмер в диапазоне: 8.5, 13.7, 32.7, 39.3 и 41.4 нм при плоскости отражения (101), (200), (120), (211) и (113) соответственно.
Далее был проведен элементный анализ, полученных пленок Na-КМЦ, содержащих стабилизированные наночастицы селена в настольном растровом электронном микроскопе “JCM-6000PLUS Neoscope” с энергодисперсионным спектрометром (Япония, “Jeol”, 2017). Полученные результаты представлены в табл. 2. Как видно, при повышении содержания селенита натрия после восстановления увеличивается содержание наночастиц.
Таблица 2.
Данные элементного анализа наночастиц селена, стабилизированных Na-КМЦ
| Образец | Концентрация Na2SeO3, % | Массовое содержание элементов, % | |||
|---|---|---|---|---|---|
| С | O | Na | Se | ||
| Плeнка Na-КМЦ | – | 51.55 | 38.54 | 9.91 | – |
| Пленка Na-КМЦ, содержащая стабилизированные наночастицы селена | 0.12 | 51.41 | 39.12 | 8.91 | 0.56 |
| 0.31 | 51.76 | 39.44 | 8.13 | 0.67 | |
| 1.7 | 51.57 | 39.46 | 7.07 | 1.90 | |
Далее была изучена стабильность образующихся в растворах Na-КМЦ наночастиц селена при хранении (рис. 6).
Рис. 6.
Изменение размеров стабилизированных Na-КМЦ частиц селена через 1 ч (а), 7 суток (б), 28 суток хранения (в) и полученных без использования стабилизатора через 1 ч (г), 7 суток (д), 28 суток хранения (е).
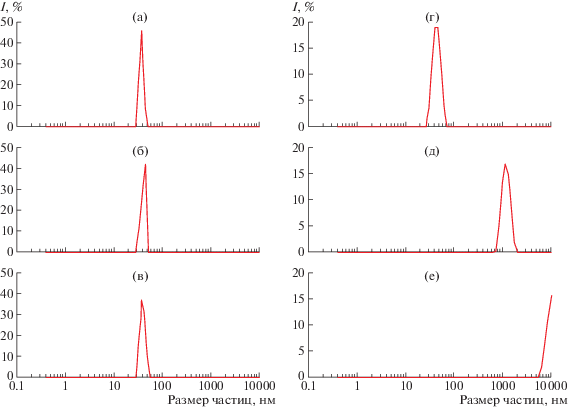
Для определения стабильности наночастиц селена в растворах Na-КМЦ при хранении в течение 28 суток были выбраны растворы Na-КМЦ, содержащие стабилизированные наночастицы селена сразмером 9–42 нм, синтезированные при мольном соотношении Na-КМЦ : Na2SeO3 = = (0.08 : (5 × 10–5)) и концентрации селенит натрия 0.3%, в которых определены изменения размеров наночастиц методом АСМ.
Для этого было исследовано изменение размеров наночастиц в процессе их хранения. На рис. 6a–6в показано изменение размеров стабилизированных наночастиц селена в период хранения в течение 1 ч, 7 и 28 суток соответственно.
За изученный период времени наблюдается незначительное увеличение ширины распределения размеров наночастиц, при этом отклонение среднего размера в сторону его увеличения составило менее 10%, что подтверждает высокую стабильность наночастиц селена при проведении их синтеза в растворах Na-КМЦ.
Исследование изменения размера нестабилизированных частиц (рис. 6г–6е) показало, что их диаметр значительно увеличивается при хранении и превышает 1 мкм и 10 мкм после 1 и 2 суток, соответственно, т.е. достигает микроразмерного уровня. В отсутствие стабилизатора распределение наночастиц по размерам более широкое, чем при проведении синтеза в присутствии полимера, что следует из сравнения рисунков 6a и 6г. Так, пик на рисунке 6а имеет значительно меньшую ширину и большую высоту по сравнению с пиком, представленным на рис. 6г.
ЗАКЛЮЧЕНИЕ
Таким образом, осуществлен синтез стабилизированных наночастиц селена путем химического восстановления оксидов селена аскорбиновой кислотой в растворах Na-КМЦ. Методами оптической, атомно-силовой микроскопии и УФ-спектроскопии установлено, что размер и форма наночастиц селена зависят от условий реакции восстановления.
С учетом соотношений Na-КМЦ, ${\text{SeO}}_{3}^{{2 - }}$, аскорбиновой кислоты и условий реакции возможно изменение размера и формы стабилизированных наночастиц селена, формирующихся в водных растворах при химическом восстановлении ${\text{SeO}}_{3}^{{2 - }}$.
Полученные растворы Na-КМЦ, содержащие наночастицы селена, могут быть использованы для создания на их основе лекарственных препаратов широкого спектра действия, в частности противоопухолевых препаратов, снижающих отрицательное воздействие на организм лучевой и химиотерапии, и препаратов, компенсирующих дефицит селена в организме.
Работа выполнена при финансовой поддержке международного проекта Узбекистан–Белоруссия при финансовой поддержке Министерства инновационного развития Республики Узбекистан MRB-AN-2019-16 “Создание полимерных форм лекарственных средств для лечения онкологических заболеваний на основе наночастиц селена стабилизированных на биоразлагаемых полимерных подложках природного происхождения” на 2019–2021 гг. и при финансовой поддержке программы научно-исследовательских работ Института химии и физики полимеров Академии наук Республики Узбекистан на 2020–2024 годы “Фундаментальные аспекты создания наноструктурных полимерных форм лекарственных средств и изделий медицинского назначения – будущее наночастиц в организме”.
Список литературы
Guo J.H., Skinner G.W., Harcum W.W., Barnum P.E. // Pharmaceut. Sci. Technol. Today. 1998. V. 1. № 6. P. 254.
Yunusov Kh.E., Sarymsakov A.A., Rashidova S.Sh. // Polymer Science A. 2014. V. 56. № 3. P. 283.
Решетняк Л.А., Парфенова Е.О. // Экология моря. 2000. № 59. С. 20.
Agnihotri S.A., Mallikarjuna N.N., Aminabhavi T.M. // J. Control Release. 2004. V. 100. № 1. P. 5.
Saini D., Fazil M., Ali M.M., Baboota S., Ameeduzzafar A., Ali J. // Drug Deliv. 2015. V. 22. № 6. P. 823.
Philipp B., Bock W., Schierbaum F. // J. Polym. Sci., Polym. Symp. 2007. V. 66. № 1. P. 83.
Hosnedlova B., Kepinska M., Skalickova S., Fernandez C., Ruttkay-Nedecky B., Peng Q., Kizek R. // Int. J. Nanomedicine. 2018. V. 13. P. 2107.
Hegerova D., Vesely R., Cihalova K., Kopel P., Milosav-ljevic V., Heger Z., Adam V. // J. Biomed. Nanotechnol. 2017. V. 13. № 7. P. 767.
Langi B., Shah C., Singh K., Chaskar A., Kumar M.S., Bajaj P.N. // Mater. Res. Bull. 2010. V. 45. № 6. P. 668.
Kopeikin V.V., Valueva S.V., Kipper A.I., Borovikova L.N., Filippov A.P. // Polymer Science A. 2003. V. 45. № 4. P. 374.
Wunderlich B. Macromolecular Physics. New York: Acad Press, 1973. V. 1.
Мартынов М.А., Вылегжанина К.А. // Рентгенография полимеров. Л.: Химия, 1972. С. 30.
Cherin P., Unger P. // Inorgan. Chem. 1967. V. 6. № 8. P. 1589.
Chen H., Yoo J.B., Liu Y., Zhao G. // Electronic Mater. Lett. 2011. V. 7. № 4. P. 333.
Bartůněk V., Sofer Z., Junková J., Ulbrich P., Babuněk M., Kuchař M. // Micro Nano Lett. 2016. V. 11. № 2. P. 91.
Yunusov K.E., Sarymsakov A.A., Jalilov J.Z., Atakhanov A.A. // Polym. Adv. Technol. 2021. V. 32. P. 1822.
Zhang Y., Wang J., Zhang L. // Langmuir. 2010. V. 26. № 22. P. 17617.
Kong H., Yong S., Zhang Y., Fang Y., Nishirari R.K., Phillips G.O. // Int. J Biol. Macromols. 2014. V. 65. P. 155.
Shaker A.M. // J. Colloid Interface Sci. 1996. V. 180. № 1. P. 225.
Ершов Д.Ю., Киппер А.И., Боровикова Л.Н. // Журн. физ. химии. 2013. Т. 87. № 12. С. 2116.
Khandsuren B., Prokisch J. // Acta Alimentaria. 2021. P. 1.
Wang Q., Webster T.J. // J. Biomed. Mater. Res. A. 2012. V. 100. № 12. P. 3205.
Vahdati M., Tohidi Moghadam T. // Sci Rep. 2020. V. 10. P. 510.
Fengrui J., Weiquan C., Guolong T. // Nanoscale Res. Lett. 2017. V. 12. P. 401.
David R.M., William P.P., Tarcha P.J. // J. Colloid Interface Sci. 1995. V. 170. № 1. P. 254.
Lin Z.H., Chris Wang C.R. // Mater. Chem. Phys. 2005. V. 92. № 2–3. P. 591.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


