Высокомолекулярные соединения (серия Б), 2022, T. 64, № 1, стр. 53-59
СИНТЕЗ ФОТОЧУВСТВИТЕЛЬНЫХ СОПОЛИМЕРОВ НА ОСНОВЕ СОПОЛИМЕРОВ СТИРОЛА С П-ФЕНИЛЗАМЕЩЕННЫМИ ЦИКЛОПРОПИЛМЕТАКРИЛАТАМИ
К. Г. Гулиев a, *, А. Э. Рзаева a, Н. Я. Ищенко a, А. М. Гулиев a
a Институт полимерных материалов Национальной академии наук Азербайджана
Az5004 Сумгайыт, ул. С. Вургуна, 124, Азербайджан
* E-mail: kazimguliyev46@gmail.com
Поступила в редакцию 01.05.2021
После доработки 05.10.2021
Принята к публикации 19.10.2021
- EDN: ULHHZK
- DOI: 10.31857/S2308113922010016
Аннотация
Проведена радикальная сополимеризация п-фенилзамещенных циклопропилметакрилатов со стиролом. Получен новый циклопропансодержащий негативный фоточувствительный сополимер. Установлены состав и структура полученного сополимера. Определены значения констант относительной активности мономеров и рассчитаны параметры Q–e по Алфрею–Прайсу. Выявлена зависимость фоточувствительности от состава сополимера. Синтезированный сополимер имеет фоточувствительность 55.3–56.0 см2/Дж и может быть использован для создания негативного фоторезистного материала.
В последнее время синтез новых фоточувствительных полимеров с заданными свойствами является актуальной задачей. В связи с расширением областей их применения в микроэлектронике, фотолитографии, голографии, в фотоотверждаемых покрытиях и т.д. [1–4].
Условия применения фоторезиста определяются его целевым назначением и требуют расширения ассортимента фоточувствительных материалов. Поэтому интерес специалистов к получению новых типов негативных фоторезистов, отвечающих современным требованиям, не ослабевает [5–8].
Известно, что высокомолекулярные соединения на основе метакрилатных мономеров активно применяются в микроэлектронике в качестве высокоэффективных фото- и электронорезистов при изготовлении интегральных микросхем. Так, новые акрилатные мономеры и полимеры на их основе обладают высокой чувствительностью к различным источникам облучения [9–11].
Функциональнозамещенные полициклопропилсодержащие полимеры также весьма перспективны в плане создания новых фоточувствительных материалов. Синтез таких полимеров был обусловлен, прежде всего, наличием в их составе макромолекул реакционных функциональных фрагментов различной природы в виде боковых радикалов, в частности циклопропансодержащих.
Настоящая работа является продолжением исследований, проведенных ранее в области сополимеризации функциональнозамещенных циклопропилстиролов [12–19].
Основная цель представленного исследования заключается в разработке нового негативного фоторезиста на основе п-фенилзамещенных циклопропилметакрилатов. Синтез мономеров был осуществлен взаимодействием метакрилоилхлорида с соответствующим п-замещенным фенилциклопропанолом в присутствии третичного амина:
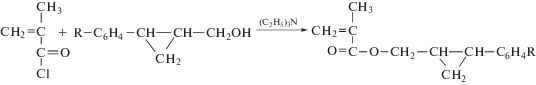
где R = Cl (соединение 1) и NO2 (соединение 2).
Наличие в макромолекулах синтезированных циклопропилзамещенных полиметакрилатов напряженных циклопропильных групп должно придать сополимерам высокую чувствительность к различным видам облучения. Кроме того, указанные сополимеры могут служить подходящими оптически прозрачными полимерными материалами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 2-п-фенилзамещенных-1-оксиметилциклопропилметакрилатов. Общая методика
В колбу с обратным холодильником помещали 0.5 моля (74 г) 2-п-хлор-фенил-1-гидроксиметилциклопропана в среде третичного амина, затем при 30°С в течение 2 ч при перемешивании по каплям добавляли 0.6 моля метакрилоилхлорида в 30 мл абсолютного бензола. После завершения реакции смесь экстрагировали, сушили и отгоняли сначала легкие фракции, а затем перегоняли основную фракцию при пониженном давлении. Аналогично синтезировали соединение 2.
В ИК-спектрах соединений 1, 2 содержатся полосы поглощения в области 1435–1440 и 3095–3100 см–1 (νс–н цикла), 2880, 2940, 2980 см–1 (νс–н алиф), 750–760 см–1 (νCl), 1365 и 1335 см–1 (NO2).
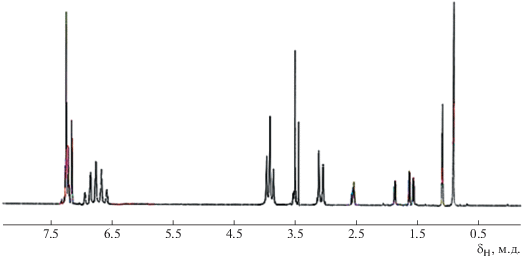
2-пара-хлорфенил-1-оксиметилциклопропилметакрилат (1). Выход продукта составил 96%; температура кипения Ткип = 110–115°С (3 мм рт. ст.), $n_{D}^{{20}} = 1.4105$, ${\text{d}}_{4}^{{20}} = 0.970$, MRD = 63.787. Спектр ЯМР 1Н (δ, м.д.): 7.36 м (4Наром), 1.88 м (1Н, СHциклопроп), 2.63 м (1Н, СHциклопроп), 1.58 м (1Н, СН2циклопроп), 1.64 м (1Н, СН2циклопроп), 4.11 д (2Н, СН2О), 5.49 с (1Н, СН2винил. г), 5.92 с (1Н, СН2винил. г), 1.66 с (3Н, СН3–С=).
2-пара-нитрофенил-1-оксиметилциклопропилметакрилат (2). Выход продукта составил 94%; Ткип = 117–125°С (3 мм рт.ст), $n_{{\text{D}}}^{{20}} = 1.4080$, ${\text{d}}_{4}^{{20}}$ = = 0.950, MRD = 67.585. Спектр ЯМР 1Н (δ, м.д.): 7.60 м (4Наром), 2.18 м (1Н, СHциклопроп), 2.70 м (1Н, СHциклопроп), 1.66 м (1Н, СН2циклопроп), 1.72 м (1Н, СН2циклопроп), 4.22 д (2Н, СН2О), 5.66 с (1Н, СН2винил. г), 6.01 с (1Н, СН2винил. г), 1.89 с (3Н, СН3–С=).
Сополимеризацию синтезированных мономеров со стиролом осуществляли в запаянных в атмосфере азота ампулах в растворе бензола. Cуммарная концентрация исходных мономеров была постоянной и составляла 1.0 моль/л, а соотношение исходных мономеров менялось (табл. 1). Полимеризационной раствор, содержащий мономер и инициатор ДАК, помещали в стеклянную ампулу, смесь продували потоком бескислородного азота в течение 10 мин, после чего пробирку плотно закрывали и помещали в термостат при 343 К. Количество инициатора составляло 0.4 моль/л от суммарной массы сомономеров. Образовавшийся сополимер очищали двукратным переосаждением из бензольного раствора в метанол и сушили при остаточном давлении (15–20 мм рт. ст.) и температуре 30°С до постоянной массы.
Таблица 1.
Сополимеризация соединений 1 и 2 (М1) со стиролом (М2)
| Состав исходной смеси, мол. % | Состав сополимеров*, мол. % | r1 | r2 | Q1 | e1 | r1r2 | ||
|---|---|---|---|---|---|---|---|---|
| М1 | М2 | m1 | m2 | |||||
| Сополимер 1 со стиролом | ||||||||
| 10 | 90 | 25.38 | 74.62 | 0.38 ± 0.03 | 0.22 ± 0.02 | 1.26 ± 0.01 | 0.77 ± 0.02 | 0.0836 |
| 25 | 75 | 40.12 | 59.88 | |||||
| 50 | 50 | 53.06 | 46.94 | |||||
| 75 | 25 | 66.56 | 33.44 | |||||
| 90 | 10 | 81.19 | 18.81 | |||||
| Сополимер 2 со стиролом | ||||||||
| 10 | 90 | 27.01 | 72.99 | 0.41 ± 0.03 | 0.20 ± 0.02 | 1.39 ± 0.01 | 0.78 ± 0.02 | 0.0820 |
| 25 | 75 | 41.53 | 58.47 | |||||
| 50 | 50 | 54.02 | 45.98 | |||||
| 75 | 25 | 67.64 | 32.36 | |||||
| 90 | 10 | 82.11 | 17.89 | |||||
Турбидиметрическое титрование проводили при 20°С на спектрофотометре КФК-2 (λ = 590 нм). Для титрования 0.03 г сополимера растворяли в 5 мл бензола и при перемешивании добавляли 0.1 мл осадителя (гексан).
Характеристическую вязкость определяли в бензоле в вискозиметре Уббелоде: [η] = 0.92–0.93 дл/г. Состав сополимеров устанавливали по данным элементного анализа.
ИК-спектры сополимеров записывали на приборе “AgilentCary 630 FTIR”, спектры ЯМР 1Н регистрировали на спектрометре “Bruker AFR-300” в CDCl3, химические сдвиги определяли относительно тетраметилсилана. Чистоту синтезированных соединений контролировали методом газо-жидкостной хроматографии.
Сополимер п-хлорфенил-циклопропил–МА со стиролом.
Сополимер п-нитрофенил-циклопропил–МА со стиролом.
Как видно из табл. 1, состав сополимеров изменяется в широком диапазоне при различных соотношениях исходных мономеров. Реакционная система остается гомогенной в бензоле, вплоть до конверсии 95%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Все полученные сополимеры после очистки и сушки представляли собой белые порошки, растворимые в ароматических и хлорсодержащих углеводородах, но нерастворимые в низших спиртах и диэтиловом эфире.
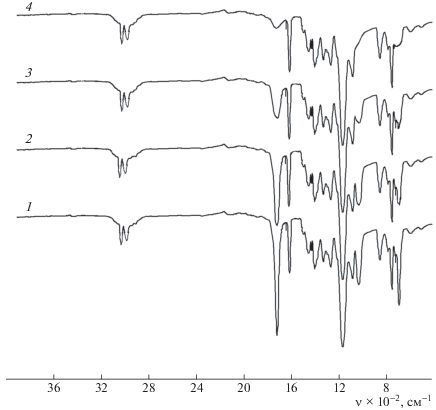
В результате проведенных исследований впервые были получены с высоким выходом образцы сополимеров со стиролом разного состава. Выявлено, что сополимеры стирола с мономером 2 на высоких степенях конверсии обогащены звеньями последнего. Установление структуры всех синтезированных сополимеров доказано ИК-спектрами (рис. 1). Полосы поглощения в ИК-спектре исходного мономера при 950 и 1635–1640 см–1, относящиеся к деформационным и валентным колебаниям винильной группы, при сополимеризации полностью исчезают. Полосы поглощения, характерные для бензольного (1490, 1510, 1605 см–1) и циклопропанового (1035–1040 см–1) кольца, после полимеризации сохраняются. Полосы 1720 и 1110 см–1, характерные для связей >С=О и –О– соответственно, присутствуют в ИК-спектрах сополимеров.
Рис. 1.
ИК-спектры пленки сополимера на основе 2-п-хлорфенил-1-оксиметилциклопропилметакрилата и стирола. Время облучения 0 (1), 10 (2), 15 (3) и 40 с (4).
В ЯМР-спектре (рис. 2) сополимера отчетливо проявляются резонансные сигналы, относящиеся к протонам бензольного ядра (δ = 6.80–7.20 м.д.) и циклопропанового кольца (δ = 1.58–2.70 м.д.), а сигналы протонов винильной группы (δ = 5.10–6.65 м.д.) в спектре ЯМР отсутствуют. Результаты спектральных анализов показывают, что сополимеризация протекает только за счет раскрытия двойных связей без участия циклопропанового фрагмента с сохранением остальных реакционноспособных функциональных групп мономера 2.
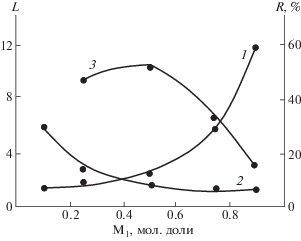
Константы сополимеризации были определены по методу Файнмана и Росса с использованием данных элементного анализа, а параметры Q и e – по методу [20]. С целью более подробного исследования структуры синтезированных сополимеров (сополимера п-хлорфенил-циклопропил-метакрилат со стиролом) по уравнениям из работы [21] была рассчитана длина блоков L и значение параметра блочности R (рис. 3). Длина блоков метакрилатов увеличивается с повышением их доли в составе сополимера. Из полученных результатов следует, что значения скорости полимеризации п-фенилзамещенных циклопропилметакрилатов 1 и 2 в условиях радикальной сополимеризации близки. Соответственно близки рассчитанные значения параметров Q и e для обоих мономеров, т.е. в указанных условиях хлор и нитрогруппа оказывают практически одинаковое влияние на активность двойной связи в молекуле синтезированных мономеров 1 и 2.
Рис. 3.
Микроструктура сополимера стирола с п-хлорфенилциклопропилметакрилатом: 1 – длина блоков метакрилата, 2 – длина блоков стирола, 3 – параметр блочности R.
Синтезированные сополимеры образуют прочные, прозрачные и эластичные пленки (светопропускание 89%, $n_{{\text{D}}}^{{20}} = 1.6110$), обладающие высокими механическими свойствами и хорошей термической стабильностью.
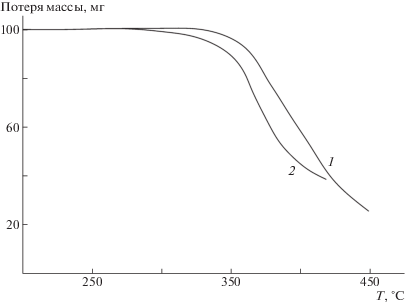
Сополимеры на основе циклопропилзамещенных метакрилатов и стирола являются устойчивыми до 300–350°С, потеря массы при 380°С составляет ~6% (рис. 4). Следовательно, в реальных условиях термообработки проявленного изображения в слоях негативных фоторезистов на основе указанных сополимеров (~250°С, 20 мин) из соответствующих полимерных пленок не выделяются летучие продукты, что повышает защитные свойства резистов.
Наличие в боковых звеньях макромолекул синтезированных сополимеров реакционноспособных группировок способствует сшивке под действием УФ-облучения. Это новый тип негативных фоточувствительных полимеров.
Из данных табл. 2 видно, что исследуемые сополимеры обладают высокими фоточувствительными характеристиками, соответствующими современным требованиям микроэлектроники, и могут быть использованы в качестве фоторезистов для изготовления интегральных микросхем с субмикронными размерами элементов.
Таблица 2.
Фоточувствительность сополимеров на основе циклопропилзамещенных полиметакрилатов
| Сополимер стирола с соединением | Концентрация, мас. % | Толщина пленки, мкм | Фоточувствительность, см2/Дж |
|---|---|---|---|
| 1 | 5.0 | 0.15 | 54.4 |
| 8.0 | 0.15 | 55.3 | |
| 10.0 | 0.20 | 51.4 | |
| 2 | 5.0 | 0.15 | 55.2 |
| 8.0 | 0.15 | 56.0 | |
| 10.0 | 0.20 | 53.2 |
Фотохимические исследования синтезированных сополимеров показали, что предполагаемая схема структурирования аналогична, приведенной в работе [22]. Благодаря наличию в макромолекулах сильнопоглощающих световую энергию фрагментов с циклопропановыми фрагментами, синтезированные сополимеры являются фоточувствительными.
Процесс структурирования полученных циклопропансодержащих сополимеров был изучен ИК-спектроскопией. Показано, что в зависимости от продолжительности облучения (10–60 с) интенсивность максимумов полос поглощения, характерных для циклопропанового кольца (1030–1035 см–1), связи C–Cl (675 см–1) и карбонильной группы (1720 см–1), значительно падает, а затем эти полосы практически полностью исчезают (см. рис. 1). Данный факт указывает на то, что процесс структурирования протекает за счет циклопропанового кольца, карбонильной группы и связи C–Cl.
Полоса поглощения при 1720 см–1, характерная для карбонильной группы в сложноэфирном фрагменте и находящейся в сопряжении с циклопропановой, после облучения смещается до 1740 см–1, что, вероятно, связано с раскрытием циклопропанового кольца и нарушением сопряжения.
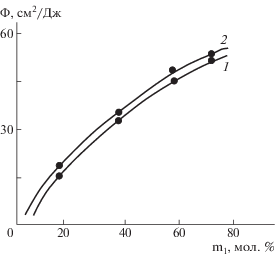
Установлено, что фоточувствительность сополимеров находится в прямой зависимости от содержания звеньев 1, 2 и с увеличением их содержания фоточувствительность увеличивается (рис. 5).
Рис. 5.
Зависимость фоточувствительности (Ф) сополимеров от их состава: 1 – сополимер стирола с мономером 1, 2 – сополимер стирола с мономером 2.
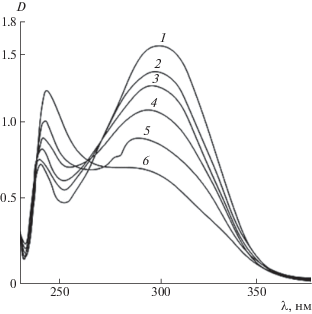
Влияние облучения на фоточувствительные сополимеры было показано по УФ-спектрам (рис. 6). При облучении достаточно очевидно прогрессирующее уменьшение или исчезновение фотоактивных фрагментов. Облучение приводит к быстрому уменьшению интенсивности максимумов 296 и 300 нм и почти полному их исчезновению в течение 6 мин облучения.
Рис. 6.
Изменение УФ-спектров при облучении сополимера стирола с мономером 2. Время облучения 0 (1), 10 (2), 30 (3), 100 (4), 200 (5) и 600 с (6).
Таким образом, наличие в макромолекулах сополимеров циклопропанового кольца, атомов хлора и карбонильных групп позволило создать на базе сополимера материал с высокой фоточувствительностью.
Список литературы
Daniel J.C., Savas K., Faiz R. // J. Vacuum Sci. Technol. B. 2017. V. 35. № 1. P. 011601.
Daniel J.C., Jason T.W., Rajan P., Faiz R. // Semicond. Sci. Technol. 2016. V. 31. № 2. P. 025010.
Jing Q., Jianfang C., Zhoggang W., Xiuyou H., Mingshan Z. // Opt. Mater. 2014. V. 36. № 4. P. 804.
Kemin W., Rong C., Juming G., Jun N. // J. Appl. Polym. Sci. 2012. V. 123. № 1. P. 26.
Gut K. // Proc. Eng. 2012. V. 47. P. 326.
Kunka D., Mohr J., Nazmov V., Meiser J., Meyer P., Amberger M., Koch F., Schulz J., Walter M., Duttenhofer T. // Microsyst. Technol. 2014. V. 20. № 10–11. P. 2023.
Pire M., Norvez S., Iliopoulos I., Rossignol B.L., Leibler L. // Polymer. 2011. V. 52. № 23. P. 5243.
Challioui A., Oulmidi A., Bouammali B., Mahy R., Derouet D., Brosse J.C., Fontaine L. // J. Mater. Environ. Sci. 2016. V. 7. № 6. P. 1898.
Shunya İto, Shu Kaneko, Cheol Min Yun, Kei Kobayashi, Masaru Nakagawa // Langmuir. 2014. V. 30. № 24. P. 7127.
Shekh M.I., Patel D.M., Patel K.P., Patel R.M. // Fibers Polym. 2016. V. 17. № 3. P. 358.
Zhang X., Yu Xu, Li L., Yan B., Bao J., Zhang A. // J. Appl. Polym. Sci. 2019. V. 136. № 21. P. 47487.
Guliev K.G., Ponomareva G.Z., Guliev A.M. // Russ. J. Appl. Chem. 2006. V. 79. № 3. P. 488.
Guliev K.G., Ponomareva G.Z., Guliev A.M. // Polymer Science B. 2007. V. 49. № 8. P. 196.
Гулиев К.Г., Пономарева Г.З., Мамедли С.Б. // Процессы нефтехимии и нефтепереработки. 2009. Т. 10. № 2. С. 183.
Guliev K.G., Alieva A.M., Guliev A.M. // Russ. J. Appl. Chem. 2013. V. 86. № 1. P. 92.
Guliyev K.G., Rzayeva A.E., Mamedli S.B., Khamedova U.A., Nurullayeva D.R., Guliyev A.M. // World J. Res. Rev. (WJRR). 2017. V. 5. № 5. P. 01.
Applied Chemistry and Chemical Engineering: Principles, Methodology, and Evaluation Methods / Eds by A.K. Haghi, Lionello Pogliani, Devrim Balköse, Omari V. Mukbaniani, Andrew G. Mercader. Boca Raton: Apple Acad. Press., 2018.
Гулиев К.Г., Рзаева А.Э., Гулиев А.М., Ищенко Н.Я. // Нефтегазовые технологии и аналитика. 2019. № 4. С. 77.
Guliyev K.G., Rzayeva A.E., Aliyeva A.M., Ponomareva G.Z., Dzhafarov R.D., Guliyev A.M. // Sci. Technol. Polym. Adv. Mater. Georgia. 2019. Ch. 11. P. 149.
Ham G.E. Copolymerization. New York: Interscience, 1964.
Зильберман Е.Н. // Высокомолек. соед. Б. 1979. Т. 21. № 1. С. 33.
Guliyev K.G., Rzayeva A.E., Guliyev A.M. // Russ. J. Appl. Chem. 2019. V. 92. № 9. P. 1131.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)