Высокомолекулярные соединения (серия Б), 2022, T. 64, № 3, стр. 163-196
ЦИАНАТЭФИРНЫЕ МОНОМЕРЫ И ОЛИГОМЕРЫ. ОБЗОР СОВРЕМЕННОГО СОСТОЯНИЯ ИССЛЕДОВАНИЙ И ПЕРСПЕКТИВЫ РАЗВИТИЯ
В. С. Аншин *
Акционерное общество “Композит”
141070 Московская обл., Королев, ул. Пионерская, 4, Россия
* E-mail: thiazole@bk.ru
Поступила в редакцию 11.10.2021
После доработки 03.02.2022
Принята к публикации 17.02.2022
- EDN: AJSLTT
- DOI: 10.31857/S2308113922200013
Аннотация
Предложен современный уровень подхода к изучению исходных мономеров и олигомеров для цианатэфирных смол – перспективных термореактивных связующих для композиционных материалов. На основании анализа литературных данных за последние 60 лет собрана и структурирована информация о строении цианатэфирных связующих, их свойствах и характеристиках полимеров, получаемых из этих соединений. Представлены последние достижения в области синтеза новых мономеров и олигомеров, не отраженные в классических обзорах, а также рассмотрены перспективные направления для новых связующих.
ВВЕДЕНИЕ
Первые наработки в области синтеза цианатэфирных связующих относятся к началу 60-х годов ХХ века. Уже тогда велись интенсивные исследования в области создания высокотемпературных полимерных материалов, которые привели к синтезу и других связующих – имидных, кремнийорганических, фталонитрильных и т.д. С тех пор цианатные связующие прошли долгий путь от лабораторной диковинки до широко используемых матриц для композиционных материалов. Обладая технологичностью эпоксидных связующих, они демонстрируют более высокую температуру эксплуатации – 250–300°С (в некоторых случаях и до 400°С), имеют невысокое влагопоглощение, относительную диэлектрическую проницаемость, а также ряд других ценных свойств.
За последние 10 лет было опубликовано несколько обзорных статей [1‒4], однако внимание в них уделялось модификации цианатэфирных материалов, технологическим особенностям их переработки и практике применения. При этом не рассматривались успехи в синтезе новых мономеров цианатэфирных связующих. Поэтому в настоящей работе была поставлена цель ‒ рассмотреть широкий спектр цианатэфирных соединений и полимеров на их основе, представить их свойства в едином удобном формате и сформировать общее представление о современном состоянии исследований в данной области и перспективах дальнейшего развития.
На основании изучения литературных данных можно сделать вывод, что основные направления по синтезу новых цианатов определяются потребностями улучшения свойств полимеров на их основе: повышением температуры стеклования, уменьшением горючести, увеличением стойкости к удару, уменьшением диэлектрической проницаемости, снижением влагопоглощения, повышением термоокислительной стойкости, улучшением технологичности переработки, отказом от использования нефтяного сырья.
Функциональными группами в составе молекул рассматриваемых соединений, обеспечивающими прохождение реакций полимеризации (циклотримеризации), являются цианатэфирные фрагменты. Атом углерода в них характеризуется высокой электрофильностью, что обеспечивает его взаимодействие с различными нуклеофильными агентами, в частности с фенолами, остатки которых после синтеза играют важную роль катализатора в реакциях циклотримеризации мономеров. Ниже представлена схема реакции в общем виде [5] с образованием узла сетки полимера:

В рамках данной работы для обозначения исходного мономера (олигомера) был использован термин “цианэфирное связующее”, а также “цианаты” или “дицианаты”, последнее указывает на наличие двух функциональных группировок в мономере; для полимера (отвержденной смолы) ‒ термин “полицианураты”, “полицианаты” или “s-триазины”. В дополнительных материалах к статье приведена сводная таблица , консолидирующая свойства цианатных связующих и полимеров на их основе.
КАРБОЦЕПНЫЕ МОНОМЕРЫ
Наибольшее практическое распространение получили мономеры на основе бисфенолов различного строения [5, 6]. Примерами таких соединений являются 2,2‑бис-(4‑цианатофенил)пропан 1 (цианатэфирное производное бисфенола-А; связующие “Primaset BA-200”, “Primaset BA-230S” и “Primaset DT-7000”), 1,1‑бис-(4‑цианатофенил)этан 2 (цианатпроизводное бисфенола-E; связующие “Primaset LECy” и “AroCy L-10”; препрег “EX-1510”), бис-(4‑цианато‑3,5‑ диметилфенил)метан 3 (цианатпроизводное тетраметилбисфенола‑F), 1,1‑бис-(4‑цианатофенил)‑1‑фенилэтан 4 (цианатпроизводное бисфенола-AP), бис-(4‑цианатофенил)дифенилметан 5, 1,3‑бис-(2‑(4‑ цианатофенил)‑2‑пропил)бензен 6 (цианатпроизводное бисфенола-М, связующие “AroCy XU 366” и “AroCy XU 378”):

Невысокая стоимость производства и доступность сырья обусловливают широкое применение смол на основе мономера 1. Он имеет температуру плавления 78°С [5]. Температура стеклования полностью отвержденных полицианатов на его основе колеблется в диапазоне 240–290°С (в зависимости от способа определения), что выше полимеров на основе эпоксидных связующих, для которых температура стеклования на превышает 200°С [6, 7]. При этом низкая вязкость мономера после плавления позволяет перерабатывать его привычными для эпоксидных смол методами. Вместе с тем полимеры на основе мономера 1 показывают недостаточную стойкость к удару – скорость высвобождения энергии деформации (характеризующая механическую вязкость) для них GIC = 140 Дж/м2 [6]. Поэтому был синтезирован мономер 6, который за счет уменьшения плотности сшивки увеличивает механическую вязкость полициануратов (GIC = 210 Дж/м2 для полицианурата на основе мономера 6 [6]). Одновременно уменьшилась относительная диэлектрическая проницаемость полимеров с 2.79 для мономера 1 до 2.54 для мономера 6 (на частоте 1 ГГц) [8]. Однако эти полицианураты продемонстрировали невысокие значения температуры стеклования ‒ всего 192°С [6] (по другим данным 179°С [8]).
Мономер 1 хоть и обладает достаточно хорошей технологичностью, но все-таки при комнатной температуре не находится в текучем состоянии, что затрудняет переработку. Обычно для получения жидкого связующего применяется мономер 2 [9], в качестве активного разбавителя к мономеру 1, но его температура плавления составляет 29°С, что несколько выше комнатной. В связи с этим синтез жидких мономеров при комнатной температуре представляет определенный технологический интерес. В работе [10] был синтезирован 2,2′-бис-(4-цианатофенил)бутан 7 (цианатпроизводное бисфенола-B) с температурой плавления ‒38°С. Свойства полициануратов на основе мономера 7 оказались схожи со свойствами полимеров на основе мономера 1.
Также к недостаткам мономера 1 и других уже рассмотренных мономеров можно отнести невысокую стойкость к горению материалов на их основе. Поэтому распространение получили галогенсодержащие мономеры 2,2‑бис-(4-циантофенил)гексафторпропан 8 (цианатпроизводное бисфенола-AF) [5]; 1,1‑дихлор‑2,2‑(4-цианатофенил)этилен 9 (цианатпроизводное бисфенола-С) [11].
Обширные исследования горючести полимеров на основе промышленно выпускаемых цианатэфиров, проведенные в работе [12], продемонстрировали высокие характеристики для полицианатов на основе мономеров 8 и 9. Тепловыделяющая способность (англ. Нeat release capacity ‒ HRC), определенная методом микромасштабной калориметрии горения (англ. Рyrolysis combustion flow calorimetry) для полимеров на основе мономеров 8 и 9 составила 62 и 24 Дж/г К, в то время как s-триазинов на основе мономеров 1, 2, 3 ‒ 283, 316, 280 Дж/г К соответственно. Дымообразующая способность, определенная как сумма поверхности частиц выделяющегося дыма на единицу массы сгорающего вещества (англ. Smoke extinction area ‒ SEA) методом конической калориметрии горения, для полимеров на основе мономеров 8 и 9 составила 55 и 97 м2/кг, в то время для полицианатов на основе мономеров 1, 3, 6 были получены значения 683, 771, 906 м2/кг соответственно (плотность теплового потока 75 кВт/м2). В работе [11] проводится подробное изучение мономера 9 и предлагается механизм его термодеструкции. К сожалению, данные о физико-механических свойствах полимеров на основе мономеров 8 и 9 не были опубликованы, видимо, по причине того, что эти соединения применяются только в смеси с другими мономерами.
Еще одним привлекательным направлением для синтеза новых связующих выступает снижение диэлектрических характеристик полимеров. Полицианатами по их природе свойственны низкие значения диэлектрической проницаемости, но постоянно ищутся пути по еe снижению. В работе [13] была синтезирована смесь изомеров дипентен-содержащих мономеров общим строением мономера 10, фенильное кольцо в которых присоединено в положение 1 или 4 (для левой части молекулы) и в положение 2 или 3 (для правой части молекулы). Разделения изомеров после синтеза проведено не было:
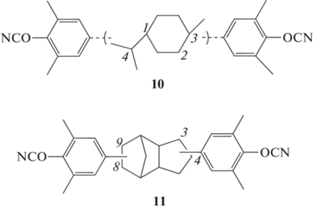
Полимеры на основе мономера 10, по сравнению с полицианатами на основе мономера 1, показали более низкие значения диэлектрической проницаемости (2.56 и 2.79 на 1 ГГц соответственно) и влагопоглощения (0.95 и 1.77 мас. %), более высокие значения модуля упругости (4.6 и 2.65 МПа при 150°С). В то же время ухудшились высокотемпературные свойства полимеров – температура стеклования, температура начала разложения, коксовый остаток.
Также были синтезированы мономеры общего строения 11 на основе дициклопентадиена [14]. Они тоже были получены в виде смеси, которая не была разделена. Фенольное кольцо присоединено в положение 8 или 9 (для левой части молекулы) и в положение 3 или 4 (для правой части молекулы). Для полимеров на основе мономера 11 диэлектрическая проницаемость составила 2.53 (1 ГГц), влагопоглощение 0.88 мас. %. При этом по сравнению с полицианатами на основе мономера 10 выросла температура стеклования полимера на основе мономера 11. Механические свойства изучены не были.
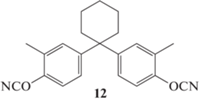
В работе [15] был синтезирован [4-[1-(4-цианато-3-метилфенил)циклогексил]-2-метилфенил] цианат 12, который также предлагается к использованию в материалах радиотехнического назначения. В чистом виде этот мономер применяться не планировался, поэтому свойства его и полицианатов на его основе не исследовались, но была определена температура начала разложения, которая составила всего 230°С.
Расположение цианатной группы на фенильном кольце в положении 2 (вместо 4 как в случае мономеров 1‒4) приводит к ухудшению свойств полимеров. В работе [16] синтезирован бис-(2-цианато-3,5-диметилфенил)метан 13. Полимеры на его основе имели низкую теплостойкость. Так, температура деформации под нагрузкой (англ. Deflection temperature under load ‒ DTUL) полицианатов (которая, как правило, несколько ниже температуры стеклования) составила всего 160°С, что значительно меньше уже рассмотренных полимеров.

Недавно [17] был синтезирован мономер похожего строения ‒ бис-(2-цианато-5-трет-бутилфенил)метан 14. При относительно высокой температуре плавления (153°С) полицианаты на его основе не отличались высокой температурой стеклования (239°С), которая не превосходит более технологичный мономер 1. Температура термостабильности отвержденного связующего была определена в районе 390°С.
Мономеры, содержащие в своeм составе одно фенольное кольцо, должны давать большую плотность сшивки, а значит более прочные, жесткие, термостойкие и негорючие пластики по сравнению с полимерами на основе мономера 1 [5, 18, 19]:
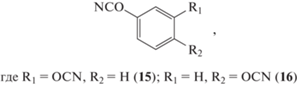

1,3-Дицианатобензол 15 и 1,4-дицианатобензол 16 считались перспективными мономерами, в частности для изготовления клеeв, однако не получили широкого распространения, по всей видимости из-за более высокой реакционной способности [5, 18] и связанными с этим сложностями хранения и переработки. Токсичность резорцинола и гидрохинона – исходного сырья для их получения ‒ является еще одним препятствием для использования, которую можно преодолеть, если при синтезе мономера применять не сам исходный фенол, а результат его взаимодействия с цианурхлоридом [20]. Из-за высокой плотности сшивки материалы на основе мономеров 15 и 16 будут более хрупкими, по сравнению с полимерами на основе мономера 1, однако сведений об ударной стойкости для соответствующих полимеров обнаружить не удалось.
Для уменьшения влагопоглощения полимеров был получен мономер 17 [21]. Полимеры на его основе действительно показывали низкое водопоглощение – 0.83 мас.%, но также и значительно снижалась температура стеклования, которая составляла всего 150°С.
Мономеры с бифенильными фрагментами привлекают внимание исследователей как возможность получения жестких полимеров с высокой температурой стеклования и трудногорючих материалов. Самым простым мономером является 4,4′-дициантобифенил 18, полученный ещe в работе [22]. В литературе имеется неопределенность, касаемо свойств мономера и полимеров на его основе. Так, в работах [19, 22] сообщается о температуре плавления 131°С, в то время как авторы работы [23] утверждают о 82°С. Так, температура стеклования полимеров в работах [19] и [23] была определена как 380 и 215°С соответственно. А. Галухин свидетельствовал (персональным сообщением) о получении полимера на основе мономера 18 с температурой стеклования 370°С:
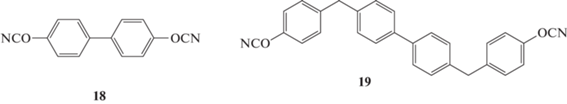
Развивая идею бифенильных мономеров, в работе [24] был синтезирован 4,4′-бис-(4-цианатобензил)бифенил 19. Полимер на его основе демонстрировал высокий коксовый остаток – 65 мас. % (N2, Т = 800°С) по сравнению с полимером на основе мономера 1 (40 мас. %) и уменьшенное водопоглощение 1.08 против 1.89% соответственно. Полученный полимер был значительно более стоек к горению и проходил испытания UL-94 по норме V-0 по сравнению с полицианатами на основе мономера 1, которые не прошли этот тест. Механические свойства полимеров не исследовались.
Технологической трудностью бифенильных мономеров является высокая температура плавления, которая для мономера 19 составляет 163°С, что затрудняет их переработку. С этой позиции интерес представляют мономеры, полученные в работе [25], в которой синтезированы различные изомеры. Наибольшую температуру стеклования показали полимеры на основе пара-изомеров – 2-(4′-цианатофенил)-2-[4-(4′-цианатофенил)фенил]пропан 20 и бис-[4-(4′-цианатофенил)фенил]пропан 21. При более низких значениях температуры плавления – 79 и 137°С соответственно, полимеры на их основе показывали довольно высокие значения температуры стеклования – 298 и 315°С (для полимера на основе мономера 1 в данной работе была получена температура стеклования 294°С):

Привлекательным направлением можно назвать синтез мономеров, содержащих в своем составе фрагменты адамантана. Это направление, судя по количеству патентов, например [26‒28], активно разрабатывается в компании “Mitsubishi Gas Chemical Company”. Однако количество научных публикаций чрезвычайно мало. В работах [29, 30] предлагаются соединения [4-[3-(4-цианатофенил)-1-адамантил]фенил]цианат 22 и [4-[3-(4-цианатофенил)-5,7-диметил-1-адамантил]фенил]цианат 23:
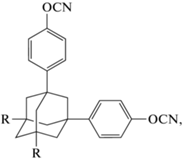
где R = H (22); Me (23); C6H4–п-OCN (24).
Утверждается, что полимеры на основе этих мономеров показывают меньшее влагопоглощение (0.2 мас.%) [30] по сравнению со связующими на основе мономера 1, но точных доказательств этого факта предоставлено не было. Синтез мономера 22 описан в работе [31]. Полученный мономер имел температуру плавления 122°С. Исследования были направлены в основном на изучение кинетики полимеризации, но были получены данные по температуре стеклования и термостабильности полимера, которые составили 345 и 446°С (в Ar).
В работе [32] сообщается о синтезе 1,3,5,7-тетракис-(4-цианатофенил)-адамантана 24. Подробного изучения мономера и полимеров на его основе не проводилось, в связи с тем что полимеры предлагается использовать как высокопористые сорбенты для органических паров, водорода и диоксида углерода, а не в качестве полимерной матрицы. При попытке получения материалов на основе мономера 24 стоит ожидать трудностей с переработкой, так как его температура плавления составляет 229‒231°С.
Мономеры с конденсированными ароматическими кольцами привлекают к себе внимание с самых ранних этапов изучения цианатных связующих [19, 22]. С помощью таких соединений пытаются повысить температуру стеклования полицианатов, увеличить их термостабильность и уменьшить горючесть. Здесь наиболее интересен 2,7-дицианатонафталин 25, первые упоминания о котором относятся к отчетам [33, 16 ]. По результатам этих исследований, для полимеров на основе мономера 25 была определена температура термостабильности ‒ 400°С и коксовый остаток ‒ 64 мас. % (N2, Т = 800°С). Температура деформации под нагрузкой (DTUL) составила 220‒267°С. Эти данные подтверждаются более поздней работой [34]. Однако, как и в случае с мономером 18, снова наблюдаются заниженные значения [23]. Так, температура плавления определена как 80°С, хотя в работах [34, 35] отчетливо показано, что она не ниже 140°С. В работе [23] видно, что температура термостабильности составила 229°С, что сильно ниже других данных. Это ставит под сомнение результаты работы [23]. Также вызывают сомнения данные работы [36] по водопоглощению полимера на основе мономера 25–0.19%, что кажется сильно заниженным значением:

Также, из продуктов реакции формальдегида и нафтола, был синтезирован дицианат строения 26 [16] который представлял, по всей видимости, смесь изомеров. Полицианаты на его основе имели ощутимо более высокую температуру деформации под нагрузкой – 291°С. Однако в научной литературе больше не удалось найти упоминаний об этом соединении.
В работе [37] описывается синтез 1,4-дицианатоантрахинона 27. Установлена его температура плавления – 120°С, хотя в работе [22] приводятся данные, что это неплавкое соединение, разлагающееся при нагревании. Его полимеры в чистом виде получены не были и свойства их не известны. Добавление данного мономера в эпоксидные композиции приводило к сильному росту их термостойкости и коксовых остатков [37]:
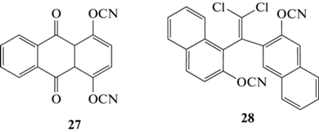
В патенте [38] предложен интересный мономер [1-[2,2-дихлоро-1-(2-цианатонафтален-1-ил)этинил]нафтален-2-ил]цианат 28, который схож по строению с мономерами 9 и 26. По замыслу авторов он должен давать трудногорючий полимер, только сведений об успешном синтезе и свойствах полимеров на его основе найти не удалось.
В ряде рекламных материалов высказывалось мнение, что [4-[6-(4-цианатофенил)фенантрен-3-ил]фенил]цианат 29 и [[4-[10-(4-цианатофенил)антрацен-9-ил]фенил]цианат 30 перспективны для материалов с пониженной горючестью. Хотя также очевидно, что они будут иметь очень высокие значения температуры плавления и давать жесткие полимерные цепи, что непременно отразится на сложности их переработки. Сведений об успешном синтезе таких соединений не обнаружено. Если такие соединения и будут представлены, то они будут применяться как добавки к классическим цианатэфирным мономерам.

На основе бисфенолов с объeмными заместителями (кардовых соединений), затрудняющих свободное перемещение фрагментов полимерной цепи, возможно получение полицианатов с высокой температурой стеклования. В работе [33] были изучены полимеры на основе 9,9-бис-(4-цианатофенил)флоурена 31. Такой полимер продемонстрировал температуру деформации под нагрузкой (DTUL) 250°С, что значительно ниже данных по температуре стеклования (метод ТМА) ‒ 375°C, представленных в работе [19]. Это сложно объяснить различием в методах оценки, а других сведений обнаружить не удалось:

где R1 = R2 = H (32); R1 = Me, R2 = H (33); R1 = i-Pr, R2 = Me (34).
В работе [39] были проведены широкие исследования мономеров на основе фенолфталеина – 3,3-бис-(4-цианатофенил)-2-бензофуран-1-она 32, 3,3-бис-(4-цианато-5-метилфенил)-2-бензофуран-1-она 33, 3,3-бис-(4-цианато-2-метил-5-пропан-2-илфенил)-2-бензофуран-1-она 34. Температура стеклования полицианатов составила 362, 328 и 298°С для мономеров 32, 33 и 34 соответственно, против 298°С для полимера на основе мономера 1, также исследованного в этой работе. Получены высокие коксовые остатки в азоте при 700°С ‒ 54, 59 и 44% соответственно. Водопоглощение полимеров исследовано не было.
Повышение функциональности мономеров – наличие трех или более функциональных цианатных групп – будет приводить к увеличению температурных характеристик отвержденных смол за счет повышения плотности сшивки полициануратной сети. Именно по этой причине 1,1,1-трис-(4-цианатофенил)этан 35 считался перспективным мономером и разрабатывался фирмой “Ciba” под маркой “RS‑255”. Имея температуру плавления 114°С, полностью отвержденные полицианураты на его основе давали температуру стеклования 419°С (при температуре разложения 420°С) [40]. Также полимеры на основе мономера 35 демонстрировали высокие коксовые остатки ‒ 59% (N2, Т = 600°C) [40]. Только массового применения мономер 35 так и не нашел, что может быть связано с конкуренцией с фенолтриазиновыми смолами, которые, обеспечивая похожие свойства, оказались проще в получении, а потому экономически привлекательнее:

В работе [41] синтезирован 1,3,5-трис-[4-(4-цианатофенил)фенил]бензол 36 ‒ трифункциональный мономер с жесткими бифенильными фрагментами. Жесткая структура мономера привела к высокой температуре плавления – 273°С, при том что отверждение с заметной скоростью наблюдается при температуре порядка 290°С, это значительно ухудшает условия для переработки таких мономеров. Температура стеклования полимера на основе мономера 36 составила 360°С, температура термостабильности ‒ рекордные 515°С, при коксовом остатке 80 мас.% (Т = 900°С, в азоте).
Увеличение функциональности мономеров, а значит и плотности сшивки приводит к увеличению хрупкости отвержденных полициануратов. Как продемонстрировали исследования [40, 42], низкая гибкость макромолекул трифункциональных мономеров способствует неполной конверсии реакционных групп. Недоотвержденность оказывает отрицательное влияние на влагопоглощение полимера, приводящее к уменьшению его температуры стеклования. В связи с этим в работе [42] синтезирован мономер 1,2,3-трис-(4-цианатофенил)пропан 37, который показывал высокую степень конверсии при отверждении. Температура стеклования полимера на основе мономера 37 составила 340°С, что ниже температуры стеклования полимера на основе новолачного цианатэфирного связующего марки “PT-30” (390°С). Однако высокая степень конверсии цианатных групп позволила значительно снизить влагопоглощение полимера (3.5 и 5.1 мас.% соответственно). Температура стеклования полимеров после влагонасыщения выровнялась и составила 245°С:

где R = H (38); Me (39).
Недостаточная, как показалась авторам работы [40], термостабильность полимеров на основе мономера 37, по сравнению с полимерами фенолтриазиновых связующих (400 против 430°С), побудила к синтезу 1,3,5-трис-[(4-цианатофенил)метил]бензена 38. Он также демонстрировал высокую степень конверсии при отверждении и низкое влагопоглощение получаемого полимера (2.2 мас.%), но температура стеклования сухого полимера осталась на том же уровне и составила, для полностью отвержденного образца, 338°С, снижаясь после влагонасыщения до 238°С. Термостабильность, действительно, немного выросла по сравнению с полимером на основе мономера 37, и составила 430°С.
Мономер похожего строения 1,3,5-трис-[1-(4-цианатофенил)этил]бензен (получен в виде рацемической смеси стереоизомеров) 39 оказывается жидким при комнатной температуре [43], но полимеры на его основе демонстрируют еще более низкие значения температуры стеклования (305°С). К сожалению, не были проведены исследования механических характеристик полученных полимеров, в частности определение стойкости к удару.
Наметившаяся тенденция к переходу от нефтяного к возобновляемым видам сырья способствовала синтезу ряда новых цианатных мономеров. Синтезирован 1-(4-цианатофенил)-2-(3,5-дициантофенил)этан 40 на основе ресвератрола [44]. Наибольшее количество ресвератрола (порядка 0.9) содержится в корнях растения рода Рейнутрия ‒ рейнутрии японской (Reynoutria japonica), рейтнурии сахалинской (Reynoutria sachalinensis) – 6.3 мг/г сухого остатка корня [45]. В листве и стеблях его практически нет. Полимер на его основе отличался высокой температурой стеклования (после окончательного отверждения) – 334 против 323°С для полицианата на основе мономера 1 [44]; температура начала разложения 407°С:
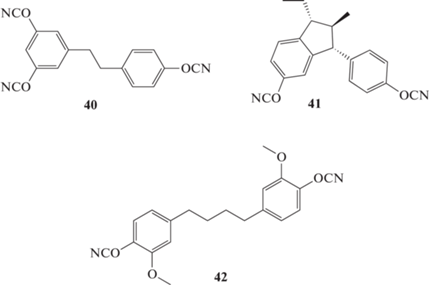
В работе [46] получен 1-этил-2-метил-3-(4-циантофенил)-5-цианатоиндан 41 (в виде смеси стереоизомеров), который также демонстрировал высокую температуру стеклования (после окончательного отверждения) ‒ 313°С и разложения – 370°С, имел относительно невысокую температуру плавления – 70°С (123°С для мономера 40). Исходным сырьем для синтеза служил природный анетол – эфир, содержащийся в маслах бадьяна настоящего (Illicium verum) – 90%, фенхеля (Foeniculum) – 80% и других растений [47].
Еще один представитель мономеров на возобновляемом сырье 1,4-бис-(3-метокси-4-цианатофенил)бутан 42 синтезирован в работе [48]. Температура стеклования полимера составила всего 186°С, что значительно ниже классических цианатных полимеров. Исходным сырьем послужил эвгенол – фенол, содержащийся в эфирных растительных маслах, в частности наибольшее содержание обнаружено у масла из гвоздичного дерева (Syzygium aromaticum) – до 85% масла, полученного из стеблей, при выходе масла из исходного сырья 15‒20%.
Основной проблемой мономеров 40‒42 является невысокое содержание исходного компонента для их синтеза в растениях и сложность его выделения, что приводит к экономическим затруднениям. Решением этой проблемы может стать применение в качестве исходного сырья креозола, получаемого из ванилина, который, в свою очередь, выделяют из природного лигнина (выход ванилина 14% при содержании лигнина в растительном сырье 15‒20%) в больших количествах по невысоким ценам. Синтез мономеров из креозола рассмотрен в работах [49, 50]. Получены бис-(2-цианато-3-метокси-5-метилфенил)метан 43, бис-(5-цианато-4-метокси-2-метилфенил)метан 44, 1,1-бис-(5-цианато-4-метокси-2-метилфенил)этан 45, 1,1-бис-(5-цианато-4-метокси-2-метилфенил)пропан 46, бис-(4-цианато-2-метилфенил)метан 47, 1,1-бис-(4-цианато-2-метилфенил)этан 48, 1,1-бис-(4-цианато-2-метилфенил)пропан 49:
 ,
,
где R = H (44); Me (45); Et (46)
 ,
,
где R = H (47); Me (48); Et (49).
Изначально были синтезированы мономеры с метокси-группой [49]. Температура плавления соединений 43, 44, 46 оказалась достаточно высокой (более 100°С) и только соединение 45 показывало температуру плавления 91°С. Также выяснилось, что соединения 43‒46 не достаточно термостойки и начинали разрушаться уже при доотверждении, в связи с чем обозначились трудности с окончательным отверждением мономеров и определением их температуры стеклования. Данный параметр был определен для не полностью отвержденных полимеров как 181°С для мономера 43 и 257°С для мономеров 44, 45, 46 и уменьшался при дополнительной термообработке. Низкотемпературное доотверждение полимеров позволило получить значения температуры стеклования 236, 240, 206 и 219°С для 43, 44, 45 и 46 соответственно. Установлено, что примеси, содержащиеся в мономерах, значительно влияют на процесс отверждения и могут приводит к снижению температуры стеклования полимеров. Температура начала разложения определена как 317, 360, 330 и 329°С для мономеров 43, 44, 45 и 46 соответственно, это относительно невысокие значения.
В дальнейшем [50] были получены мономеры 47, 48, 49, в которых отсутствовала метокси-группа. Отмечалось падение температуры плавления мономеров, которое оказалось наиболее значительным для мономера 49 (жидкий при 20°С). Температура стеклования поднялась до значений 267, 283 и 272°С для полицианатов на основе мономеров 47, 48 и 49. Значительно выросла термостойкость – признаки разложения начали проявляться при температуре выше 400°С для всех полимеров, а также существенно увеличился коксовый остаток с 27% для мономера 46 до 52% для мономера 49 (Т = 500°С, в азоте). Уменьшилось водопоглощение полимеров с 3.21 мас.% для мономера 46 до 1.84 для мономера 49 [50], тем самым представляя мономеры 47‒49 наиболее привлекательными среди всех соединений, получаемых из возобновляемого сырья.
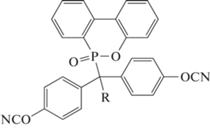
Применение фосфорсодержащих мономеров может приводить к уменьшению горючести полицианатов. По этой причине в последнее время был синтезирован ряд соединений с фрагментами 9,10-дигидро-9-окса-10-фосфафенантрен-10-оксида (англ. DOPO), который хорошо известен как антипирен для полиолефинов. Синтезированы 6-(α-метил-4,4′-дицианатобензилгидрил)-6H-дибензо[c,e] [1, 2]оксофосфрин-6-оксид 50 [51], 6-[4,4′,4′′-трицианато]-6H-дибензо[c,e] [1, 2]оксофосфрин- 6-оксид 51 [52], [4-цианато-2-(6-оксобензо[c] [2, 1 ]бензоксофосфинин-6-ил)фенил]цианат 52 (сведений о синтезе и свойствах обнаружить не удалось, но по данным работы [53], он входит в состав связующего FR-300; “Lonza”):
 ,
,
где R = Me (50); C6H4–п-OCN (51).
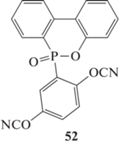
Более сложный мономер 53 был синтезирован в работе [54]:

Чистые полимеры на основе мономеров 51, 52, 53 показывали температуру стеклования 263 и 276°С по методу ДСК и 268°С по методу ДМА соответственно. Однако в чистом виде они будут либо слишком дороги, либо не технологичны (как в случае метода 53, который вообще не плавится). Эти мономеры предлагается использовать в смеси с мономером 1 или другими промышленно используемыми мономерами, что приводит к значительному уменьшению горючести полимеров на основе таких смесей [51, 52, 54].
Цианатные мономеры на основе алкильных фрагментов, в которых цианатная группа присоединена непосредственно к алкильному, а не ароматическому атому углерода, не находят практического применения. Это связанно со склонностью к реакциям изомеризации алкилцианатов в изоцианаты [55, 56] с последующим образованием изоциануратов, не позволяя тем самым получить качественный полимер. Имелось сообщение [57] о том, что введение в алифатические цианаты карборанового фрагмента дает возможность стабилизировать получаемые мономеры, только данные исследования не получили дальнейшего развития.
Гораздо больше известно о карборансодержащих мономерах с ароматическими фрагментами, примерами которых служат 1,2‑бис-(4′-цианатобензил)-о-карборан 54 и 1,4‑бис-(2′-цианатометил-о-карборан-1′-ил)бензол 55:

Исследования этих соединений проводились в 70-х годах XX века [19], и с тех пор не обнаружено новых публикаций по этой тематике. Возможно, это связанно с трудоемкостью синтеза, а значит и стоимостью конечного продукта, которая оказывается намного выше классических связующих. Отличительной и привлекательной чертой полимеров на основе мономеров 54, 55 является крайне высокий коксовый остаток. Полимер на основе мономера 54 при нагревании до 900°С теряет 2 мас. % на воздухе и 16 мас. % в атмосфере гелия, причем другие полицианураты в этих условиях сгорают практически целиком. Впрочем, такое поведение характерно и для других не цианатэфирных карборансодержащих полимеров [58]:

где n = 3 (56); 6 (57); 10 (58).
Были получены мономеры с различными фторалкильными радикалами ‒ 2,2,3,3,4,4,5,5,6,6,7,7-гексафтор-1,5-дицианатопентан 56, 2,2,3,3,4,4,5,5,6,6,7,7-додекафтор-1,8-дицианатооктан 57, 2,2,3,3,4,4, 5,5,6,6,7,7,8,8,9,9,10,10,11,11-эйкозадекафтор-1,10-дицианатододекан 58 [59, 60]. Наиболее перспективным можно считать мономер 57. Низкая диэлектрическая проницаемость 2.3–2.7 и низкое водопоглощение в отвержденном состоянии [59, 60] вызывают к ним интерес в качестве материалов радиотехнического назначения. Несмотря на это, такие мономеры не имели широкого распространения, возможно, из-за низкой температуры стеклования (86–101°С) [60] конечного полимера и склонности к гидролизу, даже при комнатной температуре [59].
ГЕТЕРОЦЕПНЫЕ МОНОМЕРЫ
До сих пор рассматривались мономеры, которые содержали в основной цепи только атомы углерода. Однако синтезировано большое количество мономеров с гетероатомами. Весьма интересным направлением в этом отношении выглядит использование кремнийорганических соединений с цианатными функциональными группами. Структуры, которые содержат связь цианатэфирной группы непосредственно с атомом кремния [61, 62] не стабильны, как и алкилцианаты, и, видимо, не имеют перспектив для практического использования.
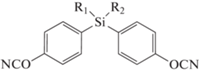
Синтезированы мономеры, содержащие атом кремния [63, 64]. В работе [63] был получен бис-(4-цианатофенил)диметилсилан 59 ‒ аналог мономера 1. По сравнению с полимерами на основе мономера 1 у материалов на основе нового связующего водопоглощение было ниже ‒ не более 1.5 мас. % (3.5 мас. % для полицианатов на основе мономера 1), при этом температура стеклования (265°С) оказывалась лишь на 10°С ниже, а механические свойства уменьшались не более чем на 10%:
 ,
,
где R1 = R2 = Me (59); R1 = Me, R2 = C6H4–п-OCN (60); R1 = R2 = C6H4–п-OCN (61).
Увеличение функциональности, как и ожидалось, приводило к увеличению температуры стеклования. В работе [64] получены полимеры на основе метил[трис-(4-цианатофенил)]силана 60 и тетракис-(4-цианатофенил)силана 61. Установлено, что она не ниже 360°С для полимера на основе мономера 60. Точное значение установить не удалось, в связи с тем что при данной температуре начинаются процессы термического распада полимера. Водопоглощение полицианатов на основе мономера 60 было определено как 5.5 мас. %, что намного больше, чем для мономера 59, и приводило к значительному падению температуры стеклования до 202°С [64]. Для четырехфункционального мономера 61, ввиду сложности его переработки, образцы из гомополимера получены не были, поэтому данных о свойствах его полимеров не представлено, но они, вероятнее всего, очень похожи на свойства полимеров на основе мономера 60. Таким образом, вопрос о перспективности многофункциональных мономеров на основе силанов остается неоднозначным.
Мономеры с эфирным мостиком в основной цепи интересуют исследователей с самых ранних этапов изучения цианатэфирных соединений. Впервые такой мономер был синтезирован в работе [22] ‒ [2-[(2-цианато-3,5-диметифенил)метоксиметил]-4,6-диметилфенил]цианат 62, но полимер не был получен. Более успешным оказался бис-(4-цианатофенил)эфир 63 [5, 19, 65], который нашел применение в промышленном связующем “ESR-288” [5], так как он имел невысокие значения температуры плавления (89°С), а полимеры на его основе демонстрировали высокую температуру стеклования – 271°С [66] (по другим данным 400°С [19]). Полимер на основе мономера 63 интересен также и тем, что все полимерные цепи содержат подвижные эфирные мостики, а значит возможно получение материала с увеличенной деформационной способностью. Действительно, для полимеров на основе мономера 63 деформация при разрушении составила порядка 5.4% [66] (6% по данным работы [5]), в то время как для полимеров на основе соединений 1‒6 она не превышает 3.8% [5]:

В последствии синтезирован [67] ряд новых мономеров ‒ [4-[2-[4-[2-(4-цианатофенил)пропан-2-илокси]фенил]пропан-2-ил]фенил]цианат 64 и [5-трет-бутил-2-[2-(4-трет-бутил-2-цианатофенокси)этокси]фенил]цианат 65. Хотя полимеры на их основе показали недостаточно высокую температуру стеклования (228 и 234°С соответственно). Это можно объяснить подвижностью эфирных связей и увеличенной длиной мономера, что уменьшало плотность сшивки. Температура начала разложения полимеров составила 336 и 329°С соответственно:
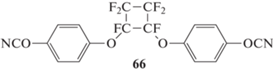
В работе [68] был синтезирован фторсодержащий мономер 4,4′-[(1,2,3,3,4,4-гексафторциклобутан-1,2-диил)-бис-(окси)]бисфенолдицианат 66. Материалы, полученные на основе этого мономера, имели крайне низкое водопоглощение – порядка 0.5‒0.6 мас. %. Температура стеклования отвержденного полимера составила 197°С, что заметно ниже полимеров на основе мономера 1. Такие связующие могут найти свое применение в судостроении, где низкое влагопоглощение играет важную роль.
Определенный интерес представляют мономеры на основе арилатов. Они рассматриваются как сырье для получения высокоориентированных жидкокристаллических полимеров и оптически-нелинейных материалов, что реализуется за счет высокой жесткости молекулы мономера:

где R = Me (68); Cl (69).
В работах [69, 70] синтезирован 4-цианатофенил-4-цианатобензоат 67. Температура плавления полученного соединения составила 139°С. Исследования были в основном направлены на изучение возможности образовывать высокоупорядоченные жидкокристаллические области – мезофазы. Показано, что отверждение мономера 67 приводит к образованию таких областей, которые сохраняются до температуры 330°С. В связи с высокой жесткостью мономера и образованием мезофазы возникли сложности с полной конверсией цианатных групп при отверждении. Температура стеклования для полностью отвержденного мономера определена не была, но на основании зависимости температуры стеклования от степени отверждения можно утверждать, что она составит порядка 250°С.
В работе [71] были синтезированы бис-(4-цианатометилфенил)терефталат 68 и бис-(4-цианатохлорфенил)терефталат 69. В связи с особенностями синтеза, полученные соединения представляли смесь изомеров, в которых радикал R у фенольного кольца мог находиться в различных положениях. Такие соединения демонстрировали интервал температуры плавления, который для мономера 68 составил 151–181°С. Полимеры на основе мономеров 68 и 69 имели температуру стеклования 177 и 191°С соответственно и температуру термостойкости порядка 440°С (в азоте). В полученных полимерах образовывалась мезофаза, где наблюдалось упорядоченное расположение мономерных звеньев, существующая до температуры 280°С. Для увеличения упорядоченности применялось воздействие магнитного поля во время отверждения.
Синтезированы мономеры с эфиркетоновыми группами [72] ‒ 4,4′-дицианатобензофенон 70, 4-(4-цианатобензоил)-4′-цианатодифениловый эфир 71, 4-(3-цианатобензоил)-4′-цианатодифениловый эфир 72, 4,4′-бис-(4-цианатобензоил)дифениловый эфир 73. Основной целью настоящей работы являлось получение сшитых полимеров – аналогов термопластичных полиэфиркетонов, в надежде получить их свойства, но при этом уменьшить температуру переработки. Подробные исследования свойств полученных полимеров в рамках работы не проводились, поэтому сложно сравнить новые материалы с термопластичными аналогами, хотя в работе наглядно иллюстрируется влияние длины мономера и положения цианатных групп в молекуле (пара-, мета-) на свойства мономера и конечного полимера:

где R1 = OCN R2 = H (71); R1 = H R2 = OCN (72)

Для исходных мономеров увеличение длины цепи приводит к значительному росту температуры плавления (182°С для мономера 73), затрудняя их переработку. Вместе с тем уменьшаются значения температуры стеклования полимеров (264, 238 и 205°С для мономеров 70, 71 и 73 соответственно), приближаясь к температуре стеклования термопластичных аналогов. Аналогичным образом влияет изменение положения цианатной группы с пара-положения (71) в мета-положение (72) (238 и 218°С соответственно). Температура стеклования может быть занижена из-за того, что конверсия цианатных групп прошла не полностью, а лишь на глубину порядка 80% [70, 72]. Все полученные полимеры демонстрировали высокие значения температуры начала разложения (385‒400°С).
Синтезированы серосодержащие мономеры с сульфидными [22, 65, 73], сульфоксидными [74] и сульфоновыми группами [22, 23, 75, 76]. Полимеры на их основе должны обладать бóльшей стойкостью к растворителям, удару и меньшей горючестью [76]. Бис-(4-цианатофенил)тиоэфир 74 входил в состав связующего AroCy‑T (“Ciba”), однако сведений о применении в настоящее время найти не удалось. Согласно работе [5], трудность использования данного мономера связана с его высокой реакционной способностью, что не подтверждается работой [65], где он демонстрировал кинетику отверждения аналогичную мономеру 63:
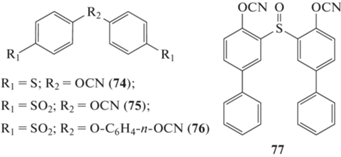
Бис-(4-цианатофенил)сульфон 75 был синтезирован, однако его переработка также оказывается затруднительной, так как температура начала отверждения меньше температуры плавления мономера [75]. Именно по этой причине в работе [76] он применяется только в смеси с мономером 1. Полученный полимер имеет температуру стеклования по одним данным 212°С [75], а по другим 360°С [19]. Причина такого расхождения не понятна.
В работах [75, 77] синтезировано более высокомолекулярное соединение 4,4-бис-(4-цианатофенокси)дифенил сульфон 76. Температура плавления мономера составила 70°С [77], а по другим данным 107°С [75]. Отвержденные полимеры на его основе демонстрировали температуру стеклования 240–254°С [75]. Данные по температуре стеклования в работе [77] стоит считать заниженными, потому что полимер не мог окончательно отвердиться в представленных условиях.
В работе [74] была синтезирована серия мономеров с сульфоксидными группами, наиболее ярким представителем которых является бис-(2-цианатодифенил)сульфоксид 77. Полученный полимер хоть и имел невысокую температуру стеклования 215°С, но показывал довольно высокий коксовый остаток при нагревании в азоте – 49% (800°С). Термостойкость полимера составила 406°С.
Данных о стойкости серосодержащих полициануратов к внешним агрессивным средам обнаружить не удалось.
Были синтезированы мономеры с атомами азота в главной цепи. С помощью таких мономеров, в первую очередь, пытаются понизить горючесть материалов. В работе [5] представлен бис-(4-цианатобензил)анилин 78, однако его свойства не раскрываются. В работе [19] сообщается о простейшем мономере с азо-группой ‒ 5-(4′-цианатобензеназо)-1-цианато-бензене 79. В дальнейшем синтезированы [78] мономеры аналогичного строения ‒ 5-(4′-цианато- бензеназо)-2,6-диметил-1-цианато-бензен 80, бис-(4′-цианато-4-азобензен)метан 81, бис-(4′-цианато-4-азобензен)сульфон 82. Полимеры на основе этих мономеров давали вполне обычную температуру стеклования в диапазоне от 245°С для мономера 80 до 276°С для мономера 81. При этом были получены аномально низкие значения энтальпии полимеризации – 30–50 кДж/моль OCN, что в 2 раза ниже обычного. Объяснения этому дано не было.
В работе [79] были синтезированы похожие соединения, но только с азометиновой группой, содержащие в цепи алкильные фрагменты различной длины ‒ 1,4-бис-[4(4-цианатофенилазометил)фенокси]бутан 83, 1,4-бис-[4(4-цианатофенилазометил)фенокси]пентан 84, 1,4-бис-[4(4-цианатофенилазометил)фенокси]гексан 85. Полимеры на основе этих мономеров демонстрировали очень низкие значения температуры стеклования, не превышающие 200°С.
Несколько более высокий коксовый остаток для рассмотренных азотсодержащих полимеров косвенно означает более низкую горючесть по сравнению с полимерами на основе мономеров 1 и 2, но подробных исследований горючести полимеров проведено не было.

где R= H (79); Me (80)
 ,
,
где R = CH2 (81); SO2 (82)
 ,
,
где R = O–C4H8–O (83); O–C5H10–O (84); O–C6H12–O (85)

Более привлекательными на этом фоне выглядят результаты, полученные для полимера на основе [3-[1-(3-цианатофенил)триазол-4-ил]фенил]цианата 86 [80]. При высоком коксовом остатке 67 мас.% (азот, Т = 800°С) полимер демонстрировал крайне низкую тепловыделяющую способность, полученную методом микромасштабной калориметрии сгорания ‒ 10 Дж/г К (332, 62, 24 для полимера на основе мономеров 1 [80], 8 и 9 [12] соответственно). Объяснений этой аномалии в рамках работы дано не было. Технологическим недостатком мономера 86 является сложность переработки, вызванная маленьким временем жизни связующего в расплавленном состоянии [80].
Интересным выглядит высказанное авторами работы мнение о возможности взаимодействия триазолового кольца мономера 86 с эпоксидными группами, что может быть полезно при модификации цианатных смол с эпоксидными связующими. К сожалению, для данного полимера не была определена температура стеклования и не приведено данных по водопоглощению, которое может оказаться достаточно высоким.
Большой практический интерес представляют фосфорсодержащие мономеры. Главным мотивом исследований в данной области выступает снижение горючести полимеров. В работе [75] синтезированы мономеры на основе фосфиноксидов с различной длиной цепи и расположением цианатных групп ‒ бис-(4-цианатофенил)фенилфосфиноксид 87, бис-(4-цианатофенокси-4'-фенил)фенилфосфиноксид 88, бис-(3-цианатофенокси-4'-фенил)фенилфосфиноксид 89.
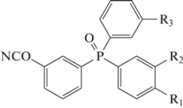 ,
,
где R1 = OCN, R2 = R3 = H (87); R1 = R3 = H, R2 = OCN (90); R1 = H, R2 = R3 = OCN (91)
 ,
,
где R1 = OCN, R2 = H (88); R1 = H, R2 = OCN (89).
Полимеры на основе этих мономеров показывали достаточно высокие значения температуры стеклования (например, 288°С для полимера на основе мономера 88). Низкая температура стеклования полимера на основе мономера 87 (195°С) объяснялась наличием примесей. К сожалению, данных о горючести полимеров приведено не было.
В работе [53] также синтезированы мономеры на основе фосфиноксидов, однако внимание было сконцентрировано на низкомолекулярных соединениях с изменением положения цианатных групп и их количества. Помимо мономера 87 был синтезирован бис-(3-цианатофенил)фенилфосфиноксид 90 и трис-(3-цианатофенил)фосфин-оксид 91.
Для полимера на основе мономера 87 в данной работе получена температура стеклования 250°С, что намного выше, чем в работе [75]. Полимер на основе мономера 90 демонстрировал похожее значение – 268°С. Более высокое значение авторы исследования связали с неполным отверждением мономера 87 в работе [75], что привело к заниженному результату. Температуру стеклования полимера на основе мономера 91 не удалось зафиксировать до температуры 350°С, возможно она находится выше. Все полимеры показывали высокие коксовые остатки.
Отличительной особенностью исследований является проведение испытаний на горючесть. Несмотря на то что методика эксперимента отличалась от стандартной UL‑94, полученные данные показывают, что введение 5‒10 мас. % мономеров 87, 90, 81 в мономер 1 или 2 может значительно увеличивать стойкость полимеров на основе таких смесей к горению.
Мономеры на основе фосфатов – бис-(4-цианатофенил)этил фосфат 92, бис-(3-цианатофенил)этил фосфат 93, трис-(4-цианатофенил) фосфат 94 – были исследованы в работе [81]. На фоне невысоких характеристик полимеров на основе мономеров 92 и 93, перспективным является мономер 94, чьи полимеры дают температуру стеклования выше 360°С, а коксовый остаток составляет 68% (азот, Т = 600°С). В рамках работы не были проведены изучения механических характеристик и стойкости к горению полимеров на основе мономера 94. К недостаткам данного мономера стоит отнести узкое температурное окно переработки – отверждение начинается почти сразу после достижения температуры плавления:
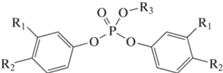 ,
,
где R1 = H, R2 = OCN, R3 = Et (92); R1 = OCN, R2 = H, R3 = Et (93); R1 = H, R2 = OCN, R3 = C6H4‒п-OCN (94).
Отдельно следует рассмотреть мономеры на основе циклофосфазенов. Изначально был синтезирован трис-фенокси-трис-4-[(4-цианатофенил)-изопропилиден]фенокси-циклотрифозфазен 95 [82]. Способ синтеза предусматривал получение мономеров с различным содержанием цианатных групп, но не был селективен относительно получаемых изомеров – структура 95 представляет собой идеализированный случай, в реальности расположение и вид заместителей у атома фосфора могли различаться. К тому же наличие свободных групп ОН у натриевой соли бисфенола-А, используемой в ходе синтеза, приводило к появлению нежелательных олигомерных продуктов высокой молекулярной массы и выделению свободного бисфенола-А в больших количествах, что значительно загрязняло конечный мономер [82]. Полимер на основе подобного мономера показывал температуру стеклования всего 160°С. При этом кислородный индекс, характеризующий горючесть, вырос незначительно (38 против 32 у полимера на основе мономера 1):
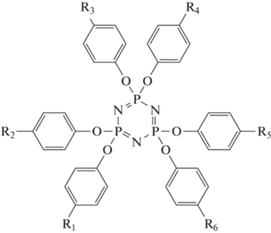 ,
,
где R1 = R4 = R6 = H, R2 = R3 = R5 = = ‒C(CH3)2‒C6H4‒п-OCN (95); R1 = R2 = R3 = H, R4 = R5 = R6 = ‒OCN (96); R1 = R2 = R3 = R4 = = R5 = R6 = ‒OCN (97).
В дальнейших исследованиях [83] был получен 1,1′,3–трис-(4-цианатофенокси)-3′,5,5-тетрафеноксициклотрифосфазен 96, но при синтезе использовались заместители, в которых вместо свободных групп ОН задействованы метокси-группы, в последствии восстанавливаемые до гидроксидных. Это позволило избежать побочных реакций, однако по-прежнему приводило к получению смеси изомеров. Выделение доминирующего изомера 96 проводили хроматографическим методом. Впрочем, все эти старания не привели к существенному изменению свойств ‒ температура стеклования полимера на основе мономера 96 составила те же 160°С, а температура начала разложения 366°С.
В работе [84] проведен похожий синтез и получен гексакис-(4-цианатофенокси)циклотрифосфазен 97. Температура начала разложения полимера согласно этим исследованиям составила 424°С, температура стеклования не определялась.
Низкие температуры стеклования возможно объяснить не полной конверсией цианатных групп при отверждении, что отмечалось в работе [83] (подробные исследования не проводились), а также подвижностью эфирных связей, в большом количестве присутствующих в молекулах мономеров. Видны сильные различия в ЯМР-спектрах, полученных в одинаковых условиях для очень похожих соединений в работах [83, 84], что не дает уверенно свидетельствовать о точной структуре полученных мономеров.
В целом, фосфорорганические мономеры считаются эффективными добавками для уменьшения горючести материалов на основе промышленно выпускаемых бисфенольных цианатов.
СУПРАМОЛЕКУЛЯРНЫЕ МОНОМЕРЫ
Совсем недавно, в связи с успехами в супрамолекулярной химии, начали появляться сообщения о синтезе новых и весьма перспективных связующих (в том числе цианатэфирных) на основе каликсаренов. В работе [85] описан синтез каликсаренов с различным количеством фенольных колец – 4, 6, 8 и получен 4-терт-бутилкаликс [4]арентетрацианат 98. Показано, что помимо целевого фенола, в продуктах реакции всегда содержится некоторое количество каликсаренов с другим числом фенольных колец, при этом каликс- [4]арен получен с наименьшим количеством побочных продуктов, поэтому и был выбран в качестве основы для получения цианатэфирных производных:
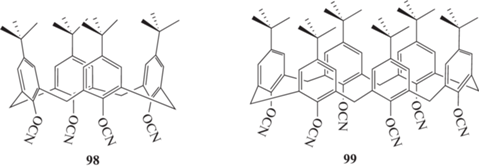
Температура плавления мономера 98 определена не была, однако при 300°С, когда начинали проходить реакции циклотримеризации, он все еще оставался в твердом состоянии, что несомненно затрудняет переработку. В связи с неплавкостью мономера, получение монолитных образцов проводилось из смеси мономеров 98 и 1 или полисилазаном. Температура стеклования образца на основе смеси 98 с полисилазаном составила 338°С. Температура термостабильности в инертной атмосфере определена как 410‒420°С. Коксовый остаток, определенный при 900°С в атмосфере азота для полимера на основе мономера 98 без добавок, составил 47 мас. %, в то время как введение 10 мас. % полисилазана увеличивало коксовый остаток до 71 мас. %.
Также были определены размеры нанопор в отвержденном полимере методом дифракции рентгеновских лучей. Получены четыре четких пика, соответствующие значениям 1.18, 1.05, 1.0 и 0.92 нм. Известно [86], что каликc[4]арены могут находится в четырех различных конформациях: конус, частичный конус, 1,2-альтернат и 1,3-альтернат. Для 4-трет-бутилкаликс [4]арена найдены энергетические барьеры перехода, полученные в различных условиях, которые составили 59‒67 кДж/моль, для мономера 98 они будут несколько выше. Это означает, что при температуре отверждения мономер 98 может находиться во всех четырех конформациях, которые после прохождения реакций тримеризации станут конфигурацией макромолекулы и образуют нанопоры указанных размеров.
В работе [87] был синтезирован 4-трет-бутилкаликс[6]арен гексацианат 99. Данное соединение растворимо в трихлорметане и тетрагидрофуране. Методом быстросканирующей калориметрии была определена температура плавления, которая составила 403°С, в то время как полимеризация проходила при температуре не выше 390°С. Таким образом, реакции сшивки проходят в твердой фазе, что подтверждается высокими значениями энергии активации полимеризации (380 кДж/моль), определенными в данной работе. Высказано мнение, что в процессе отверждения может проходить разрушение циклической структуры мономера, в результате чего он приобретает возможность переходить в жидкое состояние и полимеризоваться классическим способом. Это подтверждается снижением энергии активации реакции отверждения при высоких (более 80%) степенях конверсии. Температура термостойкости полученного полимера на основе мономера 99 составила 410°С, а коксовый остаток ‒ 45% при 600°С (атмосфера аргона).
Из полученных данных можно сделать вывод, что на данный момент подобные соединения не дают преимуществ по термостойкости материалов или по температуре теплостойкости перед классическими фенолтриазиновыми смолами (см. ниже). В то же время мономеры не могут быть переведены в текучее состояние, что является значительным препятствием для переработки. Однако они могут быть использованы в качестве добавки для классических цианатэфирных связующих. В связи с этим перспективным кажется синтез 4-трет-бутилтиокаликс[4]арен тетрацианата 100, в котором метиленовые мостики заменены на сульфидные:
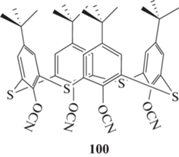
От полимеров на основе смеси классических мономеров со 100 можно ожидать пониженной горючести, повышенной стойкости к внешним агрессивным средам и т.д., что свойственно материалам на основе серосодержащих мономеров. Считается [88], что метиленовые мостики являются слабым звеном при термоокислительном разрушении фенольных смол. Замена их на сульфидные звенья поможет повысить термоокислительную стойкость полимеров. Эта гипотеза косвенно подтверждается данными по термоокислительной стойкости полимеров на основе мономеров 3 и 74, где полимер с сульфидными мостиками показывал заметно бóльшую стабильность [5].
Перспективным направлением может стать использование резорцинаренов в качестве исходного сырья для синтеза цианатов, а также каликсаренов без трет-бутильных группировок.
ОЛИГОМЕРНЫЕ СВЯЗУЮЩИЕ
До настоящего момента все рассматриваемые соединения имели относительно невысокие молекулярные массы и ограниченную длину молекулы. Значительный интерес представляют олигомерные цианаты. Функциональные группы в них могут находиться как на концах олигомерной молекулы, так и в качестве боковых заместителей.
Ярким представителем последних выступают фенол-триазиновые олигомеры (ФТ-смолы) – цианатэфирные производные фенолформальдегидных смол ‒ первые исследования и попытки внедрения которых относятся к самым ранним этапам развития цианатэфирных связующих [89, 90]. Обладая технологичностью эпоксидных связующих (возможность нахождения в жидком состоянии), теплостойкостью полиимидных связующих, низкой горючестью фенолформальдегидных смол, но при этом не выделяя летучих продуктов при отверждении ФТ-смолы считаются привлекательной основой для получения пластиков с превосходными свойствами. Общая схема новолачных ФТ-смол может быть представлена структурой 101. Здесь и далее представлена только общая для всех изомеров структура, так как ФТ-смолы и другие олигомеры представляют смеси изомеров. Они составляют основу таких промышленных связующих, как “Primaset PT-15”, “Primaset PT-30”, “Primaset PT-60” [5, 91]:
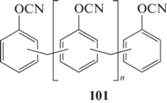
Молекулярная масса олигомеров колеблется от 320 до 2000 [5] (молекулярная масса элементарного звена 131). Агрегатное состояние при комнатной температуре с увеличением молекулярной массы изменяется от вязко-жидкого (320–420 г/моль, вязкость ~300 Па с [79]) до твердого (650–2000 г/моль). С увеличением температуры вязкость связующих уменьшается, позволяя перерабатывать их классическими методами. Так, при температуре 72°С вязкость низкомолекулярного олигомера уменьшается до 1 Па с. К сложностям переработки ФТ-смол можно отнести непостоянство кинетики отверждения, что связано с трудностью очистки связующих после синтеза – присутствующие примеси могут значительно влиять на скорость реакций отверждения [5].
Температура стеклования полимеров может быть более 400°С, что значительно выше аналогичных значений температуры для полимеров на основе фенолформальдегидных смол и цианатэфирных связующих на основе бисфенолов, при этом данный показатель значительно зависит от температуры отверждения [88]. Для достижения максимальной температуры стеклования необходимо проводить отверждение при температуре более 300°С, что вызвано низкой гибкостью цепей и сложностями прохождения реакций сшивки при низких значениях температуры [42]. Необходимость сильного нагревания для достижения высоких степеней конверсии затрудняет переработку. В работе [42] была определена температура стеклования для полностью отвержденного связующего “Primaset PT-30” методом ДМА как 390°С. В работе [92] значения температуры стеклования для полностью отвержденных “Primaset PT-30” и “Primaset PT-15” были определены значительно ниже – 275 и 330°С соответственно. Хотя из представленных результатов этой работы совершенно непонятно для образцов с какими степенями конверсии они были определены. Температура начала тепловой деформации (DTUL) в работе [33] была установлена как 442°С.
Температура термостойкости полимеров на основе этих смол составляет 400‒450°С [42, 88, 93], при этом коксовый остаток составляет 55‒75 мас. % (Т = 600°С, в азоте). Горючесть отвержденных новолачных ФТ-смол оказывается заметно ниже, чем для полицианатов на основе бисфенолов [12].
Важной, но малоизученной областью является длительная термоокислительная стойкость новолачных полициануратов. Как показывают исследования полимеров на основе “Primaset PT-30” в работе [94], постепенная деструкция в окислительной атмосфере может оказаться основным фактором долговечности изделий из этих связующих. Образец полимера термостатировался в атмосфере воздуха при 250°С (т.е. намного ниже температуры стеклования), проводилась фиксация уменьшения массы образца. Заметные изменения начинались при времени выдержки порядка 225 ч, после чего начиналось постепенное уменьшение массы. После выдержки в течение 3600 ч масса образца уменьшилась до 45% от первоначальной.
Влагопоглощение для образцов практически полностью отвержденного полимера на основе “Primaset PT-15” составляет не менее 3 мас. %, а в ряде исследований достигало отметки в 8% [42, 92, 94]. Эти значения значительно выше, чем для полимеров на основе бисфенолов. Влагопоглощение приводит к падению температуры стеклования полицианатов до 245°С (“Primaset PT-30”) [42] и 260°С (“Primaset PT-15”) [92].
Диэлектрическая проницаемость отвержденных новолачных ФТ-смол оказывается несколько выше, чем для других полициануратов – 3.08 (1 МГц) [6, 88, 91], 2.97 (1 ГГц) [5, 8] (значения при комнатной температуре).
Полимеры на основе этих связующих демонстрируют более высокую хрупкость – скорость высвобождения энергии деформации GIC для полимеров на основе связующих “Primaset” составляет 60 Дж/м2 (140 Дж/м2 полимера на основе мономера 1) [6, 91].
Имеющиеся недостатки новолачных ФТ-смол стимулируют поиск новых связующих. Предлагаются родственные олигомеры на основе мета-крезола 102 [95], резорцинола 103 [96], диметилбензола 104 [97]:

где R = Me (102); OCN (103)

Сведения о свойствах полимеров на основе мономеров 102 и 103 в литературе не приводятся, хотя следует ожидать, что мономер 103, обладая бóльшей функциональностью, будет давать полимеры с бóльшей плотностью сшивки, но при этом обеспечить полную конверсию цианатных групп будет сложно. Для полимера на основе мономера 104 была установлена температура стеклования 158°С, хотя значительное падение модуля упругости наблюдалось уже при 80°С. Степень конверсии для испытываемого образца не определялась, но можно заключить, что отверждение прошло недостаточно полно, так как проводилось при температуре не превышающей 220°С (пусть даже и с использованием катализатора). Температура начала разложения полимера составила 397°С. Влагопоглощение полициануратов составило 0.43%, что выглядит сильно занижено. Значение диэлектрической проницаемости было определено на уровне 2.85 (1 МГц) [97]. Молекулярно-массовое распределение мономера 104 не изучалось.
Развитие ФТ-смол, так или иначе, проходило с оглядкой на развитие своих прекурсоров ‒ фенолформальдегидных связующих. Успехи в синтезе фенолдициклопентадиеновых смол (без использования формальдегида) [98] привели к появлению весьма успешных цианатэфирных производных на их основе (входят в состав связующих “Primaset DT 4000”, “Primaset DT 7000”):
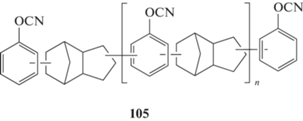
Полимеры на основе мономера 105 имеют температуру стеклования от 223 до 265°С [5, 6, 91], что ниже температуры стеклования полимеров новолачных ФТ-смол. В то же время они показывают меньшее влагопоглощение 1.4‒2.0% [91, 92, 66 ], диэлектрическую проницаемость 2.8 [8, 91, 66 ] и большую скорость высвобождения энергии деформации 125 Дж/м2 [91] по сравнению с традиционными новолачными ФТ-смолами.
Относительно структуры этого соединения наблюдается путаница в литературе. В части работ указывается, что это мономерное соединение [6, 66], в ряде работ, что это олигомерное связующее [5, 91, 92]. Путаница, видимо, связана с недостатком информации о молекулярно-массовом распределении олигомеров. В работе [92] показано, что количество звеньев n колеблется от 0 до 2. При n = 0 мы действительно получаем мономер. Однако информация о доле такого соединения в олигомерной смеси не обнаружена, возможно, она высока. Это дало повод авторам работы [6] рассматривать мономер 105 как мономерное соединение, что не совсем правомерно.
Для уменьшения хрупкости ФT-смол в работе [99] было предложено модифицировать исходные фенолформальдегидные смолы карданолом, который, впрочем, уже давно применяется для их модификации [100]. Получаемый из природного сырья карданол представляет собой смесь похожих соединений, различающихся количеством и расположением двойных связей в алкильном радикале [98]. Преобладающими компонентами являются изомеры с тремя двойными связями. В работе [99] были синтезированы резольные и новолачные фенолформальдегидные смолы с различным содержанием карданола в качестве исходного сырья ФТ-смол. Были определены среднемассовые молекулярные массы олигомеров этих смол. Для новолачных смол (кислотный катализ) они определены в диапазоне 3760‒4220 г/моль, для различного содержания карданола (структура 106, 107, 108) молекулярная масса карданольного звена 337 г/моль). Резольные смолы (щелочной катализ) показали более высокие значения – 11000‒12700 г/моль.
Термическая стабильность полимеров (определенная в атмосфере азота), полученных из этих связующих, уменьшалась с увеличением содержания карданольных звеньев с 430°С для полимера без карданола, до ~300°С при 100% содержании карданольных звеньев. При этом коксовый остаток уменьшался с 70 мас.% до практически полного нуля. Отмечены сложности с хранением связующих – некоторые образцы отверждались сразу же после получения. К сожалению, в работе не было определено влияние такой модификации на хрупкость получаемых полимеров, поэтому оценить ее качество не представляется возможным:

В литературе не удалось обнаружить сообщений о синтезе и свойствах фторсодержащих олигомеров ФТ-смол, несмотря на перспективность подобного рода соединений. Однако были синтезированы подобные олигомеры для фталонитрильных связующих [101]. При синтезе исходной новолачной смолы был использован 3‑фторфенол вместо обычного фенола. Полимер на основе нового фталонитрильного олигомера показал более низкую диэлектрическую проницаемость по сравнению с полимером на основе традиционного новолака. При этом термостабильность и теплостойкость практически не изменились. К сожалению, не были проведены измерения влагопоглощения полученных образцов. Структура мономера 109 показывает строение аналогичного цианатэфирного олигомера на основе новолачной смолы 3-фторфенола. Синтез подобных олигомеров оказывается еще более простым, чем в работе [101]. Перспективным кажется размещение нескольких атомов фтора на фенольном кольце, а также получение соолигомеров с традиционными фенолами.
Патент [102] описывает получение сополимеров 110 на основе диметилсилоксана, метилбицикло[2.2.1]гептилсилоксана и метил-2-цианатофенилэтилсилоксана, где норборненовый боковой заместитель сходен по строению с дициклопентадиеновыми фрагментами мономера 105. Исходный олигомер представляет собой соолигомер диметилсилоксана и метилгидридсилоксана со среднемассовой молекулярной массой 2000‒ 2500 г/моль. Гидридные группы выполняют роль реакционных центров для присоединения боковых заместителей с цианатной группой. Коэффициенты n, m, k могут меняться в зависимости от соотношения исходных компонент для синтеза в реакционной смеси:

Данных о свойствах полимеров на основе мономера 110 приведено не было, так как его планировалось использовать совместно с олигомером 105. Полимеры на основе смеси этих соединений были получены и показывали неплохую температуру стеклования в диапазоне 240–265°С. Было отмечено наличие двухфазной структуры в конечном полимере, вызванной выделением силоксановых олигомеров в отдельную фазу, что вполне ожидаемо.
Олигомерные цианаты с функциональными группами на концах олигомерной цепочки также являются предметом исследований. Самым простым классом соединений выступают цианатэфирные олигомеры на основе ариленоксидов. Соединения такой структуры известны уже давно [5, 19]. Модифицированная реакция Ульмана, по которой происходит синтез олигомеров, дает возможности для получения разнообразных по строению соединений. Не так давно подобные соединения были вновь синтезированы и исследованы. В работе [103] синтезировалось олигомерное связующее 111 на основе бисфенола-А. Преобладающим олигомером, в конечном продукте, было соединение с n = 1. Более точного исследования молекулярно-массового распределения не проводилось. Теми же исследователями и по той же методике был синтезирован олигомер 112 на основе бисфенола-АF [104]. Исследование молекулярно-массового распределения также не проводилось. Оба полученных соединения были жидкими при комнатной температуре:
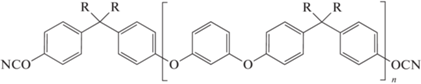 ,
,
где R = Me (111); CF3 (112).
Температура стеклования полимеров на основе соединений 111 и 112 была установлена как 140 и 175°С соответственно, что значительно ниже, чем у полимеров на основе мономера 1. Исследование термической стабильности полимеров показало, что они начинают разрушаться при 425 и 430°С и имеют коксовые остатки 33 и 50% соответственно (Т = 700°С, атмосфера азота). Для полимера на основе мономера 111 также было определено водопоглощение, которое составило 2.2 мас. %.
В надежде повысить температуру стеклования были синтезированы олигомеры на основе резорцинола, строения 113, 114, 115, 116 [105]. Эти олигомеры отличались по длине цепочки и по месту присоединения эфирной связи. Подробного исследования распределения молекулярной массы полученных соединений проведено не было, но указывалось, что преобладающими олигомерами были соединения с n = 1 и 3, в зависимости от условий синтеза. Полученные соединения были жидкими при комнатной температуре:
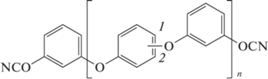 ,
,
где n = 1, позиция 1 (113); n = 1, позиция 2 (114); n = 3, позиция 1 (115); n = 3, позиция 2 (116).
На основе этих олигомеров получены полимеры, которые показывали значения температуры стеклования 118, 122, 74 и 78°С для мономеров 113, 114, 115 и 116 соответственно, что даже ниже, чем для полимеров на основе мономера 111. Это лишний раз показывает, что причиной низких значений температуры стеклования является именно подвижность эфирных мостиков. Также ясно, что увеличение длины олигомера приводит к уменьшению температуры стеклования, что связанно с уменьшением плотности сшивки.
Именно по этой причине в работе [106] синтезированы олигомеры на основе бисфенола-А и бисфенола-AF как с концевыми, так и боковыми функциональными группами строения 117 и 118 соответственно. Соединения были получены в виде смеси олигомеров с n = 1–5, но определение доли каждой фракции не проводилось. Олигомеры также имели жидкое агрегатное состояние при комнатной температуре:
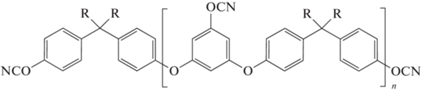 ,
,
где R = Me (117); CF3 (118).
Наличие боковых функциональных группировок повышает плотность сшивки и тем самым увеличивает температуру стеклования полимеров на основе этих соединений. Действительно, температура стеклования полимеров на основе соединений 117 и 118 определена как 287 и 286°С соответственно, что сопоставимо с полимерами на основе мономера 1. Температура термостойкости полицианатов была установлена как 380 и 410°С, а коксовые остатки 44 и 52 мас.% (Т = 900°С, атмосфера азота). Также установлена диэлектрическая проницаемость при комнатной температуре, которая составила 3.75 и 3.41 для соединений 117 и 118.
К сожалению, для всех полученных полимеров не была определена ударная стойкость, хотя именно для еe увеличения были изначально синтезированы данные соединения.
Хотелось бы отметить противоречие между данными работ [5, 19] и [103‒106]. В работах [5, 19] представлены мономеры похожие по строению на соединения 113‒116. Указывалось, что они имели температуру плавления не ниже 100°С, в то время как в соответствии с работами [103‒106] они жидкие даже при комнатной температуре.
Были получены олигомеры 119, 120, 121, 122 различной длины с концевыми цианатэфирными группами на основе арилатов [107]. В основе способа их получения лежит реакция между дихлорангидридами карбоновых кислот (изо-, терефталевой кислот) с дифенолами (бисфенол-А, фенолфталеин). Гибкие условия синтеза дают возможность для получения цепочек различной длины. Соединения 119, 120, 121 представляют собой смеси изомеров, так как при их синтезе использовалась смесь изо- и терефталевой кислот, в то время как при синтезе мономера 122 только терефталевая кислота. Температура размягчения полученных олигомеров составляла 130, 150, 160 и 250°С соответственно. Данных о вязкости не приводится.
Была определена температура стеклования для соответствующих полимеров, составляющая 220, 210, 190 и 290°С для соединений 119, 120, 121 и 122 соответственно. Температура термостабильности для полимеров на основе соединений 119 и 120 составила 350°С:
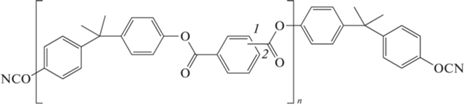 ,
,
где n = 1 (119); 3 (120); 5 (121)
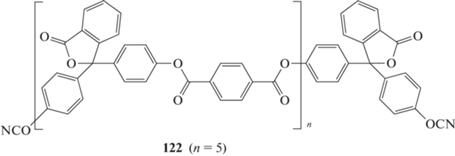
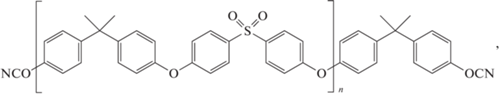
В работе [107] синтезированы олигомеры 123, 124, 125 на основе дифенилсульфона. Способ получения был аналогичен, только вместо хлорангидридов кислот использовались бис-(4-хлорфенил)сульфон. Температура размягчения для полученных соединений составила 105, 148 и 150°С соответственно.
где n = 1 (123); 3 (124); 5 (125).
Полимеры, полученные на основе соединений 123, 124, 125, демонстрировали температуру стеклования 240, 220, 190°С, показывая уже привычную картину уменьшения при увеличении длины олигомерной цепочки. Температура термостойкости составила 370 и 390°С для мономеров 123 и 125. Аналогичные соединения получены в работе [108], в которой исследовались кинетические особенности реакции отверждения данных олигомеров.
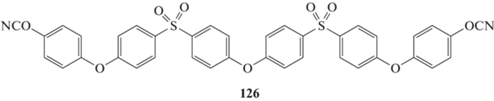
В патенте [77] сообщалось о синтезе олигомера 126 с температурой плавления 120°С. Данных о свойствах полимера не сообщалось, однако ожидать высоких значений температуры стеклования не стоит:
В литературе не удалось обнаружить данные о синтезе олигомеров строения 127, которые можно рассматривать как аналог соединения 122. Соединение 127 может быть полезно как добавка для уменьшения хрупкости полимеров на основе классических цианатэфирных связующих. Полисульфоны аналогичного строения, но без концевых цианатных групп, уже применяются в модификации цианатных смол и рассмотрены в работах [109–111]. Модификация 1 такими полисульфонами приводит к значительному увеличению ударной вязкости по Шарпи получаемых полимеров (с 17 до 55 кДж/м2 [109]), несколько уменьшая температуру стеклования (c 250 до 237°С [111]):

В работе [112] синтезированы фениленовые олигомеры 128, 129, а также фенилхинолиновые олигомеры 130, 131 c концевыми цианатэфирными группами. Условия синтеза 128 и 129 подразумевают отсутствие селективности в месте присоединения фенильных мостиков в главной цепи олигомера, поэтому они представляли собой смесь изомеров. Среднечисловые молекулярные массы для соединений 130, 131 были оценены как 2900, 6800 г/моль соответственно. Полученные олигомеры показывали высокие значения температуры размягчения (плавления) – 136, 272, 183 и 240°С для соединений 128, 129, 130 и 131. Полицианураты на их основе продемонстрировали температуру стеклования 216, 305, 260 и 265°С соответственно. Эти значения ниже значений температуры стеклования соответствующих полифениленов и полифенилхинолинов, которые составляют 327 и 266°С. Температура термостабильности полимеров составила порядка 400°С:
 ,
,
где n = 0 (128); 4 (129)
 ,
,
где n = 4 (130); 10 (131).
Синтезированы кремнийорганические олигомеры цианатными группами. Использование силоксановых цепочек привлекает исследователей, которые хотят уменьшить хрупкость, влагопоглощение, диэлектрическую проницаемость и горючесть сшитых материалов, а также повысить химическую стойкость.
В работах [113, 114] описан способ получения цианатов строения 132‒136 с диметилсилоксановыми и метилфенилсилоксановыми фрагментами. Для полимеров на основе этих соединений при увеличении длины силоксановой цепочки снижается температура стеклования – для полимера на основе соединения 132 она составляет 180°С, для 133 уже ‒75°С, а для 134 достигает ‒100°С [19]. Аналогичная картина наблюдается и для полимеров на основе соединений 135, 136, составляя ‒10 и ‒25°С соответственно [19]. Таким образом, на основе этих соединений возможно получение высокоэластичных материалов в широком диапазоне температуры. Температура термостойкости для этих полимеров была определена в границах 250–360°С, повышаясь с увеличением длины силоксановой цепочки:
 ,
,
где R = Me, m = 0 (132); R = Me, m = 10 (133); R = Me, m = 70 (134); R = Ph, m = 3 (135); R = Ph, m = 10 (136)
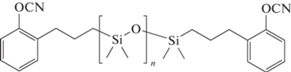 ,
,
где n = 1 (137); 2 (138); 3 (139).
В работе [115] были синтезированы похожие соединения 1,3-бис-(3′-(2-цианатофенил)пропил)-1,1,3,3-тетраметилдисилоксан 137, 1,5-бис-(3′-(2-цианатофенил)пропил)-1,1,3,3,5,5-гексаметилдисилоксан 138, 1,7-бис-(3′-(2-цианатофенил)пропил)-1,1,3,3,5,5,7,7-октаметилдисилоксан 139, однако они имели невысокие молекулярные массы. Температура плавления указанных соединений 5, 9, ‒12°С соответственно. Полимеры на основе этих олигомеров также показывают невысокие значения температуры стеклования – 15, ‒8, ‒43°С соответственно, что схоже с полимерами на основе соединений 132‒136. При этом значения температуры термостабильности определены как 445, 438 и 410°С. Хотя сравнивать их с данными по предыдущим полимерам не корректно, так как методики определения различались. Кокосовый остаток полициануратов был невысокий и уменьшался с увеличением длины силоксанового фрагмента от 23 до 9% для соединений 137 и 139 соответственно. Также были исследованы диэлектрические свойства полимеров для различных частот электромагнитных волн. Для полимера на основе мономера 139 диэлектрическая постоянная составила 28.5 (1 ГГц) и 2.47 (15 ГГц). Измерения на различных частотах проводились разными методиками, поэтому их сравнение затруднено.
Аналогично мономерам 54, 55 был синтезирован их олигомерный аналог 140 (n = 7), содержащий карборановые фрагменты [19]. Полученный полимер имел температуру стеклования 10°С и температуру термостабильности 345°С, представляя собой эластомер в данном интервале температуры. Более подробных сведений не приводилось:

Для всех рассмотренных олигомерных цианатов с концевыми функциональными группами можно отметить основную сложность в применении – полимеры, полученные на их основе, не показывают высоких значений температуры стеклования – редко выше 250°С, а часто ниже 200°С. К тому же процессы их получения, как правило, трудоемки и связаны с высокими значениями температуры и агрессивными средами, что рождает проблемы экономического характера. Однако такие соединения могут быть использованы в смеси с другими олигомерами, в частности наиболее перспективным кажется их применение для увеличения ударной стойкости классических полицианатов.
ПОЛИМЕРНЫЕ СВЯЗУЮЩИЕ
Первые сообщения о синтезе полимерных цианатов с боковыми функциональными группами появились достаточно давно [116]. Их можно получить радикальной полимеризацией из низкомолекулярных цианатов, содержащих винильные группы. Также возможна их сополимеризация с другими непредельными соединениям традиционными способами.
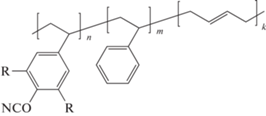
В частности, в работах [88, 117] сообщалось о синтезе полимерных цианатов на основе стирола, а также различных статистических сополимеров ‒ поли(4-цианатофенилэтилена) 141, сополимеров 4-цианатофенилэтилена и стирола 142, 3,5-диметил-4-цианатофенилэтилена и стирола 143, 4-цианатофенилэтилена и бутадиена 144:
 ,
,
где R = H, m = 0, k = 0 (141); R = H, m ≠ 0, k = 0 (142); R = Me, m ≠ 0, k = 0 (143) R = H, m = 0, k ≠ 0 (144).
Соединения 142 и 143, полученные в работе [117], имели среднемассовые молекулярные массы (35.2 и 29.1) × 103 г/моль соответственно. Их предлагалось применять в качестве фоточувствительных полимеров (негативных фоторезистов), что возможно за счет сшивания полимеров при облучении их ультрафиолетом, которое было продемонстрированно как возрастание доли нерастворимой фракции в образце при увеличении дозы излучения. Отмечено, что соединение 142 в бóльшей степени чувствительно к облучению, чем 143. Также показано, что под действием УФ-излучения происходит реакция изомеризации цианатных групп в изоцианатные группировки, что дает возможность селективной модификации облученных областей.
В работе [118] предложен несколько иной способ синтеза цианатных полимеров. Предлагается сначала радикальной полимеризацией получать макромолекулы с гидроксильными боковыми группами, которые в последствии переводятся в цианатные. В настоящей работе были синтезированы статистические сополимеры различных мономеров – стирола, метилметакрилата, бутилакрилата с 4‑гидроксифенилмалеимидом (ГФМ), гидроксильные группы которого в последующем переводились в цианатные с получением полимеров 145, 146, 147 соответственно. Среднемассовые молекулярные массы полученных полимеров составляли (118.0 и 45.1) × 103 (для соединений 146 и 147). Содержание ГФМ в полимерах изменялось от 15 до 45 мол.% Здесь приводятся данные по самым термостойким полимерам:
 ,
,
где R1 = Ph, R2 = H, 45 мол.% ГФМ (145); R1 = = COOCH3, R2 = Me, 28.7 мол.% ГФМ (146); R1 = = COOC4H9, R2 = H, 40 мол.% ГФМ (147).
Проведены исследования на термостойкость уже отвержденных полимеров. Температура начала разложения составила 365 (145), 310 (146) и 275°С (147). Для гомополимеров стирола, метилметакрилата и бутилакрилата получены значения 300, 340, 295°С. Для всех полимеров наблюдался значительный коксовый остаток – 55, 37 и 35% соответственно (азот, Т = 700°С), в то время как для гомополимеров (без ГФМ) он равнялся нулю.
Значения температуры стеклования полученных полимеров определены не были, что не дает возможности судить об их теплостойкости. Представлены лишь значения температуры стеклования исходных стирольных сополимеров с малеимидных фрагментами с группами ОН методом ДСК. Они оказались очень высокими – порядка 230°С при содержании малеимидных звеньев 20 моль. %, что кажется завышенным значением, ведь для стирольных сополимеров вообще не свойственны такие высокие показатели [119]. Для атактического полистирола, получаемого радикальной полимеризацией, температура стеклования составляет около 100°С. Это ставит под сомнение полученные результаты.
В качестве конструкционных материалов полимерные цианаты широкого распространения не получили, по всей видимости из-за того, что сшитые полимеры на их основе не имеют высокотемпературных свойств и могут быть заменены более распространeнными аналогами. Такие полимерные соединения, возможно, были бы полезны для модификации классических полициануратов или получения слабосшитых полимерных систем подобно силанольносшиваемому полиэтилену, однако сведений о подобном использовании найти не удалось.
Высокую температуру стеклования показал полифенилхиноксалин 148 с цианатными группами [120]. Температура стеклования отвержденного полимера определена не была, но составляла не менее 400°С, что намного больше других рассмотренных здесь полимерных цианатов. Только сложность переработки и дороговизна таких полимеров затрудняет их практическое использование:

ГИБРИДНЫЕ МОНОМЕРЫ
Особую группу мономеров представляют соединения, совмещающие различные функциональные группы в молекуле. Одним из направлений исследований является получение мономеров, которые используются в смесях цианатэфирных связующих с другими высокотемпературными связующими, в частности в смесях с бисмалеимидными мономерами (БT‑смолы). Совмещение этих разнородных соединений представляет собой попытку, с одной стороны, улучшить перерабатываемость бисмалеимидных материалов и избавиться от хрупкости, а с другой ‒ повысить теплостойкость цианатэфирных связующих.
Отверждение цианатэфирных смол проходит в результате взаимодействия цианатных групп, в то время как бисмалеимиды отверждаются в результате прохождения реакций Дильса‒Адера с участием двойных связей. В связи с этим было предложено использовать гибридные соединения, обладающие способностью взаимодействовать с обоими видами мономеров для получения более однородной структуры отвержденного материала, которая будет представлять связанную взаимопроникающую сетку полимеров.
В работе [121] был синтезирован 2,2-бис-(3-аллил-4-цианатофенил) пропан 149. Взаимодействие этого мономера с бисмалеимидными фрагментами осуществляется за счет наличия аллильной группы с двойной связью, в то время как наличие двух цианатных групп позволяет реагировать с другими цианатными мономерами:
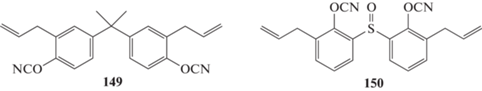
В работе [122] исследованы термодинамика отверждения соединения 149, а также свойства полимеров на основе чистого мономера и смеси с бисмалеимидами. Температура стеклования при первом испытании составила 161°С, при повторном исследовании того же образца она была определена как 360°С. Такое поведение свидетельствует о неполном отверждении полимера при подготовке образца к первому испытанию и, по всей видимости, за температуру стеклования стоит принять именно второе значение. Такое высокое значение, по сравнению с полимерами на основе мономера 1, есть результат прохождения реакций сшивания не только по цианатным группам, но и по двойной связи. Температура термостабильности гомополимера 149 была определена как 375°С.
Похожий мономер бис-(3-аллил-2-цианатофенил)сульфоксид 150 был синтезирован в работах [74, 123]. Гомополимер на основе соединения 150 имел температуру термостабильности 385°С и коксовый остаток 54% (Т = 800°С, азот). Температура стеклования не определена. Были проведены термодинамические исследования смесей 150 с бисмалеимидом, на основании которых высказано предположение о том, что наиболее оптимальным соотношением компонентов в смеси для увеличения ударной вязкости полимера будет 3 : 1 соответственно. Однако экспериментальной проверки этого предположения проведено не было.
Синтезированы [124] олигомеры бис-{[4-(3-аллил-4-цианатофенокси)]фенил} сульфон 151 и бис-{[4-[(3-аллил-4-цианатофенил)изопропилиден]фенокси]фенил} сульфон 152. Температура плавления 63 и 70°С. Получены гомополимеры на основе этих мономеров, хотя данных по температуре стеклования не приводится. Для полимера на основе соединения 152 указывается температура термостабильности 300°С:
 ,
,
где R = O (151); O‒C6H4‒C(CH3)2 (152).
В работе [125] было исследовано влияние соединений 151, 152 на свойства полицианата, полученного из смеси этих соединений с мономером 1 и бисмалеимидным связующим. Результаты, полученные для чистых (неармированных) полимеров, весьма противоречивы. С одной стороны, полимеры на основе тройной смеси мономеров показывали температуру стеклования ниже чем для полимера на основе мономера 1. Так, для смеси 1 (70%) : бисмалеимид (20%) : соединение 151 (10%) получена температура стеклования 254°С (максимальное значение для всех исследованных смесей), в то время как для полимера на основе мономера 1 она составила 260°С, а для бисмалеимидного полимера ‒ 430°С. Но в то же время полимер на основе двойной смеси 1 (65%) : бисмалеимид (35%) демонстрировал еще более низкую температуру стеклования 225°С. С другой стороны, наблюдалось неаддитивное увеличение скорости высвобождения энергии деформации GIC. Так, для полимера на основе смеси 1 (70%) : бисмалеимид (20%) : соединение 152 (10%) она составила 126 Дж/м2, в то время как для полимера на основе мономера 1 ‒ 112 Дж/м2, а для бисмалеимидного полимера только 11 Дж/м2. Полимер на основе двойной смеси 1 (65%) : бисмалеимид (35%) демонстрировал GIC = 105 Дж/м2. Влияния соединений 151 и 152 на модуль упругости полученных материалов не наблюдалось.
Несмотря на общее положительное влияние этих мономеров, эффективность их применения кажется недостаточной. Внедрение объемных группировок и получение соединений аналогичных 127, вероятно, сможет повысить температуру стеклования при сохранении положительного влияния на хрупкость полимеров.
В работе [126] синтезированы гибридные олигомеры ФТ-смол строения 153, 154 на основе новолачной смолы, содержащей как цианатэфирные группировки, так и малеимидные, и отличающиеся содержанием малеимидных фрагментов (20 и 27 мас. % в пересчете на исходный 4-гидроксифенилмалеимид, используемый при синтезе) и имеющие среднемассовые молекулярные массы 5540 и 5610 г/моль соответственно (молекулярная масса звена с малеимидным фрагментом 226 г/моль). Введением малеимидных и цианатэфирных групп пытались повысить термостойкость исходной фенолформальдегидной смолы, а также увеличить коксовые остатки при разложении:
 ,
,
где ω (4-гидроксифенилмалеимид) = 20% (153); 27% (154)
 ,
,
где nOCN = 0.13 (155); 0.43 (156); 0.69 (157) (мол. доли).
При отверждении соединений 153 и 154 на термограмме фиксировалось два четких пика, ответственных за реакции сшивки по цианатным и малеимидным группировкам. Полученные полимеры показывали температуру начала разложения 400 и 410°С соответственно. При этом полимеры на основе классической новолачной ФТ-смолы соединения 101, также полученные в данной работе, показали термостойкость 440°С. Были определены коксовые остатки при 700°С в азоте, составившие 63 и 66% для соединений 153 и 154 (74% для полимеров на основе мономера 101). Такие результаты пока не дают повода свидетельствовать о преимуществе полученных смол перед классическими ФT‑смолами и требуют более подробного их изучения.
Были синтезированы [127] олигомеры 155, 156 и 157 содержащие фталонитрильные и цианатэфирные функциональные группы. Среднечисловая молекулярная масса полученных олигомеров составила 2000–2600 г/моль. При отверждении они демонстрировали прохождение двух независимых реакций, соответствующих двум различным функциональным группам. Температура стеклования полимеров на их основе определена не была. Температура термостабильности полимеров на основе соединений 155, 156 и 157 составила 352, 347 и 343°С соответственно. Коксовый остаток превысил 70% (Т = 900°С, азот) для всех полимеров. Было определено влагопоглощение полимеров, которое увеличивалось с 0.65 до 0.90% с увеличением содержания цианатэфирных групп (выдержка 24 ч при 23°С, что явно занижает результаты).
МОНОФУНКЦИОНАЛЬНЫЕ МОНОМЕРЫ
Помимо мономеров, содержащих несколько функциональных групп, рассматриваемых до сих пор, были получены монофункциональные мономеры [128‒131], которые сами по себе не могут давать полимерных продуктов, но могут использоваться для модификации цианатэфирных связующих. Данные по этим соединениям приведены в табл. 1. Важно, что результатом применения подобных соединений является уменьшение плотности сшивки отвержденных полициануратов, в состав которых они входят (кроме мономеров для модификации смеси с бисмалеимидами).
Таблица 1.
Монофункциональные цианатэфирные мономеры
| Химическая структура | Литература | Тпл, °С | Варианты использования |
|---|---|---|---|
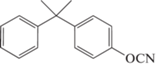 |
[5], [128] | <20 | Увеличение ударной вязкости |
 |
[5] | <20 | |
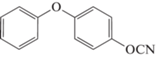 |
[72] | 31 | |
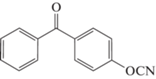 |
[72] | 96 | |
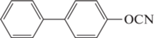 |
[5] | 62 | Уменьшение горючести |
 |
[5] | 127 | |
 |
[129] | н.д. | |
 |
[130] | н.д. | |
 |
[69], [70] | 72 | Модификация образования мезофазы |
 |
[69], [70] | 75 | |
 |
[121], [122] | <20 | Модификация совместимости с бисмалеимидами |
 |
[118] | 132 | |
 |
[5] | <20 | |
 |
[131] | 52 | |
 |
[131] | 56 |
ЗАКЛЮЧЕНИЕ
В работе рассмотрен широкий спектр цианатэфирных соединений, даны свойства исходных цианатов и полицианатов на их основе. По сравнению с уже ставшими классическими обзорами по этой тематике представленная информация по исходным мономерам (олигомерам) более структурирована, приведены ссылки на общедоступные источники. Изложены современные сведения по фосфорсодержащим, азотсодержащим мономерам, перспективным цианатам с фрагментами адамантана, термостойким мономерам с бифенильными фрагментами и другим соединениям. Показаны супрамолекулярные мономеры на основе каликсаренов. Рассмотрены свойства мономеров, получаемых из возобновляемого сырья и полимеров на их основе. Высказаны предложения по синтезу новых мономеров.
В дополнительных материалах к статье представлена сводная информация по свойствам рассмотренных в работе соединений и полимерам на их основе, включая данные работ [132, 133].
Список литературы
Прохорова Е.В., Мухаметов Р.Р. // Труды ВИАМ. 2013. № 9. С. 06.
Аристов В.Ф., Халиманович В.И., Миронович В.В., Ислентьева Т.А., Гуров Д.А. // Вестн. Сибирского гос. аэрокосмического ун-та им. академика М.Ф. Решетнева. 2013. № 2. С. 159.
Гусева М.А. // Авиац. матер. технол. 2015. № 2. С. 45.
Долгова Е.В., Лаврова К.С. // Труды ВИАМ. 2021. № 9. С. 4.
Chemistry and Technology of Cyanate Ester Resins. / Ed. by L. Hamerton. Springer-Science+Business Media, 1994.
Kessler M.R. // Wiley Encyclopedia of Composites. Second Edition / Eds. by L. Nicolais, A. Borzacchiello, S.M. Lee. New York: Wiley-Blackwell, John Wiley & Sons, 2012.
Pham H.Q., Marks M.J. // Encyclopedia of Polymer Science and Technology. New York: Wiley, 2002.
Snow L.J., Buckley A.W. // Handbook of Low and High Dielectric Constant Materials and Their Applications / Ed. by H.S. Nalwa. New York: Acad. Press, 1999. P. 189. Ch. 4.
Goertzen W.K., Kessler M.R. // Composites. A. 2007. V. 38. № 3. P. 779.
Zhan X., Wang L., Zhang J., Chen J. // Materials Design. 2015. V. 88. P. 1100.
Hamerton I., Howlin B.J., Mooring L., Stone C., Swan M., Thompson S. // Polym. Degrad. Stab. 2014. V. 110. P. 435.
Lyon R.E., Walters R.N., Gandhi S. // Fire Materials. 2006. V. 30. № 2. P. 89.
Lin C.H., Hsiao C.N., Li C.H., Wang C.S. // J. Polym. Sci., Polym. Chem. 2004. V. 42. № 21. P. 3986.
Hwang H.J., Shieh J.Y., Li C.H., Wang C.S. // J. Appl. Polym. Sci. 2007. V. 103. № 3. P. 1942.
Ariraman M., Sasikumar R., Alagar M. // J. Appl. Polym. Sci. 2014. V. 131. № 24. P. 41097.
Delano C.B., McLeo A.H., Kiskiras C.J. Synthesis of Improved Phenolic and Polyester Resins / NASA Report CR-165180. 1980.
Galukhin A., Nosov R., Taimova G., Islamov D., Vyazovkin S. // Macromol. Chem. Phys. 2021. V. 222. № 5. P. 20200410.
Handbook of Adhesive / Ed. by I. Skeist. New York: Springer, 1990.
Pankratov V.A., Vinogradova S.V., Korshak V.V. // Russ. Chem. Rev. 1977. V. 46. № 3. P. 278.
Durairaj R.B. // Resorcinol. Chemistry, Technology and Applications. Berlin; Heidelberg: Springer-Verlag, 2005.
Wright M.E. Pat. 9126902 USA. 2015.
Grigat E., Puter R. // Angew. Chem. Int. Ed. 1967. V. 6. № 3. P. 206.
Gouthamana S., Venkatesha M., Kanemotoa S.O., Suguna Lakshmia M., Hamerton I. // Polym. Int. 2019. V. 68. № 10. P. 1666.
Zhang Z., Yu R., Wang F., Wang J., Jiao Y. // J. Appl. Polym. Sci. 2011. V. 122. № 4. P. 2609.
Reams J.T., Boyles D.A. // J. Appl. Polym. Sci. 2011. V. 121. P. 756.
Koga S., Nakazumi Y., Takano K. Pat. 3611208A1 EP. 2018.
Saori H., Yamamoto K., Higashita K., Ueno Y. Pat. 20210214547A1 USA. 2021.
Saori H., Yamamoto K., Higashita K., Ueno Y. Pat. 202006039A TW. 2019.
Вихров И.А., Аристов В.Ф., Гуров Д.А. // Олигомеры-2015. Cб. тез. докл. V Междунар. конф.-школы по химии и физикохимии олигомеров, 2015. С. 128.
Вихров И.А., Аристов В.Ф., Гуров Д.А. // Решетневские чтения. 2015. 2015. Т. 1. С. 91.
Galukhin A., Nosov R., Taimova G., Nikolaev I., Islamov D., Vyazovkin S. // React. Funct. Polymers. 2021. V. 165. P. 104956.
Changjiang S., Hao Y., Zhonggang W. // Chem. Commun. 2014. V. 50. P. 11238.
Delano C.B., McLeo A.H. Synthesis of Improved Phenolic Resins / NASA Report CR-159724. 1979.
Yan H., Chen S., Qi G. // Polymer. 2003. V. 44. P. 7861.
Yan H.Q., Ji L., Qi G.R. // J. Appl. Polym. Sci. 2004. V. 91. № 6. P. 3927.
Yan H., Wang H., Cheng J., Fang Z. // Adv. Mater. Res. 2011. V. 233. P. 1636.
Jayakumari L.S., Thulasiraman V., Sarojadevi1 M. // High Perform. Polym. 2007. V. 19. № 1. P. 33.
Lin B.S., Amone M.J. Pat. 20020055648A1 USA. 2002.
Zhang B., Wang Z., Zhang X. // Polymer. 2009. V. 50. P. 817.
Guenthner A.J., Davis M.C., Ford M.D., Reams J.T., Groshens T.J., Baldwin L.C., Lubin L.M., Mabry J.M. // Macromolecules. 2012. V. 45. № 24. P. 9707.
Galukhin A., Nosov R., Nikolaev I., Melnikova E., Islamov D., Vyazovkin S.// Polymers. 2021. V. 13. № 11. P. 1686.
Guenthner A.J., Davis M.C., Lamison K.R., Yandek G.R., Cambrea L.R., Groshens T.J., Baldwin L.C., Mabry J.M. // Polymer. 2011. V. 52. № 18. P. 3933.
Cambrea L.R., Davis M.C., Groshens T.J., Guenthner A.J., Lamison K.R., Mabry J.M. // J. Polym. Sci., Polym. Chem. 2010. V. 48. № 20. P. 4547.
Cash J.J., Davis M.C., Ford M.D., Groshens T.J., Guenthner A.J., Harvey B.G., Lamison K.R., Mabry J.M., Meylemans H.A., Reamsb J.T., Sahagunb C.M. // Polym. Chem. 2013. V. 4. № 13. P. 3859.
Chen H., Tuck T., Ji X., Zhou X., Kelly G., Cuerrier A., Zhang J. // J. Agricult. Food Chem. 2013. V. 61. № 26. P. 6383.
Davis M.C., Guenthner A.J., Groshens T.J., Reams J.T., Mabry J.M. // J. Polym. Sci., Polym. Chem. 2012. V. 50. I. 19. P. 4127.
Хейфиц Л.А., Дашунин В.М. Душистые вещества и другие продукты для парфюмерии. М.: Химия, 1994.
Harvey B.G., Sahagun C.M., Guenthner A.J., Groshens T.J., Cambrea L.R., Reams J.T., Mabry J.M. // Chem. Sus. Chem. 2014. V. 7. № 7. P. 1964.
Meylemans H.A., Harvey B.G., Reams J.T., Guenthner A.J., Cambrea L.R., Groshens T.J., Baldwin L.C., Garrison M.D., Mabry J.M. // Biomacromolecules. 2013. V. 14. № 3. P. 771.
Harvey B.G., Guenthner A.J., Lai W.W., Meylemans H.A., Davis M.C., Cambrea L.R., Reams J.T., Lamison K.R. // Macromolecules. 2015. V. 48. № 10. P. 3173.
Lin C.H., Lin H.T., Tian Y.W., Dai S.A., Su W.C. // J. Polym. Sci., Polym. Chem. 2011. V. 49. P. 4851.
Lin C.H., Yang K.Z., Leu T.S., Lin C.H., Sie J.W. // J. Polym. Sci., Polym. Chem. 2006. V. 44. P. 3487.
Davis M.C., Garrison M.D., Ghiassi K.B., Groshens T.J., Redeker N.D. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 10. P. 1100.
Lin C.H., Wang M.W., Chou Y.W., Chang H.C., Juang T.Y., Su W.C. // RSC Adv. 2015. V. 5. № 14. P. 10165.
Jensen K.A., Due M., Holm A. // Acta Chem. Scandinavica. 1965. V. 19. № 2. P. 438.
Jensen K.A., Due M., Holm A., Wentrup C. // Acta Chem. Scandinavica. 1966. V. 20. № 8. P. 2091.
Korshak V.V., Vinogradova S.V., Pankratov V.A. // Russ. Chem. Bull. 1971. V. 20. № 4. P. 814.
Петрова А.П., Исаев А.Ю. // Труды ВИАМ. 2017. Т. 57. № 9. С. 75.
Snow A.W., Buckley L.J., Armistead J.P. // J. Polym. Sci., Polym. Chem. 1999. V. 37. P. 135.
Snow A.W., Buckley L.J. // Macromolecules. 1997. V. 30. P. 394.
Eaborn C., Lickiss P.D., Marquina-Chidsey G., Thorli E.Y. // J. Chem. Soc. Chem. Commun. 1982. № 22. P. 1326.
Eaborn C., El-Kaddar Y.Y., Lickiss P.D. // J. Chem. Soc. Chem. Commun. 1983. № 23. P. 1450.
Guenthner A.J., Yandek G.R., Wright M.E., Petteys B.J., Quintana R., Connor D., Gilardi R.D., Marchant D. // Macromolecules. 2006. V. 39. № 18. P. 6046.
Guenthner A.J., Vij V., Haddad T.S., Reams J.T., Lamison K.R., Sahagun C.M., Ramirez S.M., Yandek G.R., Suri S.C., Mabry J.M. // J. Polym. Sci., Polym. Chem. 2014. V. 52. № 6. P. 767.
Galukhin A., Liavitskaya T., Vyazovkin S. // Macromol. Chem. Phys. 2019. V. 220. № 13. P. 1900141.
Fang T., Shimp D.A. // Progr. Polym. Sci. 1995. V. 20. № 1. P. 61.
Anuradha G., Sarojadevi M. // J. Polym. Res. 2008. V. 15. № 6. P. 507.
Corley C.A., Guenthner A.J., Sahagun C.M., Lamison K.R., Reams J.T., Hassan M.K., Morgan S.E., Iacono S.T., Mabry J.M. // ACS Macro Lett. 2014. V. 3. № 1. P. 105.
Mormann W., Zimmermann J.G. // Liquid Cryst. 1995. V. 19. № 2. P. 227.
Mormann W., Zimmermann J.G. // Macromolecules. 1996. V. 29. № 4. P. 1105.
Barclay G.G., Ober C.K., Papathomas K.I., Wang D.W. // Macromolecules. 1992. V. 25. № 11. P. 2947.
Marcos-Fernandez A., Posadas P., Rodriguez A., Gonzalez L. // J. Polym. Sci., Polym. Chem. 1999. V. 37. № 16. P. 3155.
Lin R.H., Su A.C., Hong J.L. // J. Polym. Res. 1997. V. 4. № 4. P. 191.
Anuradha G., Rakesh S., Sarojadevi M. // Polym. Eng. Sci. 2009. V. 49. № 5. P. 889.
Abed J.C., Mercier R., Mcgrath J.E. // J. Polym. Sci., Polym. Chem. 1997. V. 35. P. 977.
Sen F., Senturk I.I., Kahraman M.V. // Polym. Comp. 2014. V. 37. № 5. P. 1312.
Loudas B.L., Paul St., Vogel H.A. Pat. 3595900 USA. 1971.
Rakesh S., Thulasiraman V., Sarojadevi M. // Polym. Eng. Sci. 2015. V. 55. № 1. P. 47.
Sakthidharan C.P., Sundararajan P.R., Sarojadevi M. // RSC Adv. 2015. V. 5. № 25. P. 19666.
Ryu B.Y., Emrick T. // Macromolecules. 2011. V. 44. № 14. P. 5693.
Harvey B.G., Chafin A.C., Garrison M.D., Cambrea L.R., Groshens T.J. // RSC Adv. 2015. V. 5. № 91. P. 74712.
Mathew D., Nair C.P.R., Ninan K.N. // Polym. Int. 2000. V. 49. № 1. P. 48.
Hamerton I., Glynn S., Hay J.N., Pullinger M.A., Shaw S.J. // Polym. Degrad. Stab. 2012. V. 97. № 4. P. 679.
Tada Y., Moriya N., Inoue T., Suzuki A., Koyama S. // Phosphorus, Sulfur, and Silicon and the Related Elements. 2012. V. 187. № 12. P. 1555.
Ning Y., Chen Y., Wang M., Zhou K., Su T., Wang Z. // High Perform. Polym. 2019. V. 31. № 3. P. 359.
Gutsche C.D., Bauer L.J. // J. Am. Chem. Soc. 1985. V. 107. № 21. P. 6052.
Galukhin A., Nikolaev I., Nosov R., Vyazovkin S. // Polym. Chem. 2020. V. 11. № 25. P. 4115.
Nair C.P.R. // Progr Polym. Sci. 2004. V. 29. № 5. P. 401.
Pat. 6607233A NL. 1966.
Pat. 6401346A NL. 1964.
Hamerton I., Hay J.N. // Polym. Int. 1998. V. 47. № 4. P. 465.
Uhlig C., Bauer M., Bauer J., Kahle O., Taylor A.C., Kinloch A.J. // Reactive Functional Polym. 2011. V. 129. P. 2.
Jankovic B. // Thermochim. Acta. 2011. V. 519. № 1‒2. P. 114.
Tsiamis A., Iredale R., Backhouse R., Hallett S.R., Hamerton I. // ACS Appl. Polym. Mater. 2019. V. 1. № 6. P. 1458.
Critchley J.P., Knight G.J., Wright W.W. // Heat-Resistant Polymers. Technologically Useful Materials Farnborough. Springer-Science+Business Media, 1983.
Grigat E., Schminke H.S. Putter C., Putter R., Stammhein C. Pat. 3448079 USA. 1969.
Wang F., Wang J., Zhu Y., Zhang Z., Jiao Y. // Int. J. Polym. Analysis Characteriz. 2010. V. 15. P. 415.
Gardziella A., Pilato L.A., Knop A. // Phenolic Resins Chemistry, Applications, Standardization, Safety and Ecology. New York; Berlin: Springer-Verlag, 2000.
Nair C.P.R., Bindu R.I., Joseph V.C. // J. Polym. Sci., Polym. Chem. 1995. V. 33. № 4. P. 621.
Tullo A.H. // Chem. Eng. News Archive. 2008. V. 86. № 36. P. 26.
Li Z., Guo Y., Wang G., Xu S., Han Y., Liu X., Luo Z., Ye L., Zhou H., Zhao T. // Polym. Adv. Technol. 2018. V. 29. № 12. P. 2936.
Liao Z.K., Jackson L., Wang C.S. Pat. 5260398 USA. 1993.
Matthew L., Dominguez D.D., Keller T.M. // Polymer. 2006. V. 47. № 11. P. 3727.
Matthew L., Dominguez D.D., Keller T.M. // J. Mater. Chem. 2005. V. 15. № 16. P. 1611.
Matthew L., Dominguez D.D., Keller T.M. // J. Polym. Sci., Polym. Chem. 2006. V. 44. № 15. P. 4559.
Yameen B., Duran H., Best A., Jonas U., Steinhart M., Knoll W. // Macromol. Chem. Phys. 2008. V. 209. № 16. P. 1673.
Пацурия М.М. Автореф. дис. … канд. хим. наук. М.: ИНЭОС АН СССР, 1976.
Chang J.-Y., Hong J.-L. // Macromol. Chem. Phys. 1995. V. 196. № 11. P. 3753.
Zhao L., Yuan L., Liang G., Gu A. // RSC Adv. 2013. V. 5. № 73. P. 58989.
Zheng L., Yuan L., Guan Q., Liang G., Gu A. // Appl. Surf. Sci. 2018. A. V. 427. P. 1046.
Wang G., Wang R., Fu G., Gao T., Fu C., Kuang H., Yang F., Jiao W., Hao L., Liu W. // Polym. Eng. Sci. 2015. V. 55. № 11. P. 2591.
Stille J.K., Nelb R.G., Norris S.O. // Macromolecules. 1976. V. 9. № 3. P. 516.
Андрианов К.А., Коршак В.В., Виноградова С.В., Макарова Л.И., Панкратов В.А., Гогуадзе Ц.А., Митина Л.М., Дмитриев В.А., Пацурия М.М. Пат. 487911 CCCР. 1975.
Андрианов К.А., Коршак В.В., Панкратов В.А., Виноградова С.В., Макарова Л.И., Пацурия М.М., Гогуадзе Ц.А., Митина Л.М. Пат. 496292 CCCР. 1975.
Maya E.M., Snow A.W., Buckley L.J. // Macromolecules. 2002. V. 35. № 2. P. 460.
Pat. 6513026 NL. 1966.
Kern W., Schroder R., Hummel K., Mayer C., Hofstotter M. // Eur. Polym. J. 1998. V. 34. № 7. P. 987.
Mathew D., Nair C.P.R., Ninan K.N. // Eur. Polym. J. 2000. V. 36. № 6. P. 1195.
Maul J., Frushour B.G., Kontoff J.R., Eichenauer H., Ott K.H., Schade C. Polystyrene and Styrene Copolymers in Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2011.
Hergenrother P.M. // Macromolecules 1974. V. 7. № 5. P. 575.
Barton J.M., Hamerton I., Jones J.R. // Polym. Int. 1992. V. 29. № 2. P. 145.
Barton J.M., Hamerton I., Jones J.R. // Polym. Int. 1993. V. 31. № 1. P. 95.
Anuradha G., Sarojadevi M., Sundararajan P.R. // J. Appl. Polym. Sci. 2008. V. 110. № 1. P. 517.
Chaplin A., Hamerton I., Howlin B.J., Barton J.M. // Macromolecules. 1994. V. 27. № 18. P. 4927.
Hamerton I., Barton J.M., Chaplin A., Howlin B.J., Shaw S.J. // Polymers. 2001. V. 42. № 6. P. 2307.
Nair C.P.R., Mathew D., Ninan K.N. // Eur. Polym. J. 2001. V. 37. № 2. P. 315.
Augustine D., Mathew D., Nair C.P.R. // RSC Adv. 2015. V. 5. № 111. P. 91254.
Barton J.M., Greenfield D.C.L., Hamerton I., Jones J.R. // Polym. Bull. 1991. V. 25. № 4. P. 475.
Galukhin A., Nosov R. // Molecules. 2019. V. 24. № 1. P. 177.
Lin C.H. // Polymer. 2004. V. 45. P. 7911.
Barton J., Chaplin A., Hamerton I., Howlin B. // Polymer. 1999. V. 40. № 19. P. 5421.
Reams J.T., Guenthner A.J., Lamison K.R., Vij V., Lubin L.M., Mabry J.M. // ACS Appl. Mater. Int. 2012. V. 4. № 2. P. 527.
Ramirez M.L., Walters R., Lyon R.E., Savitski E.P. // Polym. Degrad. Stab. 2002. V. 78. № 1. P. 73.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. СВОДНАЯ ИНФОРМАЦИЯ О СВОЙСТВАХ ЦИАНАТЭФИРНЫХ МОНОМЕРОВ/ОЛИГОМЕРОВ И ИХ ПОЛИМЕРОВ
Таблица 1. Свойства цианатэфирных мономеров/олигомеров и гомополимеров на их основе.
Инструменты
Высокомолекулярные соединения (серия Б)


