Высокомолекулярные соединения (серия Б), 2022, T. 64, № 4, стр. 268-273
НОВЫЙ ПОДХОД К СИНТЕЗУ ТЕРМОЧУВСТВИТЕЛЬНЫХ ПОЛИРОТАКСАНОВ
М. П. Курлыкин a, *, М. М. Дудкина a, Т. Ю. Кирилэ a, А. П. Филиппов a, А. В. Теньковцев a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: mike_x@mail.ru
Поступила в редакцию 24.03.2022
После доработки 06.05.2022
Принята к публикации 08.06.2022
- EDN: DIWBAK
- DOI: 10.31857/S2308113922700073
Аннотация
Предложен новый подход к синтезу термочувствительных полиротаксанов основанный на терминировании живых цепей поли-2-этил-2-оксазолина концевыми группами полипсевдоротаксана на основе альфа,омега-диаминополиэтиленгликоля 2000 и альфа-циклодекстрина. Показано, что поли-2-этил-2-оксазолин, полученный методом катионной полимеризации с раскрытием цикла, при взаимодействии с концевыми группами полипсевдоротаксана эффективно блокирует распад комплекса в растворе. Структура полученных сополимеров подробно охарактеризована методами ЯМР 1Н, ЯМР 13С, ИК-спектроскопии и ГПХ. Продемонстрировано наличие у водных растворов синтезированных полимеров нижней критической температуры растворения.
Молекулярные ожерелья – полипсевдоротаксаны представляют собой полимер, основная цепь которого проходит через внутренние полости ряда низкомолекулярных циклических соединений, впервые были получены, а затем детально исследованы в работах японских ученых [1, 2]. Среди супрамолекулярных систем данного типа наиболее изученными являются структуры, образованные в результате комплексообразования циклодекстринов с полиэтилен- [3] и полипропиленоксидами [4], хотя в литературе имеются сведения и о получении аналогичных структур при использовании полиэтилена [5], полисилоксанов [6], полилактонов [7, 8], полиуретанов [9] и полибутадиенов [10].
Полипсевдоротаксаны как динамическая система не являются устойчивыми в растворах, поскольку в отсутствие концентрационных факторов (избыток циклодекстрина) равновесие сдвигается в сторону существования компонентов независимо, т.е. деградации супрамолекулярной системы. С целью предотвращения подобного поведения, было предложено блокировать концевые группы полипсевдоротаксана объемными заместителями для снижения предотвращения распада комплекса. В качестве блокирующих фрагментов были использованы 2.4-динитрофенильная [11], тритильная [12], 9-антрильная [13, 14], 9-пиренильная [15] и ряд других стерически объемных групп.
Так как компоненты супрамолекулярной системы могут двигаться или вращаться относительно друг друга, особый интерес данные структуры приобрели для создания стимул-чувствительных полимерных систем, которые можно применять в системах доставки лекарств, тканевой инженерии и других биомедицинских приложениях [16–18]. Термочувствительные водорастворимые и биосовместимые полимеры в настоящее время являются одними из наиболее перспективных объектов в биомедицинских приложениях [19–21]. В связи с этим были предприняты попытки модифицировать полиротаксаны на основе полиэтиленгликоля и циклодекстринов с целью индуцирования термочувствительности в водных растворах. В частности, было показано [22–24], что полиротаксаны на основе частично метилированного бета-циклодекстрина и блок-сополимеров полиэтиленгликоль–полипропиленгликоль могут быть использованы в качестве инъекционного носителя белка выше нижней критической температуры растворимости. Также было изучено влияние степени ацилирования и гидрофобности ацильного радикала на термочувствительность полиротаксанов с полиэтиленгликолевым сердечником [25]. Другой подход к получению термочувствительных полиротаксанов – модификация концевых групп сердечника термочувствительными полимерами. Пионерская работа в этом направлении основана на получении псевдоротаксана с сердечником, представляющим собой альфа,омега-димеркаптополиэтиленгликоль. Синтезированный полипсевдоротаксан служил макроинициатором для фотохимической полимеризации N-изопропилариламида [26]. Аналогично были получены полипсевдоротаксаны с бис-альфа,омега-2-бром-изобутироилполиэтиленгликолевым фрагментом, который был использован для проведения АТРП-полимеризации изопропилметарилата, что привело как к блокированию возможного распада супрамолекулярной системы, так и к появлению термочувствительности целевого полимера в водных растворах [27].
Предложенные до настоящего времени методы синтеза полиротаксанов триблок-сополимерного типа с центральным ротаксановым фрагментом содержат блокирующие группы полиметакрилатного типа, что является существенным недостатком для полимеров, потенциально применимых в биомедицинских приложениях. В связи с этим в настоящей работе описан новый подход к синтезу полиротаксанов с биосовместимыми полиоксазолиновыми блокирующими фрагментами, причем в отличие от известных подходов для получения целевых соединений использован метод обрыва “живых” цепей полиоксазолина на концевых группах полипсевдоротаксана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза полимеров использовали 2-этил-2-оксазолин (“Aldrich”) и альфа-циклодекстрин (“Acros”). Внутренним блоком полиротаксана служил альфа,омега-диаминополиэтиленгликоль 2000, полученный по известной методике [28].
Спектры ЯМР получали на спектрометре “Bruker AC400” (400 МГц) для растворов в ДМСО-d6. Диализ осуществляли с применением диализных мешков (“CelluSep”, “Orange Scientific”) c MWCO 3500 и 6000 D. Хроматографический анализ проводили на хроматографе “Shimadzu LC-20AD” с колонкой SDA0830055E1 (5 мкм, 8.0 мм × 300 мм, “PSS”) с использованием рефрактометрического детектора. В качестве подвижной фазы применяли раствор LiBr (0.1 моль/л) в ДМФА при 60°C. Турбидиметрические исследования выполняли на приборе “Photocor Complex installation” (“Photocor Instruments Inc.”, Россия) при длине волны 658.7 нм. Растворители абсолютировали с использованием стандартных методик.
Получение полиротаксана–поли-2-этил-2-оксазолин–блок–ПЭГ@альфа-циклодекстрин–блок–поли-2-этил-2-оксазолин
К раствору 0.46 г (2.3 × 10–4 моль/л) альфа,омега-диаминополиэтиленгликоля 2000 в 1 мл воды добавляли раствор 0.55 г (5.65 × 10–4 моль/л) альфа-циклодектрина в 3.8 мл воды. Смесь помещали в ультразвуковую баню на 10 мин, после чего оставляли при комнатной температуре на 12 ч. Полученный псевдоротаксан отделяли центрифугированием и лиофильно высушивали.
Ампулу, содержащую 0.012 г (0.45 × 10–5 моль/л) метилтозилата, 0.4 г (4 × 10–3 моль/л) 2-этил-2-оксазолина и 1 мл сульфолана замораживали до –196°С, воздух удаляли в вакууме 0.1 мм рт. ст., затем смесь размораживали в атмосфере аргона. Цикл повторяли трижды, после чего ампулу запаивали и нагревали при 100°С в течение 120 ч.
Раствор неочищенного полипсевдоротаксана, полученного на предыдущей стадии в 2 мл абсолютного ДМСО смешивали с раствором поли-2-этил-2-оксазолина после чего реакционную смесь нагревали при 100°С в течение 12 ч. Полученный раствор полиротаксана диализовали относительно воды (MWCO 6000 D) в течение 3 суток, после чего лиофильно сушили. Выход твердого продукта 0.53 г.
ЯМР 1Н (ДМСО-d6, δн, м.д.): 5.52 (OН-2, д); 5.41 (ОН-3, д); 4.80 (СН-1, д); 4.48 (ОН-6, т); 3.51 (СН2–СН2–O, с); 3.33 (СН2–СН2–N, c); 2.28 (CO–CH2–CH3, шс); 0.96 (CO–CH2–CH3, шс).
ЯМР 13С (ДМСО-d6, δс, м.д.): 173.2 (С=О); 101.9 (С1); 82.0 (С4); 73.2 (С2); 72.1 (С3); 69.8 (С5); 60.0 (С6); 44.4 (СН2–СН2–N); 40.4 (СН2–СН2–O); 24.9 (CO–CH2–CH3); 9.4 (CO–CH2–CH3).
ИК (см–1): 3410 (ОН св); 2880 (ОН несв); 1640 (С=О); 1450; 1350; 1110.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Использованный в настоящей работе подход к синтезу полиротаксанов с триблок-сополимерным (поли-2-этил-2-оксазолин–блок–ПЭГ–блок–поли-2-этил-2-оксазолин) сердечником представлен на следующей схеме:
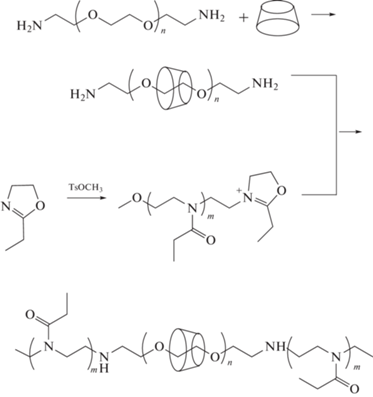
В отличие от аналогичных блок-сополимеров, полученных с использованием методов радикальной полимеризации, мало чувствительных к наличию гидроксилсодержащих примесей, существование “живых” олигооксазолинов возможно лишь в абсолютных условиях. При этом следует отметить, что полипсевдоротаксан, полученный при взаимодействии водных растворов альфа,омега-диаминополиэтиленгликоль 2000 и альфа-циклодекстрина, обладает крайне низкой растворимостью в большинстве органических растворителей, за исключением ДМСО. Кроме того, ДМСО непригоден как среда для проведения катионной полимеризации оксазолинов, поскольку при его использовании наблюдается значительная передача цепи на растворитель [29], что приводит к невозможности реализации процесса в режиме “живых” цепей. В связи с этим в качестве среды для полимеризации 2-этил-2-оксазолина был выбран сульфолан, который, как известно [30], позволяет проводить реакцию полимеризации в режиме “живых” цепей. Такое сходство, вероятно, дает возможность получить раствор полипсевдоротаксана в смеси ДМСО–сульфолан и провести реакцию обрыва цепи в гомогенных условиях. В результате реакция катионных центров “живых” цепей полиоксазолина с концевыми аминогруппами полипсевдоротаксана приводит к супрамолекулярной системе, в которой распад комплекса на компоненты механически блокируется объемными блоками полиоксазолина.
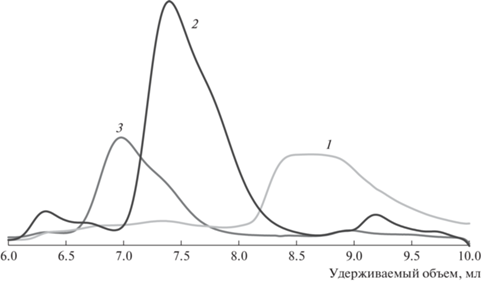
По результатам ГПХ-анализа (рис. 1), полученный полиротаксан характеризуется мономодальным достаточно узким распределением.
Рис. 1.
Хроматограмма поли-2-этил-2-оксазолина (1), полипсевдоротаксана (2), поли-2-этил-2-оксазолин–блок–ПЭГ@альфа-циклодекстрин–блок–поли-2-этил-2-оксазолина (3).
Состав ротаксанов был определен из спектров ЯМР 1Н по соотношению интенсивностей сигналов полиэтиленгликолевого блока (3.53 м.д.), сигналов гидроксильных групп циклодекстрина (5.52, 5.41, 4.80, 4.48 м.д.) и сигналов СН3СН2 группы полиоксазолина (0.96 м.д.) (рис. 2).
Рис. 2.
Спектр ЯМР 1Н поли-2-этил-2-оксазолин–блок–ПЭГ@альфа-циклодекстрин–блок–поли-2-этил-2-оксазолина.
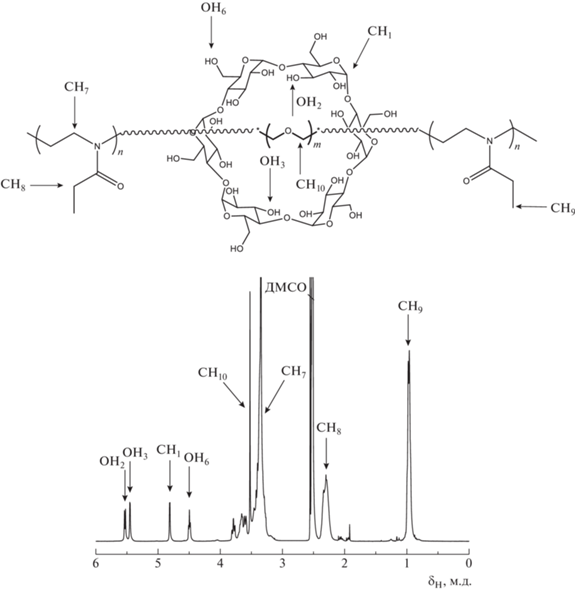
Как следует из анализа данных ЯМР, один остаток альфа-циклодекстрина приходится на 4 мономерных звена ПЭГ. При этом соотношение интенсивностей сигналов остатков полиоксазолина и ПЭГ свидетельствует о том, что Мn полиоксазолинового блока составляет 2.5 × 103 , что согласуется с результатами ГПХ.
Необходимо отметить необычное поведение полученного полиротаксана в водных растворах. Исходный полимер только частично растворим в воде при комнатной температуре, однако при нагревании образует мицеллярный раствор со средним размером мицелл 450 нм (по данным динамического светорассеяния). Аналогичный эффект наблюдался на полиротаксане с центральным блоком плюроник F127 и концевыми группами поли-N-изопропилакриламида [31]. Согласно данным рис. 3, температура необходимая для полного растворения полимера, превышает 50°С и зависит от соотношения полимер : растворитель.
Рис. 3.
Влияние концентрации полиротаксана на температуру образования мицеллярного с концентрацией 6 (1), 4 (2) и 3 мас.% (3).
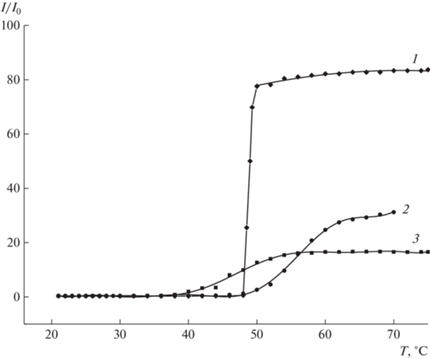
Полученные растворы полиротаксана проявляют термочувствительность, однако система является неравновесной, что проявляется в существенной зависимости температуры помутнения от термической предыстории образца. Например, 6%-ный раствор полимера, при первом нагревании, демонстрирует появление точки помутнения при 62°С, при втором цикле охлаждение–нагревание точка помутнения наблюдается при 74°С, при третьем – 84°С, при четвертом – 93°С.
Такое поведение, вероятно, связано с наличием при комнатной температуре множественных водородных связей между макроциклами, образующими полиротаксан, что способствует образованию достаточно жестких супрамолекулярных, плохо растворимых структур, несмотря на их гидрофильность. При повышении температуры такие связи частично разрываются, что приводит к увеличению подвижности цепи и способствует переходу полимера в раствор. При дальнейшем повышении температуры происходит коллапс термочувствительных поли-2-этил-2-оксазолиновых блоков, что визуально наблюдается как точка помутнения раствора. Кроме того, можно предположить, что при повторении циклов нагревание–охлаждение образование водородных связей между макроциклами полностью не восстанавливается. В результате остатки циклодекстринов более равномерно распределяются вдоль цепи, уменьшается ее жесткость и, как следствие, увеличивается температура помутнения. Очевидно, что данное предположение требует дополнительного экспериментального подтверждения и является предметом исследований авторов в настоящее время.
ЗАКЛЮЧЕНИЕ
На основе полипсевдоротаксана (альфа,омега-диаминоПЭГ2000@альфа-циклодекстрин) и “живых” олигомеров поли-2-этил-2-оксазолина, полученных катионной полимеризацией с раскрытием цикла, продемонстрирован новый подход к синтезу термочувствительных триблок-сополимеров с центральным блоком полиротаксанового типа. Показано, что полипсевдоротаксаны с концевыми аминогруппами центрального элемента комплекса могут быть эффективно терминированы “живыми” олиго-2-этил-2-оксазолинами, выполняющими роль как блокаторов распада супрамолекулярного комплекса, так и элементов, приводящих к возникновению термочувствительности в водных растворах полученных блок-сополимеров.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 22-23-00280).
Список литературы
Harada A., Li J., Nakamitsu T., Kamachi M. // J. Org. Chem. 1993. V. 58. P. 7524.
Harada A. // Acc. Chem. Res. 2001. V. 34. P. 456.
Jarroux N., Guegan P., Cheradame H., Auvray L. // J. Phys. Chem. B. 2005. V. 109. P. 23816.
Okada M., Kamachi M., Harada A. // J. Phys. Chem. B. 1999. V. 103. P. 2607.
Harada A., Li J., Kamachi M. // Chem. Commun. 1997. P. 1413.
Okumura H., Kawaguchi Y., Harada A. // Macromolecules. 2001. V. 34. P. 6338.
Shuai X., Porbeni F. E., Wei M., Bullions T., Tonelli A.E. // Macromolecules. 2002. V. 35. P. 3778.
Lu J., Mirau P.A., Tonelli A.E. // Macromolecules. 2001. V. 34. P. 3276.
Yamaguchi I., Takenaka Y., Osakada K., Yamamoto T. // Macromolecules. 1999. V. 32. P. 2051.
Michishita T., Okada M., Harada A. // Macromol. Rapid Commun. 2001. V. 22. P. 763.
Harada A., Li J., Kamachi M. // Nature. 1992. V. 356. P. 325.
Resmerita A.-M., Assaf K., Lazar A.I., Nau W.M. // Eur. Polym. J. 2017. V. 93. P. 323.
Okada M., Harada A. // Org. Lett. 2004. V. 6. P. 361.
Okada M., Harada A. // Macromolecules. 2003. V. 36. P. 9701.
Jarroux N., Guegan P., Cheradame H., Auvray L. // J. Phys. Chem. B. 2005. V. 109. P. 23816.
Tamura A., Yui N. // Chem. Commun. 2014. V. 50. P. 13433.
Tamura A., Yui N. // J. Controlled Release. 2018. V. 269. P. 148.
Zhao X., Song W., Li W., Liu S., Wang L., Ren L. // RSC Adv. 2017. V. 7. P. 28865.
Kamaly N., Yameen B., Wu J., Farokhzad O.C. // Chem. Rev. 2016. V. 116. P. 2602.
Vanparijs N., Nuhn L., De Geest B.G. // Chem. Soc. Rev. 2017. V. 46. P. 1193.
Kim Y.-J., Matsunaga Y.T. // J. Mater. Chem. B. 2017. V. 5. P. 4307.
Tamura A., Ohashi M., Yui N. // J. Biomater. Sci., Polym. Ed. 2017. V. 28. P. 1124.
Qian A., Liu K., Chen P., Yao Y., Yan J., Li W., Zhang X., Zhang A. // Macromolecules. 2019. V. 52. P. 3454.
Li W., Guo Y., He P., Yang R., Li X., Chen Y., Liang D., Kidowaki M., Ito K. // Polym. Chem. 2011. V. 2. P. 1797.
Tamura A., Ohashi M., Tonegawa A., Kang T.W., Zhang S. // Macromol. Chem. 2021. V. 222. Art. 2000420.
Yu H., Feng Z.-G., Zhang A.-Y., Hou D., Sun L.-G. // Polymer. 2006. V. 47. P. 6066.
Yasumoto A., Gotoh H., Gotoh Y., Bin Imran, Hara M., Seki T., Sakai Y., Ito K., Takeoka Y. // Macromolecules. 2017. V. 50. P. 364.
Zalipsky S. // Bioconjugate Chem. 1995. V. 6. P. 150.
Levy A., Litt M. // J. Polym. Sci. Pt 2. 1968. V. 6. P. 63–72.
Vergaelen M., Verbarken B., Hoogenboom R. // ACS Macro Lett. 2015. V. 4. P. 825.
Wang J., Gao P., Ye L., Zhang A., Feng Z. // Polym. Chem. 2011. V. 2. P. 931.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


