Высокомолекулярные соединения (серия Б), 2023, T. 65, № 2, стр. 122-133
ЭПОКСИ-АМИННЫЕ СИСТЕМЫ С РЕАКЦИОННОСПОСОБНЫМИ ГУАНИДИНОВЫМИ ПРОИЗВОДНЫМИ
И. Н. Сенчихин a, *, М. С. Меркулова b, И. П. Седишев b, Н. Э. Грамматикова c, О. Я. Урюпина a, Е. К. Уродкова a, Е. С. Жаворонок b
a Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, Россия
b МИРЭА – Российский технологический университет
119571 Москва, пр. Вернадского, 86, Россия
c Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Большая Пироговская ул., 11, Россия
* E-mail: isenchikhin@gmail.com
Поступила в редакцию 16.12.2022
После доработки 07.03.2023
Принята к публикации 21.03.2023
- EDN: WZICAC
- DOI: 10.31857/S2308113923700420
Аннотация
Для создания новых полимерных покрытий, подавляющих жизнедеятельность патогенных микроорганизмов, предпринята попытка модификации эпокси-аминных систем реакционноспособными производными мономерами на основе гуанидина. Предварительное химическое взаимодействие этих веществ с эпоксидным компонентом дает возможность ковалентно вводить их в эпокси-аминную сетку для обеспечения пролонгированного действия покрытия. Синтезированные гидросалицилат, гидро-4-аминосалицилат, гидро-5-сульфосалицилат и дигидро-5-сульфосалицилат гуанидина охарактеризованы методами элементного и термического анализа. Определены значения степени замещения гидрохлорида на остаток органической соли и температуры начала термодеструкции в аргоне, а также температуры стеклования и плавления солей. Оценена растворимость синтезированных солей в диановом эпоксидном олигомере. Показано, что замена гидрохлорида на органический остаток заметно снижает температуру начала реакции с эпоксидным олигомером. Установлена средняя функциональность солей гуанидина в реакции с эпоксидным олигомером, и обнаружено, что в химическое взаимодействие вступает большинство групп N‒Н модификаторов, в ряде случаев ‒ это остатки органических солей. Представлена стехиометрия бинарных систем гуанидин‒эпоксидный олигомер, а также стехиометрия синтезированных аддуктов с олигомерным аминным отвердителем Jeffamine D-230. Полученные пленки в первичных испытаниях продемонстрировали выраженную бактериостатическую активность по отношению к метициллин-резистентным S. еpidermidis уже при 1 мас. % гидросалицилата гуанидина, при этом значение показателя ингибирования пленкообразования составило 19.2%.
ВВЕДЕНИЕ
Разработка и получение новых полимерных защитных покрытий в настоящее время является одной из актуальных научно-практических задач [1–3]. К востребованным материалам такого рода относятся эпоксидные композиции [4, 5]. Они образуют покрытия за счет химических процессов, приводящих к формированию трехмерных полимерных сеток, исключительно устойчивых к негативному воздействию окружающей среды. Для повышения защитных свойств покрытий эпоксидные композиции модифицируют различными соединениями (см., например, работы [6–8]), причем выраженные преимущества имеет модификация реакционноспособными веществами, которые могут химически участвовать в формировании трехмерного полимера. Такой подход позволяет ковалентно зафиксировать модификатор в полимерной сетке и обеспечить его пролонгированное действие.
Серьезной проблемой покрытий, в том числе эпоксидных, эксплуатируемых в контакте с микроорганизмами (в частности, с патогенной микрофлорой), оказывается их ограниченная стойкость к биоповреждению [9–12]. Для улучшения этого показателя применяют различные неорганические и органические добавки, среди которых выделяют реакционноспособные гуанидинсодержащие модификаторы. Гуанидины и их производные характеризуются доказанной антимикробной (антивирусной, спороцидной, фунгицидной), инсектицидной, пестицидной, альгицидной, цитотоксической и противовоспалительной активностью, одновременно воздействуя на аэробную и анаэробную микрофлору [13–18]. Водорастворимые полимерные производные гуанидинов находят широкое применение в качестве действующего вещества в составе многих дезинфицирующих средств, используемых в сельскохозяйственном производстве и медицине [19, 20]. Однако гуанидинсодержащие полимеры, как правило, плохо растворимы в органических средах – эпоксидных составах, что не позволяет вводить их в концентрации, достаточной для обеспечения выраженной биологической активности. Проведенные исследования [21–23], посвященные направленной модификации гуанидинсодержащих олигомеров за счет синтеза солей с различными органическими кислотами, позволили повысить их растворимость в эпокси-аминных системах и получить в результате однородные гомогенные покрытия. Однако полностью отказаться от использования органического растворителя для таких систем не удалось. Иным способом повышения растворимости модификатора в эпокси-аминной системе может быть снижение его молекулярной массы, вплоть до мономера гуанидина. Мономерный гуанидин, имеющий аминогруппы, сам способен химически реагировать с эпоксидными олигомерами, а его производные – органические соли – могут обеспечивать дополнительный биологический эффект за счет наличия остатка органический кислоты. Влияние природы такого остатка на дыхательную активность модельных микроорганизмов было представлено в работе [22].
Среди органических солей олигомерных гуанидинсодержащих модификаторов, синтезированных и исследованных ранее [21–25], наилучший биологический эффект продемонстрировали соли с салициловой кислотой и ее производными. Таким образом, получение новых солей гуанидина, салициловой кислоты и ее производных для направленной ковалентной модификации эпокси-аминных покрытий является важным шагом в разработке эффективных полимерных покрытий с биоцидными свойствами, что и стало целью настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве базовых объектов исследования использовали диановый эпоксидный олигомер Epikote 828 (“Hexion”, США) (I), олигооксипропилендиамин Jeffamine D-230 (“Hunstman”, США) (II), а также коммерческие образцы гидрохлорида CAS 113-00-8 (III) и гидрокарбоната CAS 593-85-1 (IV) гуанидина фирмы “Merck”. Для получения других солей гуанидина применяли ароматические кислоты: салициловую (ГОСТ 247783), 4-аминосалициловую CAS 65-49-6 (“Aldrich”) и 5-сульфосалициловую CAS 97-05-2 (“Merck”). Перед проведением экспериментов диановый эпоксидный олигомер выдерживали в течение 3 ч при температуре 60°С для удаления кристаллитов. Некоторые характеристики эпоксидного олигомера и отвердителя представлены в табл. 1:
Таблица 1.
Основные характеристики эпоксидного олигомера и отвердителя
| Олигомер | Mn | Среднее число звеньев в молекуле | fэ / fNH/ fОН | Tg (ДСК, w+ = 10 град/мин), К |
|---|---|---|---|---|
| Epikote 828 | 376 | 0.12 | 1.99/–/0.13 | 255 |
| Jeffamine D-230 | 230 | 2.69 | –/3.99/0.01 | 200 |



Синтез производных гуанидина осуществляли из водно-спиртового раствора гидрокарбоната гуанидина IV и эквивалентного количества соответствующей органической кислоты с удалением выделяющегося углекислого газа, а затем, и растворителя из реакционной смеси на вакуумном роторном испарителе. Полное удаление растворителей обеспечивали растиранием твердого остатка и дополнительной сушкой в вакуумном шкафу при остаточном давлении не более 10 торр и температуре до 60°С до постоянной массы. Данные загрузки компонентов для синтеза представлены в табл. 2.
Таблица 2.
Загрузка реагентов и выход продукта при синтезе органических солей гуанидина
| Параметры | Синтезируемая соль гуанидина | |||
|---|---|---|---|---|
| гидро-салицилат | гидро-5-сульфосалицилат | дигидро-5-сульфосалицилат | гидро-4-аминосалицилат | |
| Приготовление водного раствора гидрокарбоната гуанидина (IV) | ||||
| Гуанидин (IV), г (моль) | 18.0 (0.10) | 18.0 (0.10) | 18.0 (0.10) | 18.0 (0.10) |
| Вода, мл | 50 | 50 | 50 | 50 |
| Параметры | Органическая кислота | |||
| салициловая | 5-сульфо-салициловая | 5-сульфо-салициловая | 4-амино-салициловая | |
| Приготовление спиртового раствора органической кислоты | ||||
| Кислота, г (моль) | 27.6 (0.20) | 43.6 (0.20) | 21.2 (0.10) | 30.6 (0.20) |
| Объем этанола, мл | 150 | 250 | 150 | 150 |
| Выход органической соли гуанидина, г (%) | 39.3 (99.7) | 54.8 (98.9) | 33.3 (99.1) | 42.2 (99.5) |
Степень замещения гидрокарбоната на остаток органической кислоты рассчитывали из данных элементного анализа, проведенного на приборе “EA 1112” (“Thermo Finnigan Italia S.P.A.”, Италия) по формуле
где nтеор и nпракт – теоретические и экспериментальные значения мольного содержания элемента.ИК-спектры синтезированных солей измеряли в режиме НПВО с использованием кристалла ZnSe на спектрометре “Nicolet 6700” (“Thermo Fisher Scientific”, США) в диапазоне волновых чисел 550–4000 см–1 с разрешением 4 см–1 и усреднением 64 сканирований. Для приготовления образца порошок соли гуанидина помещали на поверхность кристалла ZnSe так, чтобы полностью ее покрыть, и прижимали штатным прессом.
Изучение теплофизических свойств солей гуанидина, особенностей их взаимодействия с эпоксидным олигомером, а также характеристик отвержденных систем проводили методами дифференциальной сканирующей калориметрии и термического гравиметрического анализа, используя приборы “DSC Q-100” и “TGA Q-500” (“TA Instruments”, США), в динамическом режиме при постоянной скорости нагревания 10 град/мин. Обработку экспериментальных данных выполняли с помощью пакета программ “TA Universal Analysis 2000” (V4.5A). Отверждение композиций вели по оптимальному режиму, разработанному на основании ТТТ-диаграмм для данной эпокси-аминной системы [26, 27].
Биологическую активность отвержденных эпокси-аминных пленок исследовали путем формирования биопленок на поверхности полимера. Для этого применяли диски, вырубленные из исходных и модифицированных пленок. Диски помещали в чашки Петри и вносили инокулят S. еpidermidis 21555 (MRSA) в титре 106 КОЕ/мл, после чего инкубировали в стационарных условиях трое суток при температуре 36°С. Каждые 24 ч удаляли планктон, осторожно промывали физиологическим раствором не менее 3 раз, переносили в новые чашки Петри со свежей средой.
Анализ плотности (биомассы) биопленок (CV-тест) осуществляли окраской генцианвиолетом (0.1%-ный раствор). Диски промывали в физиологическом растворе для удаления не прикрепленных клеток, затем переносили в пробирки. Высушивали при температуре 50°С и вносили краситель до полного погружения дисков. Далее выдерживали 15 мин при комнатной температуре (25°С), удаляли краситель, промывали до получения неокрашенного промывного раствора. Диски сушили, элюировали краситель 70%-ным спиртом в течение 15–20 мин. Окрашенный спиртовой раствор переносили по 100 мкл в лунки планшета для иммунологического исследования. Измерение оптической плотности спиртового раствора выполняли при длине волны 580 нм на планшетном ридере “Bioscreen” с автоматизированной системой (“Labsystems”, Финляндия) с оригинальным программным обеспечением. Влияние концентрации органической соли гуанидина оценивали в процентах ингибирования пленкообразования ${{\gamma }}$ относительно контроля:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из коммерчески доступного гидрокарбоната гуанидина синтезированы четыре соли, однако для оценки степени замещения гидрокарбоната на органическую кислоту метод спектроскопии ЯМР, как это было для олигогексаметиленгуанидина [22, 23], не подходит, так как по спектрам ЯМР 1Н корректно оценить соотношение гуанидин : остаток кислоты не удается из-за обменных процессов протонов гуанидина с остаточными протонами в растворителях (ДМСО-d6 или D2O). В случае же спектров ЯМР 13С даже в режиме Inverse Gate не удалось задать условия эксперимента, которые давали бы адекватные соотношения интегральных интенсивностей. Поэтому был использован метод элементного анализа. В результате, определены соотношения основных элементов: углерода, водорода и азота, а для сульфосалицилатов – серы (табл. 3). Эти данные сравнивались со значениями, рассчитанными по теоретическим химическим формулам солей, и они оказались очень близки: отклонение не превышало 6%. Таким образом, можно полагать, что получены соли гуанидина и органических кислот с высокой степенью замещения.
Таблица 3.
Степень замещения солей гуанидинов по данным элементного анализа
| Соль гуанидина | М, г/моль | Теоретическое значение/практическое значение/степень замещения | |||
|---|---|---|---|---|---|
| С | H | N | S | ||
| Гидросалицилат | 197 | 48.73/48.87/100.30 | 5.62/5.74/102.10 | 21.31/15.16/100.80 | – |
| Гидросульфосалицилат | 277 | 32.77/32.68 /99.70 | 3.78/3.92/103.70 | 14.33/15.88/110.80 | 10.93/12.85/117.60 |
| Дигидросульфосалицилат | 336 | 30.68/27.81/90.60 | 4.58/5.09/111.10 | 23.85/27.56/115.60 | 9.10/10.21/112.20 |
| Гидро-п-аминосалицилат | 212 | 45.28/45.09/99.60 | 5.70/5.77/101.20 | 26.40/26.72/101.20 | – |
Полученные соли изучены методом ИК-спектроскопии. ИК-фурье-спектры солей приведены на рис. 1. Отнесение полос поглощения в спектрах осуществлялось на основании литературных данных [28–31], результаты представлены в табл. 4. Установлено, что измеренные ИК-спектры содержат полосы поглощения, характерные для всех функциональных групп синтезированных солей: гидроксильных, аминных, карбоксильных, в том числе сульфо- и ароматических. Важно, что в спектрах всех синтезированных соединений наблюдаются интенсивные полосы поглощения νas и νs –СОО‒. Полосы νas и νs, соответствующие колебаниям групп –SO3‒, зарегистрированы в спектрах гидро-5-сульфосалицилата и дигидро-5-сульфосалицилата. Вместе с тем, в спектрах отсутствуют характерные полосы колебаний неионизированной карбоксильной группы. Присутствие в спектрах всех синтезированных соединений полос гуанидиния I и II также подтверждает их солеобразный характер. Таким образом, результаты спектральных исследований позволяют заключить, что все синтезированные продукты являются солями гуанидина и салициловой кислоты или ее производных.
Рис. 1.
ИК-спектры НПВО солей гуанидина: дигидросульфосалицилата (1), гидросульфосалицилата (2), гидро-п-аминосалицилата (3), гидросалицилата (4) и гидрохлорида (5).

Таблица 4.
Характерные полосы поглощения солей гуанидина
| Волновое число, см‒1 | Отнесение полос [28–31] | Наличие в спектре* | ||||
|---|---|---|---|---|---|---|
| Г-Гс (4) | Г-Гсс (2) | Г-Дсс (1) | Г-Гас (3) | Г-Гх (5) | ||
| 3472, 3437 | валентные колебания –ОН, связанные внутримолекулярной водородной связью | + | ||||
| 3416 | + | |||||
| 3462, 3451 | + | |||||
| 3469, 3437 | + | |||||
| 3100–3000 | валентные колебания ароматических ‒СН | + | + | + | + | |
| 3366 | νas–${\text{NH}}_{2}^{{\delta + }}$ | + | ||||
| 3369 | + | |||||
| 3338 | + | |||||
| 3382 | + | |||||
| 3343 | + | |||||
| 3155 | νs–${\text{NH}}_{2}^{{\delta + }}$ | + | ||||
| 3124 | + | |||||
| 3174 | + | |||||
| 3209 | + | |||||
| 3200 | + | |||||
| 1634 | “I полоса гуанидиния” | + | ||||
| 1649 | + | |||||
| 1653 | + | |||||
| 1660 | + | |||||
| 1660 | + | |||||
| 1540 | “II полоса гуанидиния” | + | ||||
| 1576 | + | |||||
| 1568 | + | |||||
| 1578 | + | |||||
| 1572 | + | |||||
| 1488 | νas–СОО‒ | + | ||||
| 1506 | + | |||||
| 1583 | + | |||||
| 1585 | + | |||||
| 1389 | νs–СОО‒ | + | + | |||
| 1388 | ||||||
| 1359 | + | |||||
| 1378 | + | |||||
| 1127 | νas–${\text{SO}}_{3}^{ - }$ | + | ||||
| 1126 | + | |||||
| 1034 | νs –${\text{SO}}_{3}^{ - }$ | + | ||||
| 1039 | + | |||||
Примечание. Г-Гс ‒ гидросалицилат, Г-Гсс ‒ гидро-5-сульфосалицилат, Г-Дсс ‒ дигидро-5-сульфосалицилат, Г-Гас ‒ гидро-4-аминосалицилат, Г-Гх ‒ гидрохлорид.
* Номера спектров в скобках соответствуют спектрам на рис. 1.
Методами термоанализа были исследованы соли гуанидинов. На рис. 2 представлены термограммы ТГА, по которым оценены значения температуры деструкции образцов, и термограммы ДСК, показывающие, что синтезированные соли характеризуются не только переходами плавления, но и переходами кристаллизации и стеклования, т.е. являются частично кристаллическими, а не частично аморфными, в отличие от полностью кристаллического гуанидина гидрохлорида. Другими словами, наличие объемного остатка органической кислоты затрудняет кристаллизацию солей гуанидина.
Рис. 2.
Термограммы ТГА (а) и ДСК (б) гидрохлорида (1, 1'), гидрокарбоната (2, 2'), гидросалицилата (3, 3'), дигидросульфосалицилата (4, 4'), гидро-п-аминосалицилата (5, 5') и гидросульфосалицилата гуанидина (6, 6'), полученные в атмосфере аргона.

Значения температуры соответствующих переходов приведены в табл. 5. Из таблицы видно, что температура плавления кристаллической части органических солей заметно ниже, чем для гуанидина гидрохлорида и гидрокарбоната, и, так же как температура стеклования, сильно меняется при изменении природы соли. Очевидно, что при наличии полярных сульфо- и аминогрупп межмолекулярные взаимодействия сильнее, обусловливая тем самым более высокие значения температуры переходов. Температура начала деструкции от 140 до 250°С ограничивает последующий температурный режим ковалентного включения синтезированных солей в эпокси-аминные системы. Кроме того, из данных табл. 5 можно заключить, что для дальнейших исследований наиболее интересен гидросалицилат гуанидина, который переходит в жидкое состояние при более низких значениях температуры, при которых будет протекать химическое взаимодействие, и имеет достаточно высокую термостабильность.
Таблица 5.
Значения температуры стеклования Tg, плавления Tm, кристаллизации Tcr и деструкции Td синтези-рованных солей гуанидина
Соль гуанидина  , где НА≡ , где НА≡
|
${{T}_{m}}$, °С | ${{T}_{g}}$, °С | ${{T}_{{cr}}}$, °С | ${{T}_{d}}$, °С |
|---|---|---|---|---|
 Гидросалицилат |
149.7 | 26.3 | 59.0 | ~200 |
 Дигидросульфосалицилат |
136.0 | 72.6 | 117.7 | ~210 |
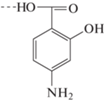 Гидро-n-аминосалицилат |
112.9 | 45.2 | – | ~140 |
 Гидрокарбонат |
198.7 | – | – | ~190 |
| ‒HCl Гидрохлорид |
178.3 | – | – | ~250 |
Синтезированные и охарактеризованные соли гуанидина были введены в эпокси-аминные смеси. Предварительное изучение растворимости этих солей в эпокси-аминных системах показало, что при введении до 10 мас. % соли гуанидина она не выпадает в осадок, как в среде эпоксидного олигомера, так и среде отвердителя. Наиболее целесообразным способом введения соли в данной работе было ее растворение в амине с последующим добавлением стехиометрического количества эпоксидного олигомера. Необходимо отметить, что при расчете стехиометрии системы следует учитывать реакцию с эпоксидной группой не только протонов гуанидина, но и функциональных групп остатка органической кислоты в соли. Возможность второго процесса была оценена методом ДСК (рис. 3).
Рис. 3.
Взаимодействие кислот сульфосалициловой (1), салициловой (2), бензойной (3) и фенола (4) с эпоксидным олигомером Epikote 828.

Оказалось, что в отсутствии катализаторов заметные химические процессы можно зафиксировать только для сульфосалициловой и, менее выраженно, для салициловой кислоты. Однако такие процессы начинают происходить при температуре 120–150°С (как это и должно быть для ароматических нуклеофилов), и они не могут повлиять на стехиометрию отверждения при более низких значениях температуры (отверждение по ТТТ-диаграммам всегда велось до 100°С).
Далее в работе оценивался экзотермический эффект от химического взаимодействия одной из солей гуанидина – гидросалицилата с эпоксидным олигомером. Для этого были зарегистрированы ДСК-термограммы при разных мольных соотношениях эпоксидной группы и реакционноспособных групп модификатора (рис. 4). Известно, что при прочих равных условиях стехиометрия системы влияет на тепловой эффект реакции, который максимален в случае эквивалентного соотношения компонентов [32]. Концентрационная зависимость теплового эффекта, рассчитанного из термограмм рис. 4, свидетельствует, что максимальное тепловыделение достигается при средней функциональности гидросалицилата равной шести (рис. 5), по-видимому, вступают пять протонов гуанидина и карбоксил салициловой кислоты, причем последний процесс, вероятно, катализируется амином гуанидина. В случае гидросульфосалицилатов и аминосалицилата, очевидно, такие эксперименты проводить нет необходимости – следует учитывать дополнительную функциональность от сульфогруппы и, безусловно, два протона от ароматического амина.
Рис. 4.
Термограмма ДСК системы Epikote 828 : гидросалицилат гуанидин с содержанием гидросалицилата в смеси с эпоксидным олигомером 17.3 (1), 14.9 (2), 13.0 (3), 11.6 мас. % (4).

Рис. 5.
Зависимость теплового эффекта реакции от содержания гидросалицилата гуанидина в эпоксидном олигомере Epikote 828.

Реальные стехиометрические соотношения для разных солей c эпоксидным олигомером и эпокси-аминной системой представлены в табл. 6. Эти значения позволили получить полностью отвержденные гомогенные прозрачные пленки для последующих испытаний.
Таблица 6.
Стехиометрия смесей солей гуанидина с диановым эпоксидным олигомером Epikote 828
| Соль гуанидина | f | М | Мэкв | Epikote 828 : соль гуанидина, мас.ч. |
|---|---|---|---|---|
 Гидросалицилат |
5 + 1 = 6 | 197 | 32.8 | 1.0 : 0.17 |
 Гидросульфосалицилат |
5 + 2 = 7 | 277 | 39.6 | 1.0 : 0.21 |
 Дигидросульфосалицилат |
5 × 2 + 2 = 12 | 336 | 28.0 | 1.0 : 0.15 |
 Гидро-n-аминосалицилат |
5 + 3 = 8 | 212 | 26.5 | 1.0 : 0.14 |
Важно, что синтезированные и охарактеризованные в настоящей работе модельные соли дают возможность не только установить участие различных реакционноспособных фрагментов гуанидиновых модификаторов разной молекулярной массы в отверждении эпоксидного олигомера, но и могут быть использованы в качестве самостоятельного модификатора, ковалентно встраивающегося в эпокси-аминную сетку.
Для полученных эпокси-аминных пленок, модифицированных разным количеством салицилатом гуанидина, была оценена биологическая активность по отношению к биопленкам тестовых микроорганизмов. В первичных испытаниях пленки показали выраженную бактериостатическую активность по отношению к эпидермальному стафилококку S. еpidermidis 21555 (MRSE).
Staphylococcus еpidermidis – основной комменсал кожи человека, однако он становится причиной инфекций, связанных с оказанием медицинской помощи. Считается, что S. еpidermidis является одной из наиболее распространенных причин внутрибольничной инфекции, при этом частота инфицирования столь же высока, как и у S. аureus. Из-за склонности к образованию биопленок S. еpidermidis, особенно метициллин-резистентные штаммы, имеет высокий эпидемический потенциал, вызывая тяжелые и сложные для лечения инфекции [33]. Эксперименты показали (рис. 6), что уже при содержании 1 мас. % гидросалицилата гуанидина в пленке значение показателя ингибирования пленкообразования ${{\gamma }}$ составляет 19.2%, а при содержании модификатора 5 мас. % – 43.2% относительно контрольного образца (без модификатора).
ЗАКЛЮЧЕНИЕ
В настоящей работе эпокси-аминные системы на основе дианового эпоксидного олигомера и олигомерного аминного отвердителя были модифицированы реакционноспособными производными мономерами на основе гуанидина. Продемонстрирована возможность ковалентного связывания модификатора с формирующейся сеткой, которое обеспечит пролонгированное бактериостатическое действие покрытия. Синтезированы соли гуанидина и органических кислот. Проведена оценка растворимости этих солей в диановом эпоксидном олигомере. Установлено, что замена гидрохлорида на органический остаток заметно снижает температуру начала реакции с эпоксидным олигомером. Также определена средняя функциональность солей гуанидина в реакции с эпоксидным олигомером и показано, что в реакцию вступает большинство групп N‒Н модификаторов. Так, в ряде случаев в химическом взаимодействии участвуют остатки органических солей. Определена стехиометрия бинарных систем гуанидин : эпоксидный олигомер, а также стехиометрия полученных аддуктов с олигомерным аминным отвердителем. Отмечено, что предложенным способом возможно вводить до 10 мас. % соли, причем наиболее целесообразным способом является растворение соли гуанидина в амине с последующим добавлением стехиометрического количества эпоксидного олигомера. Полученные пленки в первичных испытаниях продемонстрировали выраженную бактериостатическую активность по отношению к метициллин-резистентному S.еpidermidis.
Таким образом, направленная модификация гуанидинсодержащих соединений и оптимизация способов их введения в эпокси-аминные составы, а также формирования готовых покрытий позволяет получать новые материалы с выраженным антимикробным действием, не опасные для человека и животных. Такие материалы будут востребованы в учреждениях медицинского, фармацевтического и пищевого профиля.
Работа выполнена с использованием оборудования ЦКП Института физической химии и электрохимии им. А.Н. Фрумкина РАН и ЦКП РТУ МИРЭА, получившего поддержку Министерства науки и высшего образования Российской Федерации в рамках Соглашения от 01.09.2021 №075-15-2021-689.
Список литературы
De With G. Polymer Coatings: a Guide to Chemistry, Characterization, and Selected Applications. Weinheim: Wiley-VCH, 2018.
Polymer Coatings: Technologies and Applications / Eds by S.M. Rangappa, J. Parameswaranpillai, S. Siengchin. Boca Raton: CRC Press, 2020.
Jones F.N., Nichols M.E., Pappas S.P. Organic Coatings: Science and Technology. London: Wiley, 2017.
Petrie E. Epoxy Adhesive Formulations. New York: McGraw-Hill Education, 2005.
Resins for Surface Coatings / Ed. by P.K.T. Oldring. London: Wiley, 2001. V. 1.
Cao K.Y., Yu Z.X., Zhu L.J., Yin D., Chen L.G., Jiang Y., Wang J. // Surf. Coatings Technol. 2021. V. 465. P. 771.
Kopsidas S., Olowojoba G.B., Kinloch A.J., Taylor A.C. // Int. J. Adhes. Adhesiv. 2021. V. 104. P. 1.
Aguirre-Guerrero A.M., de Gutierrez R.M. // Construct. Build. Mater. 2021. V. 268. P. 1.
Yastrebinskaya A.V., Matveeva L.Yu., Edamenko A.S. // Diffus. Defect Data. B. 2020. V. 299. P. 55.
Gavrilov M., Erofeev V., Afonin V. // Alfa Build. 2021. V. 20. P. 2006.
Taioli S., Trevisanutto P.E., Vera P., Simonucci S., Abril I., Garcia-Molina R., Dapor M. // J. Phys. Chem. Lett. 2021. V. 12. P. 487.
Zhang J., Zhu B., Wang H., Zhang C., Zeng W., Zhou Q. // Frontiers Mater. 2021. V. 8. P. 730627.
Rauf M.Kh., Imtiaz-ud-Din, Badshah A. // Exp. Opin. Drug Discovery. 2013. № 8. P. 1.
Рыжкина И.С., Муртазина Л.И., Шерман Е.Д., Пантюкова М.Е., Масагутова Э.М., Павлова Т.П., Фридланд С.В., Коновалов А.И. // Докл. PАH. 2011. Т. 438. № 2. С. 207.
Menyashev M.R., Martynenko A.I., Popova N.I., Klescheva N.A., Sivov N.A. // Polymer Science B. 2016. V. 58. № 5. P. 394.
Мусаев Ю.И., Мусаева Э.Б., Киржинова И.Х. // Фунд. исследования. 2011. № 12. С. 139.
Бородина Е.А., Орлова Н.А., Гатилов Ю.В., Сальникова О.И. // Журн. орг. химии. 2015. Т. 51. С. 1778.
Воронков М.Г., Белоусова Л.И., Пожидаев Ю.Н., Власова Н.Н. // Журн. общей химии. 2003. Т. 73. С. 1311.
Воинцева И.И., Гембицкий П.А. Полигуанидины – дезинфекционные средства и полифункциональные добавки в композиционные материалы. М.: ЛКМ-Пресс, 2009.
Hashirova S.Yu., Musaev Yu.I., Mikitaev A.K., Malkanduev Yu.A., Ligidov M.H. // Polymer Science B. 2009. V. 51. № 9. P. 1723.
Сенчихин И.Н., Жаворонок Е.С., Матвеев А.В., Урюпина О.Я., Ролдугин В.И. // Коллоид. журн. 2018. Т. 80. С. 324.
Zhavoronok E.S., Sedishev I.P., Safonov A.V., Senchihin I.N. // Polymer Science A. 2019. V. 61. № 5. P. 610.
Zhavoronok E.S., Sedishev I.P., Merkulova M.S., Uryupina O.Ya., Senchihin I.N. // Polymer Science B. 2021. V. 63. № 1. P. 31.
Сенчихин И.Н., Жаворонок Е.С., Харитонова Е.В., Ролдугин В.И. // Тонкие хим. технологии. 2016. Т. 11. № 6. С. 98.
Сенчихин И.Н., Жаворонок Е.С., Матвеев А.В., Урюпина О.Я., Ролдугин В.И. // Инженерный журнал: наука и инновации. 2017. Т. 72. № 12. С. 1.
Zhavoronok E.S., Senchikhin I.N., Pchelintsev I.E., Roldughin V.I. // Polymer Science B. 2018. V. 60. № 2. P. 188.
Zhavoronok E.S., Senchikhin I.N. // J. Appl. Polym. Sci. 2020. V. 137. № 44. P. 1.
Smith A. Applied Infrared Spectroscopy: Fundamentals Techniques and Analytical Problem-Solving (Chemical Analysis: a Series of Monographs on Analytical Chemistry and Its Applications). New York; Chichester; Brisbane; Toronto: Wiley-Interscience, 1979.
Silverstein R.M., Webster F.X., Kiemle D.J. Spectrometric Identification of Organic Compounds. Rio de Janeiro: Willey, 2005.
Bellamy L. Infrakrasnye Spektry Slozhnykh Molekul (The Infra-Red Spectra of Complex Molecules). New York: Springer, 1975.
Nakanishi K., Solomon P.A. Infrared Absorption Spectroscopy. San Francisco: Holden Day, 1977.
Garcia F.G., da Silva P.M., Soares B.G., Briones J.R. // Polymer Testing. 2007. V. 26. P. 95.
Lee E., Anjum F. // StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK563240.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)



