Высокомолекулярные соединения (серия С), 2021, T. 63, № 1, стр. 33-53
СОВРЕМЕННЫЕ ПОРИСТЫЕ ПОЛИМЕРНЫЕ ИМПЛАНТАТЫ: ПОЛУЧЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ
Р. С. Ковылин a, *, Д. А. Алейник b, И. Л. Федюшкин a
a Институт металлоорганической химии им. Г.А. Разуваева Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
b Приволжский исследовательский медицинский университет
Министерства здравоохранения Российской Федерации
603005 Нижний Новгород, пл. Минина и Пожарского, 10/1, Россия
* E-mail: mulnir@yandex.ru
Поступила в редакцию 28.08.2020
После доработки 05.12.2020
Принята к публикации 19.12.2020
Аннотация
Современные потребности хирургии привели к интенсивному развитию трансплантологии, медицинского материаловедения и тканевой инженерии. Эти направления требуют применения инновационных материалов, среди которых одну из лидирующих позиций занимают пористые полимеры. Использование природных и синтетических полимеров позволяет подбирать структуру и комплекс свойств материала в зависимости от его конкретного назначения. В обзоре обобщены и систематизированы результаты последних исследований, описывающих требования, предъявляемые к структуре и свойствам синтетических (или искусственных) пористых полимерных материалов и имплантатов на их основе, достоинства и ограничения методов синтеза. Рассмотрены наиболее используемые и перспективные исходные материалы, а также обозначены возможные области применения имплантатов из таких материалов.
ВВЕДЕНИЕ
Потребность общества в современных имплантатах и продуктах тканевой инженерии постоянно возрастает в связи с увеличением оперативных вмешательств, вызванных болезнями, травмами и возрастными изменениями. Колоссальное число операций по трансплантации привело к высокому спросу на донорские органы и ткани. Использование аутотрансплантатов и аллотрансплантатов эффективно, но имеет целый ряд ограничений. Медицинское материаловедение, задачей которого является создание функциональных заменителей поврежденной ткани, находясь на стыке таких наук, как химия, биология и инженерия, предлагает альтернативу – различные имплантаты на основе металлов и сплавов, биокерамики и биостекла, а также натуральных и синтетических полимеров. Новые материалы и соединения – база для создания продуктов тканевой инженерии, основанных на применении скаффолд-технологий и клеточных культур. Увеличение числа исследований, посвященных созданию скаффолдов и тканевой инженерии, за последние 20 лет имеет экспоненциальный характер (рис. 1).
Рис. 1.
Количество публикаций, найденных в базе Scopus (https://www.scopus.com/) по ключевым словам “{scaffold}” (1), “{tissue engineering}” (2) и “{3D-printing}” (3), в зависимости от года опубликования за период с 2000 по 2019 год.

Разработка и практическое применение медицинских имплантатов произвели революцию в области здравоохранения. Ортопедические, зубные, сосудистые имплантаты, сердечные клапаны и стенты позволяют значительно повысить продолжительность и качество жизни. На сегодняшний день крайне остро стоит проблема создания современных функциональных имплантатов. Восстановление костных дефектов крупного или критического размера, вызванных травмами, остеопорозом, хирургическим вмешательством при инфицировании кости или при резекции опухоли кости, является сложной задачей [1, 2]. Ежегодная мировая потребность в имплантатах для устранения костных дефектов составляет более миллиона единиц, а для лечения сердечно-сосудистых заболеваний – порядка пятисот тысяч единиц.
Ключевой элемент тканевой инженерии – пористый материал “скаффолд”, действует как искусственный внеклеточный матрикс (ЕСМ) и обеспечивает миграцию, дифференцировку и размножение клеток. Контроль пористости, архитектуры и биомиметических свойств инженерных каркасов имеет решающее значение для обеспечения подходящей биологической функции в дополнение к механической целостности и массопереносу (диффузия и проницаемость).
В последние годы среди материалов для создания персонифицированных имплантатов лидирующие позиции занимают природные и синтетические полимеры (рис. 2). Прежде всего это пористые биосовместимые полимерные материалы, свойства и продолжительность функционирования которых могут варьироваться и подбираться под конкретную задачу [3].
Рис. 2.
Количество публикаций, найденных в базе Scopus (https://www.scopus.com/) по ключевым словам “(scaffold *polymer*)” (1), “(scaffold *metal*)” (2) и “(scaffold *ceram*)” (3), в зависимости от года опубликования за период с 2000 по 2019 год.
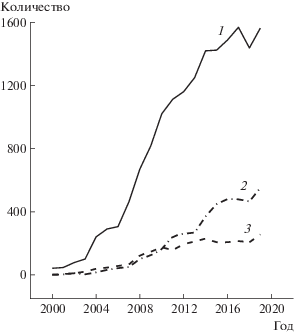
Использование полимеров позволяет в широком диапазоне трансформировать физико-механические характеристики, структуру и свойства формируемого материала. Изменение природы синтезируемого (со)полимера открывает возможность создания новых биосовместимых, нецитотоксичных материалов с необходимыми физико-механическими характеристиками для получения современных функциональных персонифицированных имплантатов. Применение полимерных материалов с системой открытых связанных пор заданного размера дает возможность либо воспроизводить необходимую структуру ткани, либо формировать каркас (скаффолд) для дальнейшего создания ткани или органа. Одним из достоинств полимерных материалов является сниженная иммуногенность по сравнению, например, с широко распространенными ксеногенными материалами. Другое несомненное преимущество полимерных материалов состоит в допустимости функционализации различными лекарственными препаратами и факторами роста, что расширяет возможности и увеличивает эффективность их применения. Классические методы создания скаффолдов для тканевой инженерии включают литье из растворителя/вымывание частиц, вспенивание газом, электроспиннинг, криогелирование, сублимационную сушку, термоиндуцированное разделение фаз. Каждый из этих методов имеет свои достоинства и ограничения. Растущая потребность в персонифицированных имплантатах диктует необходимость использования новых эффективных подходов, особенно в рамках аддитивных технологий, также называемых “3D-печатью”. Активный рост количества работ по 3D-печати наблюдается лишь последние лет шесть (см. рис. 1, кривая 3), что в значительной степени связано с техническим развитием и совершенствованием персональных компьютеров, а также с окончанием сроков действия патентов на методы 3D-печати, полученных в 80-е годы XX века. Однако создание в лабораторных условиях эффективных пористых полимерных имплантатов и их успешное внедрение в клинику до сих пор является глобальной проблемой.
Ранее авторы работы [4] рассматривали полимеры в ортопедической хирургии и тканевой инженерии, сделав акцент на биофункционализации поверхности. Основная цель данного обзора – обобщить и систематизировать наиболее значимые публикации по методам синтеза пористых полимерных материалов и имплантатов, выделить преимущества и недостатки конкретного метода в зависимости от назначения конечного изделия, очертить круг наиболее используемых и перспективных исходных материалов (полимеров и полимеризующихся систем) для получения пористых полимерных каркасов, обозначить требования к пористым полимерным имплантатам в зависимости от их назначения, а также рассмотреть перспективные направления применения таких имплантатов.
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ИМПЛАНТАТАМ
Физико-механические характеристики
Физико-механические характеристики имплантатов можно оценить путем измерения ряда физических параметров, таких как модуль упругости или модуль Юнга, объемный модуль и модуль сдвига [5, 6]. В подавляющем большинстве исследований для оценки физико-механических характеристик пористых полимерных биоматериалов применяют модуль Юнга. Для различных тканей этот параметр варьируется в очень широком интервале и составляет менее 1 кПа для мозга, ~1 МПа для хряща, ~10 кПа для мышцы, 100 кПа для кальцифицированной кости и 2–4 ГПа для кости [7, 8]. Обнаружено, что после культивирования в полиакриламидных гелях различной жесткости (0.1–1.0, 8–17 и 25–40 кПа) человеческие мезенхимальные стволовые клетки (hMSC) способны к дифференцировке в нервные, мышечные или костные клетки соответственно [9]. Следовательно, упругие свойства биоматериала, используемого для получения имплантата, оказывают огромное влияние на дальнейшую судьбу инкапсулированных в гель стволовых клеток, что позволяет управлять их дифференцировкой. Зависимость миграции, пролиферации, процессов дифференцировки клеток от физико-механических характеристик имплантата изучает новая область науки – механобиология [10, 11].
Пористость, размер и хаотичность распределения пор
Важнейшими характеристиками материала для имплантата являются его пористость и структура пор. Пористость имплантата имеет первостепенное значение, поскольку она оказывает влияние на образование и рост сосудистой сети, а также на диффузию биологических веществ. Важно, чтобы поры были открытыми и взаимосвязанными. В материалах, не обладающих оптимальной пористостью, происходит подавление необходимых процессов адгезии, пролиферации, дифференцировки и миграции клеток. Пористость определяется как отношение общего объема полостей (пор) к общему объему имплантата и находится в тесной взаимосвязи с физико-механическими характеристиками имплантата [12]. Теоретическое обоснование экспериментальных данных по влиянию пористости полимеров (полимеров на основе эмульсий и вспененных полимеров) на модуль упругости приведено в недавней работе [13].
Пористая структура имплантата для остеопластики считается оптимальной, если в ней имеются поры с размером от 5 до 200–400 мкм [14, 15]. В методах стереолитографии и селективного лазерного спекания каждый элемент пористой структуры “рисуется” лазерным лучом, причем минимальный диаметр пятна луча составляет 40 мкм. Поэтому создание такими методами полимерных материалов с размером пор от 5 мкм затруднительно. Метод нанолитографии позволяет изготавливать скаффолды с минимальным размером элемента структуры скаффолда ~100 нм, однако из-за низкой скорости “печати”, метод используется для создания 3D-объектов размером 102–103 мкм [16, 17].
Микроструктура поверхности полимера
Микроструктура поверхности полимера оказывает значительное влияние на адгезию и пролиферацию клеток [18]. Последние достижения в области микро- и нанотехнологий позволили совершить прорыв в изучении влияния микроструктуры материала на поведение клеток. Было показано, что клетки способны “чувствовать” рельеф до нескольких нанометров [19], а также обволакивать субмикронные структуры [20]. Так, наноструктурированная поверхность полиметилметакрилата проявляет повышенную адгезию к клеткам по сравнению с неструктурированной поверхностью [21].
Биофункционализация полимера
Далеко не все полимерные материалы могут быть сразу пригодны для создания имплантатов. Например, биосовместимые полиэтиленгликоль диакрилат и полиметилметакрилат являются биоинертными и требуют предварительной подготовки. При создании пористых имплантатов особое значение имеет возможность функционализации материала биологическими веществами, такими как ламинин, фибронектин, витронектин, RGD-пептиды или факторы роста. Данная функционализация может быть реализована за счет нековалентного взаимодействия (например, водородных связей, ионных или гидрофобных взаимодействий) или с помощью ковалентного (химического) связывания. Нековалентное взаимодействие часто осуществляют путем пропитки полученного пористого полимерного имплантата раствором функционализирующего вещества с последующей сушкой [22]. Если необходимо длительное выделение биологического вещества (допустим, антибиотик, VEGF) в организме, то для обработки могут быть использованы его растворы в биоразлагаемых материалах, например в поли-ε-капролактоне [23] или желатине [24]. Химическое связывание функционализирующих соединений, как правило, менее эффективно, поскольку в большинстве случаев приводит к частичной потере активности прививаемого соединения. С этой точки зрения применение пористых полимерных материалов для создания функциональных имплантатов представляется наиболее перспективным, так как полимеры позволяют реализовать множество подходов не только к поверхностной, но и к объемной химической модификации.
Для обеспечения лучшего взаимодействия полимерных материалов с клетками используют три варианта модификации поверхности полимера: первый, изменение его морфологии, т.е. создание шероховатостей и пористых покрытий для усиления прорастания тканей; второй, нековалентную адсорбцию биологически активных веществ или лекарств на поверхности пор полимерного материала [25, 26]; и третий, химическую модификацию, т.е. обработку плазмой или тлеющим разрядом, прививку биологически активных веществ, макромолекул или функциональных групп клеточной адгезии [27–29].
Биосовместимость и биоразлагаемость
Важнейшим и необходимым свойством материалов для биомедицинских приложений является биосовместимость, т.е. способность материалов при введении в организм не вызывать отрицательных реакций [30, 31]. Биосовместимость, согласно стандартам ГОСТ Р ИСО 10993-2-2009, подразумевает отсутствие местной воспалительной реакции, токсического и аллергического воздействия, онкогенности, иммуногенности при одновременном сохранении функциональных характеристик имплантата в течение заданного времени.
Природа натуральных и синтетических полимеров играет решающую роль в обеспечении биосовместимости, поскольку она определяет их воздействие на иммунную систему хозяина. Для методов биопечати или электроспиннинга часто используют природные биополимеры, например мелкодисперсные взвеси аллогенных тканей, полученных с помощью технологий “децеллюляризации” [32]. Изготовленные таким образом имплантаты состоят только из компонентов внеклеточного матрикса. Однако точность воспроизведения геометрии имплантатов, выполненных с помощью таких технологий, все еще не может достичь точности методов аддитивных технологий, основанных на инициировании излучением УФ, видимого или ближнего ИК-диапазона. Последние, в свою очередь, имеют ограничения из-за токсичности исходных материалов, поскольку большинство необходимых светочувствительных материалов не предназначены для биологических применений [33].
Требования к полимерам и изделиям из них могут отличаться в зависимости от их назначения. Так для изделий, функционирующих в условиях контакта с кровью, – эндопротезов сосудов, клапанов сердца и целого сердца важнейшее значение имеет гемосовместимость, т.е. свойство материала не вызывать изменений функций крови, трансформации ее компонентов, образования тромба. Для таких изделий должно быть минимизировано взаимодействие полимера с биологической средой. Напротив, в случае ортопедического применения требуется активное взаимодействие и срастание имплантата с тканью [34].
В некоторых случаях имплантат должен быть не только биосовместимым, но и биоразлагаемым. Биоразлагаемость – это способность материала к распаду в рамках определенной биологической системы, при котором продукты распада не являются токсичными для данной системы (организма). Образующиеся продукты распада в организме должны включаться в метаболические и биохимические процессы или поглощаться макрофагами. В последующем структуры такого имплантата могут заменяться тканями организма.
В целом каждый материал для медицинского применения должен соответствовать определенным биологическим характеристикам и его необходимо исследовать перед началом клинических испытаний согласно стандартам ГОСТ Р ИСО 10993.5-99. Основными параметрами, по которым оценивается каждый материал, являются цитотоксичность, хроническая токсичность, иммуногенность, онкогенность, безопасность и эффективность при применении для конкретной задачи.
ПОЛУЧЕНИЕ ПОРИСТЫХ ПОЛИМЕРНЫХ ИМПЛАНТАТОВ
Существует две основные группы методов получения пористых полимерных имплантатов – классические и основанные на аддитивных технологиях. Классические методы отличаются простотой исполнения и довольно распространены. Однако они не позволяют получать персонифицированные имплантаты, обладающие комплексом требуемых свойств и структурных характеристик. Этих ограничений можно избежать с помощью второй группы методов – аддитивных технологий, которые активно развиваются в последние годы. Аддитивные технологии дают возможность иметь имплантаты с высоким разрешением, а также использовать одновременно несколько биоматериалов.
Классические методы
К классическим методам принято относить литье из растворителя/вымывание частиц, вспенивание газом, электроспиннинг, криогелирование, сублимационную сушку, термоиндуцированное разделение фаз. Получение пористых полимерных имплантатов такими методами оптимально в случаях, когда дефект имеет небольшой размер и нет необходимости точного воспроизведения геометрии утраченного участка ткани. Ввиду своего назначения такие имплантаты, как правило, являются биорезорбируемыми.
Литье из растворителя/вымывание частиц (Solvent сasting/Particulate leaching – SCPL). Литье из растворителя/вымывание частиц можно назвать одним из первых методов получения пористых скаффолдов, отличающимся простотой исполнения. Оно широко применяется для получения скаффолдов с пористой структурой. В рамках данного метода раствор полимера, содержащий порообразующие компоненты, помещается в форму, где из него испаряется растворитель и образуется твердый полимерный блок. Далее порообразующие компоненты удаляются из блока путем многократного промывания водой или другим растворителем, что приводит к созданию системы пор в материале. Вместо раствора полимера возможно использование раствора мономера, который полимеризуется после заливки композиции в форму. В большинстве случаев включение порообразующих компонентов существенно не изменяет процесс инициирования, и получаемые скаффолды гомогенно сшиты. Порообразующими компонентами служат, например, соли [35, 36], полиэтиленгликоль [37] и сахар [38]. К существенным недостаткам метода относится отсутствие точного контроля над формой и размером пор скаффолда, распределением пор по размерам, а также сложность получения однородной связанности между порами. Кроме того, присутствие растворителей, зачастую токсичных, не позволяет сразу загружать клетки и биологические вещества. Удаление растворителя и создание формы для заливки увеличивают затраты времени и материалов. К достоинствам метода SCPL относят большой диапазон размеров пор, независимый контроль пористости и размера пор, возможность получать скаффолды с требуемой пористостью, которая в случае скаффолдов для остеопластики должна быть не ниже 65%. Сообщается о модифицированном методе SCPL, который позволяет получать пористые полимерные скаффолды из поли-ε-капролактона (PCL) с пористостью 91% и размером пор ~400 мкм [39]. На модели in vitro с использованием предшественников остеобластов свода черепа мыши показан потенциал применения этих конструкций в инженерии костной ткани. Прочные композитные пористые скаффолды из гранулированных фосфата кальция и полилактида (PLA) изготовлены с помощью модифицированного метода вымывания частиц соли [40]. Так, к смеси предварительно спрессованных гранул фосфата кальция, полилактида и сульфата натрия прикладывали давление 2.5 ГПа и далее из нее вымывали соль. Сформированные образцы с пористостью 50% показали сочетание прочности на сжатие (4–6 МПа) и проницаемости, характерное для губчатой кости. Методом SCPL из сополимера гликолида и ε-капролактона (PGCL) был получен эластичный биоразлагаемый имплантат с размером пор 250 мкм [41]. Гистологический и иммуногистохимический анализы показали, что посеянные на скаффолды гладкомышечные клетки крыс образуют ткани гладких мышц. Пористые имплантаты из поли (3-гидроксибутирата) с порошком биоактивного стекла, изготовленные методом SCPL в присутствии частиц сахара, имели взаимосвязанную пористость 85% и обнаружили хорошую адсорбцию и пролиферацию клеток остеобластов [42]. Кроме того, образцы продемонстрировали бактерицидные, биоактивные, электропроводящие и антиоксидантные свойства.
Вспенивание газом (Gas foaming). Метод вспенивания газом основан на зарождении и росте пузырьков газа, диспергированных в полимере, для создания пористой структуры. Метод позволяет получать высокопористые скаффолды, гибко регулировать пористость, а также вводить биоактивные вещества и лекарства. Возможно вспенивание за счет химической реакции или обработки полимера сверхкритическим CO2. Для проведения химической реакции используют пенообразователь – вещество, которое добавляется в исходную смесь и выделяет газ при химическом разложении. Наиболее часто пенообразователем служат бикарбонаты натрия или аммония. Благодаря доступности вспенивающих агентов и простоте исполнения метод получил распространение. Важно, что вспенивающие агенты обычно безопасны для клеток, нет необходимости применения органических растворителей, что делает метод актуальным для тканевой инженерии.
В другом варианте вспенивание проводят сверхкритическим CO2. Ячейку высокого давления заполняют полимером, который расплавляют и насыщают сверхкритическим CO2 в условиях высокого давления. Затем быстро снижают давление до атмосферного, что приводит к вскипанию расплава с выделением СО2 и образованию пористой полимерной структуры. Параметры процесса – давление, температура и время насыщения полимера газом, существенно влияют на микроструктуру, механические свойства и биологическую активность изготовленных полимерных пористых материалов [43]. Обработка полимеров сверхкритическим CO2 является привлекательным подходом для получения пористых имплантатов, поскольку данный газ инертен, нетоксичен и недорог. Изменение давления позволяет создавать объекты с градиентной пористостью. Сверхкритический CO2 широко используется в качестве вспенивающего агента для создания пористости в PLA, PCL и сополимере поли(лактид-со-гликолид) (PLGA).
Обработкой PLA сверхкритическим CO2 получены высокопрочные скаффолды с открытой ячеистой структурой пор с размером от 60 до 140 мкм [44]. Эксперименты показали, что такие материалы поддерживают адгезию, пролиферацию и дифференцировку клеток эмбриональных фибробластов мыши. Пористые полимерные скаффолды на основе PCL с добавками восстановленного оксида графена, изготовленные методом вспенивания в сверхкритическом CO2, имеют перспективы применения в качестве костных имплантатов [45].
Электроспиннинг (Electrospinning). Это простой и универсальный метод создания пористых имплантатов из полимерных волокон. Установка для электроспиннинга обычно состоит из трех компонентов: источника высокого напряжения, заземленного металлического коллектора и емкости для раствора с фильерой. В процессе электроспиннинга между концом фильеры и коллектором прикладывается сильное электрическое поле, а заряженный раствор полимера выталкивается из фильеры и подвергается расщеплению из-за нестабильности потока жидкости. В результате образуются непрерывные ультратонкие волокна, которые осаждаются в виде нетканого материала на коллекторе. Структура, состав, морфология, диаметр и степень переплетения волокон в материале зависят от концентрации раствора полимера, его вязкости, наличия добавок, приложенного напряжения, расстояния между коллектором и фильерой, а также от ее диаметра. Среди достоинств электроспиннинга выделяют относительную легкость реализации процесса, высокие значения пористости и отношения площади поверхности к объему. Из сверхтонких волокон методом электроспиннинга можно получить листы, трубки или более сложные структуры с одинаковой толщиной, пористостью, большой площадью поверхности, градиентом механических свойств и высоким соотношением площади поверхности к объему, что важно для тканевой инженерии. Бифуркационные сосудистые имплантаты с переменным диаметром изготовлены методом электроспиннинга из PCL [46]. Сосудистый имплантат малого диаметра (1 мм) с толщиной стенки 250 мкм и размером пор 420 нм получен методом электроспиннинга биорезорбируемого материала из поли(эфир мочевины) [47]. Применение таких имплантатов в экспериментах на мышах продемонстрировало их долгосрочную проходимость и обширное ремоделирование тканей. Методом in situ электроспиннинга изготовлена персонифицированная нановолоконная повязка на основе PCL с наночастицами серебра [48]. Материал обеспечивал непрерывное высвобождение ионов серебра и показал антимикробную активность широкого спектра против двух распространенных типов патогенов – Staphylococcus aureus и Escherichia coli. В ходе экспериментов in vivo установлено, что такие антибактериальные повязки могут уменьшать воспалительную реакцию и ускорять заживление ран у крыс.
Криогелирование (Cryogelation). Криотропное гелеобразование заключается в получении пористых структур путем охлаждения раствора вещества-предшественника (мономера или способного к сшивке полимера) в воде или другом растворителе до температуры ниже точки замерзания для создания условий фазового разделения системы. При понижении температуры растворитель кристаллизуется, а в незамерзшей жидкой микрофазе – концентрированном растворе вещества-предшественника, проводят сшивание. Далее за счет нагревания расплавляют кристаллы воды, находящейся в объеме сшитого полимера, в результате чего формируется пористая структура. Продолжительность стадии сшивания оказывает прямое влияние на морфологию каркаса: чем больше время сшивания, тем выше пористость и тоньше толщина стенки, разделяющей поры [49]. Метод позволяет изменять пористость, варьируя соотношение растворителя и раствора предшественника сшитого полимера. Пористость и механические свойства криогеля также могут быть изменены путем добавления композитных наполнителей, волокон и других полимеров [50]. Мягкие условия получения и доступность различных биосовместимых полимеров, сделали метод криогелирования популярным. Метод позволяет использовать композиции, загруженные биологическими объектами, например факторами роста [51, 52]. К недостаткам метода относят отсутствие возможности точного контроля распределения пор по размерам и геометрии формируемого имплантата. Гибридный пористый имплантат для тканевой инженерии на основе ковалентно связанных PCL и желатина, функционализированного метакриламидом, был получен комбинированием методов 3D-печати и криогелирования [52]. Продемонстрирована хорошая колонизация предшественников остеобластов и прикрепление жизнеспособных клеток к криогелевой части имплантата.
Сублимационная сушка (Freeze drying). В методе сублимационной сушки раствор полимера выливают в форму требуемой геометрии и выдерживают при низкой температуре для затвердевания раствора. Затем замороженный раствор полимера сушат в вакууме, что приводит к сублимации растворителя и образованию на его месте пустот. Размер пор и пористость зависят от температуры процесса, скорости замораживания и высыхания раствора полимера [53]. Метод сублимационной сушки не требует стадии промывания и позволяет получать структуру однородных упорядоченных пор, однако процедура занимает достаточно много времени. Из смеси зеина, хитозана и гидроксиапатита (HA) данным методом получены скаффолды с размером пор 50–220 мкм и пористостью 55–64%, перспективные для регенерации костной ткани [54]. Методом сублимационной сушки был изготовлен композитный имплантат на основе коллагена и гидроксиаппатита, имитирующий градиентную поровую структуру костной ткани [55]. Благодаря бесшовно связанной структуре слоев, большой величине пористости, однородной структуре пор и высокой степени их взаимосвязанности имплантат обеспечивал оптимальные условия для адгезии и пролиферации клеток. Показано, что материал обладает хорошей биосовместимостью и остеокондуктивностью, что способствует секреции внеклеточного матрикса и образованию костной ткани.
Термоиндуцированное разделение фаз (Thermally induced phase separation). В данном методе для создания в растворе полимера двух различных фаз (с низкой и высокой концентрацией полимера) используется изменение температуры [56]. Полимер растворяют при нагревании, а затем раствор охлаждают. При этом возможно два варианта образования фаз: жидкость–жидкость и жидкость–твердое тело. В первом случае раствор полимера охлаждается до температуры ниже точки замерзания растворителя. Возникающая термодинамическая нестабильность приводит к разделению фаз. При возникновении твердой и жидкой фазы расслоение происходит за счет затвердевания растворителя. В обоих случаях после индуцирования расслоения растворитель удаляется экстракцией, испарением или сублимационной сушкой. Таким образом формируется пористая структура. Для улучшения адгезии клеток на имплантатах используют добавки HA [57]. Введение гидроксиаппатита в имплантаты на основе PLA, полученные методом термоиндуцированного разделения фаз, позволило в 2 раза увеличить модуль сжатия [58]. Методом термоиндуцированного разделения фаз изготовлен эластичный имплантат из PLA с макропорами размером более 300 мкм, в который далее был введен хитозан [59]. Использование такого имплантата на модели дефекта кости черепа крысы критического размера значительно улучшило регенерацию кости.
Аддитивные технологии
Дефекты крупного или критического размера трудно полностью восстановить в клинической практике. Аддитивные технологии привлекают большое внимание как альтернатива классическим методам вследствие возможности создания персонифицированных имплантатов с заданными характеристиками. Использование аддитивных технологий при создании пористых полимерных имплантатов позволяет получить трехмерный объект с направленным распределением в его структуре биоматериала, клеток, факторов роста, лекарств и других компонентов, необходимых для восстановления живых тканей. Аддитивные технологии могут быть реализованы в двух вариантах. Первый – биопечать, когда в одну стадию происходит “печать” трехмерного объекта заданной геометрии, содержащего необходимые клетки и биологические компоненты. Второй вариант является многостадийным, состоящим из изготовления бесклеточной трехмерной структуры с последующей ее функционализацией сигнальными молекулами и заселением биологическими объектами [60].
Процесс создания персонифицированного трехмерного пористого полимерного имплантата всегда начинается со сбора данных магнитно-резонансной томографии или компьютерной томографии пораженной ткани или органа. Полученные данные дают информацию о макроструктуре тканей и органов и используются для построения математической модели формируемого имплантата. Собственно, “печать” персонифицированного имплантата по математической модели может быть проведена в рамках нескольких технологий, разработанных в последние десятилетия и получивших широкое распространение. Примером таких технологий являются: трехмерное связывание порошка, селективное лазерное спекание, стереолитография, проекторная стереолитография, моделирование методом послойного наплавления, экструзионная биопечать и струйная печать. Схематично принцип каждого из указанных методов показан на рис. 3. Необходимо отметить, что каждый метод аддитивных технологий имеет свои преимущества и недостатки, касающиеся выбора полимеров, разрешения печати, возможности инкапсуляции биологических объектов, стоимости и необходимости последующей обработки. Влияние аддитивных технологий на окружающую среду исследовано в недавней работе [61]. Далее будут рассмотрены методы аддитивных технологий применительно к получению пористых полимерных имплантатов, а также несколько последних обзоров, касающихся их в целом [62–64].
Рис. 3.
Принцип получения трехмерных пористых материалов методами стереолитографии (а), селективного лазерного спекания (б), проекторной стереолитографии (в), моделирования методом послойного наплавления (г), трехмерного связывания порошка (д), струйной печати (е) и экструзионной биопечати (ж).
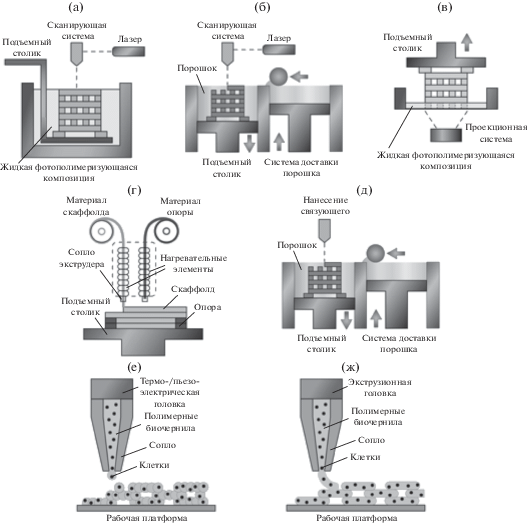
Трехмерное связывание порошка/нанесение связующего (3D-Powder binding/Binder jetting – 3DP). Технология нанесения связующего, имеющая большой потенциал применения в тканевой инженерии, была предложена в 1995 году для изготовления трехмерных объектов на основе порошка оксида алюминия [65]. В настоящее время метод нанесения связующего активно используется для получения изделий из керамики, металлов, полимеров и композитных материалов. Изготовление трехмерного объекта из порошка проводят послойно за счет склеивания частиц с помощью связующего, которое подается из сопла, перемещаемого в плоскости. При прямом нанесении связующего исходный порошок для получения пористого полимерного имплантата требуемой геометрии может представлять собой полигликолевую кислоту (PGA), полимолочную кислоту, поли-ε-капролактон или полиэтиленоксид (PEO), а связующим обычно выступает подходящий растворитель. Преимуществом данного метода является точный контроль микро- и макроархитектуры формируемого имплантата. Введение порообразующего агента в порошок позволяет достигать высокой степени взаимосвязанности пор, а также однородной пористости и необходимого размера пор после удаления порообразователя. Вместе с тем, необходимость применения в качестве порообразующих агентов органических растворителей, способных растворять компоненты печатающих головок промышленных 3D-принтеров, а также низкое разрешение, обусловленное растеканием нанесенного на порошок связующего, накладывают существенные ограничения на практическое применение метода.
Применение печатного порошка из смеси сополимера молочной и гликолевой кислоты с частицами сахарозы, позволило авторам работы [66] избежать указанных выше ограничений. После печати жидким связующим частицы полимера были соединены в трехмерный объект и зафиксированы парами растворителя. Затем из объекта удалялась сахароза и полученный каркас помещался в пластификатор (метанол), не являющийся растворителем, для перегруппировки и эффективной упаковки полимерных цепей. Здесь представляет интерес альтернативная технология – непрямое нанесение связующего, в которой на первом этапе печатается позитивная реплика заданной формы, а далее раствор полимера заливается в полость печатной формы. На следующем этапе проводят удаление реплики. С помощью технологии непрямого нанесения связующего были успешно получены персонифицированные имплантаты, имитирующие человеческий мыщелок нижней челюсти [67]. Материалом для трехмерной печати реплики служил порошок желатина, в роли полимера выступали PCL и хитозан. Была продемонстрирована возможность модификации полученных имплантатов биоактивным апатитовым покрытием, которое активировало распространение и пролиферацию стромальных клеток костного мозга. Тем не менее из-за сложности удаления материала реплики из внутренних пор имплантата такой подход не позволяет представлять объекты со сложной внутренней архитектурой.
Селективное лазерное спекание (Selective laser sintering – SLS). Метод похож на метод 3DP, однако вместо склеивания частиц связующим в SLS, реализуется их спекание под воздействием лазерного излучения [68]. Для сплавления зерен применяется лазерное излучение высокой интенсивности, а источник излучения позиционируется с помощью компьютера согласно заданной модели. После обработки одного слоя платформа с имплантатом опускается, сверху наносится следующий слой порошка, и снова происходит процесс сплавления. Получение пористых полимерных имплантатов методом SLS ограничено использованием порошков термопластов, например PCL [69] или полиэфирэфиркетона. Как и в методе 3DP, механические свойства, шероховатость и пористость можно регулировать за счет размера зерен порошка [70]. Точность воспроизведения и механическая прочность имплантата зависят от мощности лазера, размера частиц и температуры печати [71]. Основные преимущества SLS – высокая точность воспроизведения, отсутствие потенциально токсичных добавок (например, фотоинициаторов) и более высокая механическая прочность изделия по сравнению с другими методами аддитивных технологий. Кроме того, методом SLS возможно получение трехмерных объектов с градиентами жесткости и пористости [35]. Это предопределяет широкое использование SLS в инженерии костной ткани [69, 72–74]. Серьезным недостатком SLS является высокая локальная температура при спекании, которая может разрушить инкапсулированные в полимер клетки, белки и другие биоактивные компоненты. Данный недостаток можно исключить при добавлении частиц углерода для поглощения ИК-излучения, применяемого для спекания [75]. К другим факторам, сдерживающим развитие и внедрение технологии SLS, следует отнести сложность технологии производства и высокую стоимость.
Стереолитография (Stereolithography – SLА). Концепция стереолитографического синтеза трехмерных объектов предложена в начале 80-х годов ХХ века Н. Kodama, а в 1986 году C.W. Hull получил патент на послойный литографический синтез [76, 77]. Процесс заключается в послойном формировании трехмерного полимерного объекта произвольной формы из фотополимеризующейся композиции. Для этого создается математическая модель объекта, разделенного на слои заданной толщины. На следующем этапе в емкость, заполненную композицией, помещается платформа, над которой остается слой композиции, соответствующий толщине первого слоя математической модели. Затем изображение первого слоя сканируется лучом лазера по поверхности слоя фотополимеризующейся композиции, в результате чего происходит отверждение облученных участков слоя композиции на всю толщину слоя. Далее платформа опускается в композицию на толщину второго слоя и облучается сканирующим лучом в соответствии с профилем второго слоя модели и так далее. При нанесении нового слоя фотополимеризующейся композиции важную роль играет ее вязкость. В большинстве случаев для уменьшения вязкости требуется введение инертных добавок или растворителей. Время создания одного слоя зависит от скорости сканирования лучом и от размера печатаемой области. В классическом варианте технологии SLA полимеризацию инициируют излучением УФ-лазера. Альтернативой может служить инициирование видимым светом [78, 79]. Замена ультрафиолета видимым светом позволяет осуществлять полимеризацию на бόльшей толщине [80] и избежать разрушения компонентов композиции [81]. Кроме того, использование видимого света дает возможность исключить повреждение инкапсулированных клеток УФ-излучением. Поиск менее цитотоксичных фотоинициаторов в сочетании с более биосовместимыми материалами для SLA остается актуальным [82, 83]. Механические свойства получаемых имплантатов можно регулировать, изменяя степень полимеризации за счет дозы облучения или концентрации фотоинициатора либо варьируя природу исходного светочувствительного материала (мономера, олигомера или полимера). Вертикальное разрешение (толщина слоя) зависит от дозы облучения, а также от глубины проникновения света, которой можно управлять путем добавления в светочувствительный материал различного рода поглотителей инициирующего излучения. Метод SLA обеспечивает самое высокое разрешение (10–50 мкм по z-координате) среди всех методов аддитивных технологий. Для создания малых объектов с разрешением на уровне одного микрона необходимо использовать нанолитографию [84]. Практическое применение SLA ограничено светочувствительными материалами, а также тем, что растворители и фотоинициаторы могут вносить цитотоксические остатки. Тем не менее технология является хорошо отработанной и весьма популярной благодаря высокой производительности метода и относительно низкой стоимости производства.
Проекторная стереолитография (Digital light processing – DLP) похожа на SLA тем, что для получения трехмерного имплантата оба метода используют свет для послойного селективного отверждения фотополимеризующейся композиции. Однако здесь происходит экспонирование излучением, проходящим через компьютерную маску (используется проекционный аппарат) сразу всего слоя композиции, а не сканированием лазерного луча, как в SLA. Информация о каждом слое формируемого объекта представлена в виде набора цифровых черно-белых изображений, которые проецируются с помощью цифрового микрозеркального устройства (DMD) [85]. Это позволяет достигнуть разрешения в горизонтальной плоскости ~50 мкм в зависимости от проекционной системы и количества пикселей DMD, а разрешение по вертикали до 25 мкм. Источниками света могут служить как классические лампы, так и светоизлучающие диоды (LED), что позволяет перекрывать диапазон длины волн от УФ до видимого. Основным преимуществом DLP (наряду с удешевлением установки) является высокая скорость получения имплантата (за каждое экспонирование формируется новый слой).
С использованием видимого света методом DLP из композиции поли-ε-капролактон диакрилат–полиэтиленгликоль диакрилат с добавлением хитозана синтезированы пористые полимерные скаффолды [86]. Культивирование клеток in vitro показало способность хитозана регулировать гидрофобные свойства и тем самым улучшать адгезию и дифференциацию клеток. В недавнем исследовании методом DLP из композиций на основе серии различных полиуретанакрилатов были напечатаны с высоким разрешением пористые персонифицированные скаффолды с регулируемыми механическими свойствами и способностью к разложению [87]. Авторам удалось подобрать состав композиции, отверждение которой позволяет получать имплантат со свойствами, аналогичными свойствам хряща. Методом DLP на основе метакрилированного полилактида синтезированы пористые трехмерных скаффолды со средним размером пор 600 мкм и пористостью 70% [88]. Образец имел максимальную прочность на сжатие 2.2 Мпа и показал отсутствие цитотоксичности и биосовместимость по результатам исследования методом MTT (колориметрический тест для оценки метаболической активности клеток).
Моделирование методом послойного наплавления (Fused deposition modeling – FDM). Метод послойного наплавления, запатентованный в 1992 году S.S. Crump [89], можно назвать одной из первых аддитивных технологий. Для создания трехмерных объектов используется термопластичная полимерная нить, которая расплавляется, выдавливается через нагретое сопло и осаждается согласно заданной компьютерной модели на рабочую платформу. Сопло, камера и рабочая платформа могут нагреваться независимо друг от друга. Метод позволяет сформировать трехмерную структуру произвольной формы без выступов. Объекты с выступами получают с помощью опорных структур, которые затем удаляют. Разрешение FDM составляет ~100 мкм и зависит от диаметра сопла, которое подбирается, исходя из реологических свойств используемой нити. На характеристики формируемого трехмерного объекта влияет не только диаметр сопла, но и скорость экструзии [90]. Направление и угол осаждения, толщина слоя и технология подготовки нити существенно влияют на механические свойства формируемой трехмерной структуры [91]. Объединение различных исходных материалов в одну структуру может быть осуществлено посредством систем с несколькими соплами. Для изделий медицинского назначения в качестве термопласта в FDM чаще всего используются биоразлагаемые полимеры – PCL [91] и PLGA, а также неразлагаемые полимеры, например ударопрочный полистирол [92]. В недавней работе [93] на основе выделяемых из биомассы материалов (5-гидроксиметилфурфурол и этиленгликоль), синтезирован полиэтилен-2,5-фурандикарбоксилат. Показаны преимущества применения этого полимера при печати методом FDM – оптимальная адгезия, термопластичность, отсутствие расслоения и низкая термоусадка. К недостаткам метода FDM следует отнести низкую шероховатость поверхности формируемого объекта и необходимость нагревания для плавления полимера, что может разрушить внесенные биоактивные материалы. Для получения методом FDM пористых полимерных имплантатов, инкапсулированных биоактивными молекулами, используют два подхода – либо покрывают объект биоактивным материалом, либо снижают до приемлемых значений температуру обработки и (или) давление экструзии. Однако метод FDM широко распространен для получения трехмерных скаффолдов, поскольку на рынке представлен богатый выбор относительно недорогих 3D-принтеров такого типа.
Экструзионная биопечать (Extrusion bioprinting). Метод экструзионной биопечати аналогичен FDM, однако, заключается в осаждении не готового полимера, а текучей матрицы (биочернила), содержащей необходимые биомолекулы и клетки, которая далее подвергается отверждению под действием температуры или облучения [94]. Экструзионный биопринтер производит печать на основе CAD-модели, а экструзия материала происходит непрерывно. В результате сразу удается получить биоактивную трехмерную структуру требуемой геометрии. Уменьшение временного интервала между экструдированием и отверждением под действием температуры или облучения приводит к более высокой точности печати и увеличению прочности объекта. Для метода экструзионной биопечати важно оптимизировать вязкоупругие свойства биочернил во время экструзии и механическую стабильность формируемой структуры после экструзии. При этом необходимо учитывать, что после получения имплантата инкаспулированные биологические вещества могут значительно различаться по активности в зависимости от давления экструзии, напряжения сдвига и размера сопла. Самым большим преимуществом экструзионной биопечати является возможность печати имплантатов, содержащих биологически активные вещества, включая факторы роста, белки, лекарственные препараты и даже клетки. В настоящее время технология хорошо отработана и предлагает широкий выбор коммерчески доступных экструзионных биопринтеров и биочернил, которые могут быть адаптированы под различные задачи [95–97]. Однако низкая точность печати ограничивает применение экструзионной биопечати в тканевой инженерии.
Струйная печать (Inkjet рrinting). В этом методе капли биочернил распыляются с помощью теплового [98] или пьезоэлектрического [99] воздействия по заданному алгоритму. Далее нанесенные материалы отверждаются методом УФ-облучения [100], химической или ионной сшивки. Преимущества струйных термопринтеров состоят в высокой скорости печати, низкой стоимости и широкой доступности. Однако при печати существует риск термического и механического воздействия на клетки. Также серьезными ограничениями термопринтеров в трехмерной биопечати считаются неоднородный размер капель и частое засорение сопла. Достоинства струйных принтеров с пьезоэлектрическим кристаллом состоят в возможности получения одинаковых капель требуемого размера и в отсутствии воздействия на клетки тепла и давления. Струйная печать позволяет наносить чернила с очень высокой скоростью (104 капель в секунду) [101] и имеет широкий диапазон пространственного разрешения (50 мкм) [94]. Несмотря на то что метод струйной печати дает возможность вводить клетки, их концентрация должна быть тщательно подобрана. Низкая концентрация клеток облегчает образование капель и предотвращает засорение сопла, а высокая концентрация может ингибировать процесс сшивки. Возможность модификации имеющихся в продаже струйных принтеров для трехмерной биопечати делает этот метод привлекательным. Биочернилами для струйной печати может служить большой набор материалов (мет)акрилового ряда [100]. Методом струйной печати был изготовлен пористый имплантат на основе полиэтиленгликоль диметакрилата с инкапсулированными человеческими хондроцитами [100]. Модуль сжатия у напечатанного имплантата был близок к таковому у нативного суставного хряща человека. Методом струйной печати на основе чернил желатинметакрилат–хитозан–глицерилфитат получены трехмерные пористые материалы, перспективные для регенерации мягких тканей [102]. При отверждении чернил ультрафиолетовым излучением достигнуто разрешение 150 мкм. Эксперименты in vitro с использованием фибробластов продемонстрировали хорошую адгезию, дифференцировку и пролиферацию клеток на этих матрицах.
ПОЛИМЕРЫ ДЛЯ ПОЛУЧЕНИЯ ПОРИСТЫХ ИМПЛАНТАТОВ
Выбор полимерного материала зависит от требуемых характеристик пористого имплантата, подбираемых под конкретную задачу, а также от методов получения. Развитие синтетических подходов привело к созданию биокомпозитов и гибридных биоматериалов, что делает возможной точную настройку широкого спектра свойств, таких как биосовместимость, биоразлагаемость, механическая жесткость, структурная прочность, цитотоксичность и биоактивность. Все полимеры, используемые для создания пористых имплантатов, можно разделить на биоматериалы природного происхождения и синтетические. К первой группе относятся коллаген, альгинат, хитозан, шелк, гиалуроновая кислота, подробно описанные в работе [103]. Данные материалы получают из естественного внеклеточного матрикса, поэтому они обладают свойствами, очень близкими к свойствам естественных тканей. Вторую группу составляют полимолочная кислота, полиэфирэфиркетон, поли-ε-капролактон, полипропиленфумарат, полилактид-со-гликолид, тройной сополимер акрилонитрила, бутадиена и стирола (ABS); некоторые из них далее будут рассмотрены более подробно. Отдельно разобраны фоточувствительные материалы, применяемые в SLA- и DLP-технологиях.
Полимолочная кислота
Полимолочная кислота (PLA) – биоразлагаемый, биосовместимый и нетоксичный полиэфир, широко используемый для получения пористых полимерных скаффолдов методами SLS [104, 105], FDM [106–109] и с помощью воздействия света [110–113]. В последнем случае PLA предварительно метакрилируют. К достоинствам PLA следует отнести возобновляемость сырья и простоту обработки, а также низкий коэффициент расширения, что позволяет достигать отличного контроля формы в FDM. В зависимости от метода, возможно получение скаффолдов с различным размером пор – от 20 мкм для двухфотонной фотополимеризации [110], до 100 мкм и 1 мм для FDM [106] и SLA [111] соответственно. Полимолочная кислота находит применение в инженерии костной ткани [114], поскольку имеет самую высокую механическую прочность среди всех биоразлагаемых полимеров (модуль упругости 3–4 ГПа, предел прочности при растяжении 50–70 МПа) [104]. Однако высокая хрупкость и меньшая прочность на сжатие по сравнению с натуральной костью остаются серьезными ограничениями для использования данного материала. Влияние указанных недостатков пытаются свести к минимуму за счет смешивания PLA с другими материалами (PCL, PGA) [115]. Улучшения механических свойств, а также улучшения адгезии и пролиферации клеток на таких образцах можно достичь путем введения частиц другого материала, например шелка [116], HA или оксида графена [107–109].
Полиэфирэфиркетон
Полиэфирэфиркетон (РЕЕК) – биоинертный термопласт [117] с высокой химической стойкостью и большим временем биоразложения [118]. Вследствие довольно высокой температуры плавления PEEK (343°C) пористые полимерные имплантаты из него получают по технологиям SLS [119] и FDM [117, 120]. Экструзионные методы требуют точного контроля температуры сопла, камеры и рабочей платформы, которые сильно влияют на свойства получаемого объекта [121]. Благодаря комплексу свойств (биосовместимость, низкая теплопроводность, эластичность, прочность) [122], близких к таковым для костной ткани, PEEK используется для ее замещения [123]. К основным недостаткам PEEK относят высокую стоимость производства полимера по сравнению с другими термопластами и низкую биоактивность. Для увеличения биоактивности в PEEK вводят различные добавки. Полученные методом SLS имплантаты из PEEK с трикальцийфосфатом и PLA имеют улучшенные показатели адгезии, пролиферации и дифференцировки остеобластов [119]. Сульфированный пористый PEEK, загруженный системой хлорогеновая кислота–привитой пептид, имел повышенный уровень пролиферации и дифференцировки остеобластов, а также обладал высокой антибактериальной активностью в отношении грамотрицательных и грамположительных бактерий [124]. Метод FDM позволяет оптимизировать механические свойства (прочность на растяжение, сжатие и изгиб) [125] имплантата за счет теплового градиента во время печати [121] или путем изменения толщины формируемого слоя [126].
Поли-ε-капролактон
Поли-ε-капролактон является биоразлагаемым, биосовместимым, нецитотоксичным полимером, одобренным американским управлением по санитарному надзору за качеством пищевых продуктов и медикаментов FDA [127]. Благодаря отлично подходящим для экструзионных методов реологическим свойствам расплава (актуально для FDM), низкой температуре плавления (60°С) и относительно невысокой стоимости PCL широко применяется для создания пористых полимерных имплантатов методами SLS [73], FDM [128], экструзионной биопечати [129], а также SLA [130], DLP [131] и, после предварительного метакрилирования, двухфотонной фотополимеризации [127]. Поли-ε-капролактон имплантаты, полученные с помощью SLS, обладают механическими свойствами, подходящими для инженерии костной и хрящевой ткани [70, 73]. Введение трикальцийфосфата [132, 133] и HA [134] дает возможность гибко изменять свойства объекта. Метод FDM также позволяет использовать различные добавки для улучшения свойств пористых имплантатов: PLA [135], целлюлозу [136], полиуретаны [137]. Техника SLS предоставляет возможность получать пористые имплантаты из PCL со свойствами, аналогичными свойствам кости человека [74]. Использование смеси PCL с альгинатом в рамках технологии FDM позволяет улучшить смачивание и водопоглощение, увеличить эффективность посева и адгезию клеток, жизнеспособность остеобластов [138, 139]. На основе метакрилированного PCL методом SLA удалось получить трехмерные объекты с размером пор порядка 500 мкм [140].
Полипропиленфумарат
Полипропиленфумарат (PPF) представляет собой ненасыщенный линейный полиэфир, удовлетворяющий ряду медицинских требований, включая биосовместимость, механическую прочность, остеокондуктивность и стерилизуемость [141, 142]. Методом свободнорадикальной полимеризации PPF может быть сшит по двойным связям в основной цепи с (мет)акриловыми мономерами [142, 143], N-винилпирролидоном [144], диэтилфумаратом [141]. Последний наиболее часто применяется для снижения вязкости полимеризующейся смеси. Преимуществом композиций на основе PPF является низкая температура сшивки (40–55°C) [145]. Пористые полимерные имплантаты на основе PPF изготавливают как классическими методами (выщелачивание соли [146, 147], электроспиннинг [148]), так и с помощью аддитивных технологий (FDM [149], SLA [150–154], DLP [155, 156]). Аддитивные технологии открыли новые возможности для терапевтического применения материалов на основе PPF [157]. В методе FDM диаметр получаемого волокна и размер пор имплантата зависят от концентрации PPF, давления и скорости печати [149]. Гидролиз сложноэфирных связей PPF в организме приводит к разложению полимера на фумаровую кислоту (компонент цикла Кребса) и пропиленгликоль (пищевую добавку) [158]. Время деградации зависит от молекулярной массы основной цепи, типа сшивающего агента и плотности сшивки [141, 143]. В отличие от других материалов, которые разлагаются слишком быстро или слишком медленно, деградация PPF происходит за период времени, сопоставимый со сроками восстановления и ремоделирования кости [159]. Высокие прочностные характеристики PPF делают материалы на его основе перспективными для инженерии костной ткани [160]. Механические свойства имплантатов из PPF могут быть улучшены за счет введения HA [161], трикальцийфосфата [145], нанопроволок TiO2 [162], а также посредством изменения молекулярной массы [159] или плотности сшивки. Трехмерный скаффолд с размером пор 150 мкм на основе PPF был синтезирован методом микростереолитографии (μ-SLA) [163]. Иммобилизация на поверхности пор RGD-пептида позволила эффективно поддерживать начальную адгезию и пролиферацию хондроцитов человека, что может способствовать регенерации хрящевой ткани. Биоактивность имплантатов на основе PPF может быть увеличена за счет сополимеризации с полиэтиленгликолем [164], функционализации поверхности пептидами [150, 165], заполнения пор коллагеном и покрытия нейротрофином-3 [166].
СВЕТОЧУВСТВИТЕЛЬНЫЕ МАТЕРИАЛЫ (СМОЛЫ) В СИНТЕЗЕ ПОРИСТЫХ ПОЛИМЕРНЫХ ИМПЛАНТАТОВ
Вещества (мономеры, олигомеры, полимеры), способные к сшивке под действием света, называют светочувствительными материалами или смолами. Класс светочувствительных биоматериалов, которые при отверждении дают широкий спектр соединений (от твердых термореактивных материалов до мягких гидрогелей), активно используют при создании пористых полимерных имплантатов методами SLA [167–169], DLP [170, 171] и μ-SLA [172]. При воздействии на смолы светового излучения происходит инициирование фотополимеризации, приводящей к формированию трехмерной полимерной сетки. Наиболее часто применяют (мет)акрилатные смолы (моно-, ди-, три-, тетра-, пента(мет)акрилаты) [167] или (мет)акрилированные полимеры, такие как (мет)акрилированный полиэтиленгликоль ди(мет)акрилаты (PEGDMA) [173], метакрилированный желатин (GelMA) [174], полиэфир уретанакрилаты [170], а также тиолены [171], полипропиленфумараты [156]. В недавних работах на основе промышленно выпускаемых олигомерных диметакрилатов МДФ-2 [175] и ОКМ-2 [78] получены пористые полимерные скаффолоды, характеризующиеся хорошей адгезией, пролиферацией и дифференцировкой мезенхимных стволовых клеток. За счет возможности оптимизации состава композиции, природы мономера и фотоинициатора, плотности формируемой сетки светочувствительные биоматериалы позволяют изготавливать пористый имплантат с требуемыми свойствами. В последнее время сформировался и развивается подход, основанный на отверждении светочувствительных материалов с использованием видимого света. В качестве фотоинициаторов применяют Eosin Y [79], смесь рутения с персульфатом натрия [176], а также хиноны, например карбоксилированный камфорхинон [177] и замещенный орто-хинон [78, 175]. По сравнению с УФ-излучением видимый свет обладает меньшей энергией, что позволяет безопасно вводить клетки и биологические вещества в смолу уже на стадии формирования пористого полимерного имплантата.
ОБЛАСТИ ПРИМЕНЕНИЯ ПОРИСТЫХ ПОЛИМЕРНЫХ ИМПЛАНТАТОВ
Замещение костной ткани
Кость является иерархически структурированной соединительной тканью, состоящей из неорганического (65%) и органического материала (25%), воды (10%). Неорганические и органические компоненты образуют четко ориентированную иерархическую структуру. Кость способна к самовосстановлению при переломе или при возникновении небольших дефектов [178]. Стволовые клетки из скелетной и сосудистой ткани образуют хрящевую мозоль, которая далее васкуляризируется. Однако кость не способна к самовосстановлению дефектов критического размера, и для их восстановления используют оперативное лечение с помощью аутологичных костных трансплантатов. Вместе с тем, доступность аутотрансплантатов ограничена, а их применение требует дополнительных операций и увеличивает возможность осложнений и инфицирования. Регенерация костной ткани с использованием пористых полимерных имплантатов является привлекательной альтернативой для решения этой проблемы. При этом необходимо, чтобы материал имплантата имел хорошие механические свойства и сложную иерархическую структуру пор, а также был способен к васкуляризации.
Пористые имплантаты с порами размером от 70 до 200 мкм и пористостью от 85 до 96%, изготовленные из PLA методом электроспиннинга, показали хорошие результаты при костном замещении на модели дефекта черепа кролика [179]. Проводящие пористые полимерные скаффолды представляют интерес в качестве кандидатов для улучшения пьезоэлектрических свойств костной ткани и для индукции усиленного остеогенеза при имплантации. На основе дисперсии поли-3,4-этилендиокситиофен–сульфонат полистирола методом сублимационной сушки получен высокопористый электропроводящий материал, который обладает высокой степенью взаимосвязанности пор со средним диаметром более 50 мкм, что обеспечивает инфильтрацию клеток и отложение матрикса в пустотах [180]. Обнаружена дифференцировка клеток-предшественников остеогенных клеток в положительно окрашенные остеокальцином остеобласты, делая данный материал перспективным для инженерии костной ткани. Представлен новый подход к созданию биоматериалов для индукции остеогенной дифференцировки стволовых клеток костного мозга (BMSC) [181]. Трехмерные пористые проводящие композитные скаффолды на основе нановолокон полилактид–полианилин имели хорошую цитосовместимость с BMSC и усиливали их остеогенную дифференцировку, что увеличивало уровни экспрессии щелочной фосфатазы, остеокальцина, а также минерализацию BMSC. В своей работе Н.Т. Liao с сотрудниками [182] получили макропористые криогели на основе желатина. На модели восстановления дефектов свода черепа у кроликов показано эффективное образование костной ткани. Для нескольких пациентов были разработаны персонифицированные черепно-лицевые пористые имплантаты на основе композиции бисфенол-А-глицидил метакрилат–триэтиленгликоль диметакрилат с добавлением биоактивного стекла, отверждаемой видимым светом (длина волны 468 нм) [183]. При этом за четыре года в группе из 12 пациентов ни один из имплантатов не был удален, проблемы с кожей или инфекциями не выявлены.
Кардиология
Инфаркт миокарда (закупорка одного или нескольких кровеносных сосудов) снижает обеспечение сердечной мышцы питательными веществами и кислородом, а также приводит к нарушению электрической функции сердечно-сосудистой системы (аритмия). В результате инфаркта миокарда происходит уменьшение эффективности сократительной способности сердца. При этом миокард взрослого человека не способен к эффективной регенерации. Для решения данной проблемы тканевая инженерия предлагает полимерные имплантаты с культивированными кардиомиоцитами, называемые сердечным пластырем, которые могут быть имплантированы в поврежденную область. Решающее значение для эффективной работы такого имплантата имеет электромеханическое соединение миоцитов для их синхронного ответа на сигналы электрической стимуляции.
Электроактивные полимерные скаффолды с системой открытых и связанных пор с размером от нескольких единиц до 150 мкм получены на основе смеси PCL и полиуретана, содержащего пентамер анилина [184]. Образцы имели модуль сжатия и прочность на разрыв 4.1 и 1.3 МПа соответственно. Материал изготавливали по методике вымывания порообразующих веществ – полиэтиленгликоля и поваренной соли. Было показано, что он обладает механическими и химическими свойствами, способствующими адгезии и росту неонатальных кардиомиоцитов, оказывая влияние на экспрессию кардиогенов, участвующих в сокращении и расслаблении мышц (тропонин-Т) и выравнивании цитоскелета (актинин-4). Эти результаты подчеркивают потенциал данного материала как электроактивного компонента для индукции пролиферации кардиомиоцитов и восстановления поврежденной ткани сердца. Так, L.R. Madden с сотрудниками [185] получили гидрогель сополимера 2-гидроксиэтилметакрилата с метакриловой кислотой со структурой пор, обеспечивающей интеграцию сердечной ткани. Имплантат содержал параллельные каналы для размещения кардиомиоцитов, а также сферические поры микронного размера, которые усиливают ангиогенез и уменьшают рубцевание. Каркасы с модифицированной поверхностью засевали кардиомиоцитами ES-клеток человека и культивировали in vitro. Засеянные кардиомиоциты выживали и пролиферировали в течение двух недель. Кардиальная имплантация бесклеточных каркасов с размером пор 30–40 мкм привела к ангиогенезу и снижению фиброзного ответа.
Восстановление нервных тканей
Анатомически нервную систему человека принято разделять на центральную нервную систему (ЦНС) и периферическую нервную систему (ПНС), две нейронные сети, которые согласованно функционируют и отвечают за ощущения и реакцию на внешние раздражители. ЦНС образована головным и спинным мозгом, а ПНС представлена нервными узлами, окончаниями и непосредственно нервами, распределенными по всему телу. Способность к регенерации у клеток нервной системы очень незначительна [186, 187]. Статической межфазной полимеризацией 3,4-этилендиокситиофена на поверхности пор полимера хитозан–желатин получены проводящие пористые полимерные скаффолды [188]. Наличие наночастиц поли-3,4-этилендиокситиофена повысило электропроводность, гидрофильность, механические характеристики и термическую стабильность материала, понизило его водопоглощение и биоразложение, а также усилило рост клеточных нейритов. Это первый пример изготовления проводящего пористого скаффолда поли-3,4-этилендиокситиофен–хитозан–желатин методом межфазной полимеризации in situ. Такой подход может быть перспективным для инженерии нервной ткани. Продемонстрирована перспективность использования проводящих пористых полимерных материалов в тканевой инженерии для восстановления нейронов или других тканей [189].
Сосудистые имплантаты
Кровеносная система человека, состоящая из артерий, вен и капилляров, обеспечивает газообмен и доставку питательных веществ, а также удаление продуктов жизнедеятельности для всех клеток организма. Образование новых кровеносных сосудов в органе или ткани – ангиогенез в спокойном состоянии в организме происходит с умеренной интенсивностью, а при повреждении – активизируется. В организме кровеносные сосуды объединены в сосудистую сеть, их диаметр изменяется от 2 см для крупных артерий до нескольких микрон для капилляров. Оптимальная технология изготовления сосудистого имплантата зависит от требуемого размера сосуда. L. Shao с сотрудниками [190] разработали новый метод коаксиальной биопечати для получения пористых микроволокон метакрилированной желатины, инкапсулированных в альгинате кальция. Показано, что из таких микроволокон может быть сформирована ткань, содержащая эндотелиальные клетки пупочной вены человека. В структуре этой ткани клетки постепенно мигрируют и соединяются, образуя подобие кровеносного сосуда. Методом мультиэлектроспиннинга из волокон двух типов (PLA снаружи и фиброина шелка внутри) изготовлен перспективный трубчатый имплантат с длиной 40.0 мм и внутренним диаметром 4.5 мм, обладающий пористостью 82% и прочностью на разрыв 2.2 МПа [191]. Установлено, что после культивирования на материале мышиные фибробласты и эндотелиальные клетки пупочной вены человека обладают хорошей адгезией и пролиферацией и со временем образуют непрерывный монослой. Через три месяца после имплантации под кожу такие скаффолды могли способствовать формированию сосудистой сети. Трехмерные трубчатые скаффолды малого диаметра с контролируемой ориентацией нановолокон, полученные методом электроспиннинга, потенциально могут использоваться в качестве сосудистых имплантатов.
Замещение хрящевой ткани
Хрящ – эластичная соединительная ткань, формирующаяся на ранних стадиях эмбрионального развития, которая сохраняется в некоторых частях зрелого скелета. Он присутствует в организме в трех формах: эластичной, волокнистой и суставной, каждая из которых имеет различные свойства и функции. Вследствие отсутствия сосудов и низкой концентрации клеток все три типа хряща неспособны к самовосстановлению или регенерации в функциональную ткань. J. Kundu с сотрудниками [192] напечатали методом FDM пористую PCL-структуру с инкапсулированными в альгинат хондроцитами и показали in vivo, что в ней происходит образование хряща. Методом FDM из PCL изготовлена модель ушной раковины с размером пор порядка 200 мкм [193]. С помощью загруженного клетками гидрогеля был индуцирован эффективный хондрогенез. Получены эластичные и биоразлагаемые наночастицы полиуретана, которые в виде водной дисперсии были применены для создания хрящевого имплантата методом FDM [194, 195]. Эти материалы имели механические свойства, близкие к таковым у нативного хряща, а также способствовали хондрогенезу как in vitro, так и in vivo. На 3D-принтере оригинальной конструкции, позволяющем одновременно наносить несколько различных материалов, с использованием загруженного хондроцитами гидрогеля, термопласта PCL и Pluronic F-127 удалось создать хрящевой имплантат ушной раковины [196]. Было показано, что после пяти недель культивирования в ростовой среде происходит образование нового хрящевого матрикса. Данный процесс протекал благодаря наличию микроканалов (пор) за счет диффузии питательных веществ и кислорода. Результаты гистологического исследования, проведенного после эксперимента in vivo, также продемонстрировали образование новой хрящевой ткани.
ЗАКЛЮЧЕНИЕ
Запрос современного общества на улучшение качества и увеличение продолжительности жизни стимулирует исследователей на совершенствование существующих и поиск новых подходов к созданию эффективных персонифицированных имплантатов. В течение последних десяти лет методы получения пористых, в том числе полимерных, материалов для медицины переживают бурный рост, в значительной мере связанный с активным развитием аддитивных технологий. Благодаря использованию компьютерных технологий, обеспечивающих высокое разрешение печати, а также разработке современных полимерных материалов и новых методов биофункционализации удается подойти к созданию персонифицированных имплантатов, приближающихся по свойствам к нативным тканям. Вместе с тем, потенциал применения существующих методов получения пористых полимерных имплантатов реализован не полностью. Для его реализации необходимо решить множество задач, таких как увеличение механической прочности, создание градиента пористой структуры, повышение биологической активности, обеспечение активной микроциркуляции тканевой жидкости по системе взаимосвязанных пор, увеличение эффективности иммобилизации сигнальных молекул на поверхности пор полимерных имплантатов. Кроме того, необходимо найти пути увеличения скорости и снижения стоимости их производства. По мере развития технологий пористые полимеры могут стать ключевыми материалами при создании эффективных имплантатов для клинического применения.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-13-50489.
Список литературы
Tarchala M., Engel V., Barralet J., Harvey E.J. // Injury. 2018. V. 49. № 3. P. 523.
Yan Y., Chen H., Zhang H., Guo C., Yang K., Chen K., Cheng R., Qian N., Sandler N., Zhang Y.S., Shen H., Qi J., Cui W., Deng L. // Biomaterials. 2019. V. 190–191. P. 97.
Kuznetsova D., Timashev P., Bagratashvili V., Zagaynova E. // Medical Technologies in Medicine/Sovremennye Tehnologii v Medicine. 2014. V. 6. № 4. P. 1.
Korzhikov V., Vlakh E., Tennikova T. // Polymer Science A. 2012. V. 54. № 8. P. 585.
Phani K., Sanyal D. // Mater. Sci. Eng. A. 2008. V. 490. № 1–2. P. 305.
Ramakrishnan N., Arunachalam V. // J. Mater. Sci. 1990. V. 25. № 9. P. 3930.
Cox T.R., Erler J.T. // Dis. Model. Mech. 2011. V. 4. № 2. P. 165.
Discher D.E., Mooney D.J., Zandstra P.W. // Science. 2009. V. 324. № 5935. P. 1673.
Discher D. // APS. 2010. V. 2010. P. Q7.003.
Li L., Eyckmans J., Chen C.S. // Nat. Mater. 2017. V. 16. № 12. P. 1164.
Jansen K.A., Donato D.M., Balcioglu H.E., Schmidt T., Danen E.H., Koenderink G.H. // BBA-Mol Cell Res. 2015. V. 1853. № 11. P. 3043.
Guarino V., Causa F., Ambrosio L. // J. Appl. Biomater. Biom. 2007. V. 5. № 3. P. 149.
Drozdov A.D., de Claville Christiansen J. // J. Appl. Polym. Sci. 2020. V. 137. № 10. P. 48449.
Huang L., Huang J., Shao H., Hu X., Cao C., Fan S., Song L., Zhang Y. // Mater. Sci. Eng. C. 2019. V. 94. P. 179.
Bittner S.M., Smith B.T., Diaz-Gomez L., Hudgins C.D., Melchiorri A.J., Scott D.W., Fisher J.P., Mikos A.G. // Acta Biomater. 2019. V. 90. P. 37.
Liao C., Wuethrich A., Trau M. // Appl. Mater. Today. 2020. V. 19. P. 100635.
Liu G., Petrosko S.H., Zheng Z., Mirkin C.A. // Chem. Rev. 2020. V. 120. № 13. P. 6009.
Gentile F., Tirinato L., Battista E., Causa F., Liberale C., di Fabrizio E.M., Decuzzi P. // Biomaterials. 2010. V. 31. № 28. P. 7205.
Chen W., Sun Y., Fu J. // Small. 2013. V. 9. № 1. P. 81.
McNamara L.E., Sjöström T., Seunarine K., Meek R.D., Su B., Dalby M.J. // J. Tissue Eng. 2014. V. 5. P. 2041731414536177.
Accardo A., Shalabaeva V., La Rocca R. // MRS Commun. 2017. V. 8. № 1. P. 35.
Liu X., Won Y., Ma P.X. // J. Biomed. Mater. Res. A. 2005. V. 74A. № 1. P. 84.
Guillaume O., Garric X., Lavigne J.-P., Van Den Berghe H., Coudane J. // J. Control. Release. 2012. V. 162. № 3. P. 492.
Eğri S., Eczacıoğlu N. // Artif. Cells. Nanomed. Biotechnol. 2017. V. 45. № 2. P. 321.
Visscher L.E., Dang H.P., Knackstedt M.A., Hutmacher D.W., Tran P.A. // Mater. Sci. Eng. C. 2018. V. 87. P. 78.
Zhang J., Li J., Jia G., Jiang Y., Liu Q., Yang X., Pan S. // RSC Adv. 2017. V. 7. № 89. P. 56732.
Averianov I.V., Korzhikov V.A., Tennikova T.B. // Polymer Science B. 2015. V. 57. № 4. P. 336.
Korzhikov-Vlakh V., Averianov I., Sinitsyna E., Nashchekina Y., Polyakov D., Guryanov I., Lavrentieva A., Raddatz L., Korzhikova-Vlakh E., Scheper T. // Polymers. 2018. V. 10. № 12. P. 1299.
Hu S., Cai X., Qu X., Yu B., Yan C., Yang J., Li F., Zheng Y., Shi X. // Int. J. Biol. Macromol. 2019. V. 123. P. 1320.
Штильман М.И., Подкорытова А.В., Немцев С.В., Кряжев В.Н. Технология полимеров медико-биологического назначения. Полимеры природного происхождения. M.: БИНОМ. Лаборатория знаний, 2015.
VI – Regenerative Medicine // Definitions of Biomaterials for the Twenty-First Century / Eds. by D. Williams, X. Zhang. Elsevier: 2019.
Garreta E., Oria R., Tarantino C., Pla-Roca M., Prado P., Fernández-Avilés F., Campistol J.M., Samitier J., Montserrat N. // Mater. Today. 2017. V. 20. № 4. P. 166.
Nguyen A.K., Narayan R.J. // Mater. Today. 2017. V. 20. № 6. P. 314.
Севастьянов В.И., Василец С.Л., Перова Н.В. Биосовместимые материалы. M.: Медицинское информационное агентство, 2016.
Huang R., Zhu X., Zhao T., Wan A. // Mater. Res. Express. 2014. V. 1. № 4. P. 045403.
Intranuovo F., Gristina R., Brun F., Mohammadi S., Ceccone G., Sardella E., Rossi F., Tromba G., Favia P. // Plasma Proc. Polym. 2014. V. 11. № 2. P. 184.
Sum Chow K., Khor E., Chwee Aun Wan A. // J. Polym. Res. 2001. V. 8. № 1. P. 27.
Hu C., Tercero C., Ikeda S., Nakajima M., Tajima H., Shen Y., Fukuda T., Arai F. // J. Biosci. Bioeng. 2013. V. 116. № 1. P. 126.
Thadavirul N., Pavasant P., Supaphol P. // J. Biomed. Mater. Res. A. 2014. V. 102. № 10. P. 3379.
Rakovsky A., Gotman I., Rabkin E., Gutmanas E.Y. // J. Mech. Behav. Biomed. 2014. V. 32. P. 89.
Lee S.H., Kim B.S., Kim S.H., Choi S.W., Jeong S.I., Kwon I.K., Kang S.W., Nikolovski J., Mooney D.J., Han Y.K. // J. Biomed. Mater. Res. A. 2003. V. 66. № 1. P. 29.
Misra S.K., Ansari T.I., Valappil S.P., Mohn D., Philip S.E., Stark W.J., Roy I., Knowles J.C., Salih V., Boccaccini A.R. // Biomaterials. 2010. V. 31. № 10. P. 2806.
Kosowska K., Henczka M. // Chem. Proc. Eng-Inz. 2017. V. 38. № 4. P. 1.
Kuang T., Chen F., Chang L., Zhao Y., Fu D., Gong X., Peng X. // Chem. Eng. J. 2017. V. 307. P. 1017.
Evlashin S., Dyakonov P., Tarkhov M., Dagesyan S., Rodionov S., Shpichka A., Kostenko M., Konev S., Sergeichev I., Timashev P. // Materials. 2019. V. 12. № 18. P. 2991.
Tejeda-Alejandre R., Lara-Padilla H., Mendoza-Buenrostro C., Rodriguez C.A., Dean D. // Procedia CIRP. 2017. V. 65. P. 207.
Gao Y., Yi T., Shinoka T., Lee Y.U., Reneker D.H., Breuer C.K., Becker M.L. // Adv. Healthc. Mater. 2016. V. 5. № 18. P. 2427.
Dong R.-H., Jia Y.-X., Qin C.-C., Zhan L., Yan X., Cui L., Zhou Y., Jiang X., Long Y.-Z. // Nanoscale. 2016. V. 8. № 6. P. 3482.
Kumar A., Mishra R., Reinwald Y., Bhat S. // Mater. Today. 2010. V. 13. № 11. P. 42.
Hendriks J., Riesle J., van Blitterswijk C.A. // J. Tissue. Eng. Regen. M. 2007. V. 1. № 3. P. 170.
Bölgen N., Korkusuz P., Vargel İ., Kılıç E., Güzel E., Çavuşoğlu T., Uçkan D., Pişkin E. // Artif. Cells. Nanomed. Biotechnol. 2014. V. 42. № 1. P. 70.
Van Rie J., Declercq H., Van Hoorick J., Dierick M., Van Hoorebeke L., Cornelissen R., Thienpont H., Dubruel P., Van Vlierberghe S. // J. Mater. Sci., Mater. Med. 2015. V. 26. № 3. P. 123.
Grenier J., Duval H., Barou F., Lv P., David B., Letourneur D. // Acta Biomater. 2019. V. 94. P. 195.
Shahbazarab Z., Teimouri A., Chermahini A.N., Azadi M. // Int. J. Biol. Macromol. 2018. V. 108. P. 1017.
Chen L., Wu Z., Zhou Y., Li L., Wang Y., Wang Z., Chen Y., Zhang P. // J. Appl. Polym. Sci. 2017. V. 134. № 37. P. 45271.
Boffito M., Sartori S., Ciardelli G. // Polym. Int. 2014. V. 63. № 1. P. 2.
Jack K.S., Velayudhan S., Luckman P., Trau M., Grøndahl L., Cooper-White J. // Acta Biomater. 2009. V. 5. № 7. P. 2657.
Wei G., Ma P.X. // Biomaterials. 2004. V. 25. № 19. P. 4749.
Chen S., Zhao X., Du C. // Eur. Polym. J. 2018. V. 109. P. 303.
Groll J., Boland T., Blunk T., Burdick J.A., Cho D.-W., Dalton P.D., Derby B., Forgacs G., Li Q., Mironov V.A., Moroni L., Nakamura M., Shu W., Takeuchi S., Vozzi G., Woodfield T.B.F., Xu T., Yoo J.J., Malda J. // Biofabrication. 2016. V. 8. № 1. P. 013001.
Khosravani M.R., Reinicke T. // Appl. Mater. Today. 2020. V. 20. P. 100689.
Mota C., Puppi D., Chiellini F., Chiellini E. // J. Tissue. Eng. Regen. M. 2015. V. 9. № 3. P. 174.
Ligon S.C., Liska R., Stampfl J., Gurr M., Mülhaupt R. // Chem. Rev. 2017. V. 117. № 15. P. 10212.
Mandrycky C., Wang Z., Kim K., Kim D.-H. // Biotechnol. Adv. 2016. V. 34. № 4. P. 422.
Lee S.J.J., Sachs E., Cima M. // Rapid Prototyping J. 1995. V. 1. № 4. P. 24.
Chia H.N., Wu B.M. // Biofabrication. 2014. V. 7. № 1. P. 015002.
Lee J.-Y., Choi B., Wu B., Lee M. // Biofabrication. 2013. V. 5. № 4. P. 045003.
Youssef A., Hollister S.J., Dalton P.D. // Biofabrication. 2017. V. 9. № 1. P. 012002.
Tsai K.-Y., Lin H.-Y., Chen Y.-W., Lin C.-Y., Hsu T.-T., Kao C.-T. // Materials. 2017. V. 10. № 1. P. 65.
Salmoria G., Hotza D., Klauss P., Kanis L., Roesler C. // Adv. Mech. Eng. 2014. V. 6. P. 640496.
Shirazi S.F.S., Gharehkhani S., Mehrali M., Yarmand H., Metselaar H.S.C., Kadri N.A., Osman N.A.A. // Sci. Technol. Adv. Mater. 2015. V. 16. № 3. P. 033502.
Du Y., Liu H., Yang Q., Wang S., Wang J., Ma J., Noh I., Mikos A.G., Zhang S. // Biomaterials. 2017. V. 137. P. 37.
Mazzoli A., Ferretti C., Gigante A., Salvolini E., Mattioli-Belmonte M. // Rapid Prototyping J. 2015. V. 21. P. 386.
Williams J.M., Adewunmi A., Schek R.M., Flanagan C.L., Krebsbach P.H., Feinberg S.E., Hollister S.J., Das S. // Biomaterials. 2005. V. 26. № 23. P. 4817.
Kanczler J.M., Mirmalek-Sani S.-H., Hanley N.A., Ivanov A.L., Barry J.J., Upton C., Shakesheff K.M., Howdle S.M., Antonov E.N., Bagratashvili V.N. // Acta Biomater. 2009. V. 5. № 6. P. 2063.
Kodama H. // Rev. Sci. Instrum. 1981. V. 52. № 11. P. 1770.
Hull C.W. Pat. 4575330 USA. 1986.
Yudin V.V., Kovylin R.S., Baten’kin M.A., Kulikova T.I., Aleynik D.Y., Egorikhina M.N., Rubtsova Y.P., Charykova I.N., Mlyavykh S.G., Chesnokov S.A., Fedushkin I.L. // Polymer. 2020. V. 192. P. 122302.
Wang Z., Abdulla R., Parker B., Samanipour R., Ghosh S., Kim K. // Biofabrication. 2015. V. 7. № 4. P. 045009.
Shurygina M.P., Zakharina M.Y., Baten’kin M.A., Konev A.N., Shavyrin A.S., Chelnokov E.A., Shushunova N.Y., Arsenyev M.V., Chesnokov S.A., Abakumov G.A. // Eur. Polym. J. 2020. V. 127. P. 109573.
Chesnokov S.A., Kovylin R.S., Mamysheva O.G.N., Fukin G.K., Cherkasov V.K., Lyssenko K.A. // J. Polym. Res. 2014. V. 21. № 5. P. 441.
Thavornyutikarn B., Chantarapanich N., Sitthiseripratip K., Thouas G.A., Chen Q. // Prog. Biomater. 2014. V. 3. № 2. P. 61.
Chartrain N.A., Williams C.B., Whittington A.R. // Acta Biomater. 2018. V. 74. P. 90.
Vaezi M., Seitz H., Yang S. // Int. J. Adv. Manuf. Tech. 2013. V. 67. № 5–8. P. 1721.
Sun C., Fang N., Wu D., Zhang X. // Sensor Actuat. A. 2005. V. 121. № 1. P. 113.
Cheng Y.-L., Chen F. // Mater. Sci. Eng. C. 2017. V. 81. P. 66.
Chen H., Lee S.-Y., Lin Y.-M. // Polymers. 2020. V. 12. № 7. P. 1500.
Saed A.B., Behravesh A.H., Hasannia S., Ardebili S.A.A., Akhoundi B., Pourghayoumi M. // J. Manuf. Proc. 2020. V. 56. P. 550.
Crump S.S. Pat. 5121329 USA. 1992.
Madrid A.P.M., Vrech S.M., Sanchez M.A., Rodriguez A.P. // Mater. Sci. Eng. C. 2019. V. 100. P. 631.
Patrício T., Domingos M., Gloria A., D’Amora U., Coelho J., Bártolo P. // Rapid Prototyping J. 2014. V. 20. № 2. P. 145.
Vargas-Alfredo N., Dorronsoro A., Cortajarena A.L., Rodríguez-Hernández J. // ACS Appl. Mater. Int. 2017. V. 9. № 42. P. 37454.
Kucherov F.A., Gordeev E.G., Kashin A.S., Ananikov V.P. // Angewandte Chem. 2017. V. 129. № 50. P. 16147.
Murphy S.V., Atala A. // Nature Biotechnol. 2014. V. 32. № 8. P. 773.
Park S.-H., Jung C.S., Min B.-H. // Tissue Eng. Regener. Med. 2016. V. 13. № 6. P. 622. https://doi.org/10.1007/s13770-016-0145-4
Liu J., Sun L., Xu W., Wang Q., Yu S., Sun J. // Carbohydr. Polym. 2019. V. 207. P. 297.
Derakhshanfar S., Mbeleck R., Xu K., Zhang X., Zhong W., Xing M. // Bioactive Mater. 2018. V. 3. № 2. P. 144.
Roth E.A., Xu T., Das M., Gregory C., Hickman J.J., Boland T. // Biomaterials. 2004. V. 25. № 17. P. 3707.
Markstedt K., Mantas A., Tournier I., Martínez Ávila H.C., Hagg D., Gatenholm P. // Biomacromolecules. 2015. V. 16. № 5. P. 1489.
Cui X., Breitenkamp K., Finn M., Lotz M., D’Lima D.D. // Tissue Eng. A. 2012. V. 18. № 11–12. P. 1304.
Demirci U., Montesano G. // Lab on a Chip. 2007. V. 7. № 9. P. 1139.
Mora-Boza A., Włodarczyk-Biegun M.K., del Campo A., Vázquez-Lasa B., San Román J. // Biomater. Sci. 2020. V. 8. № 1. P. 506.
Mobaraki M., Ghaffari M., Yazdanpanah A., Luo Y., Mills D. // Bioprinting. 2020. V. 18. P. e00080.
Gayer C., Ritter J., Bullemer M., Grom S., Jauer L., Meiners W., Pfister A., Reinauer F., Vučak M., Wissenbach K., Fischer H., Poprawe R., Schleifenbaum J.H. // Mater. Sci. Eng. C. 2019. V. 101. P. 660.
Woźna A.E., Junka A.F., Szymczyk A. // Acta Bioeng. Biomech. 2018. V. 20. № 3. P. 1.
Grémare A., Guduric V., Bareille R., Heroguez V., Latour S., L’Heureux N., Fricain J.-C., Catros S., Le Nihouannen D. // J. Biomed. Mater. Res. A. 2018. V. 106. № 4. P. 887.
Li Y., Liao C., Tjong S.C. // Nanomaterials. 2019. V. 9. № 4. P. 590.
Wu J., Chen N., Bai F., Wang Q. // Polym. Comp. 2018. V. 39. № S1. P. E508.
Chen Q., Mangadlao J.D., Wallat J., De Leon A., Pokorski J.K., Advincula R.C. // ACS Appl. Mater. Int. 2017. V. 9. № 4. P. 4015.
Koroleva A., Gill A., Ortega I., Haycock J., Schlie S., Gittard S., Chichkov B., Claeyssens F. // Biofabrication. 2012. V. 4. № 2. P. 025005.
Tanodekaew S., Channasanon S., Kaewkong P., Uppanan P. // Procedia Eng. 2013. V. 59. P. 144.
Melchels F.P.W., Feijen J., Grijpma D.W. // Biomaterials. 2009. V. 30. № 23. P. 3801.
Jansen J., Melchels F.P.W., Grijpma D.W., Feijen J. // Biomacromolecules. 2009. V. 10. № 2. P. 214.
Pawar P.R., Tekale U.S., Shisodia U.S., Totre T.J., Domb J.A. // Recent Pat. Regenerat. Med. 2014. V. 4. № 1. P. 40.
Saini P., Arora M., Kumar M.N.V.R. // Adv. Drug Delivery Rev. 2016. V. 107. P. 47.
Yeon Y.K., Park H.S., Lee J.M., Lee J.S., Lee Y.J., Sultan M.T., Seo Y.B., Lee O.J., Kim S.H., Park C.H. // J. Biomater. Sci., Polym. Ed. 2018. V. 29. № 7–9. P. 894.
Vaezi M., Yang S. // Virtual Phys. Prototyp. 2015. V. 10. № 3. P. 123.
Kurtz S.M., Devine J.N. // Biomaterials. 2007. V. 28. № 32. P. 4845.
Feng P., Wu P., Gao C., Yang Y., Guo W., Yang W., Shuai C. // Adv. Sci. 2018. V. 5. № 6. P. 1700817.
Deng X., Zeng Z., Peng B., Yan S., Ke W. // Materials. 2018. V. 11. № 2. P. 216.
Yang C., Tian X., Li D., Cao Y., Zhao F., Shi C. // J. Mater. Proc. Technol. 2017. V. 248. P. 1.
Wang H., Xu M., Zhang W., Kwok D.T., Jiang J., Wu Z., Chu P.K. // Biomaterials. 2010. V. 31. № 32. P. 8181.
Singh S., Prakash C., Ramakrishna S. // Eur. Polym. J. 2019. V. 114. P. 234.
He X., Deng Y., Yu Y., Lyu H., Liao L. // Coll. Surf. B. 2019. V. 181. P. 767.
Arif M.F., Kumar S., Varadarajan K.M., Cantwell W.J. // Mater. Design. 2018. V. 146. P. 249.
Wu W., Geng P., Li G., Zhao D., Zhang H., Zhao J. // Materials. 2015. V. 8. № 9. P. 5834.
Thompson J.R., Worthington K.S., Green B.J., Mullin N.K., Jiao C., Kaalberg E.E., Wiley L.A., Han I.C., Russell S.R., Sohn E.H., Guymon C.A., Mullins R.F., Stone E.M., Tucker B.A. // Acta Biomater. 2019. V. 94. P. 204.
Zein I., Hutmacher D.W., Tan K.C., Teoh S.H. // Biomaterials. 2002. V. 23. № 4. P. 1169.
Domingos M., Chiellini F., Gloria A., Ambrosio L., Bartolo P., Chiellini E. // Rapid Prototyp. J. 2012. V. 18. № 1. P. 56.
Elomaa L., Teixeira S., Hakala R., Korhonen H., Grijpma D.W., Seppälä J.V. // Acta Biomater. 2011. V. 7. № 11. P. 3850.
Green B.J., Worthington K.S., Thompson J.R., Bunn S.J., Rethwisch M., Kaalberg E.E., Jiao C., Wiley L.A., Mullins R.F., Stone E.M., Sohn E.H., Tucker B.A., Guymon C.A. // Biomacromolecules. 2018. V. 19. № 9. P. 3682.
Doyle H., Lohfeld S., McHugh P. // Medical Eng. Phys. 2015. V. 37. № 8. P. 767.
Liao H.-T., Lee M.-Y., Tsai W.-W., Wang H.-C., Lu W.-C. // J. Tissue Eng. Regenerat Med. 2016. V. 10. № 10. P. E337.
Buyuksungur S., Endogan Tanir T., Buyuksungur A., Bektas E.I., Torun Kose G., Yucel D., Beyzadeoglu T., Cetinkaya E., Yenigun C., Tönük E., Hasirci V., Hasirci N. // Biomater. Sci. 2017. V. 5. № 10. P. 2144.
Albrecht L.D., Sawyer S.W., Soman P. // 3D-Printing Additive Manufact. 2016. V. 3. № 2. P. 106.
Alemán-Domínguez M.E., Giusto E., Ortega Z., Tamaddon M., Benítez A.N., Liu C. // J. Biomed. Mater. Res. B. 2019. V. 107. № 3. P. 521.
Haryńska A., Kucinska-Lipka J., Sulowska A., Gubanska I., Kostrzewa M., Janik H. // Materials. 2019. V. 12. № 6. P. 887.
Kim Y.B., Kim G.H. // ACS Combinatorial Sci. 2015. V. 17. № 2. P. 87.
Kim M.S., Kim G. // Carbohydr. Polym. 2014. V. 114. P. 213.
Elomaa L., Teixeira S., Hakala R., Korhonen H., Grijpma D.W., Seppälä J.V. // Acta Biomater. 2011. V. 7. № 11. P. 3850.
Yaszemski M.J., Payne R.G., Hayes W.C., Langer R., Mikos A.G. // Biomaterials. 1996. V. 17. № 22. P. 2127.
Temenoff J.S., Mikos A.G. // Biomaterials. 2000. V. 21. № 23. P. 2405.
He S., Timmer M.D., Yaszemski M.J., Yasko A.W., Engel P.S., Mikos A.G. // Polymer. 2001. V. 42. № 3. P. 1251.
Peter S.J., Kim P., Yasko A.W., Yaszemski M.J., Mikos A.G. // J. Biomed. Mater. Res. 1999. V. 44. № 3. P. 314.
Ma C., Ma Z., Yang F., Wang J., Liu C. // Biomed. Mater. 2019. V. 14. № 4. P. 045002.
Fisher J.P., Vehof J.W.M., Dean D., van der Waerden J.P.C.M., Holland T.A., Mikos A.G., Jansen J.A. // J. Biomed. Mater. Res. 2002. V. 59. № 3. P. 547.
Fisher P.J., Holland T.A., Dean D., Engel P.S., Mikos A.G. // J. Biomater. Sci., Polym. Ed. 2001. V. 12. № 6. P. 673.
Cicotte K.N., Hedberg-Dirk E.L., Dirk S.M. // J. Appl. Polym. Sci. 2010. V. 117. № 4. P. 1984.
Trachtenberg J.E., Placone J.K., Smith B.T., Piard C.M., Santoro M., Scott D.W., Fisher J.P., Mikos A.G. // ACS Biomater. Sci. Eng. 2016. V. 2. № 10. P. 1771.
Lan P.X., Lee J.W., Seol Y.-J., Cho D.-W. // J. Mater. Sci., Mater. Med. 2009. V. 20. № 1. P. 271.
Lee J.W., Kang K.S., Lee S.H., Kim J.-Y., Lee B.-K., Cho D.-W. // Biomaterials. 2011. V. 32. № 3. P. 744.
Kim K., Dean D., Wallace J., Breithaupt R., Mikos A.G., Fisher J.P. // Biomaterials. 2011. V. 32. № 15. P. 3750.
Lee K.-W., Wang S., Fox B.C., Ritman E.L., Yaszemski M.J., Lu L. // Biomacromolecules. 2007. V. 8. № 4. P. 1077.
Dadsetan M., Guda T., Runge M.B., Mijares D., LeGeros R.Z., LeGeros J.P., Silliman D.T., Lu L., Wenke J.C., Brown Baer P.R., Yaszemski M.J. // Acta Biomater. 2015. V. 18. P. 9.
Wang M.O., Vorwald C.E., Dreher M.L., Mott E.J., Cheng M.-H., Cinar A., Mehdizadeh H., Somo S., Dean D., Brey E.M., Fisher J.P. // Adv. Mater. 2015. V. 27. № 1. P. 138.
Luo Y., Dolder C.K., Walker J.M., Mishra R., Dean D., Becker M.L. // Biomacromolecules. 2016. V. 17. № 2. P. 690.
Chia H.N., Wu B.M. // J. Biological Eng. 2015. V. 9. № 1. P. 1.
Rezwan K., Chen Q.Z., Blaker J.J., Boccaccini A.R. // Biomaterials. 2006. V. 27. № 18. P. 3413.
Walker J.M., Bodamer E., Krebs O., Luo Y., Kleinfehn A., Becker M.L., Dean D. // Biomacromolecules. 2017. V. 18. № 4. P. 1419.
Ulery B.D., Nair L.S., Laurencin C.T. // J. Polym. Sci., Polym. Phys. 2011. V. 49. № 12. P. 832.
Trachtenberg J.E., Placone J.K., Smith B.T., Fisher J.P., Mikos A.G. // J. Biomater. Sci., Polym. Ed. 2017. V. 28. № 6. P. 532.
Salarian M., Xu W.Z., Biesinger M.C., Charpentier P.A. // J. Mater. Chem. B. 2014. V. 2. № 32. P. 5145.
Ahn C.B., Kim Y., Park S.J., Hwang Y., Lee J.W. // J. Biomater. Sci., Polym. Ed. 2018. V. 29. № 7–9. P. 917.
Dilla R.A., Motta C.M.M., Snyder S.R., Wilson J.A., Wesdemiotis C., Becker M.L. // ACS Macro Lett. 2018. V. 7. № 10. P. 1254.
Cai Z., Wan Y., Becker M.L., Long Y.-Z., Dean D. // Biomaterials. 2019. V. 208. P. 45.
Chen X., Zhao Y., Li X., Xiao Z., Yao Y., Chu Y., Farkas B., Romano I., Brandi F., Dai J. // Adv. Healthcare Mater. 2018. V. 7. № 14. P. 1800315.
Voet V.S., Strating T., Schnelting G.H., Dijkstra P., Tietema M., Xu J., Woortman A.J., Loos K., Jager J., Folkersma R. // ACS Omega. 2018. V. 3. № 2. P. 1403.
Schüller-Ravoo S., Teixeira S.M., Feijen J., Grijpma D.W., Poot A.A. // Macromol. Biosci. 2013. V. 13. № 12. P. 1711.
Bardakova K.N., Grebenik E.A., Minaev N.V., Churbanov S.N., Moldagazyeva Z., Krupinov G.E., Kostjuk S.V., Timashev P.S. // Mater. Sci. Eng. C. 2020. V. 107. P. 110300.
Kuhnt T., Marroquín García R., Camarero-Espinosa S., Dias A., ten Cate A.T., van Blitterswijk C.A., Moroni L., Baker M.B. // Biomater. Sci. 2019. V. 7. № 12. P. 4984.
Bertlein S., Brown G., Lim K.S., Jungst T., Boeck T., Blunk T., Tessmar J., Hooper G.J., Woodfield T.B.F., Groll J. // Adv. Mater. 2017. V. 29. № 44. P. 1703404.
Timashev P., Kuznetsova D., Koroleva A., Prodanets N., Deiwick A., Piskun Y., Bardakova K., Dzhoyashvili N., Kostjuk S., Zagaynova E. // Nanomedicine. 2016. V. 11. № 9. P. 1041.
Aduba D.C. jr., Margaretta E.D., Marnot A.E., Heifferon K.V., Surbey W.R., Chartrain N.A., Whittington A.R., Long T.E., Williams C.B. // Mater. Today Comm. 2019. V. 19. P. 204.
Billiet T., Gevaert E., De Schryver T., Cornelissen M., Dubruel P. // Biomaterials. 2014. V. 35. № 1. P. 49.
Kovylin R.S., Baten’kin M.A., Kulikova T.I., Egorikhina M.N., Charikova I.N., Gusev S.A., Rubtsova Y.P., Mlyavykh S.G., Aleynik D.Y., Chesnokov S.A., Fedushkin I.L. // Chem. Select. 2019. V. 4. № 14. P. 4147.
Lim K.S., Schon B.S., Mekhileri N.V., Brown G.C.J., Chia C.M., Prabakar S., Hooper G.J., Woodfield T.B.F. // ACS Biomater. Sci. Eng. 2016. V. 2. № 10. P. 1752.
Kamoun E.A., Winkel A., Eisenburger M., Menzel H. // Arabian J. Chem. 2016. V. 9. № 5. P. 745.
Gugala Z., Lindsey R.W., Gogolewski S. // Macromol. Symp. 2007. V. 253. № 1. P. 147.
Shim I.K., Jung M.R., Kim K.H., Seol Y.J., Park Y.J., Park W.H., Lee S.J. // J. Biomed. Mater. Res. B. 2010. V. 95B. № 1. P. 150.
Guex A.G., Puetzer J.L., Armgarth A., Littmann E., Stavrinidou E., Giannelis E.P., Malliaras G.G., Stevens M.M. // Acta Biomater. 2017. V. 62. P. 91.
Chen J., Yu M., Guo B., Ma P.X., Yin Z. // J. Coll. Int. Sci. 2018. V. 514. P. 517.
Liao H.-T., Shalumon K., Chang K.-H., Sheu C., Chen J.-P. // J. Mater. Chem. B. 2016. V. 4. № 10. P. 1827.
Aitasalo K.M.J., Piitulainen J.M., Rekola J., Vallittu P.K. // Head Neck. 2014. V. 36. № 5. P. 722.
Baheiraei N., Yeganeh H., Ai J., Gharibi R., Ebrahimi-Barough S., Azami M., Vahdat S., Baharvand H. // J. Biomed. Mater. Res. A. 2015. V. 103. № 10. P. 3179.
Madden L.R., Mortisen D.J., Sussman E.M., Dupras S.K., Fugate J.A., Cuy J.L., Hauch K.D., Laflamme M.A., Murry C.E., Ratner B.D. // Proc. National Acad. Sci. 2010. V. 107. № 34. P. 15211.
Moeendarbary E., Weber I.P., Sheridan G.K., Koser D.E., Soleman S., Haenzi B., Bradbury E.J., Fawcett J., Franze K. // Nature Comm. 2017. V. 8. № 1. P. 1.
Burda J.E., Sofroniew M.V. // Neuron. 2014. V. 81. № 2. P. 229.
Wang S., Sun C., Guan S., Li W., Xu J., Ge D., Zhuang M., Liu T., Ma X. // J. Mater. Chem. B. 2017. V. 5. № 24. P. 4774.
Baniasadi H., SA A.R., Mashayekhan S. // Int. J. Biological Macromol. 2015. V. 74. P. 360.
Shao L., Gao Q., Zhao H., Xie C., Fu J., Liu Z., Xiang M., He Y. // Small. 2018. V. 14. № 44. P. 1802187.
Wang S., Zhang Y., Wang H., Yin G., Dong Z. // Biomacromolecules. 2009. V. 10. № 8. P. 2240.
Kundu J., Shim J.H., Jang J., Kim S.W., Cho D.W. // J. Tissue Eng. Regenerative Med. 2015. V. 9. № 11. P. 1286.
Lee J.-S., Hong J.M., Jung J.W., Shim J.-H., Oh J.-H., Cho D.-W. // Biofabrication. 2014. V. 6. № 2. P. 024103.
Hung K.-C., Tseng C.-S., Dai L.-G., Hsu S.-h. // Biomaterials. 2016. V. 83. P. 156.
Hung K.-C., Tseng C.-S., Hsu S.-h. // Adv. Healthcare Mater. 2014. V. 3. № 10. P. 1578.
Kang H.-W., Lee S.J., Ko I.K., Kengla C., Yoo J.J., Atala A. // Nature Biotechnol. 2016. V. 34. № 3. P. 312.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)


