Высокомолекулярные соединения (серия С), 2021, T. 63, № 2, стр. 159-170
СЕТКИ “ЖИВЫХ” МИЦЕЛЛЯРНЫХ ЦЕПЕЙ, НАПОЛНЕННЫЕ ПРИРОДНЫМИ НАНОЧАСТИЦАМИ
В. С. Молчанов a, *, А. И. Куклин b, А. С. Орехов c, d, Н. А. Архарова e, Е. С. Худолеева f, О. Е. Филиппова a
a Московский государственный университет имени М.В. Ломоносова. Физический факультет
119991 Москва, Ленинские горы, 1, Россия
b Объединенный институт ядерных исследований
141980 Дубна, ул. Жолио-Кюри, 6, Россия
c Московский физико-технический институт
141701 Долгопрудный, Институтский пер., 9, Россия
d Национальный исследовательский центр “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, 1, Россия
e Федеральный научно-исследовательский центр “Кристаллография и фотоника” Российской академии наук
119333 Москва, Ленинский пр., 59, Россия
f Общество с ограниченной ответственностью Научно-производственное объединение “НИИПАВ”
347366 Волгодонск, ул. Химиков, 62, Россия
* E-mail: molchan@polly.phys.msu.ru
Поступила в редакцию 26.03.2021
После доработки 27.05.2021
Принята к публикации 16.06.2021
Аннотация
Исследованы нанокомпозитные сетки мицеллярных цепей поверхностно-активных веществ и нанопластин природной глины бентонит методами реометрии, малоуглового рассеяния нейтронов и криогенной просвечивающей электронной микроскопии. Показано, что молекулы биоразлагаемого цвиттер-ионного ПАВ олеиламидопропилдиметилкарбоксибетаина в присутствии небольшой доли анионного ПАВ додецилсульфата натрия в водной среде образуют “живые” мицеллярные цепи микронной длины, которые, переплетаясь, формируют сетку, обладающую ярко выраженными вязкоупругими свойствами. Обнаружено, что добавление отрицательно заряженных нанопластин глины приводит к увеличению вязкости и времени релаксации на порядок. Это объясняется встраиванием нанопластин в сетку в качестве физических мультифункциональных сшивок. Встраивание происходит путем присоединения торцевых полусферических частей мицелл к поверхности частиц, покрытой слоем ПАВ, что было визуализировано методом криогенной просвечивающей электронной микроскопии. При увеличении количества нанопластин реологические свойства перестают меняться; это связано с прикреплением всех торцевых частей мицелл к нанопластинам. Разработанные нанокомпозитные мягкие сетки на основе безопасных и экологичных компонентов перспективны для разнообразных практических приложений.
Современные технологии предъявляют высокие требования к материалам, особенно в области экологии и безопасности для человека. В связи с этим стараются заменять синтетические полимеры на полимеры природного происхождения, способные к биодеградации с образованием безвредных продуктов [1]. Альтернативным подходом может служить использование вместо полимерных цепей, построенных на основе ковалентных связей, супрамолекулярных цепей, образованных за счет нековалентных взаимодействий малых молекул. Простейшим примером таких цепей являются червеобразные мицеллы поверхностно-активных веществ [2–7]. Контурная длина цепей может достигать десятков микрометров [8], а их персистентная длина обычно составляет 15–40 нм [2] при поперечном размере 4–5 нм [3, 9]. Они во многом подобны полимерным цепям, в частности, они могут переплетаться и образовывать сетку топологических зацеплений, что придает растворам вязкоупругие свойства. Но в отличие от полимерных цепей “живые” мицеллярные цепи постоянно разрываются и рекомбинируют [9, 10], и их можно легко разрушить, например, при добавлении небольшого количества неполярных веществ [11].
Червеобразные мицеллы ПАВ широко применяются как загустители в нефтедобыче [12, 13], косметике, бытовой химии [14], а также как противотурбулентные присадки, способствующие ламинарности потока при его высоких скоростях [15]. Во многих практических приложениях червеобразные мицеллы заменяют полимеры. Однако более широкому использованию мицеллярных систем препятствуют недостаточно высокие значения вязкости и модуля упругости растворов ПАВ.
Один из наиболее перспективных подходов к увеличению значений вязкости и модуля упругости сеток, предложенных в последние годы, – добавление к червеобразным мицеллам ПАВ неорганических наночастиц [16]. Мицеллярные цепи способны прикрепляться своими концами к поверхности наночастиц, покрытой слоем ПАВ, в результате чего наночастицы выступают в роли сшивателя в мицеллярной сетке. Показано, что во взаимодействии с наночастицами участвуют именно концевые фрагменты червеобразных мицелл, так как они являются энергетически невыгодными участками мицеллы. В них молекулы ПАВ имеют сферическую упаковку в отличие от цилиндрической упаковки в центральной части мицеллы, – оптимальной при образовании червеобразных мицелл. Показано, что добавление наночастиц вызывает значительное повышение вязкости растворов ПАВ. Наиболее существенный рост вязкости (на порядки) наблюдается при концентрации ПАВ вблизи концентрации перекрывания мицеллярных цепей С* [17–19]. В этом случае введение наночастиц приводит к переходу от вязкой жидкости к вязкоупругому раствору. При более высокой концентрации ПАВ, когда мицеллы уже сильно переплетаются между собой, введение наночастиц меньше повышает вязкость – в 1.5–3 раза [20–22].
Большинство исследований влияния наночастиц на реологические свойства растворов червеобразных мицелл было проведено на примере катионных [17, 22] и анионных ПАВ [18, 20, 23], а также их смесей [19]. В то же время более перспективны в экологическом смысле являются цвиттер-ионные ПАВ, которые малотоксичны, биоразлагаемы и безопасны даже для чувствительной кожи детей [24]. Однако к настоящему времени опубликована лишь одна работа, посвященная влиянию наночастиц на реологические свойства растворов цвиттер-ионных ПАВ [25]. Показано, что добавление отрицательно заряженных наночастиц оксида кремния (0.3–0.8 мас. %) радиусом 12 нм в раствор червеобразных мицелл эруцил-амидопропилдиметилбетаина с длинным хвостом С22 увеличивает вязкость системы в 2 раза. При более высоких концентрациях наночастиц (более 1 мас. %) происходило образование двухфазной системы. Структурные исследования этих суспензий не проводили.
Цель настоящей работы – изучение влияния наночастиц на реологические свойства и структуру червеобразных мицелл на основе биоразлагаемого цвиттер-ионного ПАВ олеиламидопропилдиметилкарбоксибетаина (ОАБ) с длинным хвостом С18, получаемого из биовозобновляемых источников – растительных масел, с небольшой добавкой анионного ПАВ додецилсульфата натрия (ДСН). В отличие от подавляющего большинства предыдущих работ по нанокомпозитным системам на основе червеобразных мицелл ПАВ [17–23, 25], наполнителем служили наночастицы пластинчатой формы, имеющие большую удельную поверхность по сравнению с обычно используемыми сферическими частицами, что обеспечивает большую поверхность для взаимодействия с мицеллярными цепями. Более того, выбранные для исследований пластинчатые наночастицы глины бентонит – нетоксичный материал природного происхождения. В работе показано, что добавление наночастиц бентонита в плотную сетку мицеллярных цепей увеличивает вязкость и время релаксации на порядок. Таким образом, наночастицы глины являются эффективным и экологичным наполнителем мицеллярных сеток.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Анионное поверхностно-активное вещество ДСН (молярная масса 288 г/моль) компании “Хеликон” (Россия) (>97%) и гидроксид натрия (>85%) компании “Riedel-de Haen” использовали без предварительной очистки. Цвиттер-ионное поверхностно-активное вещество ОАБ
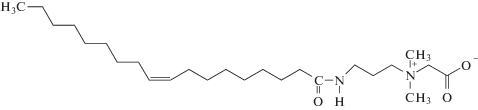
было предоставлено Обществом с ограниченной ответственностью Научно-производственное объединение “НИИПАВ” (Россия) в форме раствора, содержащего 33 мас. % ОАБ (включая ионы натрия и хлора), 0.5 мас. % олеиламидопропилдиметиламина (ОА), 17.0 мас. % изопропанола и 49.5 мас. % воды. Синтез ОАБ проводили в две стадии.
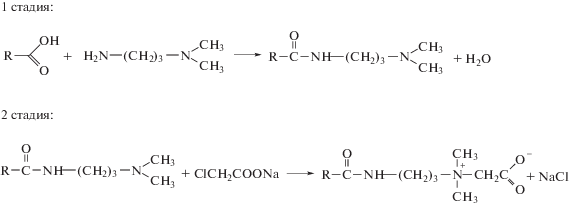
Сначала получали олеиламидопропилдиметиламин из олеиновой кислоты и диметиламинопропропиламина (160°С, под вакуумом). Затем синтезировали олеиламидопропилкарбоксибетаин из олеиламидопропилдиметиламина и монохлорацетата натрия при 80°С. Побочным продуктом в процессе реакции являлся хлорид натрия.
Для удаления изопропанола исходный раствор ПАВ, разбавленный дистиллированной водой в 5 раз, замораживали в жидком азоте и лиофильно высушивали. Отсутствие изопропанола было подтверждено спектроскопией ЯМР 1H. В экспериментах поддерживали pH в диапазоне 11.0–11.2. В этих условиях ОА был не заряжен, а ОАБ находился в цвиттер-ионной форме (pKa ОАБ равен двум [26]).
Природная глина бентонит была получена от компании “Sigma-Aldrich”. Размер нанопластин глины лежал в диапазоне 30–200 нм, а средний размер был оценен в 100 нм [27]. Приведенная площадь поверхности нанопластин составляла 63 м2/г [28]. На поверхности находятся функциональные группы Al–OH, Mg-OH и Si–OH [29], так что в щелочной среде наночастицы имели отрицательный заряд [29].
Для приготовления растворов использовали бидистиллированную деионизованную воду, полученную на установке “Milli-Q Millipore Waters” (США), а также дейтерированную воду (>99%), предоставленную компанией “Астрахим” (Россия).
Приготовление нанокомпозитных сеток
Наночастицы глины диспергировали в водной среде при помощи ультразвукового диспергатора “SonoPuls ColePalmer 350” мощностью 350 Вт в течение 30–60 мин. Время увеличивали по мере повышения количества глины. Затем добавляли ПАВ и перемешивали в течение 1 суток. Количество ПАВ (ОАБ и ДСН), адсорбированного на наночастицах бентонита, было ранее определено методами термогравиметрии и элементного анализа. Оно составляет всего 1% по массе относительно количества глины [27]. А поскольку в образцах количество глины не превышало 0.3 мас. %, количество адсорбированного ПАВ (до 0.003 мас. %) было чрезвычайно мало по сравнению с общим количеством ПАВ в исследуемой системе (2.1 мас. %). Методами просвечивающей электронной микроскопии, элементного анализа и рентгеновской дифракции [30] было показано, что в присутствии ОАБ и ДСН бентонит в основном находится в форме тактоидов из 5–10 пластин, а межплоскостное расстояние увеличивается незначительно (на 5%). Малое количество адсорбированного ПАВ практически не изменяет заряд нанопластин, зета-потенциал которых равен –27 мВ, что в пределах погрешности измерений равно зета-потенциалу исходных нанопластин –26 мВ [27]. Приготовленные суспензии были устойчивыми и сохраняли исходные вязкоупругие свойства по крайней мере в течение года.
Методы исследования
Реометрия. Для изучения вязкоупругих свойств растворов и суспензий использовали ротационную реометрию. Измерения проводили на реометре “Physica MCR301” фирмы “Anton Paar” (Австрия). К образцу прикладывали сдвиговое напряжение и определяли изменение деформации от времени. В режиме постоянного напряжения сдвига определяли вязкость образцов при течении. Для измерения каждой точки на графике зависимости вязкости от скорости сдвига к образцу прикладывали напряжение сдвига в течение времени, сравнимого с обратной величиной соответствующей скорости сдвига. В режиме осцилляционного напряжения сдвига получали частотные зависимости упругой и вязкой компонент комплексного модуля упругости G* – модуля накоплений G ' и модуля потерь G ". Указанные эксперименты выполняли при малых амплитудах воздействия после предварительного определения линейной области вязкоупругости. Все измерения проводили при 25°С в термостатируемой измерительной ячейке конус–плоскость с конусом диаметром 49.93 мм и углом 1°.
Малоугловое рассеяние нейтронов. Для исследования структуры образцов использовали метод малоуглового рассеяния нейтронов. Эксперименты проводили на времяпролетном спектрометре ЮМО с двухдетекторной системой [31] реактора ИБР-2 лаборатории нейтронной физики имени М.В. Франка объединенного института ядерных исследований (Дубна, Россия) в динамическом диапазоне векторов рассеяния q = = 0.006–0.7 Å–1 в термостатируемой ячейке при 25°С. Для получения рассеяния от всей структуры в целом в качестве растворителя использовали D2O, а для получения рассеяния только от нанопластин глины в нанокомпозитной сетке – смесь обычной и дейтерированной воды (85%/15%), позволяющую “скрыть” рассеяние от мицелл ПАВ. Кривые интенсивности, полученные методом малоуглового рассеяния нейтронов, были нормированы на ванадиевый рассеиватель, скорректированы по пропусканию образца, толщине образца и фоновому рассеянию при использовании программы SAS [32].
Криогенная просвечивающая электронная микроскопия (крио-ПЭМ). Для визуализации структуры сеток использовали метод крио-ПЭМ. Образец изучали в замороженно-гидратированном состоянии, что является прямым способом визуализации объектов самоорганизующихся систем практически в том виде, в каком они существуют в растворе. Образцы исследовали на микроскопе “Titan Krios 60-300 TEM/STEM” (FEI, USA) с корректором сферических аберраций (Cs-corrector), прямым детектором электронов (“DDE Falcon II”) и фазовой пластиной (Volta phase plates). ПЭМ-изображения получали при ускоряющем напряжении 300 кВ в режиме параллельного пучка, доза облучения составляла не более 100 e/Å2. Для обработки изображений использовали программы Digital Micrograph и TIA. Образцы для крио-ПЭМ-измерений готовили путем нанесения исследуемого раствора или суспензии через боковой порт Витробота (“Vitrobot Mark IV”, FEI, USA) непосредственно на трехмиллиметровую микроскопическую медную сеточку, покрытую углеродным слоем [33]. После нанесения образца на сеточку ее погружали в жидкий этан для быстрого замораживания.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения нанокомпозитных гидрогелей использовали червеобразные мицеллы ПАВ на основе смеси ОАБ и ДСН при общей концентрации ПАВ 0.048 моль/л (2.03 об. %) и мольном соотношении ОАБ : ДСН = 10. Данное соотношение обеспечивает образование длинных червеобразных мицелл ПАВ благодаря большому размеру гидрофобного хвоста ОАБ и добавке анионного ПАВ [27, 34], экранирующего отталкивание между катионными фрагментами ОАБ. Концентрация наполнителя – нанопластин бентонита (0–0.13 об. %) не превышала концентрацию перекрывания пластин бентонита (1 об. %), чтобы обеспечить преимущественное взаимодействие наночастиц с мицеллами, а не друг с другом (рис. 1). Концентрация перекрывания пластин, отвечающая перколяции, была определена экспериментально. Показано, что суспензии глины без ПАВ при концентрациях выше 1 об. % обладают пределом текучести, что обусловлено образованием трехмерной структуры нанопластин глины [35].
Рис. 1.
Фотографии вязкоупругих образцов, содержащих 0.044 моль/л (1.93 об. %) ОАБ и 0.004 моль/л (0.1 об. %) ДСН в отсутствие глины (а) и в присутствии 0.03 (б) и 0.1 об. % (в) глины бентонит. Цветные рисунки можно посмотреть в электронной версии.

Реологические свойства
На рис. 2 представлены кривая вязкости и частотные зависимости модуля накоплений G '(ω) и модуля потерь G "(ω) для исходной мицеллярной сетки без наночастиц. Видно, что в области низких скоростей сдвига на кривой течения наблюдается ньютоновское плато, позволяющее определить вязкость при нулевой скорости сдвига η0. Величина ньютоновской вязкости η0 составляет 2 × 102 Па с, что на пять порядков выше вязкости воды. При увеличении скорости сдвига наблюдается падение вязкости, связанное с вытягиванием мицелл вдоль направления сдвига [36]. На частотных зависимостях G '(ω) и G "(ω) видна широкая область упругого отклика, в которой G ' > G ". Кроме того, на зависимости G '(ω) имеется плато, что указывает на образование сетчатой структуры за счет топологических зацеплений мицелл [2, 37]. Плато модуля накоплений G0 пропорционально количеству эластически активных цепей в сетке [10, 37]. Таким образом, в отсутствие наночастиц мицеллярные цепи переплетаются между собой, образуя сетчатую структуру, обладающую вязкоупругими свойствами.
Рис. 2.
Частотные зависимости модуля накоплений (темные точки) и модуля потерь (светлые) (а), а также зависимости вязкости от скорости сдвига (темные точки) (б) для растворов червеобразных мицелл ПАВ, содержащих 0.044 моль/л ОАБ и 0.004 моль/л ДСН, до добавления глины (1) и с 0.07 (2) и 0.13 об. % (3) диспергированной глины. На рис. 4б приведены зависимости модуля комплексной вязкости от частоты для растворов без глины (светлые треугольники) и с 0.07 об. % глины (светлые круги). На рис. 4а стрелками отмечены значения минимума модуля потерь $G_{{{\text{мин}}}}^{{''}}$, на рис. 4б cплошные линии – аппроксимация данных моделью Каро.
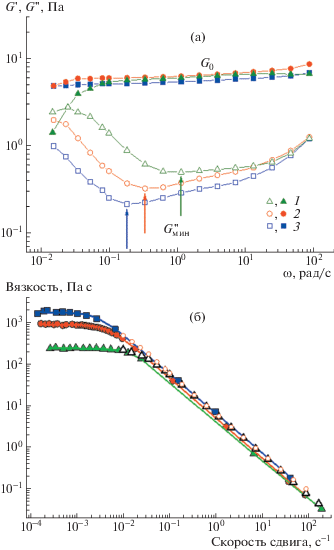
Изменение реологических свойств сетки переплетенных мицелл ПАВ по мере добавления наночастиц глины показано на рис. 2. Видно, что в присутствии нанопластин ньютоновская вязкость системы η0 возрастает на порядок, и расширяется частотная область упругого отклика G ' > G ", но при этом величина модуля накоплений G ' остается практически неизменной. Наблюдаемые изменения можно объяснить встраиванием нанопластин в сетку переплетенных мицеллярных цепей ПАВ в качестве многофункциональных физических сшивок между мицеллами. Такое встраивание может происходить за счет прикрепления энергетически невыгодных полусферических концов червеобразных мицелл к слою ПАВ на поверхности частиц, как было показано в ряде недавних теоретических и экспериментальных работ и в компьютерном моделировании на примере частиц различной природы [17, 19, 20, 27, 38–40]. Связывание мицелл с наночастицами глины затрудняет их рептацию, что при течении приводит к увеличению вязкости системы (рис. 2б), а при осцилляционном сдвиговом воздействии – к уменьшению доли неупругого отклика сетки (рис. 2а). Стоит отметить, что при высоких скоростях сдвига (рис. 2б) при вытягивании цепей вдоль направления деформации значение вязкости не зависит от присутствия частиц, что можно объяснить разрывом связей мицелл с частицами в этих условиях. Слабое влияние наночастиц на модуль накоплений системы связано с малым количеством новых эластически активных зацеплений, образованных наночастицами, по сравнению с общим количеством зацеплений, образованных переплетением цепей, как было продемонстрировано ранее для сферических наночастиц [41].
Таким образом, показано, что нанопластины глины бентонит могут эффективно увеличивать вязкость и расширять область упругого отклика сетки переплетенных мицеллярных цепей ПАВ. Мы полагаем, что причиной эффекта является связывание концов червеобразных мицелл с поверхностью нанопластин, покрытых слоем ПАВ.
Структура
Структура нанокомпозитной сетки была исследована методом малоуглового рссеяния нейтронов. Для интерпретации результатов кривые рассеяния нанокомпозитной сетки были сопоставлены с кривыми рассеяния от наночастиц в мицеллярной сетке, полученными с использованием метода вариации контраста, и с кривыми рассеяния для мицеллярной сетки без глины (рис. 3).
Рис. 3.
Кривые малоуглового рассеяния нейтронов нанокомпозитной сетки червеобразных мицелл ПАВ, содержащей 0.044 моль/л ОАБ, 0.004 моль/л ДСН и 0.04 об. % нанопластин глины бентонит, в D2O (1) и в смеси D2O/H2O (объемные доли 15/85) (2), выявляющей рассеяние только от нанопластин глины, а также кривая малоуглового рассеяния нейтронов соответствующей мицеллярной сетки ОАБ/ДСН без глины в D2O (3).
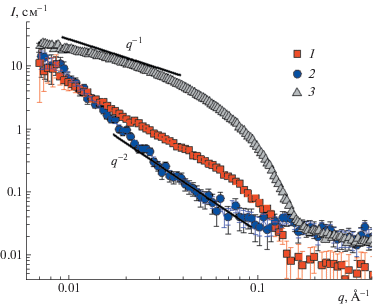
Из рис. 3 следует, что кривая рассеяния от наночастиц глины бентонит в области средних q имеет наклон q–2, характерный для случайно ориентированных пластинчатых объектов [42]. В области малых q можно заметить небольшое отклонение от данного наклона, указывающее на взаимодействие заряженных нанопластин друг с другом (слабый структурный пик [42]). Для мицеллярной сетки без глины наблюдается традиционная для цилиндрических объектов зависимость q–1 в области малых q. Структурный пик электростатического взаимодействия отсутствует, что связано с относительно слабым зарядом мицеллярных цепей ОАБ/ДСН [27], содержащих только 10% анионного ПАВ.
Что касается кривой рассеяния от нанокомпозитной сетки в дейтерированной воде, то в области малых q (характеризующей рассеивающие объекты крупного размера) она близка к кривой рассеяния нанопластин, а в области больших q (характеризующей рассеивающие объекты малого размера) она согласуется с кривой рассеяния от мицеллярной сетки. Таким образом, можно полагать, что при добавлении наночастиц мицеллярные цепи сохраняют локальную цилиндрическую структуру, а наночастицы равномерно распределены по сетке, т.е. не возникает дополнительного структурирования или сильного электростатического взаимодействия между нанопластинами в сетке.
Мицеллярная сетка до добавления нанопластин и нанокомпозитная сетка были визуализированы методом крио-ПЭМ. Из рис. 4а и 4б следует, что в обеих системах ПАВ образует червеобразные мицеллы микронной длины, которые переплетаются и образуют плотную сетку зацеплений.
Рис. 4.
Изображения мицеллярной сетки без наночастиц (а) и соответствующей нанокомпозитной сетки, содержащей 0.044 моль/л ОАБ, 0.004 моль/л ДСН и 0.04 об. % нанопластин глины бентонит (б), полученные методом крио-ПЭМ, а также схема нанокомпозитной сетки из мицеллярных цепей и нанопластин глины и схема прикрепления мицеллы к частице (образование сшивки) (в). На рис. 4б стрелками отмечены области прикрепления мицеллярных цепей к поверхности частиц.

На крио-ПЭМ изображении нанокомпозитной сетки (рис. 4б) наблюдаются нанопластины глины бентонит размерами 100–200 нм. Отметим, что сетка переплетенных мицелл не деформирована вблизи наночастиц несмотря на то, что размер последних гораздо больше размера элементарной ячейки сетки. Это можно объяснить тем, что сетка “живых” мицелл благодаря способности к перестроению и самоорганизации “подстраивается” под наночастицы. На изображении ясно видны точки (отмечены стрелками на рис. 4б), в которых мицеллы прикрепляются торцевыми частями к поверхности нанопластин, покрытой оболочкой ПАВ, что подтверждает предложенную ранее в литературе модель взаимодействия червеобразных мицелл с наночастицами [17, 27, 40, 43]. Насколько нам известно, ранее сшивки между наночастицами и мицеллярными цепями были экспериментально продемонстрированы только для сетки, наполненной сферическими наночастицами оксида кремния [19, 41]. Такое связывание объясняет увеличение ньютоновской вязкости, показанное выше.
Сравним размер элементарной ячейки сетки ξ из реологических данных и из данных крио-ПЭМ. Величина ξ, рассчитанная из значения модуля упругости как $\xi = {{\left( {\frac{{kT}}{{{{G}_{0}}}}} \right)}^{{1/3}}}$ [10], составляет 80 нм. На изображениях крио-ПЭМ плотность сетки кажется намного выше, чем приведенный расчет (рис. 5). Это может быть связано с тем, что мы наблюдаем двухмерную картину от нескольких слоев сетки, что визуально увеличивает плотность сетки зацеплений.
Рис. 5.
Размер элементарной ячейки сетки ξ, рассчитанный из полученных методом крио-ПЭМ изображений нанокомпозитной сетки, содержащей 0.044 моль/л ОАБ, 0.004 моль/л ДСН и 0.04 об. % нанопластин глины бентонит.
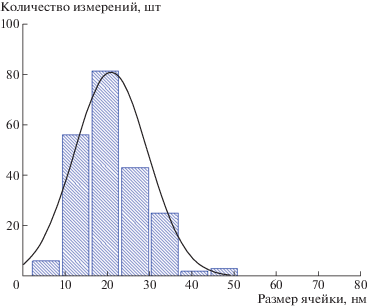
Таким образом, нанопластины глины равномерно распределены в сетке и не деформируют ее, благодаря перестроению “живых” мицеллярных цепей. Визуализированы точки сшивки червеобразных мицелл и нанопластин глины, обеспечивающие повышение вязкости исследуемых систем.
Роль концентрации наночастиц
Рассмотрим, как изменяются реологические свойства по мере возрастания количества добавленных наночастиц. Величину ньютоновской вязкости определяли из аппроксимации зависимостей вязкости от скорости сдвига с использованием модели Каро [44, 45]. На рис. 6а видно, что при увеличении концентрации бентонита от 0 до 0.04 об. % наблюдается интенсивный рост ньютоновской вязкости, а затем он заметно ослабевает. При этом значение модуля накоплений на плато практически не меняется (рис. 6в).
Рис. 6.
Зависимость вязкости при нулевой скорости сдвига (а), терминального времени релаксации (б) и значения модуля накоплений на плато (модуль упругости) (в) от концентрации наночастиц глины бентонит в сетках, содержащих 0.044 моль/л ОАБ и 0.004 моль/л ДСН.
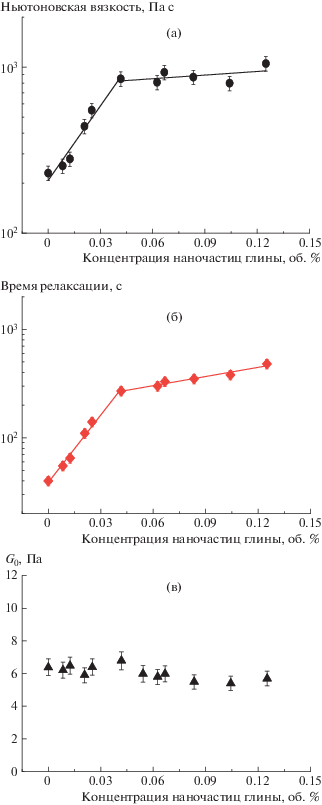
На рис. 6б представлена зависимость терминального времени релаксации от концентрации бентонита. Для оценки терминального времени релаксации в данной системе вычисляли обратную величину скорости сдвига, при которой наблюдается переход от плато вязкости к области падения на графике зависимости вязкости от скорости сдвига. Известно [46, 47], что этот переход происходит при частоте, соответствующей пересечению частотных зависимостей модуля накоплений G ' и модуля потерь G " [48]. Соответствующая скорость сдвига в нашем случае была определена при помощи аппроксимации моделью Каро (рис. 2б) [44, 45]. Такой метод оценки терминального времени релаксации основан на том, что для исследуемой системы, как и для большинства растворов червеобразных мицелл ПАВ [46, 47], выполняется правило Кокса–Мерца, т.е. зависимость модуля комплексной вязкости от частоты хорошо согласуется с зависимостью вязкости от скорости сдвига (рис. 2б). В связи с этим оценка терминального времени релаксации из зависимости вязкости от скорости сдвига соответствует оценке данного времени релаксации из частотной зависимости модуля накоплений и потерь.
Показано (рис. 6б), что характер зависимости времени релаксации от концентрации наночастиц глины Сн в целом повторяет характер зависимости вязкости от Сн, что согласуется с формулой η = G0τ [10], выполняющейся для большинства вязкоупругих растворов червеобразных мицелл ПАВ. Таким образом, для нанокомпозитной системы данное соотношение также выполняется.
Итак, значительное повышение вязкости, сопровождающееся увеличением времени релаксации, при Сн от 0 до 0.04 об. % можно объяснить ростом количества сшивок между нанопластинами и червеобразными мицеллами ПАВ и замедлением рептации мицелл.
При более высоких концентрациях Сн влияние наночастиц на реологические параметры заметно ослабевает. Выход реологических характеристик на насыщение при повышении концентрации наночастиц Сн ранее был предсказан в рамках модели взаимодействия, предложенной N.J. Wagner [17], и был экспериментально обнаружен при добавлении наночастиц диоксида кремния в сетку червеобразных мицелл катионных [17] и анионных ПАВ [20], а также при добавлении субмикронных частиц магнетита в мицеллярную сетку катионного ПАВ [43]. В настоящей работе этот эффект впервые был обнаружен для системы с несферическими наночастицами. Причина эффекта объясняется тем, что при определенной концентрации бентонита все торцевые части мицелл оказываются связанными с поверхностью наночастиц, поэтому дальнейшее увеличение количества наночастиц не вызывает образования дополнительных сшивок, а приводит к перераспределению торцевых частей мицелл между наночастицами, что слабо влияет на вязкость и время релаксации. Отметим, что в данной системе насыщение наблюдается при более низких концентрациях наночастиц глины по сравнению со сферическими наночастицами оксида кремния [17, 20]. Это позволяет предположить, что к одной нанопластине прикрепляется гораздо больше мицеллярных цепей, чем к сферической наночастице.
Оценим количество торцевых частей мицелл, присоединенных к одной наночастице в сетке, при насыщении, когда все концы мицелл присоединены к нанопластинам глины. Общее число торцевых частей мицеллярных цепей можно рассчитать, зная концентрацию мицелл в сетке. Для этого из реологических данных определим среднюю контурную длину мицелл L, используя формулу Гранека–Кейтса [37]
где G0 – значение модуля накоплений на плато, $G_{{{\text{мин}}}}^{{''}}$ – значение минимума модуля потерь в области плато модуля накоплений (рис. 2а), le – контурная длина участки мицеллы между двумя зацеплениями.Получено, что средняя длина мицелл составляет 2000 нм. Исходя из этого и зная массу ПАВ в растворе и объем одной молекулы ПАВ, можно оценить концентрацию мицелл в сетке как 3.5 × × 1017 1/л. Соответственно концентрация торцевых частей будет в два раза больше – 7 × 1017 1/л. Количество нанопластин глины можно оценить, зная концентрацию нанопластин и их средний размер (согласно работе [27], он равен 100 нм). Определенная таким образом концентрация нанопластин составляет 1.1 × 1016 1/л. При насыщении сетки наночастицами на каждую нанопластину приходится порядка 60 торцов мицелл. Отметим, что в случае наночастиц оксида кремния 30 нм к одной частице присоединяется не более трех торцевых частей червеобразных мицелл [41]. Таким образом, использование нанопластин глины с относительно большой площадью поверхности (размер пластин от 30 до 200 нм) по сравнению со сферическими наночастицами оксида кремния (диаметр 30 нм) позволяет увеличить функциональность сшивок в системе более чем на порядок. Полагая, что глина равномерно распределена в сетке, можно оценить, что расстояние между наночастицами составляет около 500 нм, что в несколько раз меньше контурной длины мицелл. Это обеспечивает условия для прикрепления всех торцевых частей мицелл к частицам глины.
Реологические данные позволяют также оценить характерное время жизни червеобразных мицелл τж (время между последовательными разрывом и рекомбинацией цепи) из частоты ω* минимума на частотной зависимости модуля потерь $G_{{{\text{мин}}}}^{{''}}$ как τж = 1/ω* [10, 36, 49]. Время жизни мицелл τж характеризует интенсивность обновления сетки за счет обратимого разрыва живых цепей и вместе со временем рептации мицелл определяет время релаксации системы [2, 9]. Поскольку характерное время жизни червеобразных мицелл обычно составляет 0.01–1 с [9, 27], минимум модуля потерь $G_{{{\text{мин}}}}^{{''}}$ обычно находится на частотной зависимости в области 1–100 рад/с. Для исследуемой сетки мицелл ПАВ без наночастиц время жизни 0.8 с (рис. 5). При добавлении глины минимум $G_{{{\text{мин}}}}^{{''}}$ сдвигается в область более низких частот (рис. 1), что указывает на рост времени жизни. В нанокомпозитной системе обновление сетки происходит не только за счет обратимого разрыва цепей, но и за счет обратимого разрыва сшивок. В связи с этим наблюдаемое увеличение времени жизни может быть связано с тем, что время жизни сшивок мицелл с наночастицами больше времени жизни мицелл.
На рис. 7 представлена зависимость времени жизни от количества нанопластин в сетке. Видно, что в области интенсивного роста времени релаксации (0–0.04 об. % глины) время жизни возрастает, что согласуется с увеличением количества сшивок в сетке. Таким образом, повышение времени релаксации нанокомпозитной сетки объясняется образованием сшивок с временем жизни большем, чем время жизни мицелл, что приводит к упрочнению мицеллярной сетки. Заметим, что если бы время жизни сшивок было бы меньше времени жизни мицелл, то эффект добавления наночастиц был бы незначительным.
Рис. 7.
Зависимость времени жизни, характеризующего интенсивность обновления сетки, от концентрации наночастиц глины бентонит, добавленной в раствор, содержащий 0.044 моль/л ОАБ и 0.004 моль/л ДСН.
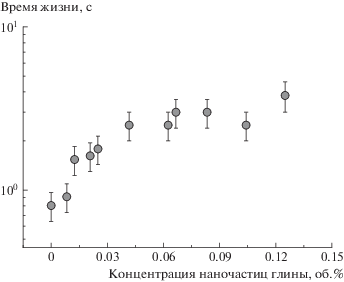
Наше предположение о роли времени жизни сшивок по сравнению со временем жизни мицелл ранее не обсуждалось в литературе и может внести значимый вклад в объяснение эффектов добавления наночастиц в мицеллярную сетку, так как обнаруженные в литературе закономерности изменения свойств нанокомпозитных мицеллярных сеток не всегда могут быть объяснены в рамках существующей модели [16].
Таким образом, в работе созданы и изучены нанокомпозитные сетки мицеллярных цепей ОАБ/ДСН и нанопластин природной глины бентонит. Показано, что нанопластины, действуя как физические сшивки, могут эффективно увеличивать ньютоновскую вязкость и расширять область упругого отклика сетки переплетенных мицеллярных цепей ПАВ. Нанопластины природной глины бентонит являются перспективным наполнителем для сеток “живых” мицеллярных цепей ПАВ, а полученные нанокомпозитные сетки на основе экологичных компонентов перспективны для практического применения, в частности в косметике или нефтедобыче.
Авторы выражают благодарность Е.Е. Махаевой (МГУ) за плодотворное обсуждение результатов.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 17-13-01535). Часть работы, связанная с получением изображений крио-ПЭМ (А.С. Орехов, Н.А. Архарова), поддержана Министерством науки и высшего образования РФ.
Список литературы
Lukanina K.I., Grigoriev T.E., Krasheninnikov S.V., Mamagulashvilli V.G., Kamyshinsky R.A., Chvalun S.N. // Carbohydr. Polym. 2018. V. 191. P. 119.
Magid L.J. // J. Phys. Chem. B. 1998. V. 5647. № 97. P. 4064.
Kwiatkowski A.L., Molchanov V.S., Philippova O.E. // Polymer Science A. 2019. V. 61. № 2. P. 215.
Schubert B.A., Kaler E.W., Wagner N.J. // Langmuir. 2003. V. 19. № 10. P. 4079.
Chu Z., Feng Y., Su X., Han Y. // Langmuir. 2010. V. 26. № 11. P. 7783.
Kuni F.M., Shchekin A.K., Rusanov A.I., Grinin A.P. // Colloid J. 2004. V. 66. № 2. P. 174.
Movchan T.G., Soboleva I.V., Plotnikova E.V., Shchekin A.K., Rusanov A.I. // Colloid J. 2012. V. 74. № 2. P. 239.
Lin Z. // Langmuir. 1996. V. 12. № 7. P. 1729.
Turner M.S., Marques C., Cates M.E. // Langmuir. 1993. V. 9. № 3. P. 695.
Kern F., Lequeux F., Zana R., Candau S.J. // Langmuir. 1994. V. 10. № 6. P. 1714.
Boek E.S., Jusufi A., Löwen H., Maitland G.C. // J. Phys. Condens. Matter. 2002. V. 14. P. 9413.
Al-Muntasheri G.A., Liang F., Hull K.L. // SPE Prod. Oper. 2017. V. 32. P. 186.
Philippova O.E., Khokhlov A.R. // Pet. Chem. 2010. V. 50. № 4. P. 266.
Danov K.D., Kralchevska S.D., Kralchevsky P.A., Ananthapadmanabhan K.P., Lips A. // Langmuir. 2004. V. 20. № 13. P. 5445.
Qi Y., Kesselman E., Hart D.J., Talmon Y., Mateo A., Zakin J.L. // J. Colloid Interface Sci. 2011. V. 354. № 2. P. 691.
Philippova O.E., Molchanov V.S. // Curr. Opin. Colloid Interface Sci. 2019. V. 43. P. 52.
Nettesheim F., Liberatore M.W., Hodgdon T.K., Wagner N.J., Kaler E.W., Vethamuthu M. // Langmuir. 2008. V. 24. № 15. P. 7718.
Luo M., Jia Z., Sun H., Liao L., Wen Q. // Colloids Surf. A. 2012. V. 395. P. 267.
Fan Q., Li W., Zhang Y., Fan W., Li X., Dong J. // Colloid Polym. Sci. 2015. V. 293. № 9. P. 2507.
Ismagilov I.F., Kuryashov D.A., Idrisov A.R., Bashkirtseva N.Y., Zakharova L.Y., Zakharov S.V., Alieva M.R., Kashapova N.E. // Colloids Surf. A. 2016. V. 507. P. 255.
Adamy S.T. // J. Surfactants Deterg. 2019. V. 22. № 5. P. 1189.
Zhao M., Zhang Y., Zou C., Dai C., Gao M., Li Y., Lv W., Jiang J., Wu Y. // Materials (Basel). 2017. V. 10. № 9. P.1096.
Chauhan G., Ojha K., Baruah A. // Brazilian J. Chem. Eng. 2017. V. 34. № 1. P. 241.
FernLey G.W. // J. Am. Oil Chem. Soc. 1978. V. 55. № 1. P. 98.
Gaynanova G.A., Valiakhmetova A.R., Kuryashov D.A., Bashkirtseva N.Y., Zakharova L.Y. // J. Surfactants Deterg. 2015. V. 18. № 6. P. 965.
Weers J.G., Rathman J.F., Axe F.U., Crichlow C.A., Foland L.D., Scheuing D.R., Wiersema R.J., Zielske A.G. // Langmuir. 1991. V. 7. № 5. P. 854.
Molchanov V.S., Efremova M.A., Orekhov A.S., Arkharova N.A., Rogachev A.V., Philippova O.E. // J. Mol. Liq. 2020. V. 314. P. 113684.
Tayebee R., Mazruy V. // J. Water Environ. Nanotechnol. 2018. V. 3. № 1. P. 40.
Luckham P.F., Rossi S. // Adv. Colloid Interface Sci. 1999. V. 82. № 1. P. 43.
Molchanov V.S., Efremova M.A., Kiseleva T.Y., Philippova O.E. // Nanosyst.: Phys., Chem., Math. 2019. V. 10. № 1. P. 76.
Kuklin A.I., Rogachev A.V., Soloviov D.V., Ivankov O.I., Kovalev Y.S., Utrobin P.K., Kutuzov S.A., Soloviev A.G., Rulev M.I., Gordeliy V.I. // J. Phys., Conf. Ser. 2017. V. 848. № 1. P. 012010.
Andreeva A.S., Philippova O.E., Khokhlov A.R., Islamov A.K., Kuklin A.I. // Langmuir. 2005. V. 21. № 20. P. 1216.
Iancu C.V., Tivol W.F., Schooler J.B., Dias D.P., Henderson G.P., Murphy G.E., Wright E.R., Li Z., Yu Z., Briegel A., Gan L., He Y., Jensen G.J. // Nat. Protoc. 2007. V. 1. P. 2813.
Christov N.C., Denkov N.D., Kralchevsky P.A., Ananthapadmanabhan K.P., Lips A. // Langmuir. 2004. V. 20. № 3. P. 565.
Paineau E., Michot L.J., Bihannic I., Baravian C. // Langmuir. 2011. V. 27. № 12. P. 7806.
Calabrese M.A., Rogers S.A., Murphy R.P., Wagner N.J. // J. Rheol. 2015. V. 59. № 5. P. 1299.
Granek R., Cates M.E. // J. Chem. Phys. 1992. V. 96. № 6. P. 4758.
Jodar-Reyes A.B., Leermakers F.A.M. // J. Phys. Chem. B. 2006. V. 110. P. 18415.
Sambasivam A., Sangwai A. V, Sureshkumar R. // Langmuir. 2016. V. 32. № 5. P. 1214.
Qin W., Yue L., Liang G., Jiang G., Yang J., Liu Y. // Chem. Eng. Res. Des. 2017. V. 123. № 18. P. 14.
Helgeson M.E., Hodgdon T.K., Kaler E.W., Wagner N.J., Vethamuthu M., Ananthapadmanabhan K.P. // Langmuir. 2010. V. 26. № 11. P. 8049.
Ramsay J.D.F., Lindner P. // J. Chem. Soc., Faraday Trans. 1993. V. 89. № 23. P. 4207.
Pletneva V.A., Molchanov V.S., Philippova O.E. // Langmuir. 2015. V. 31. № 1. P. 110.
Kwiatkowski A.L., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Philippova O.E. // J. Phys. Chem. B. 2016. V. 120. № 49. P. 2547.
Croce V., Cosgrove T., Dreiss A., King S., Maitland G., Hughes T. // Langmuir. 2005. № 20. P. 6762.
Manero O., Bautista F., Soltero J.F.A., Puig J.E. // J. Nonnewton. Fluid Mech. 2002. V. 106. № 1. P. 1.
Anderson V.J., Pearson J.R., Boek E.S. // Rheol. Rev. 2006. P. 217.
Couillet I., Hughes T., Maitland G., Candau F. // Macromolecules. 2005. V. 38. № 12. P. 5271.
Rogers S.A., Calabrese M.A., Wagner N.J. // Curr. Opin. Colloid Interface Sci. 2014. V. 19. № 6. P. 530.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)


