Высокомолекулярные соединения (серия С), 2022, T. 64, № 2, стр. 192-205
ПОСЛЕДНИЕ ДОСТИЖЕНИЯ В ОБЛАСТИ СИНТЕЗА ПОЛИКАРБОРАНСИЛОКСАНОВ
В. А. Васнев a, Г. Д. Маркова a, *
a Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: mgaly@yandex.ru
Поступила в редакцию 19.04.2022
После доработки 12.07.2022
Принята к публикации 26.07.2022
- EDN: HKUWNI
- DOI: 10.31857/S2308114722700157
Аннотация
Рассмотрены результаты работ по синтезу и исследованию поликарборансилоксанов, опубликованные после 2000 г. Приведены данные, полученные при С- и В-замещении карборанового ядра. Оценены основные характеристики синтезированных полимеров, среди которых термические, механические и другие.
ВВЕДЕНИЕ
Поликарборансилоксаны – это элементоорганические полимеры, модифицированные в основной или боковой цепи карборановыми структурами. Полисилоксаны сами по себе обладают уникальными характеристиками, в частности достаточно высокой термической и термоокислительной стойкостью, устойчивостью к низким значениям температуры, проявляют биологическую инертность и т.д. Это позволяет использовать их в качестве различных материалов и изделий: эластомеров, каучуков, смол, лаков, масел, смазок и других. Полисилоксаны сохраняют свои свойства в широком интервале температуры от –100 до 250°С. Однако для современной промышленности таких показателей уже недостаточно. Одним из перспективных направлений решения поставленных задач является введение карборанов в структуру полисилоксанов. В данном случае, это клозо-карборан, который представляет собой полный многогранник (икосаэдр) формулы С2B10H12. Карбораны по расположению атомов углерода имеют три изомера: орто-, мета- и пара-. При высоких значениях температуры происходит последовательное превращение орто- изомера в мета- и пара-:
Начиная с 60-х годов ХХ века, был выполнен обширный цикл исследований по разработке методов синтеза различных карборансодержащих мономеров и полимеров на их основе, изучен механизм химических превращений в полимерах, позволивший понять причины их термического своеобразия.
Карборансодержащие полиамиды, сложные полиэфиры, полиуретаны, полифосфазены, полисилоксаны, фенолформальдегидные и эпоксидные полимеры и прочие – чрезвычайно интересные классы полимеров со специфическими свойствами. Так называемые полимеры специального назначения, прежде всего в тех областях, где от материалов требуются повышенные термические характеристики.
В настоящее время среди указанных полимеров особое внимание уделяется кремнийорганическим карборансодержащим соединениям, в частности поликарборансилоксанам. Так, большую практическую ценность имеют поликарборансилоксаны, сочетающие термическую стойкость до 500°С с хорошей огнестойкостью. На их основе созданы клеевые композиции, способные длительно (до 2000 ч) работать при 600°С и выдерживать кратковременное воздействие температуры до 1200°С. Эти клеи предназначены для склеивания полупроводниковых материалов с металлами и силикатными стеклами. Поликарборансилоксаны используют и в качестве покрытий для проводов в конструкциях, подвергающихся облучению при высокой температуре. Одной из важнейших областей применения карборансилоксанов является получение термостойкой керамики. Также поликарборансилоксаны нашли широкое применение в качестве жидких фаз в газовой хроматографии для разделения кремнийорганических и органических веществ и для анализа циклических ароматических углеводородов в широком диапазоне температуры 20–450°С. Помимо карборансилоксановых жидкостей, интересно получение полимерных сеток с использованием карборансилоксанов, на основе которых можно создать резины с уникальным комплексом свойств.
Интерес к карборанам как модификаторам полисилоксанов был вызван несколькими причинами. Во-первых, карборановые структуры характеризуются высокой термической и термоокислительной стабильностью. Во-вторых, карборановое ядро служит акцептором электронов (сильная кислота Льюиса), которое способно образовывать стабильные комплексы с силоксановыми связями (основания Льюиса). В-третьих, объемная жесткая структура карборанового ядра уменьшает физическое взаимодействие между силоксановыми цепями, что также повышает стабильность последних.
Карборановые циклы могут быть включены в полисилоксаны как через атомы углерода, так и бора (соответственно С- и В-замещение). Для этой цели применяют различные методы полимерной химии – поликонденсацию, полимеризацию, полиприсоединение, полимераналогичные превращения и другие. В данном обзоре сопоставлены результаты синтеза поликарборансилоксанов, содержащих С- и В-замещенные карборановые ядра. Так как в этой области имеется достаточное количество монографий и обзоров [1–7], то будут рассмотрены результаты, полученные после 2000 г.
С-ЗАМЕЩЕННЫЕ КАРБОРАНЫ
Подавляющее большинство поликарборансилоксанов получено при С-замещении карборанов.
На основе м-карборансодержащих термопластов, содержащих силоксандиацетиленовые группы, синтезированы термореактивные и керамические коксы [8]. В качестве исходных полимеров использованы полидиацетиленсилоксаны (I), полидиацетиленсилоксанкарбораны (II) и сополимеры III с содержанием звеньев I и II, равным 90 : 10. При отжиге образцов в течение 100 ч при 316°C на воздухе из II и III образуются хрупкие продукты с температурой стеклования выше 340°C, тогда как из II формируется прочный продукт с температурой стеклования ниже 94°C. При отжиге при 800°C у всех образцов выход кокса составляет 80%, но в случае II, наблюдается более плотный кокс. К сожалению, в статье не рассматриваются методы синтеза и свойства исходных структур I–III.
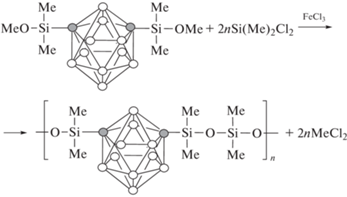
Интересные результаты исследования влияния м-карборановых групп на термическую стабильность полисилоксановых эластомеров приведены в работах [9, 10]. Эластомеры были синтезированы поликонденсацией бис-(диметилметоксисилил)-м-карборана с дихлордиметилсиланом или смеси дихлордиметилсилана с дихлорметилфенилсиланом в присутствии кислоты Льюиса (хлорида железа) в качестве катализатора:
Поли-м-карборансилоксан с диметилсилильными группами показывает небольшую кристалличность, тогда как полимеры с метилфенильными группами являются аморфными и обладают хорошими эластичными свойствами. Дифференциально-термический анализ на воздухе показал, что поли-м-карборансилоксаны проявляют повышенную термическую стабильность по сравнению с обычным полисилоксаном. Данные ИК-спектров подтверждают целостность каркаса м-карборана при значениях температуры до 580°С. Данные ДТА в сочетании с инфракрасными исследованиями свидетельствуют об экзотермическом расщеплении фрагмента м-карборана при более высоких значениях температуры.
В развитии этого исследования поли-м-карборанилсилоксановые эластомеры, содержащие смесь диметил- и метил(фенил)-силильных звеньев, были подвергнуты термическому и радиационному воздействию: их нагревали на воздухе при повышенной температуре и подвергали γ-облучению от 60Co источника [11, 12]. Для оценки деструкции полимеров использовался метод спектроскопии ЯМР 1H, ЯМР 13C и ЯМР 11B в растворе и в твердом теле. Обнаружено, что дозы γ-облучения до 1 MГр вызывают лишь небольшое снижение свойств эластомера. Нагревание при температуре ниже 350°C также показало небольшое уменьшение подвижности цепей и сопутствующую потерю массы, измеренную с помощью ДСК. При температуре выше 350°C деструкция эластомера была более существенной. Выявлено, что целостность каркаса м-карборана и сегментарная динамика значительно понижаются при значениях температуры выше 580°C, что соответствует известной температуре перестройки каркаса для икосаэдрических карборанов.
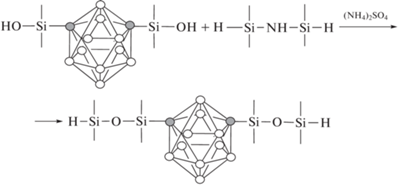
В работе [13] был разработан новый, удобный способ синтеза поликарборансилоксанов поликонденсацией 1,7-бис-(диметилгидроксил-силил)-м-карборана с циклосилазаном в присутствии (NH4)2SO4:
Полимеры с винильными группами при нагревании образуют сшитые структуры с высокой термической стабильностью. Так, выход кокса при нагревании на воздухе до 800°C и в азоте до 1000°C составляет боле 83%. Обнаружено, что сшивание винильных групп способствует повышению термической стабильности полимеров и сохранению целостности кокса.
Впервые детально изучена кинетика поликонденсации в массе диметилметокси-м-карборана и дихлордиметилсилана в присутствии FeCl3 [14]:
Путем мониторинга реакции полидиметилсилоксана с концевыми метокси-группами и дихлордиметилсилана с использованием метода спектроскопии ЯМР 1H была найдена скорость определяющей стадии реакции. Энергия активации оказалась равной +43.6 кДж/моль. Образование электрофильных промежуточных соединений на первой стадии реакции было исследовано с помощью циклической вольтаметрии. Показано, что, первоначальное предсказание обратимости первой стадии реакции оказалось неверным. Об этом свидетельствует уменьшение нормализованного максимального пика окисления с увеличением скорости сканирования, что указывает на механизм химической реакции с переносом электронов.
Стабильные к термоокислительной деструкции поли-м-карборансилоксанарилацетилены (IV) были синтезированы поликонденсацией 1,7-бис-(хлортетраметилдисилоксил)-м-карборана с димагниевыми солями м-диэтинилбензола или п-диэтинилбензола [15]:
По данным методов ИК-фурье, твердотельного ЯМР 13C, ЯМР 29Si и РСА термическая обработка полимеров при температуре 500°C приводит к формированию полностью сшитого термореактивного материала в результате реакции циклоприсоединения с участием ацетиленовых и арильных функциональных групп и последующего образования мостиковых дисилилметиленовых связей. Рентгеноструктурный анализ показал, что термореактивные материалы, полученные из пара-IV, обладают повышенной кристалличностью по сравнению с таковой, полученной из мета-IV. Присутствие арильных групп в структуре IV увеличивает модули упругости и объема термореактивных материалов по сравнению с таковыми на основе не содержащих м-карборан полисилоксанацетиленов. Диэлектрические исследования полученных поли-м-карборансилоксанарилацетиленов выявили сегментарные пики релаксации выше их температуры стеклования, при этом п-производные демонстрируют более широкий пик с более низкой скоростью релаксации, чем м-изомеры.
Важные результаты были получены при изучении влияния карборановых групп на свойства элементоорганических клеев [16]. Показано, что модификация клеевых композиций бис-(гидроксиметил)карбораном приводит к увеличению прочностных характеристик адгезивных композитов и их термостойкости при 400°C. К сожалению, в работе не указаны структуры использованных соединений.
Карборановые жидкие силиконовые смолы без растворителей синтезированы реакцией гидросилилирования [17]:
Структура и термические свойства силиконовых смол были охарактеризованы методами ЯМР, ИК-фурье, ДСК, ТГА и ДМА. Отвержденные силиконовые смолы, содержащие карборан, имели лучшую термостойкость и термоокислительную стабильность, чем их традиционные аналоги. Метод ДМА показал, что отвержденные силиконовые смолы имеют хорошие перспективы для применения в качестве демпфирующих материалов. Выявлено, что для карборансодержащей силиконовой смолы, приклеенной к нержавеющей стали, тест на прочность на сдвиг внахлест был выше, чем для традиционной силиконовой смолы. Найдено, что прочность сцепления адгезива повышается с увеличением содержания карборана.
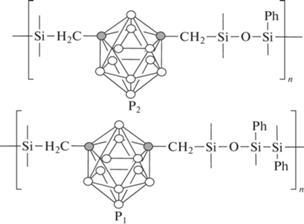
Интересный подход представлен в работе [18], где авторы сначала разрабатывают эффективные и простые способы синтеза мономеров, а именно 1,7-бис-(гидроксил(диметил)силилметил)-м-карборана (М1) и 1,7-бис-[диэтиламино(диметил)силилметил]-м-карборана (М2):

Поликонденсацией М1 с диэтиламинометилфенилсиланом М4 или М2 с 1,3-диметил-1,3-дифенилсилоксандиола (М3) получают соответственно полимеры Р2 и Р1:
Структура мономеров и полимеров была доказана методами ЯМР и ИК-фурье. Из смеси полимеров Р1 и Р2, SiO2 и полисилазана синтезированы эластомеры E1 и Е2. Результаты ДСК и ТГА продемонстрировали, что эти эластомеры по сравнению с полимерами Р1 и Р2 обладают лучшей термической и термоокислительной стабильностью с 5%-ной потерей массы при температуре выше 570, 650°C в азоте и 536, 730°C на воздухе. С помощью РСА и твердотельного ЯМР 29Si показано, что на поверхности эластомеров карборан и органосилоксан постепенно окисляются до B2O3 и SiO2 соответственно, а внутри образцов происходит расщепление связи Si–Ph, вызванное концевыми гидроксильными группами, что приводит к разветвлению цепи и замедлению доступа кислорода для внутреннего окисления.
Поли-м-карборансилоксаны заданной молекулярной массы с различными боковыми группами были синтезированы поликонденсацией м-карборансодержащих дисиланолов и бис-уреидосиланов [19]:
Метод TГА показал, что термическая циклизация полисилоксанов в азоте значительно уменьшается за счет карборановых ядер, поскольку силоксановые связи внутри основной цепи усилены индуктивным эффектом карборана. Результаты ДСК и ИК-фурье подтвердили, что как силоксановый блок, так и карборановые ядра окисляются при повышенной температуре на воздухе, что способствует превращению полимеров в смесь SiO2 и B2O3 и высокому выходу кокса. Кроме того, электронный эффект боковых групп также влияет на разложение полисилоксанов, содержащих м-карборан. Температура начальной деструкции увеличивается с изменением природы заместителя в порядке: CH2CH2CF3 < CH3 ≈ Ph < CH=CH2.
Из приведенных выше структур поликарборансилоксанов следует, что все они содержат связь Скб-Si, которая не отличается достаточно высокой термической и химической стабильностью [20]. Для устранения этого недостатка необходимо ввести метиленовую группу между атомом кремния и карборановым ядром, что придает стабильность образующейся связи Cкб-CH2–Si [21]. Для решения этой задачи были выполнены исследования реакций замещения о- и м-карборанов с различными производными силоксанов, результаты которых могут быть положены в основу синтеза новых мономеров и полимеров.
Впервые с использованием 1,7-бис-(галоидмагнийметил)-м-карборана разработан эффективный способ синтеза 1,7-бис-[хлор(диметил)-силилметил]-м-карборана – прекурсора для получения поликарборансилоксанов [22]:
Следует отметить, что при взаимодействии 1,2-бис-(броммагнийметил)-о-карборана с четырехкратным избытком диметилдиметоксисилана образуется смесь из 1,2-бис-(метоксидиметилсилилметил)-о-карборана и 1,2-(о-карборанилено)-4,6-бис-(диметилсилил)-5-окса-циклогептана. В случае м-изомера в аналогичных условиях образуется только 1,7-бис-(метоксидиметилсилилметил)-м-карборан [23].
В развитии новых подходов использования реактива Гриньяра для синтеза алкоксисилилметил-о-карборанов найдены оптимальные условия проведения реакции 1-броммагнийметил-о-карборана с алкоксисиланами [24].
Впервые получены карборанилметилсодержащие силоксаны из неизвестных ранее галоидмагнийметилкарборанов [25]:
В случае реакции 1,2-бис-(броммагнийметил)-о-карборана с четырехкратным мольным избытком 1,3-дихлор-1,1,3,3-тетраметилдисилоксана получен необычный результат, так как в этом случае образуется только экзоциклическое соединение – 1,2-(о-карборанилено)-4,6-бис-(диметилсилил)-5-окса-циклогептан:
При взаимодействии 1,7-бис-(броммагнийметил)-м-карборана с 1,3-дихлор-1,1,3,3-тетраметилдисилоксаном в зависимости от соотношения реагентов образуется 1,7-бис-(хлор-1,1,3,3-тетраметилдисилоксанилметил)-м-карборан или димер:
Новый подход для получения карборанилметилсилоксанов разработан на основе взаимодействия карборансодержащих реактивов Гриньяра с хлорсиланами [26, 27]. В частности, найдено, что при проведении реакции 1-броммагнийметил-о-карборана с избытком диметилдихлорсилана, метилтрихлорсилана и тетрахлорсилана образуются с выходом до 80% хлор(диметил)силилметил-о-карборан, 1-дихлор(метил)силилметил-о-карборан и 1-трихлорсилилметил-о-карборан соответственно:
Результаты исследований по синтезу кремнийсодержащих карборановых структур открывают перспективу получения высокотермостойких и химически стойких поликарборансилоксанов с группами Cкб,-CH2–Si.
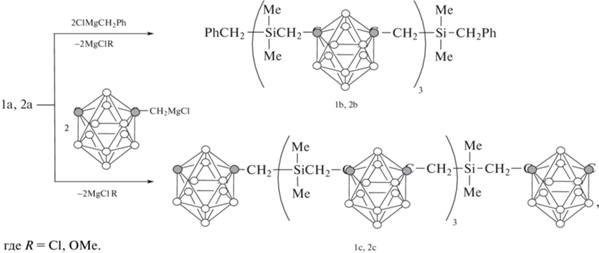
В развитии этих работ получены и исследованы новые олиго-м-карбораниленметиленсиланы, содержащие связи Скб-CH2–Si [28]. Ниже представлены олиго(диметил)силаны с 1,7-бис-(метил)-м-карборановыми звеньями и концевыми группами хлор(диметил)силильными – олигомер (1a) или метокси(диметил)силильными – олигомер (2a):
Схема синтеза олигомеров 1b, 2b с концевыми бензильными группами и олигомеров 1с, 2c с концевыми м-карборанилметильными группами показана ниже:
Элементный анализ, ИК- и ЯМР-спектроскопия подтверждают строение полученных олигомеров, которые являются вязкими жидкостями, растворимыми в органических растворителях. По данным ТГА, потеря массы на воздухе и в инертной среде олигомера 1b с концевыми бензильными группами начинается соответственно при 400 и 480°С, тогда как у олигомера 1с с концевыми м-карборанилметильными группами при 510 и 580°С.
Другой возможностью получения поликарборансилоксанов с группами Cкб,-CH2–Si было использование нового мономера – 1,7-бис-[гидрокси(диметил)силилметил]-м-карборана (диола). На основе диола и бис-(диметиламино)диорганосиланов синтезированы и исследованы новые термостойкие полимеры и вулканизаты на их основе [29, 30]. Ниже показана поликонденсация 1,7-бис-[гидрокси(диметил)силилметил]-м-карборана с бис-[(диметил)амино]диорганосиланами (R, R' и x, y, z см. в табл. 1):
Таблица 1.
Состав, молекулярные массы и значения температуры стеклования полимеров 1–9
| Образец, № | Брутто-формула | R | R' | Количество звеньев, мол. доли | Mw × 103 | Tс, °C | ||
|---|---|---|---|---|---|---|---|---|
| х | y | z | ||||||
| 1 | C10H32B10О2Si3 | Me | Me | 1 | 0 | 0 | 47 | –50 |
| 2 | C15H34B10О2Si3 | Me | Ph | 1 | 0 | 0 | 137 | –13 |
| 3 | C20H36B10О2Si3 | Ph | Ph | 1 | 0 | 0 | 130 | –35 |
| 4 | С11.85H32/66B10O2Si3 | Me | Ph | 0.67 | 0.33 | 0 | 132 | –38 |
| 5 | С13.35H33.34B10O2Si3 | Me | Ph | 0.33 | 0.67 | 0 | 55 | –23 |
| 6 | С12.40H32.96B10O2Si3 | Ph | Ph | 0.76 | 0.24 | 0 | 153 | –33 |
| 7 | С13.3H33.3B10O2Si3 | Ph | Ph | 0.67 | 0.33 | 0 | 165 | –26 |
| 8 | С11.62H32.66B10O2Si3 | Me | Ph | 0.66 | 0.33 | 0.01 | 125 | –38 |
| 9 | С13.27H33.32B10O2Si3 | Ph | Ph | 0.66 | 0.33 | 0.01 | 153 | –25 |
Строение полимеров 1–9 подтверждено элементным анализом, ЯМР и ИК-спектроскопией. Они являются твердыми веществами, растворимыми в органических растворителях. Полимеры 2–9 отличаются высокой термостойкостью. Значения температуры начала их разложения и температуры, при которых отмечены максимальные потери массы, лежат в достаточно узких интервалах: в аргоне при 380–425 и 520–570°С; на воздухе при 350–380 и 435–570°С соответственно. На основе поликарборансилоксанов 8 и 9 получены термостойкие вулканизаты; наполненные SiO2 они обладают высокими прочностными свойствами при значениях температуры от –40 до 300°С и устойчивы к воспламенению – их кислородный индекс достигает 65. Для сравнения, кислородный индекс вулканизата из промышленного низкотемпературного полидиметилсилоксанового каучука, содержащего 30 весовых частей диоксида кремния, составляет всего 37.
В-ЗАМЕЩЕННЫЕ КАРБОРАНЫ
Имеется большое количество публикаций, посвященных получению В-замещенных карборанов, в том числе по синтезу их функциональных производных [1, 31]. К сожалению, практически отсутствуют работы по полимерам, содержащим В-замещенные карбораны, в том числе по В-замещенным поликарборансилоксанам. Однако, начиная с 2016 г. стали появляться фундаментальные работы по этой тематике [32–34]. На первом этапе были синтезированы В-замещенные карбораны с моно- и дифункциональными группами: 9-аллил-м-карборан и 9,12-диаллил-о-карборан [32, 34], с помощью которых получены поликарборансилоксаны различной микроструктуры, содержащие карборан на концах цепи, в главной цепи в качестве боковых заместителей и в структуре силсесквиоксанов. Строение полимеров с различным расположением карборановых групп в ПДМС было подтверждено методами ЯМР, ИКС и ГПХ.
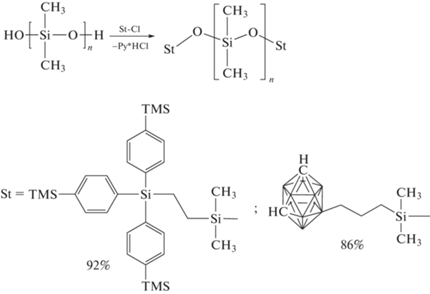
Представляет интерес работа по оценке влияния концевых объемных карборанильных групп на физико-химические свойства ПДМС [32]. Для этой цели синтезированы полидиметилсилоксаны с концевыми карборанильными группами, влияние которых было сопоставлено с объемными трис-(4-триметилсилилфенил)силильными концевыми группами Схема синтеза таких ПДМС приведена ниже:
Введение объемных концевых групп в структуру ПДМС небольшой молекулярной массы (7.0 × 103) подавляет кристаллизацию и повышает температуру стеклования. В случае ПДМС бóльшей молекулярной массы (35.0 × 103) введение объемных концевых групп не влияет на его теплофизические и реологические свойства.
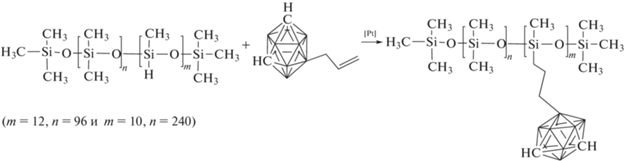
Для получения полимеров с карборановыми фрагментами в главной цепи сначала были синтезированы диметилсилоксановые олигомеры с концевыми гидридными функциональными группами. Далее полученные олигомеры использовались в реакции гидросилилирования с 9,12-диаллил-о-карбораном в присутствии катализатора Карстеда:
В результате получены полимеры с карборановыми фрагментами в главной цепи и различной длиной силоксанового блока [34]. Установлено, что введение карборана подавляет кристаллизацию полимеров с молекулярной массой (17.0–59.0) × 103 и числом звеньев в силоксановом блоке от 11 до 55. Можно предположить, что введение в силоксановую цепь объемных карборановых фрагментов влияет на подвижность главной цепи и препятствует упаковке макромолекул. Кристаллизация появляется лишь у полимера, содержащего 126 диметилсилоксановых звеньев. Реологическими исследованиями выявлено, что у полимеров вязкость не зависит от скорости сдвига, что характерно для ньютоновских жидкостей.
Для оценки влияния расположения карборана на свойства ПДМС получены поликарборансилоксаны с карборановыми ядрами в качестве боковых групп [34]. С этой целью на первой стадии равновесной катионной полимеризацией синтезированы полимеры с распределенными по цепи гидридными группами. На второй стадии реакцией гидросилилирования в присутствии катализатора Карстеда, полученных полимеров 9-аллил-м-карбораном, синтезированы поликарборансилоксаны с различной длиной цепи и разным содержанием карборановых фрагментов в виде боковых радикалов:
Введение карборана в виде привесок к диметилсилоксановой цепи подавляет кристаллизацию полимеров, которые являются ньютоновскими жидкостями. Интересно отметить, что у всех полимеров с различным числом карборановых ядер не повышает термостойкость.
Заслуживает внимание работа по синтезу карборансодержащих органосилсесквиоксанов [33]. Одним из направлений был синтез трифункционального прекурсора – 9–γ-трихлорсилилпропил-м-карборана, который гидролизом с последующей конденсацией превращали в целевой октасилсесквиоксановый продукт с клозо-карборанильными заместителями:
Строение полученного соединения подтверждено элементным анализом, ЯМР, ИКС и масс-спектрометрией. Методом РСА установлена его молекулярная и кристаллическая структура. По данным ТГА силсесквиоксановое производное карборана обладает достаточно высокой температурой начала деструкции (около 400°С) с высоким выходом кокса (52%) при температуре 600°С. Полученный продукт может быть использован в качестве нанонаполнителя для получения термостойких композиционных материалов.
Будущее развитие В-замещенных поликарборансилоксанов во многом зависит от работ по синтезу новых В-замещенных мономеров с функциональными группами, способными участвовать в формировании полисилоксановых структур. К таким работам относится синтез B-[хлорсилил(органо)метил]-замещенных о-карборанов из хлорметил(органо)хлорсиланов и о-карборана в присутствии хлористого алюминия [35, 36]. Было найдено, что в условиях проведения реакции происходит монозамещение В–Н-атомов в карборановых ядрах с образованием изомеров В-хлор(органо)силилметил-о-карборанов при атомах 9(12) или 8(10) в приблизительно равном количестве:
Полученные по известным реакциям о-карбораны с хлорсилильными группами можно использовать для модификации полисилоксанов.
ЗАКЛЮЧЕНИЕ
Анализ литературных данных показал, что те преимущества, которые дает введение карборана в структуру полисилоксанов, привлекает внимание исследователей к таким полимерам. Действительно, высокая термостойкость, хорошая огнестойкость, потенциальная защита от нейтронного облучения и другое – это уникальные качества, вызывающие большой прикладной интерес. Конечно, высокая стоимость карборана будет определять конкретные направления работ, способствующие дать наибольший эффект. Необходимо учитывать, что могут появиться новые возможности от введения карборана в структуру полимера. В частности, это может быть связано с химическими превращениями карборанового ядра, протекающими при повышенной температуре, что может привести в результате взаимодействия с полимерной матрицей к образованию новых высокотермостойких сетчатых структур. Это открывает перспективу использования небольшого количества карборана и его производных в качестве модификаторов полимерных материалов.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации.
Список литературы
Grimes R.N. Carboranes. London: Acad. Press, 2016.
Коршак В.В., Замятина В.А., Бекасова Н.И. Борорганические полимеры. М.: Наука, 1975.
Peters E.K. // J. Ind. Eng. Chem. Prod. Res. Dev.: Review section. 1984. V. 23. P. 28.
Patel M., Swain A.C. Macromolecules Containing Metal and Metal-Like Elements / Eds. by A. Abd-El-Aziz, Ch. Carraher jr., Ch. Pittman jr., M. Zeldin. New York: Wiley, 2007. P. 77. V. 8.
Anisimov A.A., Zaitsev A.V., Ol’shevskaya V.A., Buzin M.I., Vasil’ev V.G., Shchegolikhina A.M., Muzafarov A.M. // J. INEOS OPEN. 2018. V. 1. № 2. P. 71.
Vinas C., Nunez R., Romero I., Teixidor F. Smart Inorganic Polymers: Synthesis, Properties, and Emerging Applications in Materials and Life Sciences / Eds. by E. Hey-Hawkin, M. Hissler. New York: Wiley, 2019. P. 41.
Jiaqi Sun, Muyao Gao, Lihua Zhao, Yangzhong Zhao, Tianhao Li, Re Chen, Xiao Hu, Liu He, Qing Huang, Ming Liu, Yajie Song // React. Functional Polym. 2022. V. 173. P. 105213.
Armistead J.P., Houser E.J., Son D.Y., Keller T.M. // Mat. Res. Soc. Symp. Proc. 1999. V. 576. P. 93.
Patel M., Swain A.C., Skinner A.S., Mallinson L.G., Hayes G.F. // Macromol. Symp. 2003. V. 202. P. 47.
Patel M., Swain A.C. // Polym. Degrad. Stab. 2004. V. 83. P. 539.
Swain A.C., Patel M., Murphy J.J. // Mater. Res. Symp. Proc. 2005. V. 851. № 8.7.1.-7.5.
Patel M., Swain A.C., Cunningham J.L., Maxwell R.S., Chinn S.C. // Polym. Degrad. Stab. 2006. V. 91. P. 548.
Zhanga X., Konga L., Daia L., Zhanga X., Wanga Q., Tana Y., Zhanga Z. // Polymer. 2011. V. 52. P. 4777.
Apedaile A., Liggat J., Parkinson J., Nikiforidis G., Berlouis L., Patel M. // J. Appl. Polym. Sci. 2012. V. 123. P. 2601.
Kolel-Veetil M.K., Dominguez D.D., Klug Ch.A., Fears K.P., Qadri S.B., Fragiadakis D., Keller T.M. // J. Polym. Sci., Polym. Chem. 2013. V. 51. P. 2638.
Petrova P., Lukina N.F., Kotova E.V. // J. Polym. Sci. D. 2014. V. 7. № 2. P. 89.
Xie J., Sun H., Zhang X., Xie Z., Zhang Z. // J. Phosph. Sulf. Silicon Related Elements. 2015. V. 190. № 3. P. 277.
Lou P., Zhang X., Liu B., Gao X., Zhang Z., Xie Z. // Polym. Degrad. Stab. 2017. V. 144. P. 304.
Yang X., Zhao Y., Wang C., Zhang X., Jiang S., Yafei L jr. // IOP Conf. Ser. Mater. Sci. Eng. 2017. V. 250. P. 012009.
Андрианов К.А., Астапов Б.А. // Докл. АН СССР. 1976. Т. 227. № 6. С. 1357.
Kalinin V.N., Izmaylov B.A., Kazantzev A.A., Myakushev V.D., Zhdanov A.A., Zakharkin L.I. // J. Organomet. Chem. 1981. V. 216. P. 295.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Inorg. Chim. Acta. 2018. V. 471. P. 475.
Izmaylov B.A., Bai J.P., Vasnev V.A., Markova G.D. // J. Organomet. Chem. 2018. V. 867 P. 220.
Izmaylov B.A., Vasnev V.A., Markova G.D. // J. INEOS OPEN. 2018. V. 1. № 2. P. 25.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Dokl. Chem. 2019. V. 486. Part 1. P. 119.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Mendeleev Commun. 2019. V. 29. № 2. P. 194.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Russ. Chem. Bul. 2019. V. 68. № 1. P. 1.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Russ. Chem. Bull. 2020. V. 69. № 6. P. 1130.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Dokl. Chem. 2019. V. 488. № 2. P. 249.
Izmailov B.A., Vasnev V.A., Markova G.D. // Polymer Science B. 2020. V. 62. № 3. P. 176.
Bregadze V.I. // Chem. Rev. 1992. V. 92. P. 208.
Anisimov A.A., Zaytsev A.V., Ol’shevskaya V.A., Buzin M.I., Vasil’ev V.G., Boldyrev K.L., Shchegolikhina O.I., Kalinin V.N., Muzafarov A.M. // Mendeleev Commun. 2016. V. 26. P. 524.
Anisimov A.A., Ol’shevskaya V.A., Novikov R.A., Korlyukov A.A., Buzin M.I., Shchegolikhina O.I., Kalinin V.N., Muzafarov A.M. // J. Organomet. Chem. 2016. V. 822. P. 1.
Анисимов A.A. Дис. … канд. хим. наук. М.: ИНЭОС РАН, 2017.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Dokl. Chem. 2020. V. 492. № 1. P. 71.
Izmaylov B.A., Vasnev V.A., Markova G.D. // Mendeleev Commun. 2021. V. 31. № 1. P. 130.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)