Водные ресурсы, 2022, T. 49, № 1, стр. 77-90
К вопросу о биоиндикации нефтяного загрязнения пресноводных лимнических экосистем с использованием зоопланктона на примере озера Cамотлор (ХМАО)
Н. И. Ермолаева *
Институт водных и экологических проблем СО РАН,
Новосибирский филиал
630090 Новосибирск, Россия
* E-mail: hope413@mail.ru
Поступила в редакцию 09.06.2020
После доработки 30.06.2021
Принята к публикации 15.07.2021
- EDN: UEGIMG
- DOI: 10.31857/S0321059622010060
Аннотация
Показано, что присутствие нефтяных углеводородов в воде может оказывать как угнетающее, так и стимулирующее влияние на развитие отдельных видов зоопланктона. Численность и биомасса зоопланктонного сообщества, как и количественные показатели отдельных групп, не могут быть надежными индикаторами, характеризующими качество воды. Загрязненность различных участков озера нефтепродуктами отражает соотношение отдельных видов внутри групп. На наиболее загрязненных участках преобладают веслоногие рачки, снижается видовое разнообразие коловраток и фитофильных форм ветвистоусых. При оценке состояния озер после нефтяного загрязнения необходимо пользоваться комбинаторными индексами биологической индикации, по возможности охватывая все звенья экосистемы.
ВВЕДЕНИЕ
Объем добычи и транспортировки сырой нефти растет как в мировом масштабе, так и в масштабе Западной Сибири, на территории которой в настоящий момент открыто порядка пятисот нефтяных, нефтегазоконденсатных и нефтегазовых месторождений, которые содержат в себе 73% всех разведанных на данный момент запасов российской нефти. Загрязнение природной среды, в частности водных объектов, нефтью и сопутствующими загрязнителями в районах размещения нефтегазодобывающих промыслов – острейшая экологическая проблема. Загрязнение рек и озер на территории Западносибирских нефтегазовых месторождений имеет хронический характер и, как правило, связано с нарушением технологического режима добычи, подготовки и транспортировки нефти, с различными авариями [4, 5]. Экологические последствия разливов в пресноводных экосистемах остаются недостаточно изученными. Наибольшую опасность для водоемов представляет загрязнение нефтью и высокоминерализованными водами, поступающими из нижних водоносных горизонтов при закачке в них подпорных вод. Под влиянием нефтяного и минерального загрязнения происходят существенные изменения структуры водных биоценозов. При этом зоопланктон практически не исследован как возможный компонент экологического мониторинга нефтяного загрязнения водоемов [23].
Класс опасности сырой нефти и нефтепродуктов в международной классификации определен как невысокий [15], и экологическим бедствием считается превышение рыбохозяйственного ПДК (ПДКрх) в воде в ≥15 раз. ПДК для нефти и нефтепродуктов (за исключением бензина) в почвах и донных отложениях не утверждены, что позволяет разрабатывать региональные нормативы. В соответствии с Российскими законами, региональные нормы не могут быть ниже требований и норм, установленных на федеральном уровне [14], в которых указано, что допустимо содержание нефтепродуктов в почвах <1.0 г/кг; уровень загрязнения, г/кг: 1.0–2.0 – низкий; 2.0–3.0 – средний; 3.0–5.0 – высокий; > 5.0 – очень высокий [3, 9 ] .
Зоопланктон – хороший биоиндикатор для оценки направленности изменений экосистем озер, поскольку большинство таксонов зоопланктона имеет относительно короткий период смены поколений и изменения условий окружающей среды быстро отражаются на структуре сообщества [20, 24, 25, 27, 29]. Однако проблема использования зоопланктона как индикатора нефтяного загрязнения пресноводных экосистем к настоящему времени далека от разрешения. Большая часть информации, касающейся воздействия нефти на зоопланктон, получена в результате морских [16–19, 22, 26, 28] либо лабораторных [21] исследований. Вместе с тем из-за видовых различий морские и пресноводные организмы зоопланктона могут иметь разную степень чувствительности к нефти. Кроме того, как правило, изучаются процессы, происходящие при разовом залповом воздействии (аварийные разливы), тогда как хроническое загрязнение, которое наблюдается при добыче нефти непосредственно в районе расположения пресных внутриконтинентальных водоемов, остается вне внимания исследователей зоопланктона.
Цель данной работы — оценка возможности использования зоопланктона в качестве индикатора хронического нефтяного загрязнения пресных озер на территориях активно разрабатываемых нефтяных месторождений.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
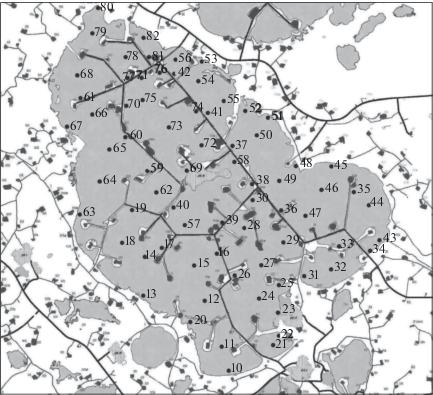
Самотлорское нефтегазовое месторождение находится в центральной части Западно-Сибирской равнины в пределах Нижневартовского района Ханты-Мансийского автономного округа Тюменской области. Его площадь составляет >2400 км2. Самотлор – самое крупное озеро в Самотлорской группе. До начала освоения месторождения оно имело площадь 63 км2, глубину – 1.5–3.0 м. Было проведено отсыпание искусственных островов для буровых вышек нефтедобычи. В 1968 г. из озера была спущена вода по сбросному каналу в р. Люк-Колен Еган, в результате чего нарушился естественный гидрологический режим. В настоящее время озеро представляет собой неглубокий водоем (1.0–1.5 м) с сетью автодорог, вдоль которых проложены трубопроводы. Суммарная площадь зеркала воды 46.07 км2. Озеро разделено дамбами на 14 не сообщающихся участков разной величины (рис. 1). По дамбам, акватории и берегам озера проложены трубопроводы – потенциальные источники загрязнения.
С 8 по 25 сентября 2007 г. проводилось комплексное обследование оз. Самотлор с целью оценки состояния экосистемы озера и потенциала его биологического самоочищения в условиях активной нефтедобычи, в том числе исследовался зоопланктон. Работы проведены в рамках обследования водных объектов на территории ОАО “Самотлорнефтегаз”. На оз. Самотлор было выбрано 72 пункта отбора проб, расположенных равномерно по акватории водоема с учетом охвата как мелководных прибрежных, так и относительно глубоких центральных участков (рис. 1).
Химико-аналитические работы выполнялись в аккредитованных лабораториях Экологического аналитического центра Дочернего ЗАО “НижневартовскНИПИнефть” и Экоаналитического комплекса ЗАО “Региональный Аналитический Центр Механобр инжиниринг аналит” по стандартным методикам анализа пресных вод, согласно действовавшему на момент проведения работ РД 52.18.595-96 [11]. Концентрация растворенного кислорода в водах измерялась йодометрическим методом по Винклеру. БПК определяли скляночным методом, также применяя йодометрический метод. Концентрация ионов Cl– и ${\text{NO}}_{3}^{ - },$ общая минерализация и рН измерены потенциометрическим методом с ионселективным электродом. Массовая концентрация аммонийного азота и фосфатов определялась фотометрическим методом. Массовая концентрация железа, марганца, меди, никеля, хрома и цинка измерена методом атомной абсорбции с прямой электрометрической атомизацией проб. Концентрацию нефтепродуктов в воде определяли методом инфракрасной спектрометрии по ПНД Ф 14.1:2:4.168-2000 [7]. Содержание нефтепродуктов в донных отложениях определяли методом инфракрасной спектрометрии по ПНД Ф 16.1:2.2.22-98 [8], в случае очень высокого их содержания – весовым методом путем экстракции хлороформом, согласно РД 39-0147098-015-90 [10].
Пробы зоопланктона отбирали путем процеживания 100 л воды через сеть Апштейна с размером ячеи 64 мкм. Зоопланктон фиксировали 4%-м формалином. Камеральную обработку проводили по стандартной методике [2, 13]. Для оценки экологического состояния водотоков использовали метод биоиндикации по индексу сапробности Пантле и Букк с использованием значений региональных индексов индикаторной значимости, полученных для зоопланктонных организмов водоемов Западной Сибири, степень эврибионтности и стенобионтности зоопланктонных организмов оценивали по их индикаторному весу [24]. Расчет индекса Шеннона проводили с учетом показателей и численности, и биомассы [12].
Статистическая обработка результатов проводилась с использованием пакета программ “STATISTICA 12”. Поскольку изменения значений гидрохимических и гидробиологических показателей не соответствуют нормальному распределению, для выявления и оценки тесноты связи между рядами сопоставляемых показателей использовали коэффициент ранговой корреляции Спирмена. Достоверность значений коэффициентов корреляции оценивали по критерию Стьюдента при p < 0.05. Анализ зависимости количественных показателей различных видов зоопланктона от концентрации нефтепродуктов в воде и в донных отложениях проводился методом главных компонент PCA (Principal Component Analysis) [30].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средняя глубина озера в период наблюдений составила 0.8, максимальная – 1.9, минимальная – 0.2 м. Температура воды была в пределах 5.2–13.6°С. Концентрация кислорода составляла 8.64–12.16 мг/дм3. По степени гумификации озеро относится к олигогумозным дистрофированным водоемам. Воды озера относятся к ά-гипогалинным, хлоридно-натриевым водам. рН варьировал по участкам акватории от 6.3 до 8.5. Минерализация в момент исследования в разных секторах также колебалась от 49 до 171 мг/дм3 (табл. 1). Нефтепродукты – главные органические токсиканты. По содержанию нефтепродуктов в воде наблюдается превышение ПДК в среднем в 4 раза (табл. 1). По общим показателям содержания в воде органического вещества качество вод озера относится к разрядам 3б “слабо загрязненная” – 4б “сильно загрязненная”, по уровню содержания биогенных веществ качество воды на различных участках варьирует от класса 3а “достаточно чистая” до класса 4б “сильно загрязненная” [6].
Таблица 1.
Средние показатели гидрохимических параметров на различных участках оз. Самотлор (август 2007 г.)
| Номер участка | рН | Минерализация общая, мг/дм3 | Cl–, мг/дм3 | Нефтепродукты, ДО, мг/кг | ${\text{NH}}_{4}^{ + },$ мг/дм3 | ${\text{NO}}_{3}^{ - },$ мг/дм3 | ${\text{PO}}_{4}^{3},$ мг/дм3 | БПК5, мгО2/дм3 | Нефтепродукты в воде, мг/дм3 | Cr, мг/дм3 | Mn, мг/дм3 | Fe, мг/дм3 | Ni, мг/дм3 | Cu, мг/дм3 | Zn, мг/дм3 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | 6.9 | 76.0 | 31.0 | 3090 | 0.19 | 0.27 | 0.05 | 3.41 | 0.23 | 0.014 | 0.020 | 0.90 | 0.036 | 0.020 | 0.035 |
| II | 6.8 | – | – | 1760 | 0.24 | 0.28 | 0.05 | 2.24 | 0.11 | 0.016 | 0.022 | 1.00 | 0.040 | 0.023 | 0.041 |
| III | 7.6 | 105.7 | 35.6 | 4358 | 0.26 | 0.20 | 0.05 | 3.46 | 0.11 | 0.031 | 0.039 | 0.57 | 0.110 | 0.056 | 0.059 |
| IV | 7.2 | 107.3 | 43.9 | 3890 | 0.09 | 0.45 | 0.05 | 1.94 | 0.02 | 0.017 | 0.029 | 0.36 | 0.052 | 0.027 | 0.028 |
| V | 7.7 | – | – | 1353 | 0.10 | 0.64 | 0.05 | 3.36 | 0.07 | 0.012 | 0.029 | 1.40 | 0.054 | 0.022 | 0.026 |
| VI | 7.6 | 109.7 | 46.4 | 3086 | 0.38 | 0.20 | 0.13 | 1.92 | 0.06 | 0.014 | 0.050 | 1.56 | 0.044 | 0.025 | 0.029 |
| VII | 7.1 | 110.6 | 34.6 | 3066 | 0.27 | 0.27 | 0.07 | 5.12 | 0.04 | 0.010 | 0.036 | 0.63 | 0.032 | 0.018 | 0.017 |
| VIII | 7.5 | 90.8 | 29.3 | 1442 | 0.35 | 0.60 | 0.08 | 3.09 | 0.09 | 0.011 | 0.018 | 1.11 | 0.049 | 0.033 | 0.014 |
| IX | 7.5 | 81.9 | 25.1 | 3487 | 0.52 | 0.35 | 0.10 | 2.99 | 0.06 | 0.016 | 0.028 | 1.03 | 0.057 | 0.031 | 0.021 |
| X | 7.9 | 89.6 | 28.9 | 2630 | 0.55 | 0.56 | 0.05 | 2.56 | 0.09 | 0.016 | 0.018 | 0.92 | 0.052 | 0.029 | 0.016 |
| XI | 7.1 | 63.7 | 26.4 | 1047 | 0.14 | 0.36 | 0.11 | 4.00 | 0.05 | 0.022 | 0.057 | 0.86 | 0.084 | 0.036 | 0.034 |
| XII | 7.2 | 103.7 | 52.6 | 4363 | 0.22 | 0.44 | 0.11 | 2.67 | 0.09 | 0.015 | 0.015 | 0.69 | 0.050 | 0.037 | 0.017 |
| XIII | 7.4 | 68.0 | 33.0 | 2300 | 0.23 | 0.51 | 0.17 | 1.92 | 0.04 | 0.017 | 0.016 | 0.64 | 0.052 | 0.034 | 0.014 |
| XIV | 8.5 | 107.0 | 43.9 | 4660 | 0.40 | 0.10 | 0.13 | 2.56 | 0.06 | 0.005 | 0.030 | 1.40 | 0.010 | 0.011 | 0.012 |
Видовой состав зоопланктона оз. Самотлор характерен для мелких озер Западной Сибири с развитой высшей водной растительностью (табл. 2). Всего обнаружено 97 видов зоопланктона: 39 – Rotifera, 40 – Cladocera, 18 – Copepoda. Такое видовое разнообразие свидетельствует о чрезвычайно широком спектре экологических ниш, образовавшихся в оз. Самотлор к моменту обследования, соответственно – о значительных различиях экологических условий на разных участках его акватории.
Таблица 2.
Видовой состав зоопланктона оз. Самотлор (2007 г.) (I–XIV – номера участков)
| Видовой состав | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII | XIII | XIV |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rotifera | ||||||||||||||
| Asplanchna herricki de Guerne | + | + | + | + | ||||||||||
| Asplanchna priodonta Gosse | + | + | + | + | ||||||||||
| Brachionus angularis Gosse | + | + | ||||||||||||
| Brachionus calyciflorus Pallas | + | |||||||||||||
| Brachionus diversicornis (Daday) | + | |||||||||||||
| Brachionus quadridentatus Hermann | + | + | ||||||||||||
| Cephalodella catellina (Műller) | + | + | ||||||||||||
| Conochilus hippocrepis (Schrank) | + | + | ||||||||||||
| Epiphanes brachyonus Ehrenberg | + | + | + | + | ||||||||||
| Euchlanis dilatata Ehrenberg | + | + | + | + | + | + | ||||||||
| Euchlanis dilatata lucksiana Hauer | + | + | + | + | + | |||||||||
| Euchlanis incisa Carlin | + | |||||||||||||
| Filinia longiseta (Ehrenberg) | + | + | + | + | + | + | ||||||||
| Filinia terminalis maior Colditz | + | |||||||||||||
| Kellicottia longispina (Kellicott) | + | + | + | + | ||||||||||
| Keratella cochlearis (Gosse) | + | + | ||||||||||||
| Keratella cochlearis robusta (Lauterborn) | + | + | + | + | + | + | + | |||||||
| Keratella cochlearis tecta (Gosse) | + | + | ||||||||||||
| Keratella quadrata (Müller) | + | + | + | |||||||||||
| Keratella quadrata dispersa Carlin | + | + | + | + | + | + | + | + | + | + | ||||
| Keratella serrulata cuvicornis Rylov | + | + | ||||||||||||
| Keratella testudo (Ehrenberg) | + | + | ||||||||||||
| Lecane luna (Müller) | + | + | + | |||||||||||
| Lecane lunaris Ehrenberg | + | |||||||||||||
| Notholca acuminata (Ehrenberg) | + | |||||||||||||
| Polyarthra dolichoptera Idelson | + | + | + | |||||||||||
| Polyarthra major Burckhardt | + | + | + | + | + | |||||||||
| Polyarthra minor Voigt | + | + | + | |||||||||||
| Pompholyx sulcata Hudson | + | + | ||||||||||||
| Synchaeta monopus Plate | + | |||||||||||||
| Synchaeta oblonga Ehrenberg | + | + | + | |||||||||||
| Testudinella patina (Hermann) | + | + | + | + | + | |||||||||
| Testudinella reflexa (Gosse) | + | |||||||||||||
| Trichocerca bidens (Lucks) | + | + | ||||||||||||
| Trichocerca cylindrica (Imhof) | + | + | + | |||||||||||
| Trichocerca elongata (Gosse) | + | + | ||||||||||||
| Trichocerca forficata Ehrenberg | + | |||||||||||||
| Trichocerca sulcata Jenning | + | + | ||||||||||||
| Trichotria truncata (Whitelegge) | + | |||||||||||||
| Cladocera | ||||||||||||||
| Acroperus harpae (Baird) | + | + | + | + | + | + | ||||||||
| Alonella nana (Baird) | + | + | + | + | + | + | + | + | + | + | + | + | ||
| Alona quadrangularis (O.F. Müller) | + | + | + | |||||||||||
| Alona (Coronatella) rectangula (G.O. Sars) | + | |||||||||||||
| Alonopsis ambigua Lill. | + | + | ||||||||||||
| Biapertura affinis (Leydig) | + | + | + | + | + | + | + | + | + | |||||
| Bosmina longirostris (O.F. Müller) | + | + | + | + | ||||||||||
| Bosmina (Eubosmina) coregoni Baird Sars | + | + | + | + | + | + | + | + | + | + | + | |||
| Bythotrephes longimanus Leydig | + | + | + | |||||||||||
| Ceriodaphnia quadrangula (O.F. Müller) | + | + | + | + | + | + | + | + | + | |||||
| Pseudochydorus globosus (Baird) | + | + | + | |||||||||||
| Chydorus ovalis Kurz | + | + | ||||||||||||
| Chydorus sphaericus (O.F. Müller) | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Daphnia arctica Werestschagin | + | + | + | + | + | + | + | + | + | |||||
| Daphnia longispina O.F. Müller | + | + | ||||||||||||
| Daphnia pulex (De Geer) | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| Diaphanosoma brachyurum (Lievin) | + | + | + | + | + | + | + | + | + | + | ||||
| Disparalona rostrata (Koch) | + | + | + | + | + | |||||||||
| Eurycercus glacialis Lilljeborg | + | + | ||||||||||||
| Eurycercus lamellatus (O.F. Müller) | + | + | ||||||||||||
| Graptoleberis testudinaria (Fischer) | + | + | + | + | + | |||||||||
| Ilyocryptus acutifrons G.O. Sars | + | |||||||||||||
| Ilyocryptus sordidus (Liévin) | + | + | ||||||||||||
| Ophryoxus gracilis (G.O. Sars) | + | |||||||||||||
| Leptodora kindtii (Focke) | + | |||||||||||||
| Macrothrix hirsuticornis Norman & Brady | + | + | ||||||||||||
| Macrothrix laticornis (Jurine) | + | + | ||||||||||||
| Monospilus dispar G.O. Sars | + | + | + | + | + | + | + | |||||||
| Oxyurella tenuicaudis (G.O. Sars) | + | + | + | |||||||||||
| Peracantha truncata (O.F. Müller) | + | + | + | + | + | |||||||||
| Picripleuroxus laevis (G.O. Sars) | + | |||||||||||||
| Picripleuroxus striatus (Schödler) | + | + | + | + | + | + | + | + | + | |||||
| Pleuroxus aduncus (Jurine) | + | + | ||||||||||||
| Pleuroxus trigonellus (O.F. Müller) | + | |||||||||||||
| Polyphemus pediculus (Linnaeus) | + | + | + | + | ||||||||||
| Rhynchotalona falcata (G.O. Sars) | + | |||||||||||||
| Scapholeberis mucronata (O.F. Müller) | + | + | ||||||||||||
| Sida crystallina (O.F. Müller) | + | + | + | + | + | + | + | + | + | + | ||||
| Simocephalus vetulus (O.F. Müller) | + | + | ||||||||||||
| Copepoda | ||||||||||||||
| Megacyclops gigas (Claus) | + | + | + | |||||||||||
| Acanthocyclops vernalis (Fischer) | + | + | ||||||||||||
| Cyclops kolensis Lilljeborg | + | + | + | |||||||||||
| Cyclops scutifer Sars G.O. | + | + | + | + | + | + | ||||||||
| Cyclops vicinus Uljanin | + | + | + | + | + | |||||||||
| Eucyclops macrurus (Sars G.O.) | + | + | ||||||||||||
| Eucyclops macruroides (Lilljeborg) | + | |||||||||||||
| Eucyclops serrulatus (Fischer) | + | + | + | + | ||||||||||
| Macrocyclops albidus (Jurine) | + | + | + | + | + | |||||||||
| Mesocyclops leuckarti (Claus) | + | + | + | + | + | + | + | + | + | |||||
| Thermocyclops oithonoides (Sars G.O.) | + | + | + | + | + | + | + | + | + | + | ||||
| Paracyclops fimbriatus (Fischer) | + | + | + | + | + | + | + | + | ||||||
| Arctodiaptomus dentifer (Smirnov) | + | + | + | + | ||||||||||
| Arctodiaptomus ulomskyi Chechuro | + | |||||||||||||
| Eudiaptomus graciloides Lilljeborg | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Eudiaptomus gracilis (Sars G.O.) | + | + | ||||||||||||
| Mixodiaptomus theeli (Lilljeborg) | + | + | + | |||||||||||
| Attheyella crassa (Sars G.O.) | + | |||||||||||||
| Количество видов | 12 | 16 | 16 | 23 | 12 | 18 | 28 | 22 | 12 | 17 | 16 | 12 | 18 | 14 |
Участок I (точки с 10 по 20). Грунт на участке – илисто-глинистый с примесью детрита. Максимальная концентрация нефтепродуктов в донных отложениях отмечена в детрите – 10 400 мг/кг грунта, тогда как в илистых отложениях в центре участка она составляла 1700–1900 мг/(кг грунта). Концентрация нефтепродуктов в воде в центральной части сектора составляла 0.03–0.11 мг/дм3, а на отдельных участках, прилегающих к дамбе, достигала 0.82 мг/дм3. Максимальная численность зоопланктона составляла 231.7 тыс. экз/м3 при биомассе 28.8 г/м3. Доминировали Eudiaptomus graciloides, Daphnia pulex, Daphnia arctica, Epiphanes brachyonus. Значения индекса сапробности Пантле и Букк на разных точках колебались от 1.58 до 1.79 (табл. 3).
Таблица 3.
Численность N, биомасса В, индекс Пантле и Букк S и индекс Шеннона–Уивера H для сообществ зоопланктона на различных участках акватории оз. Самотлор
| № участка | Nобщ, тыс. экз/м3 |
Bобщ, г/м3 | Rotifera | Cladocera | Copepoda | S | H | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Саlanoida | Cyclopoida | |||||||||||
| N | B | N | B | N | B | N | B | |||||
| I | 220.6 ± 110.3 | 24.47 ± 12.24 | 80.2 ± 40.1 | 78.4 ± 39.2 | 103.6 ± 51.8 | 20.90 ± 10.45 | 55.2 ± 27.6 | 3.08 ± 1.54 | 11.5 ± 5.7 | 0.42 ± 0.21 | 1.58–1.79 | 0.74–2.23 |
| II | 26.0 ± 12.4 | 1.09 ± 0.33 | 2.4 ± 1.1 | 2.22 ± 0.56 | 8.8 ± 3.9 | 0.44 ± 0.13 | 1.2 ± 0.1 | 0.04 ± 0.00 | 13.6 ± 4.5 | 0.61 ± 0.17 | 1.71 | 2.37 |
| III | 37.0 ± 14.4 | 1.97 ± 1.44 | 17.3 ± 16.6 | 46.6 ± 48.5 | 5.6 ± 4.3 | 1.40 ± 1.53 | 0.2 ± 0.1 | 4.4 ± 2.3 | 13.9 ± 5.6 | 0.52 ± 0.17 | 1.59–1.89 | 1.47–2.52 |
| IV | 26.2 ± 16.7 | 1.50 ± 0.6 | 3.6 ± 1.9 | 0.01 ± 0.00 | 11.4 ± 6.7 | 0.84 ± 0.33 | 3.2 ± 0.2 | 0.35 ± 0.02 | 8.0 ± 3.9 | 0.31 ± 0.14 | 1.67 | 2.44 |
| V | 30.2 ± 18.9 | 12.70 ± 11.09 | 2.7 ± 1.3 | 4.3 ± 2.7 | 24.9 ± 18.7 | 12.60 ± 11.13 | 0.50 ± 0.02 | 0.01 ± 0.00 | 2.6 ± 1.0 | 0.10 ± 0.04 | 1.63–1.74 | 1.02–2.26 |
| VI | 49.8 ± 46.0 | 13.93 ± 21.25 | 2.9 ± 1.4 | 2.5 ± 1.7 | 43.9 ± 43.6 | 21.19 ± 13.80 | 0.2 ± 0.1 | 0.02 ± 0.01 | 3.1 ± 1.9 | 0.11 ± 0.07 | 1.54–1.78 | 0.79–1.84 |
| VII | 61.8 ± 46.2 | 0.67 ± 0.37 | 50.9 ± 40.2 | 0.16 ± 0.14 | 4.5 ± 3.4 | 0.26 ± 0.17 | 0.2 ± 0.1 | 0.01 ± 0.00 | 6.3 ± 4.8 | 0.24 ± 0.16 | 1.50–1.63 | 1.79–2.09 |
| VIII | 30.9 ± 6.6 | 3.12 ± 1.08 | 52.3 ± 1.5 | 0.01 ± 0.00 | 13.8 ± 11.1 | 2.43 ± 0.83 | 5.7 ± 3.6 | 0.46 ± 0.26 | 6.1 ± 1.2 | 0.23 ± 0.09 | 1.62–1.77 | 2.04–2.57 |
| IX | 62.6 ± 8.2 | 17.80 ± 13.46 | 4.8 ± 4.6 | 0.002 ± 0.002 | 25.3 ± 18.9 | 15.44 ± 14.42 | 32.6 ± 24.3 | 1.42 ± 0.88 | 17.9 ± 6.9 | 0.94 ± 0.38 | 1.68–1.78 | 1.59–1.87 |
| X | 62.7 ± 3.4 | 6.65 ± 1.19 | 1.7 ± 0.1 | 0.62 ± 0.05 | 16.2 ± 0.9 | 3.88 ± 0.77 | 16.8 ± 1.3 | 1.51 ± 0.07 | 28.0 ± 1.4 | 1.26 ± 0.34 | 1.71 | 2.13 |
| XI | 33.9 ± 14.6 | 0.63 ± 0.15 | 15.7 ± 15.1 | 0.02 ± 0.02 | 10.8 ± 4.7 | 0.27 ± 0.07 | 2.6 ± 2.1 | 0.14 ± 0.12 | 4.8 ± 1.6 | 0.19 ± 0.05 | 1.63–1.68 | 1.62–2.11 |
| XII | 31.9 ± 7.6 | 1.71 ± 0.06 | 1.4 ± 1.0 | 3.18 ± 2.79 | 18.0 ± 14.9 | 0.89 ± 0.67 | 8.4 ± 8.4 | 0.65 ± 0.64 | 4.0 ± 0.7 | 0.16 ± 0.03 | 1.70–1.77 | 1.87–2.41 |
| XIII | 62.0 ± 9.5 | 3.45 ± 0.62 | 11.6 ± 4.6 | 27.90 ± 0.02 | 37.6 ± 6.1 | 2.54 ± 0.86 | 6.4 ± 2.4 | 0.57 ± 0.19 | 6.4 ± 0.2 | 0.31 ± 0.03 | 1.61 | 2.03 |
| XIV | 59.5 ± 23.2 | 3.12 ± 1.22 | 20.0 ± 8.8 | 19.39 ± 6.56 | 14.7 ± 5.7 | 1.18 ± 0.57 | 19.2 ± 7.5 | 1.70 ± 0.66 | 5.6 ± 1.6 | 0.22 ± 0.02 | 1.66 | 1.94 |
Участок II (точки 21–22). Донные отложения – иловые с видимой примесью тяжелых фракций нефти. Максимальная концентрация нефтепродуктов в иле на момент обследования составила 2200 мг/кг грунта, в воде – 0.11 мг/дм3. Численность зоопланктона достигала 26 тыс. экз/м3, биомасса – 1.08 г/м3. Доминировали веслоногие ракообразные Mesocyclops leuckarti, Mesocyclops oithonoides, Eubosmina coregoni, Alonella nana. Индекс сапробности Пантле и Букк составил 1.71 (табл. 3).
Участок III (точки 23–30). Донные отложения представлены илом с примесью детрита. В центральной зоне участка ил содержал 1700–2700 мг/(кг грунта) нефтепродуктов; а на участках, прилегающих к берегам и дамбам, концентрация достигала 5600–7000 мг/(кг грунта). В воде также в центре участка концентрации нефтепродуктов колебались в пределах 0.02–0.05 мг/дм3, на прибрежных участках достигая 0.17 мг/дм3 (табл. 1). Максимальная численность зоопланктона на участке составила 59.9 тыс. экз/м3 (за счет массового развития коловраток), а биомасса – 4.8 г/м3 (за счет крупных кладоцер Daphnia arctica и Daphnia pulex) (табл. 3). В состав сообщества входили Sida crystallina, Iliocryptos sordidus, Macrotrix laticornis и другие фитофильные формы (табл. 2). Значения индекса сапробности Пантле и Букк колебались в пределах 1.59–1.89.
Участок IV (точки 31–33). Грунт – бурый ил и песок с видимой примесью тяжелых фракций нефти. Концентрация нефтепродуктов достигала в донных отложениях 4860 мг/кг грунта, а в воде ≤0.07 мг/дм3. Численность зоопланктона составила 26.2 тыс. экз/м3, биомасса – 1.5 г/м3. Отмечено очень высокое видовое разнообразие всех трех групп (табл. 2). Помимо эврибионтных форм, активно развивались Diaptomidae и фитофильные Cladocera. Индекс сапробности Пантле и Букк составил 1.67.
Участок V (точки 34–35, 43–44). На дне – ил с примесью детрита, песок – вдоль береговой линии и вдоль дамб. Максимальный уровень содержания нефтепродуктов в грунтах отмечен в илах и достиг 3000 мг/(кг грунта), тогда как в воде на всей акватории концентрация ≤0.07 мг/дм3. Численность зоопланктона достигала 49.2 тыс. экз/м3, биомасса – 23.8 г/м3 (табл. 3). По численности и биомассе доминировали ветвистоусые рачки Daphnia arctica, Daphnia pulex, Alonella nana, Chydorus sphaericus. Отмечено значительное развитие фитофильного комплекса: Pleuroxus striatus, Disparalona rostrata, Acroperus harpae. Индекс сапробности Пантле и Букк составил 1.63–1.74.
Участок VI (точки 36–37, 45–52). Грунты – глинистые со значительными включениями детрита и участками торфа. Максимальные концентрации нефтепродуктов (до 9870 (мг/кг грунта)) отмечена в торфе. Средняя концентрация нефтепродуктов в воде в центральной части сектора составляла 0.06 мг/дм3, а в прибрежной зоне вдоль дамбы – до 0.18 мг/дм3. Численность зоопланктона достигала 117.7 тыс. экз/м3, биомасса – 56.3 г/м3. Отмечено очень высокое видовое разнообразие ветвистоусых (12 видов) и коловраток (10 видов) (табл. 2). Доминировали Daphnia pulex, Daphnia arctica, Monospilus dispar, Graptoleberis testudinaria. Индекс сапробности Пантле и Букк составил 1.54–1.78.
Участок VII (точки 38, 40, 57–58). Донные отложения представлены преимущественно серым илом с видимым включением нефтепродуктов, концентрация которых достигала 10 900 мг/(кг грунта). Концентрации нефтепродуктов в воде на всем участке ≤0.06 мг/дм3. Численность зоопланктона достигла 154.2 тыс. экз/м3 при биомассе 1.4 г/м3 – высока за счет массового развития Filinia longiseta и Asplanchna herricki. Отмечено очень высокое видовое разнообразие ветвистоусых (11 видов) и коловраток (14 видов) (табл. 2). Доминировали Bosmina longirostris, Alona affinis, Monospilus dispar. Индекс сапробности Пантле и Букк составил 1.51–1.60.
Участок VIII (точки 69–75). На дне в центре – ил с торфом, вдоль берега – пески, загрязненные нефтью. Максимальная концентрация нефтепродуктов в донных отложениях составила 3700 мг/(кг грунта), а в воде в среднем 0.05 мг/дм3 в центральной части и до 0.19 мг/дм3 вдоль береговой полосы сектора. Численность зоопланктона достигала 40.8 тыс. экз/м3 при биомассе 2.3 г/м3 (табл. 3). Доминировали эврибионты Daphnia pulex, Eubosmina coregoni, Chydorus sphaericus. Значительной численности достиг Monospilus dispar (2.4 тыс. экз/м3). Индекс сапробности Пантле и Букк 1.62–1.77.
Участок IX (точки 59–60, 62–67). Донные отложения в центральной части сектора представлены серым илом с торфом и детритом. Максимальная концентрация нефтепродуктов отмечена в торфе и детрите – до 5470 мг/(кг грунта). В воде при этом над торфяными залежами концентрации нефтепродуктов составили <0.02 мг/дм3, а у берегов над песками – 0.12 мг/дм3. Численность зоопланктона достигала 78.1 тыс. экз/м3, биомасса – 16.7 г/м3. Доминировали Eubosmina coregoni, Daphnia pulex, Daphnia arctica, Sida crystallina, Acroperus harpae, Mesocyclops oithonoides. Видовое разнообразие коловраток невелико (3 вида). Индекс сапробности Пантле и Букк 1.66–1.78.
Участок X (точки 61, 68). На дне – серый ил с большим количеством детрита и с содержанием нефтепродуктов до 3290 мг/(кг грунта). В воде на всей акватории концентрации нефтепродуктов – 0.04–0.09 мг/дм3. Численность зоопланктона – 62.7 тыс. экз/м3, биомасса – 6.6 г/м3. Доминировали Daphnia pulex, Daphnia arctica, Eubosmina coregoni. Индекс сапробности Пантле и Букк составил 1.71.
Участок XI (точки 42, 56). На дне – ил с детритом, концентрация нефтепродуктов в донных отложениях достигала 2450 мг/(кг грунта). В воде в центре участка концентрации нефтепродуктов составили <0.02 мг/дм3, а у берега над песками – до 0.07 мг/дм3. Численность зоопланктона достигла 48.5 тыс. экз/м3 при биомассе 776.04 мг/м3. Доминировали по численности и биомассе ветвистоусые рачки (табл. 3), в основном эврибионты Chydorus ovalis, Alonella nana, Chydorus sphaericus. Значительное развитие получили фитофильные формы: Sida crystallina, Peracantha truncata, Acroperus harpae. Индекс сапробности Пантле и Букк составил 1.63–1.68.
Участок XII (точки 77, 78, 80). Донные отложения представлены преимущественно илом и торфом с максимальной концентрацией нефтепродуктов до 10 710 мг/(кг грунта). В воде отмечено 0.04 мг/дм3 нефтепродуктов в центре сектора и до 0.20 мг/дм3 вдоль дамб. Численность зоопланктона достигала 39.5 тыс. экз/м3 при биомассе 1.70 г/м3. Отмечено высокое видовое разнообразие Clado-cera (табл. 2). Доминировали Alonella nana, Eubosmina coregoni, Ceriodaphnia quadrangula, Pleuroxus striatus, Acroperus harpae, Eudiaptomus graciloides и Mesocyclops oithonoides. Только на этом участке отмечен Ophryoxus gracilis – обычный обитатель зарослей северных озер. Индекс сапробности Пантле и Букк составил 1.70–1.77.
Участок XIII (точки 81–82). В центре сектора на дне – серый ил с глиной, вдоль дамб, как и на остальных участках, – песок. Содержание нефтепродуктов в грунте достигало 2870 мг/кг, а в воде – 0.04 мг/дм3 в центре сектора и до 0.14 мг/дм3 на участках вдоль берега. Численность зоопланктона составила 62.0 тыс. экз/м3, биомасса – 3.50 г/м3. Отмечено массовое развитие Daphnia pulex и Eubosmina coregoni. Фитофильных Cladocera в пробах не найдено. Видовой состав коловраток тоже характеризовался исключительно эвритопными формами. Индекс сапробности Пантле и Букк составил 1.61.
Участок XIV (точки 41, 53–55). На дне – преимущественно торф с примесью ила и глины. В донных отложениях уровень содержания нефтепродуктов относительно невысокий (до 800 мг/(кг грунта)), как и в воде (0.03–0.04 мг/дм3). Численность зоопланктона составила 59.5 тыс. экз/м3, биомасса – 3.1 г/м3 при массовом развитии Daphnia pulex и Epiphanes brachyonus. Высокая численность наблюдалась у Diaphanosoma brachyurum (1.6 тыс. экз/м3) и Ceriodaphnia quadrangula (2.4 тыс. экз/м3). Среди Copepoda доминировал Mesocyclops oithonoides. Индекс сапробности Пантле и Букк составил 1.66.
Исследованные участки озера заметно различаются между собой по содержанию нефтепродуктов в воде и в донных отложениях. Это обусловлено прежде всего давностью разлива нефти на участках. Поступившая в поверхностные воды нефть вступает в цепочку сложных и мало исследованных процессов (испарение, растворение, эмульгирование, окисление, фотолиз, образование агрегатов, седиментация, биодеградация и проч.) [1]. В итоге тяжелые фракции нефти сорбируются в донных отложениях, а легкие испаряются. Там, где продолжается добыча и нефтяные разливы свежие, в воде наблюдаются нефтепродукты в повышенных концентрациях, они видны как пленка на поверхности воды. А на участках, где уже произошло разделение нефти на фракции, наблюдаются преимущественно отложения тяжелых битумов на дне.
На организмы зоопланктона одновременно действует целый ряд факторов, которые меняются на разных участках озера независимо. В связи с этим возникает вопрос: являются ли именно нефтепродукты ведущим фактором перестройки сообщества? Известно, что нефть – природный материал. Все составляющие ее углеводороды, включая ароматические, – результат преобразования живого вещества и, следовательно, не “чужие” для водных организмов. Для зоопланктона может отмечаться как угнетающее, так и стимулирующее влияние присутствующих в воде углеводородов на развитие отдельных видов [22, 29]. Если все же при хроническом загрязнении именно нефтепродукты оказывают токсическое воздействие на зоопланктон, то какие именно виды можно выбрать как индикаторные для оценки уровня загрязнения водоема?
Для зоопланктонных сообществ различных участков оз. Самотлор отмечена значимая, но невысокая корреляция общей численности с концентрацией нефтепродуктов в воде (k = 0.36, p = = 0.0085), главным образом за счет роста численности мелких коловраток (k = 0.50, p = 0.0317). При росте концентрации нефтепродуктов в воде наблюдается совместный рост показателей БПК5 и перманганатной окисляемости (k = 0.60, p = = 0.0186), т. е. увеличивается концентрация органических веществ, оказывающих стимулирующее воздействие на отдельные виды зоопланктона. Индекс сапробности Пантле и Букк показал невысокую, но все же положительную связь с концентрацией нефтепродуктов в воде: k = 0.29 при p = 0.0482.
При этом рост концентрации нефтепродуктов в воде приводит к обеднению видового состава зоопланктона (k = –0.43, p = 0.0175). Наиболее требовательными к концентрации нефтепродуктов в воде оказались Cladocera и Rotifera. Iliocryptos sordidus, Brachionus diversicornis; Synchaeta monopus Testudinella reflexa не отмечены в пробах при концентрации нефтепродуктов в воде >0.03 мг/дм3; Trichocerca sulcata, Trichotria truncata, Alona rectangula, Bosmina longirostris, Ophryoxus gracilis, Pleuroxus laevis, Pleuroxus trigonellus, Polyphemus pediculus, Simocephalus vetulus, Scapholeberis mucronata – при концентрациях >0.05 мг/дм3. Индекс видового разнообразия Шеннона–Уивера оказался отрицательно скоррелирован с концентрацией нефтепродуктов в воде: k = –0.26 при p = 0.0024. Связь данного показателя с нефтяным загрязнением невысока и обеспечивается главным образом изменением численности и видового разнообразия ветвистоусых рачков, тогда как сукцессия видового и количественного состава веслоногих достоверно не сказывается на величине индекса.
Однако целый ряд видов не показал зависимости численных показателей от содержания нефтепродуктов, при этом демонстрируя высокую вариабельность численности и биомассы на разных участках, вызванную, очевидно, другими причинами. Так как при добыче нефтепродуктов происходит комплексное загрязнение водной среды, в том числе высокоминерализованными пластовыми водами и буровыми растворами, в результате отрицательного воздействия на гидробионтов нескольких токсикантов может наблюдаться синергический эффект. Чтобы выявить виды зоопланктона, чувствительные именно к нефтяному загрязнению, был проведен многофакторный анализ.
Факторный анализ методом главных компонент PCA продемонстрировал, что для оз. Самотлор первые шесть компонент объясняют >80% дисперсии численности отдельных видов зоопланктона и включают в себя все исследованные авторами статьи факторы (табл. 4, 5). Первую компоненту можно интерпретировать по факторным нагрузкам как концентрации ионов тяжелых металлов Cr, Ni, Cu, Zn. Вторая компонента имеет отрицательную корреляцию с минерализацией, соответственно – и с концентрацией ионов Cl–, и с рН. Третья компонента отрицательно скоррелирована с содержанием нефтепродуктов в донных отложениях и положительно – с концентрацией иона ${\text{PO}}_{4}^{{3 - }}$ и с содержанием общего Fe и Mn. Четвертая компонента положительно связана с БПК5, с содержанием нефтепродуктов в воде и с перманганатной окисляемостью (ПО). Пятую компоненту можно интерпретировать как концентрацию ${\text{NH}}_{4}^{ + },$ а шестая скоррелирована с содержанием ${\text{NO}}_{3}^{ - }$.
Таблица 4.
Вклад объясненной дисперсии в общую дисперсию численности отдельных видов зоопланктона в зависимости от факторов среды
| Главные компоненты | Собственное значение главных компонент | Объясняемая дисперсия, % | Накопленные собственные значения | Накопленная дисперсия, % |
|---|---|---|---|---|
| 1 | 3.937621 | 24.61013 | 3.93762 | 24.6101 |
| 2 | 2.507412 | 15.67132 | 6.44503 | 40.2815 |
| 3 | 2.310995 | 14.44372 | 8.75603 | 54.7252 |
| 4 | 1.796370 | 11.22731 | 10.55240 | 65.9525 |
| 5 | 1.263645 | 7.89778 | 11.81604 | 73.8503 |
| 6 | 1.076403 | 6.72752 | 12.89244 | 80.5778 |
Таблица 5.
Вклад факторных нагрузок в главные компоненты
| Анализируемые факторы |
Факторные нагрузки после Варимакс-вращения, анализ по методу главных компонент | |||||
|---|---|---|---|---|---|---|
| компонента 1 | компонента 2 | компонента 3 | компонента 4 | компонента 5 | компонента 6 | |
| Общая минерализация | –0.127427 | –0.746266* | –0.425483 | 0.271578 | –0.253512 | 0.154973 |
| Cl– | –0.161555 | –0.647188* | –0.366957 | 0.250814 | –0.536207* | 0.103456 |
| Нефтепродукты в ДО | –0.044168 | –0.478642 | –0.533528* | –0.001328 | 0.384007 | –0.003858 |
| Нефтепродукты в воде | –0.001912 | 0.322859 | 0.077137 | 0.649650* | 0.179458 | 0.355471 |
| рН | –0.263031 | –0.665375* | 0.028467 | –0.173971 | 0.387510 | 0.102712 |
| ${\text{NH}}_{4}^{ + }$ | 0.101227 | –0.432011 | 0.412188 | –0.205550 | 0.504751* | 0.331571 |
| ${\text{NO}}_{3}^{ - }$ | 0.169955 | 0.172533 | 0.372819 | –0.209191 | –0.462977 | 0.642627* |
| ${\text{PO}}_{4}^{{3 - }}$ | 0.038360 | –0.377438 | 0.585432* | –0.211220 | –0.004361 | 0.030170 |
| БПК5 | 0.044470 | 0.330261 | –0.093362 | 0.659387* | 0.300199 | 0.201245 |
| ПО | –0.175499 | –0.301325 | 0.403974 | 0.688733* | 0.013640 | 0.006253 |
| Cr | –0.972439* | 0.132267 | 0.034114 | –0.072728 | –0.003616 | 0.055029 |
| Mn | –0.495133 | –0.135785 | 0.535691* | 0.207057 | –0.091902 | –0.483167 |
| Fe | 0.073816 | –0.329257 | 0.768135* | 0.159791 | –0.110592 | –0.060366 |
| Ni | –0.946638* | 0.153033 | –0.000604 | –0.142798 | –0.005472 | 0.132135 |
| Cu | –0.910584* | 0.065973 | –0.026142 | –0.226904 | 0.041946 | 0.266571 |
| Zn | –0.910622* | 0.157294 | –0.038883 | 0.148502 | –0.010170 | –0.108443 |
Достоверный уровень корреляции (k ≥ 0.3 при p < 0.05) с вышеперечисленными главными компонентами продемонстрировали всего 26 видов. В этот список не вошли эврибионтные виды с широкой экологической лабильностью и узкие стенобионты, которые отмечены единично и на менее чем четырех участках из 14 исследованных (табл. 6; рис. 2).
Таблица 6.
Факторные нагрузки, основанные на корреляциях для зависимых переменных (численность отдельных видов зоопланктона)
| Переменные | Сокращения видовых наименований на графике (рис. 2) | Компонента 1 | Компонента 2 | Компонента 3 | Компонента 4 | Компонента 5 | Компонента 6 |
|---|---|---|---|---|---|---|---|
| Epiphanes brachyonus | E. brachyonus | 0.114 | 0.436* | –0.032 | 0.514* | 0.077 | 0.035 |
| Euchlanis dilatata lucksiana | E. d. lucksiana | 0.092 | –0.412* | –0.396* | 0.123 | –0.314* | –0.067 |
| Keratella cochlearis robusta | K. cochl. robusta | 0.022 | –0.032 | 0.154 | –0.212 | 0.190 | 0.308* |
| Keratella quadrata dispersa | K. q. dispersa | –0.477* | 0.032 | –0.289 | –0.031 | 0.014 | 0.109 |
| Keratella quadrata | K. quadrata | 0.087 | –0.060 | –0.327* | 0.180 | 0.328* | –0.144 |
| Polyarthra minor | – | 0.232 | –0.510 | 0.123 | 0.081 | –0.026 | –0.062 |
| Synchaeta oblonga | S. oblonga | –0.231 | –0.019 | –0.355* | 0.199 | 0.292 | –0.052 |
| Acroperus harpae | – | 0.081 | –0.434 | –0.182 | 0.065 | –0.297 | 0.107 |
| Alonella nana | – | –0.016 | 0.034 | –0.068 | 0.010 | –0.375* | 0.043 |
| Eubosmina coregoni | E. coregoni | 0.087 | –0.082 | 0.220 | –0.174 | 0.175 | 0.422* |
| Daphnia longispina | D. longispina | –0.203 | –0.209 | 0.323* | 0.047 | –0.081 | –0.244 |
| Daphnia pulex | – | 0.228 | –0.138 | 0.117 | –0.118 | 0.301* | 0.247 |
| Diaphanosoma brachyurum | D. brachyurum | 0.280 | 0.172 | –0.037 | –0.329* | 0.166 | –0.101 |
| Graptoleberis testudinaria | G. testudinaria | –0.014 | –0.240 | –0.363* | 0.111 | –0.597* | 0.089 |
| Monospilus dispar | M. dispar | –0.197 | –0.069 | 0.436* | 0.081 | –0.128 | –0.265 |
| Oxyurella tenuicaudis | O. tenuicaudis | –0.199 | –0.054 | 0.436* | 0.064 | –0.118 | –0.287 |
| Peracantha truncata | – | 0.103 | –0.409* | –0.066 | 0.073 | –0.046 | –0.025 |
| Pleuroxus striatus | – | 0.021 | –0.252 | –0.270 | 0.130 | –0.519* | 0.122 |
| Megacyclops gigas | M. gigas | 0.014 | –0.009 | –0.270 | 0.463* | –0.487* | 0.180 |
| Acanthocyclops vernalis | A. vernalis | 0.116 | 0.025 | 0.220 | –0.084 | 0.088 | 0.318* |
| Cyclops kolensis | C. kolensis | 0.063 | –0.051 | 0.201 | –0.236 | 0.192 | 0.360* |
| Cyclops scutifer | C. scutifer | –0.402* | 0.075 | –0.234 | 0.161 | 0.229 | –0.046 |
| Eucyclops serrulatus | – | –0.032 | –0.233 | –0.084 | 0.112 | –0.536* | 0.121 |
| Macrocyclops albidus | – | 0.243 | –0.649* | –0.076 | 0.003 | 0.074 | –0.065 |
| Paracyclops fimbriatus | – | –0.252 | –0.062 | –0.197 | 0.119 | –0.433* | 0.053 |
| Mixodiaptomus theeli | M. theeli | 0.095 | –0.102 | –0.157 | –0.267 | –0.043 | 0.328* |
Рис. 2.
Ординационная диаграмма (РСА) проекций векторов численности отдельных видов зоопланктона на различных участках оз. Самотлор в зависимости от факторов среды (факторы 3 × 4) на плоскость главных компонент (* – зависимые показатели). Сокращения видовых названий – в табл. 6.

Отметим, что из этих 26 видов только 10 продемонстрировали связь с концентрацией нефтепродуктов в воде или в донных отложениях (3 и 4 компоненты в табл. 6). Численность Euchlanis dilatata lucksiana, Keratella quadrata, Synchaeta oblonga и Graptoleberis testudinaria снижалась при росте концентрации нефтепродуктов в воде, тогда как численность Daphnia longispina, Monospilus dispar и Oxyurella tenuicaudis достоверно возрастала. Epiphanes brachyonus и Megacyclops gigas положительно реагировали на увеличение содержания нефтепродуктов в донных отложениях, а Diaphanosoma brachyurum – отрицательно. При этом, например, E. dilatata lucksiana продемонстрировал снижение численности при росте минерализации и рН, а Megacyclops gigas отрицательно реагирует на повышение концентрации ионов аммония.
Таким образом, в озерных экосистемах воздействие хронического нефтяного загрязнения на зоопланктон отличается от такового в реках [23, 31]. В озере не происходит быстрого восстановления планктонного сообщества за счет поступления видов из пойменных болотных систем. При залповом загрязнении, пока нефть в водном объекте не расслоилась на фракции (как правило, в течение нескольких суток), в озере происходит обеднение видового состава зоопланктона за счет выпадения стенобионтных видов Cladocera и Rotifera, а также фитофильных и нектобентосных форм. При этом может наблюдаться активное развитие видов, обладающих широкой экологической лабильностью, как правило − веслоногих рачков и мелких эврибионтных коловраток, которые численно компенсируют исчезающие более чувствительные к загрязнению виды. Таким образом, численность и биомасса зоопланктонного сообщества, как и количественные показатели отдельных групп, не могут быть индикаторами качества воды. Загрязненность различных участков озера нефтепродуктами до некоторой степени можно оценить по соотношению отдельных видов внутри сообщества.
ВЫВОДЫ
При оценке состояния озер после нефтяного загрязнения необходимо пользоваться комбинаторными индексами биологической индикации, по возможности охватывая все звенья экосистемы, включая изменения в бактериальной петле, перифитоне, бентосе, водной растительности.
При разработке системы биоиндикации нефтяных загрязнений пресных водоемов субарктической зоны можно рекомендовать обратить особое внимание на численность широко распространенных видов зоопланктона, которая показала зависимость от концентрации нефтепродуктов в воде: Brachionus diversicornis, Euchlanis dilatata lucksiana, Keratella quadrata, Alona rectangula, Eubosmina coregoni, Ophryoxus gracilis, Pleuroxus laevis, Pleuroxus trigonellus, Polyphemus pediculus, Simocephalus vetulus, Scapholeberis mucronata, Graptoleberis testudinaria.
Список литературы
Воробьев Д.С. Донные сообщества пойменно-речных систем бассейна Васюгана в условиях нефтяного загрязнения. Автореф. дис. … канд. биол. наук. Томск: ТГУ, 2003. 19 с.
Методика изучения биогеоценозов внутренних водоемов / Под ред. Ф.Д. Мордухай-Болтовской. М.: Наука, 1975. 240 с.
Методические рекомендации по выявлению деградированных и загрязненных земель. М.: Минприроды РФ, Роскомзем, Минсельхозпрод РФ, 1995.
Московченко Д.В. Экологическое состояние рек Обского бассейна в районах нефтедобычи // Геогр. и природ. ресурсы. 2003. № 1. С. 35–41.
Московченко Д.В., Убайдулаев А.А. Влияние разливов нефти на загрязнение поверхностных вод Ханты-Мансийского автономного округа – Югры // Вестн. Тюменского гос. ун-та (Науки о Земле). 2014. № 4. С. 5–16.
Оксиюк О.П., Жукинский В.Н., Брагинский Л.П., Линник Г.Н., Кузьменко М.И., Кленус В.Г. Комплексная экологическая классификация качества поверхностных вод суши // Гидробиол. журн. 1993. № 4. С. 62–76.
ПНД Ф 14.1:2:4.168-2000. Количественный химический анализ вод. Методика (метод) измерений массовой концентрации нефтепродуктов в пробах питьевых, природных и очищенных сточных водах методом ИК-спектрофотометрии с применением концентратомеров серии КН. М.: Росприронадзор, 2017. 28 с.
ПНД Ф 16.1:2.2.22-98 Количественный химический анализ почв. Методика выполнения измерений массовой доли нефтепродуктов в минеральных, органогенных, органоминеральных почвах и донных отложениях методом ИК-спектрометрии. М.: Государственный комитет Российской Федерации по охране окружающей среды, 1998. 21 с.
Постановление Правительства Ханты-Мансийского автономного округа – Югры от 10.10.2004 г. № 441-п “Об утверждении регионального норматива предельно допустимого уровня содержания нефти и нефтепродуктов в донных отложениях поверхностных водных объектов на территории ХМАО–Югры” // Электронный фонд правовых и нормативно-технических документов. http:// docs.cntd.ru/document/991016047 (дата обращения: 01.06.2020)
РД 39-0147098-015-90. Инструкция по контролю за состоянием почв на объектах предприятий Миннефтегазпрома. М.: Министерство нефтяной и газовой промышленности, 1989. 30 с.
РД 52.18.595-96. Федеральный перечень методик выполнения измерений, допущенных к применению при выполнении работ в области мониторинга загрязнения окружающей природной среды. Обнинск: Росгидромет, 1999. 48 с.
Розенберг Г.С. Информационный индекс и разнообразие: Больцман, Котельников, Шеннон, Уивер… // Самарская Лука: проблемы региональной и глобальной экологии. 2010. Т. 19. № 2. С. 4–25.
Руководство по гидробиологическому мониторингу пресноводных экосистем / Под ред. В.А. Абакумова. СПб.: Гидрометеоиздат, 1992. 320 с.
Федеральный закон от 10.01.2002 № 7-ФЗ “Об охране окружающей среды”. 90 с.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. Количественная гидроэкология: методы, критерии, решения. Кн. 1. М.: Наука, 2005. 280 с.
Almeda R., Baca S., Hyatt C., Buskey E.J. Ingestion and sublethal effects of physically and chemically dispersed crude oil on marine planktonic copepods // Ecotoxicol. 2014. № 23. P. 988–1003.
Almeda R., Connelly T.L., Buskeya E.J. How much crude oil can zooplankton ingest? Estimating the quantity of dispersed crude oil defecated by planktonic copepods // Environ. Poll. 2016. V. 208. Pt B. P. 645–654.
Almeda R., Wambaugh Z., Wang Z., Hyatt C., Liu Z., Buskey E.J. Interactions between Zooplankton and Crude Oil: Toxic Effects and Bioaccumulation of Polycyclic Aromatic Hydrocarbons // PLoS One. 2013. V. 8(6). e67212. https://doi.org/10.1371/journal.pone.0067212
Barnett C.J., Kontogianis J.E. The effect of crude oil fractions on the survival of tidepool copepod, Tigriopus californicus // Environ. Poll. 1975. № 8. P. 45–54.
Brett M.T. Zooplankton communities and acidification process (a review) // Water Air Soil Pollut. 1989. V. 44. P. 387–414.
Cederwall J., Black T.A., Blais J.M., Hanson M.L., Hollebone B.P., Palace V.P., Rodríguez-Gil J.L., Greer C.W., Maynard C., Ortmann A.C., Rooney R.C., Orihel D.M. Life under an oil slick: response of a freshwater food web to simulated spills of diluted bitumen in field mesocosms // Can. J. Fish. Aquat. Sci. 2020. № 77(5). P. 779–788.
Davenport J., Angel M.V., Gray J.S., Crisp D.J., Davies J.M. Oil and Planktonic Ecosystems: Discussion // Philosophical Transactions Royal Society. B. Biol. Sci. 1982. № 297. P. 369–384.
Ermolaeva N.I. Zooplankton of a Taiga River under Chronic Oil Pollution // Wat. Res. 2020. V. 47. № 1. P. 113–121.
Ermolaeva N.I., Dvurechenskaya S.Y. Regional indices of the indicator significance of zooplanktonic organisms in water bodies of southern Western Siberia // Rus. J. Ecol. 2013. V. 44. № 6. P. 527–531.
Haberman J., Haldna M. Indices of zooplankton community as valuable tools in assessing the trophic state and water quality of eutrophic lakes: long-term study of Lake Võrtsjärv // J. Limnol. 2014. V. 72. № 2. P. 61–67.
Harris R.P., Bergudo V., Corner E.D.S., Kilvington C.C., O’Hara S.C.M. Factors Affecting the Retention of a Petroleum Hydrocarbon by Marine Planctonic Copepods // Fate and effects of Petroleum Hydrocarbons in Marine Ecosystems and Organisms. Washington: Pergamon, 1977. P. 206–304.
Havens K.E., Hanazato T. Zooplankton community responses to chemical stressors: a comparison of results from acidification and pesticide contamination research // Environ. Pollut. 1993. V. 82. P. 277–288.
Jiang Z., Huang Y., Chen Q., Zeng J., Xu X. Acute toxicity of crude oil water accommodated fraction on marine copepods: the relative importance of acclimatization temperature and body size // Mar. Environ. Res. 2012. V. 81. P. 12–17.
Marmorek D.R., Korman J. The use of zooplankton in a biomonitoring program to detect lake acidification and recovery // Water Air Soil Pollut. 1993. V. 69. № 3–4. P. 223–241.
Sherry A., Henson R. Conducting and Interpreting Canonical Correlation Analysis in Personality Research: A User-Friendly Primer // J. Personality Assessment. 2005. Iss. 84. № 1. P. 37–48.
Yermolaeva N.I. Modern state of zooplankton in Vasyugan river // Contemporary Problems of Ecol. 2013. V. 6. № 6. P. 627–633.
Дополнительные материалы отсутствуют.