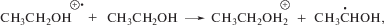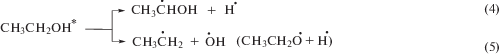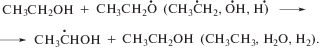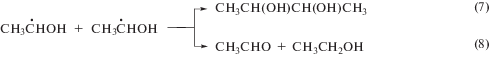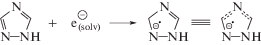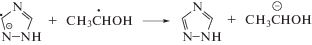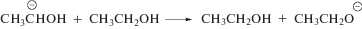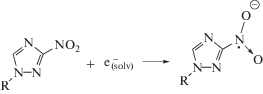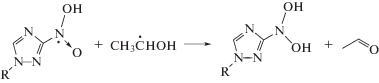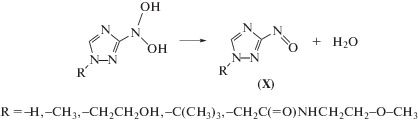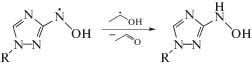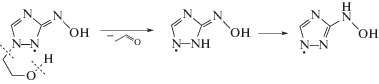Химия высоких энергий, 2019, T. 53, № 2, стр. 140-147
Взаимодействие нитропроизводных 1,2,4-триазола с α-гидроксиэтильными радикалами: исследование методом стационарного радиолиза
С. Д. Бринкевич a, А. Я. Малиборский a, И. А. Капусто a, Р. Л. Свердлов a, Ю. В. Григорьев a, О. А. Ивашкевич a, О. И. Шадыро a, *
a Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
* E-mail: shadyro@tut.by
Поступила в редакцию 10.09.2018
После доработки 01.11.2018
Принята к публикации 29.10.2018
Аннотация
В работе синтезирован ряд нитро- и динитропроизводных 1,2,4-триазола. Методом стационарного радиолиза исследовано взаимодействие полученных соединений с углеродцентрированными радикалами, образующимися при радиолизе деаэрированного этанола. Установлено, что 1,2,4-триазол незначительно изменяет соотношение радиационно-химических выходов продуктов радиолиза деаэрированного этанола в пользу ацетальдегида, в то время как нитропроизводные этого азотсодержащего гетероциклического соединения количественно окисляют α-гидроксиэтильные радикалы. Показано, что введение второй нитрогруппы в 1,2,4-триазольный цикл не приводит к существенным изменениям в эффективности взаимодействия тестируемых веществ с α-гидроксиэтильными радикалами. Предложен механизм образования идентифицированных методом жидкостной хромато-масс-спектрометрии конечных молекулярных продуктов радиационно-индуцированных превращений радиосенсибилизатора саназола в деаэрированном этаноле.
ВВЕДЕНИЕ
Лучевая терапия является одним из основных видов лечения онкологических заболеваний наряду с хирургией и химиотерапией. В основе использования ионизирующих излучений для подавления роста и радиохирургии опухолей лежит их, как правило, более высокая по сравнению со здоровыми тканями радиобиологическая чувствительность из-за интенсивных процессов репликации и транскрипции ДНК, связанных с высокой скоростью клеточного роста [1, 2]. Однако в силу особенностей метаболизма некоторые виды раковых опухолей или их части, имеющие плохое кровоснабжение вследствие интенсивного роста, обладают низкой степенью оксигенации и, как следствие, высокой радиорезистентностью [1].
Одним из способов повышения эффективности радиотерапии гипоксических опухолей является применение радиосенсибилизаторов на основе нитропроизводных имидазола, 1,2,4-триазола, и ряда других гетероциклических соединений [3], которые способны накапливаться преимущественно в тканях с пониженным парциальным давлением кислорода и увеличивать в них радиотоксическое воздействие ионизирующих излучений. Несмотря на наличие положительного клинического опыта применения нитропроизводных, механизм их действия в условиях облучения все еще является предметом активной научной дискуссии [4].
Ранее нами было показано, что помимо реакций окисления, протекающих с участием кислородцентрированных радикалов, значительный вклад в радиационно-индуцированное повреждение биомолекул в условиях гипоксии могут вносить процессы с участием α-гидроксилсодержащих углеродцентрированных радикалов [5–7]. В то же время, реакции такого рода в условиях облучения могут приводить к образованию физиологически активных соединений, в том числе и фосфатидной кислоты, индуцирующей пролиферацию клеток [7]. Поэтому исследование реакционной способности нитропроизводных имидазола, 1,2,4-триазола, и ряда других гетероциклических соединений по отношению к основным типам органических радикалов, образующихся при гипоксии, позволит оптимизировать использование радиосенсибилизаторов в комплексной терапии радиорезистентных опухолей.
Радиолиз веществ в этаноле является удобной моделью для изучения их реакционной способности по отношению к α-гидроксилсодержащим углеродцентрированным радикалам и позволяет выявлять полезные фармакологические свойства тестируемых веществ. В настоящей работе был синтезирован ряд нитро- и динитропроизводных 1,2,4-триазола, методом стационарного радиолиза были исследованы их радиационно-индуцированные превращения в деаэрированном этаноле.
МЕТОДИКА ЭКСПЕРИМЕНТА
Структурные формулы использовавшихся в работе производных 1,2,4-триазола приведены в табл. 1. Соединения Ι и VI, ацетальдегид, бутандиол-2,3 фирмы Aldrich, а также метанол для хромато-масс-спектрометрии компании J.T. Baker использовали без предварительной очистки.
Таблица 1.
Структурные формулы используемых в работе соединений
| № | Название | Структура |
|---|---|---|
| Ι | 1,2,4-триазол |  |
| ΙΙ | 3-нитро-1,2,4-триазол | 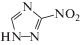 |
| ΙΙΙ | 1-метил-3-нитро-1,2,4-триазол | 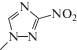 |
| IV | 1-трет-бутил-3‑нитро-1,2,4-триазол |  |
| V | 1-(2-гидроксиэтил)-3-нитро-1,2,4-триазол | 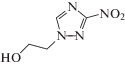 |
| VI | Саназол | 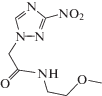 |
| VII | 3,5‑динитро-1,2,4-триазолат натрия | 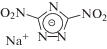 |
| VIII | 1-метил-3,5‑динитро-1,2,4‑триазол | 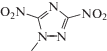 |
| IX | 1-трет-бутил-3,5-динитро-1,2,4-триазол | 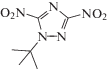 |
3-Нитро-1,2,4-триазол (II) синтезировали согласно методике [8] с выходом 78%. 1-Метил-3-нитро-1,2,4-триазол (III) получали путем метилирования соединения I диметилсульфатом в присутствии NaOH при Т = 75–80°С в течение 3 ч, выход продукта 51%. 1-(2-Гидроксиэтил)-3-нитро-1,2,4-триазол (V) с выходом 51% синтезировали алкилированием соединения III 2-хлорэтанолом в присутствии NaOH при Т = 100°С в течение 20 ч. Соединение (V) отделяли от изомера методом экстракции смесью этанола и диэтилового эфира. Натриевую соль 3,5-динитро-1,2,4-триазола (VII) получали аналогично [9]. Свободный 3,5-динитро-1,2,4-триазол не выделяли в индивидуальном виде из-за высокой взрывоопасности последнего [10]. 1-Метил-3,5-динитро-1,2,4-триазол (VIII) синтезировали по методике [11] путем метилирования соединения VII в ДМСО в течение 24 ч при комнатной температуре. 1-трет-Бутил-3,5-динитро-1,2,4-триазол (IX) получали посредством алкилирования соединения VII трет-бутанолом при комнатной температуре в присутствии HClO4.
Для радиационно-химического эксперимента растворы исследуемых соединений готовили путем растворения их точных навесок в 96 об. % этаноле. Для приготовления растворов использовали спирт этиловый пищевой марки “Люкс” (96 об. %), который перед использованием очищали перегонкой на ректификационной колонне.
В силу высокой летучести этанола для приготовления деаэрированных этанольных растворов тестируемых соединений растворы продували аргоном (Ar) высокой степени чистоты (99.998%) в течение часа, после чего объем доводили до метки деаэрированным растворителем, затем растворы разливали по 1.5 мл в предварительно продутые аргоном ампулы и запаивали. Концентрация используемых веществ в образцах для радиационно-химического эксперимента составляла 1 × 10–3 моль/л, если иное не указано.
Облучение этанольных растворов проводили на установке MPX-γ-25M с источником 60Co. Мощность поглощенной дозы составляла 0.148 ± ± 0.008 Гр/с. Интервал поглощенных доз составлял 0.1–1.6 кГр.
Продукты радиационно-химических превращений этанола – ацетальдегид (АА) и бутандиол-2,3 (БД) определяли на газовом хроматографе GC-17A (Shimadzu, Япония) по методике, описанной в работе [12]. Выходы разложения добавок измеряли на спектрофотометре Specord S600 (An-alytik Jena, Германия) аналогично [13].
Идентификацию продуктов радиационно-индуцированных превращений соединения VI выполняли по модифицированной методике [14]. Использовали растворы саназола (VI) с концентрацией до облучения 4 × 10–3 моль/л для накопления большего количества продуктов радиолиза при облучении и увеличения интенсивности их сигнала при анализе. Исследование выполняли на жидкостном хроматографе фирмы “Shimadzu”, укомплектованном масс-спектрометром LCMS-2020, детектором на диодной матрице SPD-M20A, колонкой Shim-pack VP-ODS (Shimadzu, Япония) (150 мм, 2.0 мм, зерно 4.6 мкм). Хроматографическую колонку термостатировали при 35°С, скорость потока элюента – 0.4 мл/мин, элюент – метанол : вода (20 : 80 об./об.). Определение концентрации веществ проводили в режиме измерения суммарного ионного тока.
Методика обработки экспериментальных данных и расчета радиационно-химических выходов (G, молекула/100 эВ) приведена в работах [12, 15].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
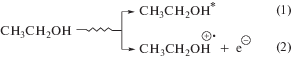
Радиационная химия этилового спирта детально изучена [16], что делает его удобной моделью для исследования реакционной способности тестируемых соединений по отношению к углерод- или кислород-центрированным радикалам в зависимости от условий облучения [17]. Основным радикальным интермедиатом радиолиза деаэрированного этанола является α-гидроксиэтильный радикал (α-ГЭР), образующийся с радиационно-химическим выходом ~5.5 частиц/100 эВ в результате реализации ион-молекулярной реакции (3), радикал-молекулярных процессов (6) и непосредственно при распаде возбужденной молекулы спирта (4):
В отсутствие добавок α-ГЭР расходуются с примерно одинаковой вероятностью в бирадикальных реакциях рекомбинации (7) и диспропорционирования (8) с образованием соответственно БД и АА:
По изменению радиационно-химических выходов основных продуктов радиолиза деаэрированного этанола в присутствии тестируемых соединений можно судить о реакционной способности и механизме реакций исследуемых веществ с α-ГЭР.
Ранее нами было показано, что реакции дефосфорилирования органических фосфатов [6, 7], разрыва амидной связи и дезаминирования аминокислот и пептидов [18], расщепления О‑гликозидной связи [5] происходят через стадию 2β-фрагментации α-гидроксилсодержащих углерод-центрированных радикалов, структурно родственных α-ГЭР. Поэтому изучение радиационно-индуцированных превращений тестируемых веществ в этанольных растворах позволяет осуществлять направленный поиск соединений с полезными фармакологическими свойствами, в том числе радиопротекторной, противовирусной, антиоксидантной и гепатопротекторной активностью [19–21].
Радиационно-химические выходы АА и БД, образующихся при радиолизе деаэрированного этанола в присутствии исследуемых веществ, представлены в табл. 2.
Таблица 2.
Влияние 1,2,4-триазола и его производных на радиационно-индуцированные превращения деаэрированного этанола
| Тестируемое соединение | Радиационно-химический выход (G), молекула/100 эВ | ||
|---|---|---|---|
| Ацетальдегид | Бутандиол‑2,3 | Расходование добавки | |
| Без добавок | 2.03 ± 0.20 | 2.04 ± 0.07 | – |
| 1,2,4-Триазол (I) | 2.92 ± 0.28 | 1.55 ± 0.24 | –0.15 ± 0.08 |
| 3-Нитро-1,2,4-триазол (II) | 5.56 ± 0.20 | 0.12 ± 0.01 | –0.50 ± 0.15 |
| 1-Метил-3-нитро-1,2,4‑триазол (III) | 6.33 ± 0.38 | 0.09 ± 0.01 | –0.75 ± 0.21 |
| 1-трет-Бутил-3-нитро-1,2,4‑триазол (IV) | 5.01 ± 0.24 | 0.10 ± 0.01 | –1.01 ± 0.16 |
| 1-(2-Гидроксиэтил)-3-нитро-1,2,4-триазол (V) | 6.31 ± 0.52 | 0.11 ± 0.01 | –3.03 ± 0.62 |
| Саназол (VI) | 5.53 ± 0.22 | 0.11 ± 0.01 | –1.01 ± 0.06 |
| 3,5-Динитро-1,2,4-триазолат натрия (VII) | 5.30 ± 0.14 | 0.07 ± 0.01 | –0.88 ± 0.20 |
| 1-Метил-3,5-динитро-1,2,4-триазол (VIII) | 5.06 ± 0.14 | 0.06 ± 0.01 | –0.75 ± 0.09 |
| 1-трет-Бутил-3,5-динитро-1,2,4-триазол (IX) | 5.49 ± 0.25 | 0.06 ± 0.01 | –0.26 ± 0.13 |
Необходимо отметить, что все 1,2,4-триазолы (I–IX) проявили себя как окислители, изменяя соотношение выходов продуктов радиолиза деаэрированного этанола в пользу АА. При этом радиационно-химические выходы разложения большинства исследуемых соединений были меньше 1 молекулы/100 эВ, что характерно для веществ, взаимодействующих с несколькими α-ГЭР или подвергающимся регенерации до исходных структур в ходе радиационно-индуцированных превращений [12, 15].
При облучении этанола в присутствии 1,2,4-триазола (I) снижение радиационно-химического выхода продукта рекомбинации α-ГЭР–БД составляет примерно половину величины прироста радиационно-химического выхода АА. Однако радиационно-индуцированное разложение исследуемого соединения I практически не происходит. Поэтому наблюдаемые изменения радиационно-химических выходов продуктов радиолиза этанола связаны не с окислением α-ГЭР под действием 1,2,4-триазола (I), а с его способностью акцептировать сольватированные электроны:
Образующийся в реакции (9) анион-радикал 1,2,4-триазола (I) далее восстанавливает ароматическую систему посредством переноса электрона на α-ГЭР:
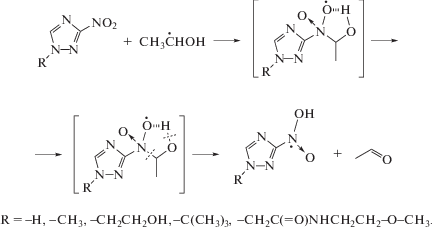
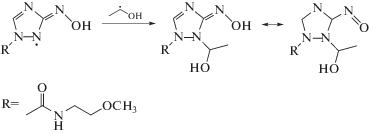
Известно, что нитроароматические соединения имеют диффузионно-лимитируемую константу (выше 1010 л моль–1 с–1) скорости взаимодействия с сольватированным электроном [22] и одновременно способны окислять α-гидроксилсодержащие углерод-центрированные радикалы по реакции 13 [23]. По нашему мнению подобного типа реакции могут реализовываться и при облучении нитропроизводных 1,2,4-триазола в деаэрированном этаноле (реакции 12–13):
При облучении деаэрированного спирта первичный радиационно-химический выход сольватированного электрона составляет 1.6 иона/100эВ, а α-ГЭР – 5.5 радикалов/100эВ. Поэтому 3.9 α-ГЭР на каждые 100 эВ поглощенной дозы образуются вследствие радикал-молекулярных реакций (6) и распада возбужденных молекул этанола (4). К тому же, образующийся при ионизации спирта катион-радикал, в конечном итоге превращается в α-ГЭР по реакции (3). Следовательно, акцептирование электрона 1,2,4-триазолами (II–VI) по реакции (12) не может являться причиной наблюдаемого снижения радиационно-химического выхода продукта рекомбинации α-ГЭР практически до нуля. Замеченные изменения радиационно-химических выходов основных продуктов радиолиза деаэрированного этанола в присутствии соединений II–VI связаны именно с реализацией реакции (13).
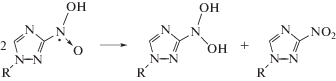
Продукты одноэлектронного восстановления нитрогруппы соединений II–VI, образующиеся в реакциях (12) и (13), вступают в реакции диспропорционирования (14) и (15) с образованием соответствующих нитрозопроизводных (16):
Радиационно-химические выходы разложения нитропроизводных 1,2,4‑триазола (II–IV, VI) по крайней мере в 5 раз меньше выхода α-ГЭР в деаэрированном этаноле. Это может происходить за счет регенерации добавок, что мы наблюдали в случае аскорбиновой кислоты [24], либо в результате взаимодействия добавляемых веществ с более чем одним α-ГЭР радикалом [12–14, 19].
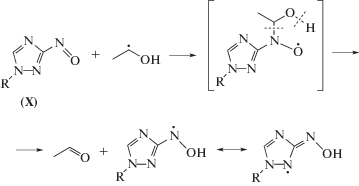
Для установления конечных молекулярных продуктов радиационно-индуцированных превращений соединений II–VI в деаэрированном этаноле и подтверждения предложенного механизма их взаимодействия с α-ГЭР мы провели хромато-масс-спектрометрическое исследование облученного раствора (1.6 кГр) саназола (VI) с начальной концентрацией 4 × 10–3 моль/л. Ожидаемо среди продуктов радиационно-индуцированных превращений саназола (VI) был обнаружен продукт его двухэлектронного восстановления X, образующийся в реакции 16. Однако, соответствующее нитрозопроизводное X не являлось основным продуктом радиационно-индуцированных превращений соединения VI. Более высокую скорость накопления при облучении саназола (VI) в деаэрированном этаноле имело вещество с массой молекулярного иона m/z = 215. С выходом примерно в 20 раз ниже накапливался еще один продукт с идентичной молекулярной массой.
Первый продукт с m/z = 215 нами был идентифицирован как производное гидроксиламина, поскольку в его масс-спектре при положительной ионизации четко проявлялся ион, образующийся после отщепления воды. Второй продукт с идентичным соотношением m/z = 215 имел низкий выход катионов при анализе, но значительно более интенсивный сигнал в отрицательной ионизации. По нашему мнению, он соответствует нитрозопроизводному X с восстановленной кратной связью в 1,2,4-триазольном цикле.
Оба соединения с m/z = 215 могут образоваться при восстановлении нитрозопроизводного X в результате взаимодействия с α-ГЭР по следующей серии реакций:
Подтверждением предложенной схемы радиационно-индуцированных превращений саназола (VI) является идентификация в качестве минорного продукта вещества с m/z = 259, которое соответствует аддукту α-ГЭР с азотцентрированным радикалом, образующимся в реакции (17).
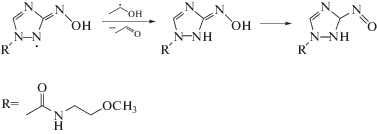
Соединение V отличается от аналогичных нитропроизводных 1,2,4-триазола (II–IV, VI) наличием гидроксиэтильного заместителя и при этом имеет в 3–12 раз более высокий выход разложения по сравнению с другими тестируемыми соединениями II–IV, VI. По нашему мнению, наблюдаемые особенности радиационно-индуцированных превращений соединения V могут быть связаны именно с элиминированием гидроксиэтильного фрагмента из азотцентрированного радикала, например, по реакции (21):
Косвенным подтверждением данной гипотезы может служить более высокий выход АА при облучении соединения (V) в деаэрированном этаноле по сравнению с другими нитропроизводными 1,2,4-триазола (II, IV, VI). Механизм радиационно-индуцированных превращений соединения V в этаноле будет объектом наших последующих исследований.
При анализе закономерностей радиолиза динитропроизводных 1,2,4-триазола (VII–IX) в деаэрированном этаноле (табл. 2) можно сделать заключение, что введение второй нитрогруппы в гетероцикл не приводит к существенным изменениям выходов молекулярных продуктов радиолиза деаэрированного этанола и разложения исследуемых веществ VII–IX в сравнении с мононитропроизводными 1,2,4-триазола (II–IV, VI). Это дает основание утверждать, что реакционная способность и механизмы радиационно-индуцированных превращений динитропроизводных 1,2,4-триазола (VII–IX) в деаэрированном этаноле будут идентичны таковым для соединений II–IV, VI, содержащих одну нитрогруппу.
Таким образом, нитропроизводные 1,2,4-триазола (II–IX) количественно окисляют α-ГЭР подавляя реакции их рекомбинации. Основными про-дуктами радиационно-индуцированных пре-вра-щений исследуемых веществ II–IX в деаэрированном этаноле являются соответствующие нитрозопроизводные и гидроксиламины, которые образуются в результате последовательного восстановления нитрогруппы. Полученные результаты имеют важное значение для понимания закономерностей радиационно-химических процессов с участием нитропроизводных 1,2,4-триазола, протекающих при облучении гипоксических тканей, и формирования радиосенсибилизирующих эффектов при их использовании в радиотерапии.
ВЫВОДЫ
В работе синтезирован ряд нитро- (II–V) и динитропроизводных (VII–IX) 1,2,4-триазола. Методом стационарного радиолиза исследовано взаимодействие полученных соединений с углеродцентрированными радикалами, образующимися при радиолизе деаэрированного этанола. Установлено, что 1,2,4-триазол (I) незначительно изменяет соотношение радиационно-химических выходов продуктов радиолиза деаэрированного этанола в пользу ацетальдегида, в то время как нитро- (II–VI) и динитропроизводные (VII–IX) этого азотсодержащего гетероциклического соединения количественно окисляют α-гидроксиэтильные радикалы. При этом все соединения, за исключением 1‑(2-гидроксиэтил)-3-нитро-1,2,4-триазола (V) практически не разлагаются в результате радиационно-химических превращений. Показано, что введение второй нитрогруппы в 1,2,4-триазольный цикл не приводит к существенным изменениям эффективности взаимодействия тестируемых веществ с α-гидроксиэтильными радикалами. Предложен механизм образования конечных молекулярных продуктов радиационно-индуцированных превращений радиосенсибилизатора саназола (VI) в деаэрированном этаноле, идентифицированных методом жидкостной хромато-масс-спектрометрии. Полученные в работе результаты имеют важное значение для понимания молекулярных механизмов формирования радиационных повреждений при лучевой терапии онкологических заболеваний с использованием радиосенсибилизатора саназола (VI) или других нитропроизводных 1,2,4‑триазола (II–V, VII–IX).
Работа выполнена при частичной финансовой поддержке Белорусского республиканского фонда фундаментальных исследований (№ Х17М-072).
Список литературы
Rockwell S., Dobrucki I.T., Kim E.Y., Marrison S.T., Vu V.T. // Current Molecular Medicine. 2009. V. 9. № 4. P. 442.
Dizdaroglu M., Jaruga P. // Free Radic. Res. 2012. V. 46. №. 41. P. 382.
Wardman P. // Clinical Oncology. 2007. V. 19. №. 6. P. 397.
Kapoor S., Mathew R., Huilgol N.G., Kagiya T.V., Nair C.K.K. // J. Radiat. Res. 2000. V. 41. № 4. P. 355.
Edimecheva I.P., Kisel R.M., Shadyro O.I., Kazem K., Murase H., Kagiya T. // J. Radiat. Res. 2005. V. 46. № 3. P. 319.
Юркова И.Л., Кисель М.А., Арнхольд Ю., Шады-ро О.И. // Химия высоких энергий. 2006. Т. 40. № 5. С. 345.
Юркова И.Л. // Успехи химии. 2012. Т. 81. № 2. С. 175.
Sukhanova A.G., Sakovich G.V., Sukhanov G.T. // Chemistry of Heterocyclic Compounds. 2008. V. 44. № 11. P. 1368.
Чернышев В.М., Земляков Н.Д., Таранушич В.А. // Журн. прикладной химии. 2000. Т. 23. № 5. С. 791.
Haiges R., Bélanger-Chabot G., Kaplan S.M., Christe K.O. // Dalton Transactions. 2015. V. 44. № 16. P. 7586.
Багал Л.И., Певзнер М.С., Шелудякова Н.И., Керусов В.М. // Химия гетероциклических соединений. 1970. № 2. С. 265.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Radiat. Phys. Chem. 2014. V. 98. P. 77.
Samovich S.N., Brinkevich S.D., Edimecheva I.P., Shadyro O.I. // Radiat. Phys. Chem. 2014. V. 100. P. 13.
Бринкевич С.Д., Свердлов Р.Л., Шадыро О.И. // Химия высоких энергий. 2013. Т. 47. № 1. С. 19.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2008. Т. 42. № 4. С. 297.
Freeman G.R. // Radiation chemistry of ethanol: a review of data on yields, reaction rate parameters, and spectral properties of transients / Washington: NBS, 1974.
Jore D., Champion B., Kaouadji N., Jay-Gerin J.-P., Ferradini C. // Radiat. Phys. Chem. 1988. V. 32. № 3. P. 443.
Shadyro O.I., Sosnovskaya A.A., Vrublevskaya O.N. // Int. J. Radiat. Biol. 2003. V. 79. № 4. P. 269.
Brinkevich S.D., Ostrovskaya N.I., Parkhach M.E., Samovich S.N., Shadyro O.I. // Free Rad. Res. 2012. V. 46. № 3. P. 295.
Brinkevich S.D., Boreko E.I., Savinova O.V., Pavlova N.I., Shadyro O.I. // Bioorganic and Medicinal Chemistry Letters. 2012. V. 22. № 7. P. 2424.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Free Rad. Res. 2014. V. 48. № 10. P. 1200.
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. // J. of physical and chemical reference data. 1988. V. 17. № 2. P. 513.
Jagannadham V., Steenken S. // J. Am. Chem. Soc. 1988. V. 110. № 7. P. 2188.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2011. Т. 45. № 2. С. 123.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий