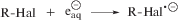Химия высоких энергий, 2019, T. 53, № 4, стр. 294-302
Авторадиолитическое разложение радиофармпрепарата “2-[18F]фтордезоксиглюкоза”
С. Д. Бринкевич a, *, О. В. Тугай a, Д. И. Невзоров b
a ГУ “Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова”
223040 аг. Лесной, Минский район, Республика Беларусь
b ФГБУ “Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина”
115478 Москва, Каширское ш., д. 24, Россия
* E-mail: BrinkevichSD@bsu.by
Поступила в редакцию 10.01.2019
После доработки 22.02.2019
Принята к публикации 25.02.2019
Аннотация
В работе изучена кинетика авторадиолитического разложения радиофармацевтического препарата “2-[18F]фтордезоксиглюкоза” ([18F]ФДГ) в насыщенном воздухом физиологическом растворе с начальными объемными активностями 1 и 2 ГБк/мл. Установлено, что единственным радиоактивным продуктом радиационно-индуцированных превращений [18F]ФДГ является [18F]фторид, доля которого в общей активности радиофармпрепарата возрастает по мере хранения. Показано, что увеличение начальной объемной активности радиофармпрепарата или снижение концентрации этанола в нем приводят к интенсификации авторадиолитического разложения [18F]ФДГ. В то время как повышение температуры хранения растворов с 25 до 40°С не оказывает влияния на скорость радиационно-индуцированного дегалогенирования [18F]ФДГ.
ВВЕДЕНИЕ
Являясь аналогом глюкозы – важнейшего энергетического метаболита человека, 2-[18F]фтор-2-дезокси-D-глюкоза ([18F]ФДГ) интенсивно применяется для диагностики онкологических, кардиологических и неврологических заболеваний методом позитронно-эмиссионной томографии (ПЭТ) [1, 2]. В настоящее время с ее использованием выполняется порядка 70% ПЭТ-исследований, объемы производства [18F]ФДГ продолжают расти, причем наиболее активно – в развивающихся странах [3].
Отличительной особенностью радиофармацевтических препаратов (РФП) от нерадиоактивных лекарственных средств является авторадиолиз – радиационно-индуцированное разложение меченого соединения при хранении под действием собственного излучения радионуклида, входящего в состав. В результате авторадиолитических превращений происходит снижение радиохимической чистоты РФП – доли активности диагностического агента от общей активности препарата. Накопление примесей, которые отличаются по фармакокинетике от действующего вещества, приводит к ухудшению коэффициентов распределения радиоактивной метки между очагами патофизиологических процессов и здоровыми тканями. Как следствие, снижаются соотношения сигнал/шум на ПЭТ-томограмме, а дозовая нагрузка на пациентов при выполнении диагностических исследований, напротив, увеличивается [4].
Ранее было показано [5, 6], что при хранении [18F]ФДГ в радиофармацевтическом лекарственном средстве происходит интенсивное накопление остеотропного [18F]фторида, что приводит к интенсивному облучению красного костного мозга – наиболее критичного с точки зрения радиобиологии органа-мишени. Авторадиолиз [18F]ФДГ сокращает срок годности препарата до нескольких часов, затрудняет диагностическое применение РФП и его доставку из мест централизованного производства в отдаленные клиники [5]. Это указывает на необходимость изучения закономерностей авторадиолитических превращений [18F]ФДГ и поиска ингибиторов данного нежелательного процесса.
В настоящей работе исследована динамика изменения радиохимической чистоты и доли активности [18F]фторида в РФП “2-[18F]фтордезоксиглюкоза” с начальными объемными активностями 1–2 ГБк/мл в насыщенном воздухом физиологическом растворе.
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе без предварительной очистки использовали следующие коммерчески доступные реагенты – этанол, ацетонитрил, натрия [19F]фторид, 50% NaOH в воде (Sigma-Aldrich, США); 2‑[19F]фтор-2-дезокси-D-глюкозу ([19F]ФДГ), 2‑[19F]фтор-2-дезокси-D-маннозу ([19F]ФДМ), 1,2,3,5-тетра-О-ацетил-D-глюкозу (ABX, Германия). Ультрачистую воду с удельным сопротивлением не менее 15 МОм получали с использованием Milli-Q (Millipore, США).
Для исследования авторадиолитического разложения использовали инъекционное лекарственное средство “2-[18F]фтордезоксиглюкоза” для ПЭТ-диагностики, полученное по стандартной технологии [7] на кассетных модулях Synthera (IBA, Бельгия) с использованием наборов реагентов для производства [18F]ФДГ фирмы ABX (Германия). Контроль качества готового лекарственного средства осуществляли в соответствии с требованиями соответствующей статьи государственной фармакопеи Республики Беларусь, гармонизированной с европейской фармакопеей [8]. Для снижения дозовых нагрузок персонала и улучшения коэффициента разделения компонентов растворы РФП непосредственно перед измерениями разбавляли в 5 раз.
Для определения активности [18F]фторида и радиохимической чистоты препарата использовали две независимые фармакопейные методики: радио-ТСХ и радио-ВЭЖХ. Первая позволяет разделить с использованием силикагелевых пластин (Merck) [18F]фторид (Rf = 0), сумму [18F]ФДГ + + [18F]ФДМ (Rf = 0.4–0.5) и частично ацилированные аналоги [18F]ФДГ (Rf ~ 0.8). В качестве подвижной фазы использовали систему вода/ацетонитрил 5/95 (об./об.). Раствор РФП объемом 0.1 мкл наносили на линию старта. Пластинку высушивали на воздухе в течение 1 мин и помещали в резервуар с подвижной фазой. По достижению фронтом элюента линии финиша высушивали пластину промышленным феном при температуре 50°С в течение минуты для исключения размывания пиков и фиксации радиоактивных веществ. Счет импульсов от линии старта до финиша (соответственно 0.1 и 0.9 от высоты пластины) осуществляли с использованием автоматического сцинтилляционного сканера miniGita (Raytest, Германия).
Подлинность и радиохимическую чистоту РФП определяли методом ионообменной радио-ВЭЖХ на Agilent 1260 с колонкой Dionex CarboPac PA10 Analyticlal (длинна 0.25 м, диаметр 4 мм, зерно 10 мкм) и предколонкой Dionex CarboPac PA10 Guard. Для приготовления подвижной фазы: 4 г/л NaOH в воде – использовали 50% раствор щелочи без карбоната и дегазированную ультразвуком при нагревании воду. Время выхода радиоактивных веществ определяли с использованием их стабильных копий и рефрактометрического детектора Agilent G1362A, последовательно соединенного капилляром с откалиброванным объемом с проточным детектором по радиоактивности Gabi (Raytest, Германия). Скорость потока – 1 мл/мин, температура колонки составляла 30°С, объем вводимой пробы – 20 мкл. Раствор РФП объемом 30 мкл с помощью хроматографического шприца на 50 мкл вводили в дозирующую петлю инжектора. Время выхода [18F]ФДГ + + [18F]ФДМ составляло 9.50–10.15 мин в зависимости от ионообменной емкости колонки.
Содержание остаточных растворителей: этанола, ацетонитрила – определяли методом газовой хроматографии на Agilent 6850 с пламенно-ионизационным детектором аналогично [9]. Температура инжектора и детектора – 250°С, поток газа-носителя – 3 мл/мин. Ввод пробы РФП объемом 1 мкл осуществляли с помощью автоинъектора.
Для изучения динамики изменения радиохимической чистоты препарата и накопления свободного [18F]фторида при хранении фасовали по 1.5 мл РФП во флаконы объемом 15 мл, после чего их укупоривали бутилкаучуковой пробкой и обжимали алюминиевой крышкой. Полный контроль качества проводили на протяжении 8 ч (назначенный срок хранения) с двухчасовыми интервалами.
При проведении исследований в лаборатории поддерживали постоянный температурный режим – 25 ± 2°С. Для изучения стабильности РФП в условиях “ускоренного старения” защитные свинцовые контейнеры CF18 Pb (Comecer, Италия) термостатировали 1 ч при 40 ± 1°С до загрузки флакона с РФП и потом на протяжении всего срока хранения. За 5 мин до проведения испытаний пробу охлаждали путем перемещения в идентичный свинцовый контейнер, термостатированный при 25°С, после чего флакон вскрывали.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Интенсивность авторадиолитического разложения радиофармпрепарата [18F]ФДГ во время хранения будет в значительной мере определяться величиной поглощенной раствором дозы. Эту величину можно оценить расчетным путем, поскольку использование стандартных методов химической дозиметрии для радиофармпрепаратов затруднительно. Согласно данным работы [6], раствор [18F]ФДГ с объемной активностью 1 ГБк/мл при полном распаде радионуклида получит поглощенную дозу в 405 Гр, из которых 368 Гр формируется при термализации позитрона, а 37 Гр – за счет анигиляционного фотонного излучения.
При рассмотрении возможных радиационно-химических процессов под действием невысоких (по меркам радиационной химии органических соединений) поглощенных доз необходимо принимать во внимание то, что раствор с рассматриваемой объемной активностью будет содержать всего 2.87 × 10–9 г/мл или 15.8 × 10–9 моль/л [18F]ФДГ. Несложные расчеты показывают, что при распаде одного атома 18F в водном растворе образуется примерно 7200 •ОН и столько же ${\text{e}}_{{{\text{aq}}}}^{ - }.$
Для фармакопейного анализа радиофармпрепарата [18F]ФДГ традиционно используются методы радио-ВЭЖХ и радио-ТСХ. В соответствии со статьей 01/2014:1325 европейской фармакопеи [8] и, созданному на ее основе разделу государственной фармакопеи Республики Беларусь, радио-ТСХ используется для определения доли активности (%) [18F]фторида от общей активности радионуклида 18F в препарате. Оба хроматографических метода используются для определения подлинности лекарственного средства и определения его радиохимической чистоты – доли активности 18F, которая приходится на основное вещество ([18F]ФДГ) от общей активности 18F в радиофармпрепарате.
Типичная хроматограмма радио-ТСХ представлена на рис. 1. В условиях анализа [18F]ФДГ и [18F]ФДМ не разделяются и имеют одинаковый коэффициент удерживания Rf – примерно 0.45. [18F]Фторид в условиях анализа не движется по ТСХ-пластине и остается на линии старта. В процессе синтеза из-за неполного гидролиза иногда могут оставаться незначительные количества частично ацилированной [18F]ФДГ с Rf в диапазоне от 0.8 до 0.95. Другие радиоактивные вещества на радио-ТСХ хроматограмме не проявлялись ни по окончании синтеза, ни в процессе хранения радиофармацевтического препарата.
Рис. 1.
Радио-ТСХ хроматограмма радиофармпрепарата [18F]ФДГ с относительной активностью [18F]фторида 1.4%.

При анализе радиофармацевтического препарата [18F]ФДГ методом радио-ВЭЖХ перечень идентифицируемых веществ значительно шире. На рефрактометрическом детекторе (рис. 2а), используемом для определения времени выхода стандартов “холодных” (нерадиоактивных) фторированных сахаров [19F]ФДГ и [19F]ФДМ, а также [19F]фторида, присутствует только пик глюкозы. Это продукт щелочного гидролиза 1,3,4,6-тетра-О-ацетил-2-О-трифлата маннозы – предшественника, используемого для синтеза [18F]ФДГ.
Рис. 2.
Радио-ВЭЖХ хроматограмма радиофармпрепарата [18F]ФДГ с радиохимической чистотой 98.87% и относительной активностью [18F]фторида 0.87%; а – рефрактометр, б – сцинтилляционный детектор.
С использованием детектора по радиоактивности (рис. 2б) регистрируются 3 примеси и основной пик со временем выхода 9.50–10.15 мин (в зависимости от анионообменной емкости колонки), который принадлежит [18F]ФДГ. На левом фронте пика основного вещества выходит [18F]ФДМ, как правило, на нее приходится 2–7% от общей активности препарата. [18F]ФДМ образуется в ходе синтеза и учитывается вместе с [18F]ФДГ при расчете радиохимической чистоты.
Детектируемые методом радио-ВЭЖХ радиохимические примеси, как правило, имеют долю в 0.1–1.0% от общей активности препарата на момент выпуска партии лекарственного средства. При этом относительная активность второй из них увеличивается по мере хранения радиофармпрепарата. С использованием метода “подсадки” (введения в пробу предполагаемого вещества) было показано, что пик со временем выхода 5.55–6.05 мин (на детекторе по радиоактивности) соответствует [18F]фториду. На рефрактометре нерадиоактивный фторид [19F]F– имеет идентичное время выхода с учетом длины капилляра между детекторами и скорости потока элюента. С учетом того, что пики других радиоактивных примесей не накладываются на [18F]F-, используемый для определения подлинности лекарственного средства и его радиохимической чистоты метод радио-ВЭЖХ можно применять в качестве вспомогательного способа определения содержания [18F]фторида в радиофармпрепарате [18F]ФДГ.
Примеси со временами выхода 4.15–4.25 (соединение 1) и 6.40–6.55 (соединение 3) присутствуют в лекарственном средстве сразу по окончании синтеза и практически не изменяют величину своей относительной активности в процессе хранения. В частности, например, на соединение 3 обычно приходится около 0.20% от активности радиофармпрепарата (рис. 3). Тот факт, что данные примеси регистрируются и спустя 6–8 ч, поле синтеза, однозначно, указывает на присутствие в их составе 18F (T1/2 = 110 мин). Другие примесные радионуклиды, которые могут нарабатываться на циклотроне при облучении воды [18O]H2O, имеют периоды полураспада всего 10 и 20 мин (соответственно для 13N и 11C).
Рис. 3.
Динамика изменения относительной активности радиохимических примесей в радиофармпрепарате [18F]ФДГ при хранении по данным радио-ВЭЖХ. Начальная активность 1915 МБк/мл.

Представленный на рис. 3 характер изменения относительной активности радиохимических примесей в радиофармпрепарате [18F]ФДГ может свидетельствовать о том, что соединения 1 и 3 образовались в процессе синтеза активной фармацевтической субстанции. Таким образом, единственным регистрируемым радиоактивным продуктом авторадиолитических превращений радиофармпрепарата [18F]ФДГ является [18F]фторид.
Закономерности изменения доли [18F]F- при хранении от общей активности радионуклида 18F в радиофармпрепарате [18F]ФДГ с начальными объемными активностями 780–1200 МБк/мл представлены на рис. 4, с начальными объемными активностями 1715–2080 МБк/мл – на рис. 5. Доля активности фторида в препарате на момент окончания синтеза (EOS) колебалась в диапазоне от 0.15 до 0.42%. Что может быть связано, как с неполной очисткой [18F]ФДГ от сырьевого радионуклида на картридже твердофазной экстракции Alumina B (Waters, США) после синтеза, так и активным протеканием авторадиолиза фармацевтической субстанции после синтеза и до ее разведения изотоническим раствором NaCl, когда объемная активность может достигать 17 000 МБк/мл. Незначительное количество [18F]фторида может также образовываться за время, которое проходит после укупорки радиофармпрепарата во флаконе (время фасовки) и до вскрытия пробы в лаборатории контроля качества.
Рис. 4.
Изменение относительной активности [18F]фторида при хранении растворов радиофармпрепарата [18F]ФДГ с начальной объемной активностью порядка 1 ГБк/мл; а – данные радио-ТСХ, б – данные радио-ВЭЖХ

Рис. 5.
Изменение относительной активности [18F]фторида при хранении растворов радиофармпрепарата [18F]ФДГ с начальной объемной активностью порядка 2 ГБк/мл; а – данные радио-ТСХ, б – данные радио-ВЭЖХ.
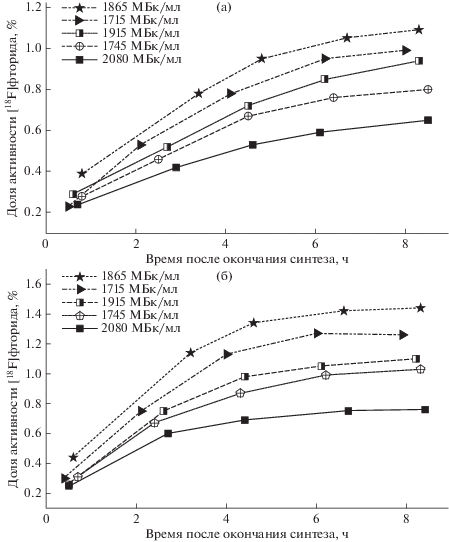
При сопоставлении рис. 4 и 5 становится очевидно, что значения относительной активности [18F]фторида в радиофармпрепарате, измеренные методом радио-ВЭЖХ, примерно на 30–50% выше, чем соответствующие величины, определенные посредством радио-ТСХ. Но при этом характер наблюдаемых закономерностей не изменяется при переходе от одного хроматографического метода к другому. По нашему мнению, такие различия в измеренных значениях могут быть связаны с условиями регистрации излучения радиоактивного изотопа.
При счете активности с ТСХ-пластинки детектор β-излучения многократно пробегает от линии старта к линии фронта. Для уменьшения “засветки” и, как следствие, увеличения пространственного разрешения алюминиевый защитный корпус сцинтиллятора имеет узкое окно для сбора позитронов с поверхности пластины. Однако алюминий слабо защищает детектор от аннигиляционных γ-квантов, что может приводить к некоторому завышению количества зарегистрированных импульсов над пятном [18F]ФДГ и, соответственно, занижению полученной методом радио-ТСХ относительной активности [18F]фторида. При анализе методом радио-ВЭЖХ смесь радиоактивных веществ вначале разделяется на колонке и только потом подается по тонким капиллярам на детектор. Сам сцинтиллятор экранирован свинцовыми кольцами толщиной 50 мм и имеет проточную камеру для счета активности объемом 5 мкл, что кардинально снижает эффект “засветки”.
Необходимо также отметить значительно более низкое соотношение сигнал–шум в случае радио-ТСХ, что зачастую осложняет обсчет низких или вовсе следовых количеств [18F]фторида. Тем не менее, именно этот метод является арбитражным и используется для определения относительной активности [18F]фторида в радиофармацевтическом препарате [18F]ФДГ в соответствии с требованиями фармакопеи [8].
Сопоставление профилей изменения относительной активности [18F]фторида при хранении радиофармацевтического препарата [18F]ФДГ (рис. 4, 5) позволяет выявить следующие закономерности. Увеличение начальной объемной активности раствора [18F]ФДГ c 1 до 2 ГБк/мл приводит к возрастанию регистрируемых значений относительной активности [18F]фторида, что свидетельствует об интенсификации авторадиолитического разложения радиофармацевтического препарата. Наблюдаемый эффект может быть одновременно связан с увеличением как концентрации радиолизуемого вещества, так и поглощенной раствором дозы.
Однако изменение относительной активности [18F]фторида не происходит пропорционально возрастанию начальной объемной активности раствора [18F]ФДГ. К тому же в пределах рассматриваемых диапазонов 780–1200 и 1715–2080 МБк/мл видно, что концентрация радиоактивного вещества не является единственным фактором, определяющим скорость авторадиолитического разложения [18F]ФДГ. Анализ химического состава радиофармацевтического препарата позволяет проследить зависимость интенсивности прироста относительной активности [18F]фторида при хранении от концентрации остаточных растворителей, в первую очередь этанола (табл. 1). С увеличением его концентрации происходит снижение интенсивности авторадиолитического разложения [18F]ФДГ.
Таблица 1.
Содержание фторида [18F]F– по данным радио-ВЭЖХ в радиофармпрепарате [18F]ФДГ через 8 ч с момента выпуска партии в зависимости от начальной концентрации этанола
| Объемная активность, МБк/мл | Содержание этанола после синтеза, 10–6 моль/литр | Доля активности [18F]F–, % |
|---|---|---|
| 911 | 464 | 0.94 |
| 1003 | 205 | 1.31 |
| 1015 | 429 | 1.03 |
| 1715 | 403 | 1.26 |
| 1745 | 735 | 1.03 |
| 1865 | 458 | 1.44 |
Этанол широко используется в процессе радиофармацевтического производства [18F]ФДГ. В частности, перед синтезом картридж твердофазной экстракции C18 (Waters, США) кондиционируется 96% раствором этанола. Этот растворитель входит в состав щелочного реагента для гидролиза (1 M NaOH), а также применяется для обеспечения асептики производства при ежедневной обработке модуля синтеза, линий трансфера активности и камеры фасовки.
При хранении радиофармпрепарата [18F]ФДГ наблюдается снижение концентрации этанола, например, для раствора с начальной объемной активностью 1150 МБк/мл за 8 ч хранения содержание этанола падает с 350 × 10–6 до 274 × 10–6 моль/литр. Необходимо отметить, что концентрация спирта в данном случае на 4 порядка больше, чем меченого соединения. Поэтому ингибирование авторадиолитического разложения [18F]ФДГ вероятно происходит за счет того, что этанол (или продукты его радиолиза) выигрывает конкуренцию у [18F]ФДГ за радикальные продукты радиолиза воды.
Одним из стандартных тестов для изучения свойств лекарственных препаратов является исследование стабильности “в условиях ускоренного старения” при повышенной температуре хранения. Приведенные в табл. 2 результаты свидетельствуют о том, что увеличение температуры хранения радиофармацевтического препарата с 25 до 40°С не приводит к интенсификации авторадиолитического разложения [18F]ФДГ.
Таблица 2.
Содержание фторида [18F]F– по данным радио-ТСХ в радиофармпрепарате [18F]ФДГ в зависимости от начальной объемной активности и температуры хранения
| № образца | Объемная активность, на момент фасовки МБк/мл | Т, °С | Доля активности [18F]F–, % | |
|---|---|---|---|---|
| количество часов после синтеза |
||||
| 0 ч | 8 ч | |||
| 1а | 1038 | 25 | 0.14 | 0.75 |
| 1б | 40 | 0.11 | 0.78 | |
| 2а | 1984 | 25 | 0.35 | 1.61 |
| 2б | 40 | 0.37 | 1.56 | |
| 3а | 2015 | 25 | 0.20 | 1.27 |
| 3б | 40 | 0.22 | 1.33 | |
Необходимо отметить, что вне зависимости от концентрации этанола и температуры хранения для всех исследованных в работе образцов радиофармацевтического препарата [18F]ФДГ относительная активность [18F]фторида по истечении 8 ч с момента выпуска партии с запасом не превышала предельного значения в 5%, установленного фармакопеей [8]. Таким образом, при выполнении настоящего исследования было получено экспериментальное подтверждение соответствия параметров качества лекарственного средства [18F]ФДГ с начальными объемными активностями порядка 1–2 ГБк/мл требованиям соответствующей фармакопейной статьи по радиохимической чистоте на протяжении заявленного восьмичасового срока хранения.
Для того, чтобы выразить интенсивность разложения радиофармацевтического препарата [18F]ФДГ под действием собственного излучения в более привычных для радиационной химии величинах, можно оценить радиационно-химический выход образования [18F]фторида. Мы использовали методологию расчета поглощенной раствором [18F]ФДГ дозы, приведенную в работе [6]. Концентрацию ионов [18F]фторида, образовавшихся в растворе, определяли как произведение начальной концентрации [18F]ФДГ на относительную активность [18F]фторида на момент окончания восьмичасового срока хранения, что позволило не учитывать фактор радиоактивного распада [18F]фторида при расчете. Полученные таким образом значения радиационно-химического выхода образования [18F]фторида составляли 2.8–3.2 × 10–6 ионов/100 эВ для растворов с начальными объемными активностями в диапазоне 780–1200 МБк/мл и 3.0–5.4 × 10–6 ионов/100 эВ – соответственно для 1715–2080 МБк/мл.
По нашему мнению, крайне низкие по меркам классической радиационной химии величины G([18F]F–) обусловлены наномолярными концентрациями [18F]ФДГ в растворе. В этих условиях образующиеся при распаде нуклида 18F радикальные продукты радиолиза воды будут преимущественно рекомбинировать межу собой и вступать в радикал-молекулярные реакции с остаточными растворителями, глюкозой и другими соединениями, присутствующими в микро- и милимолярных концентрациях в фармацевтической субстанции.
В заключение рассмотрим возможные механизмы радиационно-индуцированного элиминирования [18F]фторида. Несмотря на колоссальные объемы мирового производства радиофармацевтического препарата [18F]ФДГ, механизм ее радиационно-индуцированного дегалогенирования до настоящего момента не установлен. Отдельные молекулярные продукты авторадиолитических превращений радиофармацевтического препарата [18F]ФДГ были идентифицированы с использованием хромато-масс-спектрометрии [10]. Однако, по мнению авторов исследования, обнаруженные соединения могли образоваться как из глюкозы, так и из ее фторированного производного.
Общеизвестно, что галогеналифатические соединения (в том числе фторорганические) в водных растворах имеют высокие константы скорости реакции с сольватированным электроном [11]. Образующиеся в реакции (2) анион-радикалы хлор-, бром- и особенно йодорганических соединений быстро элиминируют соответствующие анионы. При анализе литературных данных нам не удалось найти подтверждений реализации реакции, аналогичной (3), для анион-радикалов фторалифатических соединений.
В монографии [12] было показано, что взаимодействие •ОН и •Н радикалов с 1-хлор-2-гидроксиэтаном, 1-хлор-2,3-дигидроксипропаном и 2-бром-3-гидроксибутаном приводит к образованию α-гидроксилсодержащих углеродцентрированных радикалов, элиминирующих галогеноводород по следующим реакциям:
Способность [18F]ФДГ элиминировать [18F]HF по реакции, аналогичной (5), также является открытым вопросом. Исследование механизма авторадиолитического дегалогенирования [18F]ФДГ в водных растворах будет предметом наших последующих публикаций.
ЗАКЛЮЧЕНИЕ
В настоящей работе изучена кинетика авторадиолитического разложения радиофармацевтического препарата [18F]ФДГ в насыщенных воздухом водных растворах с начальными объемными активностями в диапазоне от 780 до 2080 МБк/мл. Показано, что используемый для определения подлинности лекарственного средства и его радиохимической чистоты метод радио-ВЭЖХ можно применять в качестве вспомогательного способа определения содержания [18F]фторида в радиофармпрепарате [18F]ФДГ. Установлено, что единственным регистрируемым радиоактивным продуктом авторадиолитических превращений радиофармпрепарата [18F]ФДГ является [18F]фторид, доля активности которого в радиофармпрепарате увеличивается по мере хранения. Показано, что увеличение начальной объемной активности радиофармпрепарата или снижение концентрации этанола в нем приводят к ускорению авторадиолитического разложения [18F]ФДГ. Повышение температуры хранения растворов с 25 до 40°С не приводит к интенсификации радиационно-индуцированного разложения [18F]ФДГ. Получено экспериментальное подтверждение соответствия радиохимической чистоты препарата [18F]ФДГ с начальными объемными активностями порядка 1–2 ГБк/мл требованиям статьи 01/2014:1325 европейской фармакопеи на протяжении восьмичасового срока хранения.
Авторы выражают благодарность Баскаловой Юлии Олеговне за помощь в изучении радиохимической чистоты радиофармацевтического препарата [18F]ФДГ.
Список литературы
Gary A. Ulaner // Fundamentals of Oncologic PET/CT / Book Elsevier, 2019. P. 352.
Zhuang H., Codreanu I. // J. Biomed. Res. 2015. V. 29. I. 3. P. 189.
Brinkevich S., Pires L.P., Portilho F.L., Santos-Oliveira R. // Current Radiopharmaceuticals. 2018. V. 11. P. 69.
Vallabhajosula S. // Molecular Imaging: Radiopharmaceuticals for PET and SPECT / Book, Springer-Verlag Berlin Heidelberg. 2009. P. 372.
Walters L.R., Martin K.J., Jacobson M.S., Hung J.C., Mosman E.A. // J. Nuclear Medicine Technology. 2012. V. 40. P. 52.
Fawdry R.M. // Appl. Radiat. Isot. 2007. V. 65. P. 1193.
Иванюкович А.А., Сорока С.А., Крот В.О., Бринкевич Д.И., Бринкевич С.Д., Чиж Г.В., Свердлов Р.Л. // Медицинская физика. 2018. № 4 (80). С. 59.
Council of Europe // European Pharmacopoeia 8.0. Article 01/2014:1325: Fludeoxyglucose (18F) injection / Strasbourg, France. 2013. P. 1052.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2018. Т. 52. № 4. С. 347.
Búriová E., Macášek F., Melichar F., Kropá M., Procházka L. // J. Radioanal. Nucl. Chem. 2005. V. 264. № 3. P. 595.
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 513.
Петряев Е.П., Шадыро О.И. // Радиационная химия бифункциональных органических соединений / Минск: Университетское, 1986. С. 165.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий