Химия высоких энергий, 2020, T. 54, № 1, стр. 78-80
Фотохимический синтез тиоперренатов
Н. Б. Егоров a, *, Д. В. Гусева a, Е. А. Исаева a, О. С. Толкачёв a
a Томский политехнический университет
634050 Томск, Россия
* E-mail: egorov@tpu.ru
Поступила в редакцию 01.07.2019
После доработки 23.07.2019
Принята к публикации 23.07.2019
Получение тиоперренатов в водных растворах представляет интерес для изучения геохимических процессов [1], а также для усовершенствования способов синтеза гептасульфида рения [2, 3], который используется в промышленности в качестве катализатора [4] и в медицине в качестве реагента для лимфосцинтиграфии [5].
В настоящем сообщении впервые показана возможность получения тиоперренатов при УФ-облучении водных растворов, содержащих перренат натрия $\left( {{\text{NaRe}}{{{\text{O}}}_{4}}} \right)$ и тиосульфат натрия $\left( {{\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}} \right).$
Предварительно было установлено, что смеси растворов, содержащие ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ подвергаются фотолизу, только если в растворе содержится избыток последнего. Для изучения фотолиза в качестве источников УФ-излучения использовали ртутные лампы низкого (лампа ДКБУ-9) и высокого (лампа ДРТ-125) давлений, а также эксимерные лампы KrBr (λmax = 207 нм) и KrCl (λmax = 222 нм). Исследования показали, что из перечисленных источников УФ-излучения при использовании эксимерной лампы KrCl в фотолите спектрофотометрическим методом регистрируется наибольшая концентрация продуктов фотолиза. Также было обнаружено, что заметное влияние на процесс фотолиза оказывает кислород воздуха и только в аэрированных растворах возникает интенсивная окраска, обусловленная продуктами фотолиза. Поэтому в дальнейших исследованиях УФ-облучение водных растворов, содержащих ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ осуществляли на воздухе с использованием эксимерной лампы KrCl.
Электронные спектры продуктов фотолиза, образующихся в водных растворах, регистрировали на спектрофотометре Evolution 600. Для спектрофотометрических исследований общий объем облучаемого раствора всегда составлял 2 мл. Для его приготовления смешивали по 1 мл водных растворов ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}.$
На рис. 1 представлен электронный спектр раствора, содержащего 1 × 10–4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ который имеет поглощение с λмакс ∼ 210 нм. После УФ-облучения в спектре исходный пик раздваивается и возникают поглощения при λмакс ∼ 198 нм и при λмакс ∼ 212 нм. Согласно работе [6] поглощение при ∼198 нм соответствует n → π* переходу, вовлекающему несвязанные электроны на атомах кислорода иона ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }},$ а поглощение при ∼212 нм соответствует переносу заряда с иона ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ на растворитель. С увеличением времени УФ-облучения интенсивность этих поглощений снижается, что указывает на уменьшение концентрации иона ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ в фотолите, при этом раствор приобретает желтую окраску, а в электронном спектре появляется поглощение с λмакс ∼ 300 нм (рис. 1, кривые 2–4).
Рис. 1.
Электронные спектры смеси водных растворов 1 × 10–4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ при различном времени УФ-облучения: 1 – 0; 2 – 1; 3 – 2; 4 – 4 мин. Вставка – электронные спектры водного раствора 1 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ при различном времени УФ-облучения: 1' – 0; 2' – 1; 3' – 2; 4' – 4 мин. 5' – электронный спектр раствора, содержащего 1 × 10–4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ после 4 мин УФ-облучения.
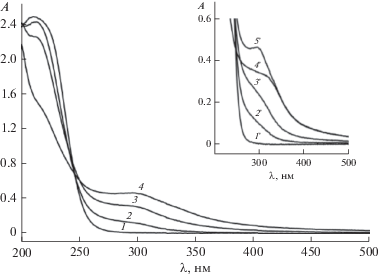
Для идентификации продуктов фотолиза, имеющих поглощение при ∼300 нм, был исследован фотолиз водного раствора ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ с концентрацией 1 × 10–3 моль/л. Условия его фотолиза были идентичны условиям фотолиза раствора, содержащего 1 × 10–4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}.$
С увеличением времени фотолиза водного раствора ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ в электронном спектре происходит уменьшение интенсивности поглощения при ∼198 нм и при ∼214 нм, а также появление поглощения в области ∼300 нм (рис. 1, вставка, кривые 2 '–4 '). Однако при этом в растворе визуально наблюдается образование коллоидной серы, и он не окрашивается в желтый цвет.
Сопоставление электронных спектров облученных в течение 4 мин раствора ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ (1 × × 10–3 моль/л) и раствора, содержащего 1 × × 10‒4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ (рис. 1, вставка, кривые 4 ' и 5 '), показало, что интенсивность поглощения при ∼300 нм не одинакова. Для раствора, содержащего ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ оптическая плотность фотолита выше. Учитывая, что исходные растворы не поглощают в этой области спектра, был сделан вывод, что в облученном растворе, содержащем 1 × 10–4 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 2 × 10–3 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ при ∼300 нм поглощают как минимум два продукта фотолиза, одним из которых является элементная сера.
Облучение более концентрированных растворов, содержащих ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ приводит к появлению в электронном спектре, помимо поглощения при ∼300 нм, поглощений при λмакс ∼ 415 нм и при λмакс ∼ 480 нм, при этом раствор окрашивается в светло-коричневый цвет (рис. 2, кривые 2–6).
Рис. 2.
Электронные спектры смеси водных растворов 6 × 10–3 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 4 × 10–1 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}}$ при различном времени УФ-облучения: 1 – 0; 2 – 2; 3 – 4; 4 – 6; 5 – 8; 6 – 10 мин.

Согласно [7] фотолиз иона ${\text{ReO}}_{4}^{--}$ происходит в присутствии восстановителя только в сильнокислых растворах. Раствор, содержащий 6 × 10–3 моль/л ${\text{NaRe}}{{{\text{O}}}_{4}}$ и 4 × 10–1 моль/л ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ имеет почти нейтральную реакцию. Облучение 10 мл раствора в течение 10 мин сопровождается изменением рН от 6.3 до 5.3. Это указывает, что образование окрашенных продуктов фотолиза в водном растворе происходит при взаимодействии ${\text{ReO}}_{4}^{--}$ с продуктами фотолиза ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}.$
Согласно работе [6] фотораспад ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}~$ в водных растворах при УФ-облучении излучением с λmax = 228.8 нм преимущественно протекает по реакции:
(1)
${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}\xrightarrow{{h\nu }}{\text{\;}}{{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}} + {{{\bar {e}}}_{{{\text{aq}}}}}.$Это позволяет предположить, что образующиеся при фотолизе ион-радикалы ${\text{\;}}{{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}$ способны реагировать с ионами ${\text{ReO}}_{4}^{--},$ последовательно замещая в них атомы кислорода на атомы серы, с образованием тиоперренат-ионов по схеме:
(2)
$\begin{gathered} \operatorname{Re} {\text{O}}_{4}^{ - }\xrightarrow[{{\text{--SO}}_{4}^{{\dot { - }}}}]{{ + {{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}}}\operatorname{Re} {{{\text{O}}}_{3}}{{{\text{S}}}^{ - }}\xrightarrow[{{\text{--SO}}_{4}^{{\dot { - }}}}]{{{\text{ + }}{{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}}} \\ \to {{\operatorname{ReO} }_{2}}{\text{S}}_{2}^{ - }\xrightarrow[{{\text{\;--SO}}_{4}^{{\dot { - }}}}]{{{\text{ + }}{{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}}}\operatorname{Re} {\text{OS}}_{3}^{ - }\xrightarrow[{{\text{--SO}}_{4}^{{\dot { - }}}}]{{ + {{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}}}\operatorname{Re} {\text{S}}_{4}^{ - }. \\ \end{gathered} $Поэтому отнесение полос поглощения, наблюдаемых после фотолиза смеси водных растворов ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ в электронных спектрах было сделано на основании анализа литературных данных по светопоглощению тиоперренат-ионов в водных растворах [1, 8, 9]. Из имеющихся в литературе сведений следует, что тиоперренат-ио-ны имеют индивидуальные электронные спектры поглощений в видимой и ультрафиолетовой областях, которые частично перекрываются.
Наличие поглощения, наблюдаемого в электронных спектрах при ~ 480 нм указывает на присутствие в фотолите ионов $\operatorname{Re} {\text{S}}_{4}^{--}$ и , а при ~ 415 нм можно отнести к присутствию ионов $\operatorname{Re} {\text{OS}}_{3}^{--}$ и $\operatorname{Re} {{{\text{O}}}_{{\text{2}}}}{\text{S}}_{2}^{--}$. Полоса поглощения при ~300 нм характерна для всех четырех тиоперренат-ионов, в том числе и для ионов ReO3S–, поэтому она обладает самой высокой интенсивностью.
С помощью ИК-спектроскопии, как это описано в работе [10], в водном растворе, содержащем ${\text{NaRe}}{{{\text{O}}}_{4}}$ и ${\text{N}}{{{\text{a}}}_{2}}{{{\text{S}}}_{2}}{{{\text{O}}}_{3}},$ после его УФ-облучения обнаружены ионы ${\text{SO}}_{4}^{{2 - }}$ и ${{{\text{S}}}_{4}}{\text{O}}_{6}^{{2 - }},$ образование которых может осуществляться в результате расходования ион-радикалов ${\text{SO}}_{4}^{{\dot { - }}}$ и ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{\dot { - }}}$ соответственно.
Работа выполнена в рамках реализации программы повышения конкурентоспособности ТПУ.
Список литературы
Helz G.R., Dolor M.K. // Chemical Geology. 2012. V. 304–305. P. 131.
Антипкин Н.Р., Богородская М.А. // Успехи в химии и химической технологии. 2011. Т. 25. № 6. С. 105.
Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974.
Ряшенцева М.А. // Успехи химии.1998. V. 67. № 2. С. 175.
Manuilov B.M., Ermakov A.V. // Applied Biochemistry and Microbiology. 2017. V. 53. № 8. P. 823.
Sperling R., Treinin A. // J. Phys. Chem.1964. V. 68. № 4. P. 897.
Немодрук А.А., Безрогова Е.В. Фотохимические реакции в аналитической химии. М.: Химия, 1972.
Krebs V.B., Kindler E. // Zeitschrift fur anorganische und allgemeine Chemie. 1969. B. 368. P. 293.
Miiller A., Diemann E., Jostes R., Bogge H. // Angew. Chem. Int. Ed. Engl. 1981. V. 20. P. 934.
Егоров Н.Б. // Химия высоких энергий. 2016. Т. 50. № 4. С. 327.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


