Химия высоких энергий, 2020, T. 54, № 1, стр. 13-18
Окислительная деструкция фенола в водной среде при совместном воздействии ультрафиолетового излучения и пероксида водорода
Н. А. Иванцова a, Д. А. Паничева a, *, О. Ю. Кузнецов a
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская площадь, д. 9, Россия
* E-mail: pochta@muctr.ru
Поступила в редакцию 02.07.2019
После доработки 30.07.2019
Принята к публикации 31.07.2019
Аннотация
Целью настоящей работы являлось исследование процессов окислительной деструкции водных растворов фенола при индивидуальном воздействии ультрафиолетового излучения и комбинации ультрафиолетового излучения и пероксида водорода. Установлено, что степени окисления фенола под воздействием ультрафиолетового излучения достигают 99.9%. Доказано, что существенное влияние на степень и скорость процесса окисления имеют исходные концентрации поллютанта и реагентов. Впервые экспериментально обнаружен кинетический эффект деструкции фенола, поступившего в водную среду после завершения ее ультрафиолетового облучения. Количественно и качественно определены продукты окислительной деструкции фенола.
Загрязнение природных вод различными, сложными по своему химическому строению и свойствам органическими соединениями искусственного происхождения является проблемой большинства развивающихся стран мира. Большой вклад в загрязнение окружающей среды вносят сточные воды, содержащие трудно окисляемые растворенные соединения, в частности, фенолы. Фенол и его производные являются опасными загрязнителями природных и сточных вод. Он широко используется в областях производства синтетических волокон, каучука, пластмасс, лекарственных препаратов, пестицидов, красителей [1]. Из-за высокой токсичности, растворимости в воде и низкой способности к биоразложению, фенолы считаются одними из самых опасных соединений, которые имеют высокий канцерогенный потенциал [2]. Многие исследования показали, что концентрация фенола и его производных в воде ниже 0.1 мг/л приводит к нежелательным вредным воздействиям на людей, флору и фауну [3].
Весьма перспективными способами решения проблемы очистки сточных вод от органических соединений, в частности от фенолов, являются усовершенствованные окислительные методы (Advanced Oxidation Methods – AOMs) [4]. Первоначально эту концепцию создал William F.Glase в 1987 г., который показал, что AOMs протекают с участием мощных окислительных радикалов, главным образом гидроксильных радикалов (НО•) [5, 6]. К подобным методам относятся химические, фотохимические, фотокаталитические процессы окисления (O3, O3/H2O2, H2O2/Fe2+, УФ/O3, УФ/H2O2, TiO2/УФ, УФ/H2O2/Fe2+) и др. Главной особенностью таких окислительных методов является то, что они основаны на двух последовательных стадиях: генерировании активных частиц и их взаимодействии с загрязняющими веществами, растворенными в воде. В различных исследованиях уже сообщалось, что для очистки воды от фенолпроизводных соединений возможно применение таких AOMs-методов, как совместное воздействие ультрафиолетового излучения (УФ) (или озона) и пероксида водорода (УФ/Н2О2, О3/Н2О2) [7, 8]. Однако пока еще не существует целостного представления об эффективности использования подобных технологий в реальных условиях. Реализация таких методов невозможна без знания механизмов деструкции органических загрязнителей, позволяющих смоделировать их поведение в процессе воздействия на них различного рода окислителей.
Целью настоящей работы являлось исследование процессов окислительной деструкции водных растворов фенола при индивидуальном воздействии УФ и комбинации УФ и пероксида водорода.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследования по окислительной деструкции модельных растворов фенола (С6Н5ОН) проводили на лабораторной установке, принципиальная схема которой представлена на рис. 1. Установка включает в свой состав: перистальтический насос 1, ртутно-кварцевую лампу низкого давления ДРБ-8 мощностью 8 Вт 2, кварцевый змеевиковый фотореактор 3 и приемник для сбора обработанной жидкости 4. Световая мощность лампы ДРБ-8, соответствующая резонансной линии 254 нм, составляет 2.5 Вт. Доза облучения (D, Дж/см2), в экспериментах прямо пропорциональная времени контакта жидкости с зоной облучения (τк), изменялась в диапазоне от 0.05 до 0.52 Дж/см2. В установке (рис. 1) лампа ДРБ-8 2 расположена соосно с кварцевым змеевиком 3, диаметр витка которого составляет 45 мм, а внутренний диаметр кварцевой трубки равен 5 мм. Лампа и змеевик заключены в корпус из нержавеющей стали. Насос 1, обеспечивающий движение облучаемого раствора внутри кварцевой трубки змеевика с расходом жидкости от 1 до 10 мл/с (что соответствует времени контакта τк жидкости с зоной облучения от 20 до 2 с), и приемник для сбора обработанной жидкости 4, размещены вне корпуса. Они соединены с кварцевым змеевиком 3 гибкими полиэтиленовыми шлангами.
Рис. 1.
Схема лабораторной установки. 1 – перистальтический насос; 2 – УФ лампа ДРБ-8; 3 – кварцевый змеевиковый фотореактор; 4 – приемник.

Преимуществами установки в целом являются практически полное улавливание УФ-излучения лампы и отсутствие необходимости использовать перемешивающие устройства. Последнее достигается за счет постоянной предварительной аэрации (на рисунке не показанной) воздухом модельных растворов, облучаемых ультрафиолетом, что необходимо для процесса фотоокисления органических соединений. Исходную концентрацию фенола в модельных растворах варьировали в диапазоне от 0.5 до 50 мг/л, что соответствует реальным значениям в сточных водах. Обработанный ультрафиолетом образец водного раствора, в котором достигнута полная деструкция содержащегося в нем фенола, использовали для изучения эффекта последействия УФ-излучения на фенол, поступивший в водную среду после завершения ее УФ-облучения, для чего в него вводили градуировочный раствор фенола из расчета создания заданной концентрации последнего.
Для исследования возможности интенсификации процесса фотоокисления в обрабатываемые растворы фенола вводили микродобавки пероксида водорода с концентрацией в пробе в диапазоне от 5 до 100 мг/л. Определение содержания фенола в исследуемой воде проводили фотоколориметрическим методом с применением 4-аминоантипирина [9]. Метод определения суммы одноосновных карбоновых кислот основан на цветной реакции данных соединений (на примере уксусной кислоты) с ванадатом аммония [9].
Выполнение измерений массовой концентрации формальдегида фотометрическим методом основано на отгонке его из пробы воды с водяным паром и последующем взаимодействии с ацетилацетоном в присутствии ионов аммония с образованием окрашенного в желтый цвет продукта реакции [10]. Для идентификации продуктов деструкции фенола на качественном уровне были проведены измерения коэффициента пропускания (А) растворов с использованием спектрофотометра GBC Cintra 303, выполненные на оборудовании Центра коллективного пользования РХТУ им. Д.И. Менделеева.
Для нахождения скоростей деструкции фенола, проводилась обработка кинетических кривых разложения исходных соединений с использованием программного обеспечения пакета Origin 8.0. Анализ возможных ошибок показал, что погрешность измерений определялась главным образом невоспроизводимостью условий эксперимента. Случайная погрешность измерений концентрации фенола в воде, определенная в серии из 7 опытов для доверительной вероятности 0.95, не превышала величины 10%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно экспериментальным данным, представленным на рис. 2, обнаружено, что степень окислительной деструкции фенола (α, %) экспоненциально снижается с увеличением исходной концентрации его в растворе. Так, при концентрации фенола 0.5 мг/л степень окисления составила – 99.9%, а при концентрации – 25 мг/л она уменьшилась в 20 раз. Факт уменьшения степени разложения фенола при увеличении его концентрации, вероятно, связан с недостатком активных частиц, участвующих в процессе окисления. При этом уменьшение исходной концентрации (и, соответственно, возрастания степени деструкции) под воздействием излучения связано, как это следует из рис. 3, не только с увеличением физического времени контакта молекул фенола с ультрафиолетом, но и увеличением количества образующихся в растворе кислородсодержащих окислительных агентов, способствующих их разрушению. Так, при увеличении времени контакта раствора фенола с зоной облучения, концентрация его в процессе ультрафиолетового окисления уменьшается примерно в 4.5 раза, а при совместном воздействии УФ-облучения и пероксида водорода (УФ/Н2О2) – в 11.5 раз. Кроме того, экспериментально доказано (см. рис. 3), что дополнительное введение пероксида водорода в систему приводит к возрастанию степени и скорости окисления фенола по сравнению с использованием только УФ-излучения или пероксида водорода. К примеру, при времени контакта 15 с степень окисления фенола при обработке его водного раствора в УФ-реакторе составляла 65%, а при введении в систему пероксида водорода дозой 10 мг/л при тех же условиях эксперимента она возросла до 90%. Вероятно, при фотолизе фенола происходит образование достаточно устойчивых промежуточных продуктов, дальнейшее разрушение которых требует высоких доз УФ-облучения или присутствие окислителя (например, Н2О2), который ускоряет процесс разрушения органических соединений [11]. При этом использование коротковолнового УФ- излучения для окислительной деструкции органических соединений в водной среде сопровождается эффективным процессом образования гидроксидных радикалов за счет фотодиссоциации молекул воды:
Рис. 2.
Зависимость степени фотоокисления фенола (α, %) от его начальной концентрации (Сн, мг/л). τк – 14.5 с; D – 0.37 Дж/см2.

Рис. 3.
Кинетика окисления фенола (Сн = 2 мг/л). 1 – окисление только Н2О2 ([Н2О2] = 10 мг/л); 2 – УФ-излучение; 3 – УФ/Н2О2.

В дальнейшем гидроксидный радикал способен окислять молекулу органического вещества RH по принципу:
(2)
${\text{Н}}{{{\text{О}}}^{ \bullet }} + {\text{RH}} \to {{{\text{R}}}^{ \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Такая реакция приводит к образованию органического радикала R•, который при взаимодействии с молекулярным кислородом образует пероксидный радикал, инициирующий цепные реакции:
(3)
$\begin{gathered} {{{\text{R}}}^{ \bullet }} + {{{\text{O}}}_{2}} \to {\text{RO}}_{2}^{\centerdot } \to \\ \to {\text{цепные окислительные реакции}} \to \\ \to {\text{продукты деструкции}}{\text{.}} \\ \end{gathered} $Таким образом, гидроксидные радикалы, образующиеся в объеме раствора в результате последующих превращений способны разложить молекулу фенола вплоть до полной минерализации или, по крайней мере, до форм, легко подверженных биодеградации. Дополнительное введение пероксида водорода к процессу окисления приводит к увеличению концентрации кислородсодержащих радикалов (в частности, гидроксидных и гидропероксидных), которые способствуют расщеплению молекул фенола за более короткий промежуток времени.
Высокая эффективность рассмотренной технологии по УФ-очистке воды от фенола, скорее всего, обусловлена синергетическим эффектом, в результате многократного взаимного усиления отдельных воздействий. В частности, при исследовании процесса окислительной деструкции фенола в модельных водных растворах, впервые экспериментально обнаружен кинетический эффект деструкции фенола, поступившего в водную среду после завершения ее ультрафиолетового облучения. Эксперименты, позволившие сделать такой вывод, проведены на примере раствора фенола с концентрацией 4 мг/л, который подвергали ультрафиолетовому облучению до полной деструкции содержащегося в нем фенола. После этого ультрафиолетовое воздействие прекращали и в облученный ультрафиолетом образец вводили градуировочный раствор фенола в количестве, обеспечивающем создание в растворе его концентрации 1.4 мг/л, что подтверждали аналитически. Затем через каждые 10 мин в исследуемом образце аналитически определяли содержание фенола. Полученные результаты представлены в табл. 1. Аналогичные результаты получены в экспериментах с дистиллированной водой, подвергнутой ультрафиолетовому облучению, в облученный ультрафиолетом образец которой вводили градуировочный раствор фенола в том же количестве.
Таблица 1.
Кинетика деструкции фенола в активированной ультрафиолетом водной среде
| Время, через которое отбирается проба для анализа, мин | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
|---|---|---|---|---|---|---|---|
| Концентрация фенола в растворе, мг/л | 1.4 | 1.4 | 1.3 | 1.1 | 0.9 | 0.6 | 0.2 |
По данным представленных выше экспериментов можно сделать вывод о том, что под действием ультрафиолета в водной среде происходит не только полное разрушение растворенных молекул фенола, но и активация ее компонентов. Другими словами, в процессе ультрафиолетового облучения в водной среде наряду с фотодеструкцией фенола происходит образование некоторого количества неизвестного ранее долгоживущего активного компонента, обладающего способностью длительное время разрушать молекулы фенола, которые поступают в водную среду уже после завершения ее ультрафиолетового облучения. Отсюда можно заключить, что в процессе исследований установлен неизвестный ранее кинетический пост-эффект деструкции молекул фенола, которые вносятся в водную среду после прекращения инициирования фотодеструкции вещества ультрафиолетом.
Для определения оптимальных доз реагентов в процессе окисления были проведены эксперименты по деструкции фенола в УФ-реакторе с добавлением различных концентраций пероксида водорода (5 < [Н2О2] < 100 мг/л).
Согласно реакции (4) концентрация пероксида водорода, необходимая для окисления фенола с концентрацией 2 мг/л равна 13.9 мг/л
(4)
${{{\text{С}}}_{{\text{6}}}}{{{\text{Н}}}_{{\text{6}}}}{\text{О}} + 14{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{2}} \to 6{\text{С}}{{{\text{О}}}_{2}} + 17{{{\text{Н}}}_{{\text{2}}}}{\text{О}}.$Найдено (рис. 4), что при увеличении концентрации пероксида водорода степень окисления фенола при УФ-облучении возрастает.
Рис. 4.
Степень окисления фенола (Сн = 2 мг/л) при УФ/Н2О2 при различных концентрациях пероксида водорода. 1 – [Н2О2] = 5.1 мг/л; 2 – [Н2О2] = 10 мг/л; 3 – [Н2О2] = 50 мг/л; 4 – [Н2О2] = 100 мг/л.
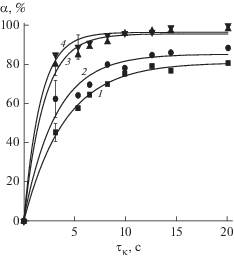
Количественное определение возможных продуктов деструкции фенола (формальдегида и одноосновных карбоновых кислот) показало, что ход кинетических кривых зависит от типа воздействия (рис. 5). Экспериментально доказано, что при концентрации фенола 2 мг/л независимо от типа воздействия (УФ или УФ/Н2О2) кинетика образования суммы одноосновных карбоновых кислот (в пересчете на уксусную кислоту) описывается кривой с выраженным максимумом, что говорит о том, что данный продукт деструкции является промежуточным. В то же время зависимости образования формальдегида описываются кривой с насыщением, что, вероятно, указывает на то, что данный продукт является основным (и/или конечным). Таким образом, выявлен предположительный механизм окисления фенола при УФ/Н2О2 из которого можно сделать вывод, что основными продуктами окислительной деструкции фенола являются формальдегид и кислоты, причем формальдегид (в дополнение к ${\text{HCO}}_{3}^{ - }$) является конечным продуктом деструкции. При этом деструкция фенола вероятнее всего происходит за счет разрушения ароматического кольца с образованием ди-/монокарбоновых кислот, альдегидов (на присутствие которых указывает интенсивная полоса поглощения в ближней УФ-области), которые в последствии окисляются до диоксида углерода и воды.
Рис. 5.
Кинетика образования предполагаемых продуктов окислительной деструкции фенола (Сн = 2 мг/л). 1, 3 – CH2O и CH3COOH при УФ-окислении; 2, 4 – CH2O и CH3COOH при УФ/Н2О2.

Существенным параметром в очистке воды от любых загрязняющих соединений является скорость окисления. В табл. 2 показано, что, введение микродобавок пероксида водорода позволяет резко увеличить начальные скорости процесса окисления фенола по сравнению с применением индивидуальных окислителей (только УФ-облучение или пероксид водорода). Сопоставление результатов, отраженных на рис. 4 и в табл. 1 показывает, что при увеличении концентрации пероксида водорода в 20 раз скорость окислительной деструкции фенола в начальный момент времени увеличивается в 3 раза, а степень окисления – 2 раза.
Таблица 2.
Скорости окислительной деструкции водного раствора фенола (Сн = 2 мг/л) при различных УФ- воздействиях
| Метод окислительной деструкции | Скорость (v), мкмоль/(л с) |
|---|---|
| Только Н2О2 ([Н2О2] = 10 мг/л) | 0.12 |
| Только УФ-окисление | 3.7 |
| УФ/Н2О2 ([Н2О2] = 5 мг/л) | 4.0 |
| УФ/Н2О2 ([Н2О2] = 10 мг/л) | 5.4 |
| УФ/Н2О2 ([Н2О2] = 50 мг/л) | 9.9 |
| УФ/Н2О2 ([Н2О2] = 100 мг/л) | 12.2 |
ВЫВОДЫ
1. Применение усовершенствованных окислительных методов, в частности, совместное воздействие ультрафиолетового излучения и пероксида водорода, позволяет получить высокие эффективности и степени разложения исходных соединений, а также широкий концентрационный диапазон применения.
2. Обнаружено, что исходные концентрации реагентов в системе оказывают существенное влияние на окислительную деструкцию фенола при использовании УФ-излучения.
3. Установлен неизвестный ранее кинетический пост-эффект деструкции молекул фенола, которые вносятся в водную среду после прекращения инициирования фотодеструкции этого соединения ультрафиолетом.
4. На качественном и количественном уровнях определены промежуточные и конечные продукты деструкции фенола при УФ-обработки его водных растворов.
5. Учитывая, что исследованный процесс деструкции фенола не обеспечивает достижения ПДК, рекомендуется использовать совместное воздействие ультрафиолетового излучения и пероксида водорода для предварительной очистки воды от загрязняющих веществ в целях перевода их в легко биоразлагаемые соединения с последующей доочисткой.
Список литературы
Karigar C., Mahesh A., Nagenahalli M., Yun D.J. // Biodegradation. 2006. V. 17. P. 47.
Ming Z.W., Long C.J., Cai P.B., Xing Z.Q., Zhang B. // J. Hazard. Mater. 2006. V. 128. P. 123.
Saravanakumar K., Kumar A. // Res. J. Pharm., Biol. Chem. Sci. 2011. V. 2. P. 18.
Poyatos J.M., Munio M.M., Almecija M.C., Torres J.C., Hontoria E., Osorio F. // Water, Air, Soil Pollut. 2010. V. 205. № 1–4. P. 187.
Glaze W.H. // Environ. Sci. Technol. 1987. V. 21. № 3. P. 224.
Glaze W.H., Kang J.W., Chapin D.H. // Ozone: Sci. Eng. 1987. V. 9. P. 335.
Han W., Zhu W., Zhang P., Zhang Y., Li L. // Catal. Today. 2004. V. 90. № 3–4. P. 319.
Иванцова Н.А., Петрищева М.С. // Вода: химия и экология. 2013. № 10. С. 90.
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. Москва: Химия, 1984. С. 448.
ПНД Ф 14.1;2.97-97. Количественный химический анализ вод. Методика выполнения измерений массовой концентрации формальдегида в пробах природных и очищенных сточных вод. Москва: Изд-во стандартов, 1997. С. 11.
Десятов А.В., Кручинина Н.Е., Тихонова И.О. Современные методы очистки сточных вод промышленных предприятий: учебное пособие для студентов вузов (Техника защиты окружающей среды). Москва: ООО НИЦ “Инженер”, 2012. С. 132.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


