Химия высоких энергий, 2020, T. 54, № 3, стр. 206-210
Фотопроцессы 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона и его производных в ацетонитриле
В. Н. Гутров a, Г. В. Захарова a, *, В. Н. Нуриев a, b, С. З. Вацадзе a, b, С. П. Громов a, b, **, А. К. Чибисов a
a Центр фотохимии РАН, ФНИЦ “Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, 7а, кор. 1, Россия
b Химический факультет, Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: gvzakharova@gmail.com
** E-mail: spgromov@mail.ru
Поступила в редакцию 13.11.2019
После доработки 13.11.2019
Принята к публикации 27.12.2019
Аннотация
Исследованы спектральные, люминесцентные и спектрально-кинетические свойства 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона и его производных с электронодонорными заместителями (диэтиламино-, метокси-, метилтио-, диметокси-) в бензольном цикле в ацетонитриле при комнатной температуре. Наличие заместителей приводит к длинноволновому смещению максимума полосы поглощения на 26–114 нм по сравнению с незамещенным диеноном и к длинноволновому смещению максимума флуоресценции на 43–125 нм по сравнению с метоксипроизводным. Под действием лазерного облучения обескислороженных растворов диенонов происходит интеркомбинационный переход в триплетное состояние с временем полупревращения 0.7–1.5 мкс. Для метокси-, метилтио- и диметоксипроизводных диенонов образуется стабильный фотопродукт.
Кросс-сопряженные диеноны, также известные как кетоцианиновые красители, содержащие электронодонорную группу в пара-положении бензольного цикла, проявляют сольватохромные свойства [1] и в этом отношении могут быть использованы для определения степени полярности среды [2, 3]. Кроме того, диеноны используются в лазерах на красителях, в качестве фотосенсибилизаторов [4, 5], для оптической регистрации информации и в органическом синтезе [6, 7]. Влияние полярности среды находит отражение не только в спектрах поглощения, но и в спектрах флуоресценции и квантовых выходах флуоресценции кетоцианиновых красителей. В работах [8–11] для ряда кетоцианиновых красителей отмечался батохромный сдвиг максимума полосы поглощения и уменьшение интенсивности флуоресценции с ростом полярности среды.
Нами было ранее показано, что при импульсном лазерном возбуждении 2,5-бисбензилиденциклопентанонов с электронодонорными заместителями в ацетонитриле наблюдали кратковременное изменение поглощения, обусловленное переходом в триплетное состояние с временем жизни τ1/2 равным 0.3–1 мкс и образование стабильного продукта, также способного к переходу в триплетное состояние с временем жизни ~ 1 мкс [12].
В настоящей работе приведены результаты спектрально-люминесцентного и спектрально-кинетического исследования 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона с электронодонорными заместителями в ацетонитриле.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-Бензилиден-5-(пиридин-3-илметилиден)цик-лопентанон 1a и его производные 1b-e были синтезированы на химическом факультете МГУ.
Для приготовления растворов кетоцианина использовали ацетонитрил “Криохром” марки “осч”. Измерения разностных спектров триплет-триплетного (Т-Т) поглощения и продуктов лазерного возбуждения, а также кинетики дезактивации триплетного состояния проводили на установке лазерного импульсного фотолиза [13, 14]. Лазерное возбуждение осуществляли с помощью 3-й (λ = 354 нм) гармоники лазера Nd:YAG, “Solar”. Для стационарного облучения растворов кетоцианина использовали лампу КГМ-100. Облучение проводили как полным, так и фильтрованным светом через светофильтры ЖС-18 + СЗС-21. Растворенный кислород воздуха удаляли продувкой раствора аргоном. Обработку результатов эксперимента выполняли с помощью программного обеспечения (OriginLab, версия 8.0). Соединение экспериментальных точек на спектральных кривых в экспериментах по лазерному фотолизу проводили с помощью операции сплайн. Регистрацию спектров поглощения проводили на спектрофотометре “Agilent 8453”, спектров флуоресценции осуществляли на спектрофлуориметре “Cary Eclipse”. Все измерения выполняли при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Поглощение и флуоресценция
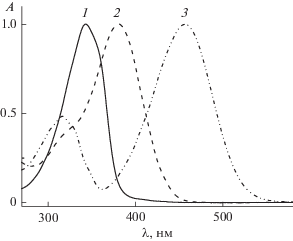
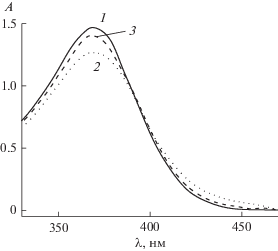
На рис. 1 приведены спектры поглощения соединений 1а, 1d и 1e в ацетонитриле. Спектры характеризуются двумя полосами поглощения, из которых наиболее интенсивной является длинноволновая полоса с максимумами при 340–460 нм. Максимумы коротковолновой полосы расположены в интервале 260–330 нм. Согласно [15, 16] наиболее интенсивная длинноволновая полоса в спектрах поглощения диенонов обусловлена переносом заряда от электронодонорной группы на карбонильную, тогда как наименее интенсивная коротковолновая полоса обусловлена π → π* переходом в ароматическом кольце. Длинноволновая полоса поглощения претерпевает существенный батохромный сдвиг максимума с ростом электронодонорности заместителя. Коротковолновую полосу следует отнести к состоянию с переносом заряда от электронодонорного заместителя на атом азота пиридинового остатка.
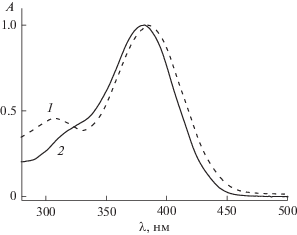
В пользу этого говорит положительный сольватохромный эффект при увеличении полярности растворителя. Интенсивность коротковолновой полосы растет по мере увеличения электронодонорности заместителя. При сравнении исследуемых в настоящей работе диенонов с ранее изученными 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанонами (2a–e) с такими же электронодонорными заместителями в бензольном цикле [17] следует обратить внимание на величину спектрального сдвига полос поглощения (табл. 1). Из данных таблицы следует, что наличие атома азота в положении 3 пиридинового остатка происходит гипсохромный сдвиг длинноволновой полосы поглощения и батохромный сдвиг коротковолновой полосы. На рис. 2 приведены спектры поглощения 1d и 2d в ацетонитриле. Следует отметить, что при изменении положения атома азота в пиридиновом остатке из 3 в 4 наблюдается рост оптической плотности коротковолновой полосы поглощения, что говорит об увеличении силы осциллятора для π → π* перехода. Это свидетельствует в пользу увеличения степени сопряжения атома азота, находящегося в положении 4 пиридинового остатка.
Таблица 1.
Спектральные характеристики 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона и его производных (1a–e) и 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его производных (2a–e)
| Максимум поглощения, нм | Максимум флуоресценции, нм | Стоксов сдвиг, нм | Iфл, отн. ед. | τ1/2, мкс | |
|---|---|---|---|---|---|
| 1a | 343 | – | – | – | 0.3 |
| 1b | 369*, 316 | 480 | 111 | 10 | 0.1 |
| 1c | 382*, 329 | 520 | 138 | 380 | 1.2 |
| 1d | 380*, 317 | 523 | 143 | 210 | 0.1 |
| 1e | 457*, 317 | 605 | 148 | 290 | 1.5 |
| 2a | 344 | – | – | – | 0.7 |
| 2b | 371*, 308 | 498 | 127 | 15 | 0.9 |
| 2c | 386*, 316 | 546 | 160 | 650 | 2.5 |
| 2d | 384*, 307 | 540 | 156 | 450 | 1.0 |
| 2e | 465*, 308 | 627 | 162 | 85 | 3.0 |
Для диенона 1с в отличие от диенонов 1b, 1d и 1e наблюдается батохромный сдвиг и рост интенсивности коротковолновой полосы поглощения, что обусловлено наличием метоксигруппы в м-ета-положении. Существенно отметить, что при переходе от 1d к 1с для основной полосы поглощения характерен сдвиг в 2 нм, в отличие от коротковолновой полосы, батохромный сдвиг которой составляет 12 нм.
На рис. 3 приведены спектры флуоресценции 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона с различными электронодонорными заместителями в бензольном цикле. Спектры испускания состоят из одной полосы, которая претерпевает батохромный сдвиг при увеличении электронодонорности заместителя. Для незамещенного диенона 1a флуоресценция не была обнаружена. Разгорание флуоресценции при введении электронодонорных заместителей обусловлено инверсией nπ* и ππ* уровней в молекуле диенона, приводящей к расположению nπ* уровня над ππ* [18, 19].
В таблице 1 приведены спектральные характеристики 2-бензилиден-5-(пиридин-3-илметил-иден)циклопентанона и его производных 1a–e.
Интенсивность флуоресценции измеряли в условиях одинакового поглощения на длине волны возбуждения. Из данных таблицы следует, что с ростом электронодонорности заместителя имеет место увеличение Стоксова сдвига, достигающего 148 нм для диэтиламинопроизводного диенона. Наблюдаемые изменения спектров люминесценции производных 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона указывают на стабилизацию возбужденного состояния при введении электронодонорных заместителей.
ИМПУЛЬСНЫЙ ЛАЗЕРНЫЙ ФОТОЛИЗ
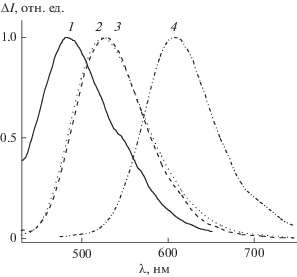
При лазерном импульсном облучении обескислороженных растворов 1а–е наблюдали кратковременные обратимые изменения в спектре поглощения, обусловленные интеркомбинационным переходом в триплетное состояние. Наряду с образованием триплетного состояния со временем жизни τ1/2, равным 0.3–1.5 мкс, наблюдали образование стабильного продукта фотохимической реакции, который следует отнести к изомеру красителя [20]. Для незамещенного диенона 1a наблюдали только триплет-триплетное поглощение со временем полупревращения 0.3 мкс (рис. 4).
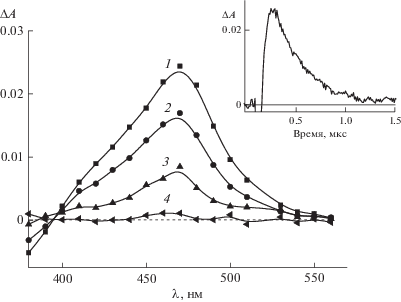
Рис. 4.
Разностные спектры триплет-триплетного поглощения 1a в ацетонитриле, измеренные через 0.25 (1), 0.5 (2), 0.75 (3) и 5 (4) мкс после лазерного импульса. На вставке – кинетика дезактивации триплетного состояния (λ = 470 нм).
Лазерное импульсное облучение метокси-, диметокси- и метилтиопроизводных диенонов (1b–d) приводит к образованию триплетного состояния и промежуточного продукта. Время полупревращения триплетного состояния для диенонов 1b–d составляет 0.1, 1.2 и 0.1 мкс соответственно. На рис. 5 приведены разностные спектры поглощения и кинетика превращения 1с, измеренные к различным моментам времени после лазерного импульса.
Рис. 5.
Разностные спектры поглощения 1с в ацетонитриле, измеренные через 0.2 (1) и 2.5 мкс (2) после лазерного импульса. На вставке – кинетика дезактивации триплетного состояния (λ = 470 нм).
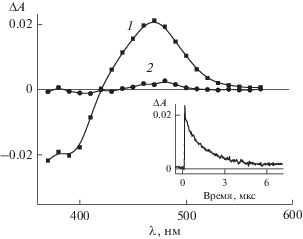
Спектр 1 (рис. 5) с максимумом при 470 нм отражает суммарное поглощение, обусловленное образованием как триплетного состояния 1с, так и промежуточного фотопродукта, в то время как спектр 2 с максимумом при 480 нм отвечает поглощению только продукта. Разностные спектры поглощения 1b и 1d подобны разностным спектрам 1с.
Ранее нами было показано [12], что для 2,5-бис-(диаминобензилиден)циклопентанона как при лазерном импульсном, так и при стационарном облучении наблюдается образование стабильного фотопродукта (В) фотохимической реакции, проявляющего способность к интеркомбинационному переходу в триплетное состояние. Продукт (В) обнаруживает способность к фотоиндуцированному переходу в исходный 2,5-бис-(диаминобензилиден)циклопентанон, протекающему как через синглетно-возбужденное, так и через триплетное состояние. Для производных 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанона также происходит образование стабильного продукта фотохимической реакции при лазерном облучении. На рис. 6 приведены спектры поглощения 1b, измеренные до лазерного облучения (спектр 1), после серии повторных лазерных импульсов (спектр 2), а также при последующем стационарном облучении в области λ > 450 нм (спектр 3), отвечающей поглощению продукта (В) фотохимической реакции. При стационарном облучении происходит переход в исходный диенон. Для 1е не наблюдали образование стабильного продукта фотохимической реакции, в отличие от соединений 1a–d.
ВЫВОДЫ
1. Введение электронодонорных заместителей в 2-бензилиден-5-(пиридин-3-илметилиден)циклопентанон приводит к батохромному сдвигу полосы в спектрах поглощения и флуоресценции.
2. При импульсном лазерном облучении 2‑бензилиден-5-(пиридин-3-илметилиден)циклопентанона и его метокси-, диметокси-, метилтио-, диэтиламинопроизводных имеет место интеркомбинационной переход в триплетное состояние с временем жизни 0.3–1.5 мкс.
3. Стационарное и импульсное облучение 2‑бензилиден-5-(пиридин-3-илметилиден)циклопентанона и его метокси-, диметокси-, метилтиопроизводных приводит к образованию стабильных продуктов, способных к фотопревращению в исходные диеноны.
Список литературы
Doroshenko A.O., Pivovarenko V.G. // J. Photochem. Photobiol. A: Chemistry. 2003. V. 156. P. 55.
Khalaf A.A., Etaiw S.H., Issa R.M. et al. // Rev. Roum. Chim. 1977. V. 22. P. 1251.
Kessler M.A., Wolfbeis O.S. // Spectrochim. Acta A. Molecular Spectroscopy. 1991. V. 47. № 2. P. 187.
Barnabas M.V., Liu A., Trifunac A.D. et al. // J. Phys. Chem. 1992. V. 96. № 1. P. 212.
Zoto C.A., Ucak-Astarlioglu M.G., Connors R.E. // J. Mol. Struct. 2016. V. 1105. P. 396.
Вацадзе С.З., Манаенкова М.А., Свириденкова Н.В. и др. // Изв. РАН. Сер. хим. 2006. С. 1141.
Вацадзе С.З., Голиков А.Г., Кривенько А.П. и др. // Успехи химии. 2008. Т. 77. С. 661.
Doroshenko A.O., Grigorovich A.V., Posokhov E.A. et al. // Mol. Eng. 1998. V. 8. № 3. P. 199.
Rurack K., Dekhtyar M.L., Bricks J.L. et al. // J. Phys. Chem. A. 1999. V. 103. № 48. P. 9626.
Rurack K., Bricks J.L., Reck G. et al. // J. Phys. Chem. A. 2000. V. 104. № 14. P. 3087.
Doroshenko A.O., Sychevskaya L.B., Grygorovych A.V. et al. // J. Fluorescence. 2002. V. 12. № 3–4. P. 455.
Захарова Г.В., Зюзькевич Ф.С., Гутров В.Н. и др. // Химия высоких энергий. 2017. Т. 51. № 2. С. 121.
Атабекян Л.С., Чибисов А.К., Алфимов М.В. // Химия высоких энергий. 1997. Т. 31. № 5. С. 381.
Захарова Г.В., Авакян В.Г., Маркелов В.П. и др. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
Mondal J.A.l., Verma S., Ghosh H.N. et al. // J. Chem. Sci. 2008. V. 120. № 1. P. 45.
Marcotte N., Fery-Forgues S. // J. Photochem. Photobiol. A: Chemistry. 2000. V. 130. P. 133.
Гутров В.Н., Захарова Г.В., Артюшевский Н.А. и др. // Химия высоких энергий. 2019. Т. 53. № 3. С. 193.
Захарова Г.В., Зюзькевич Ф.С., Гутров В.Н. и др. // Химия высоких энергий. 2017. Т. 51. № 2. С. 121.
Kedia N., Sarkar A., Shannigrahi M., Bagchi S. // Spectrochim. Acta. A. 2011. V. 81. P. 79.
Pronkin P., Tatikolov A. // Sci – Open Access Journal. 2019. V. 1. № 1. P. 19. https://doi.org/10.3390/sci1010019
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий