Химия высоких энергий, 2020, T. 54, № 3, стр. 223-227
Роль озона при химических процессах в плазме электрического разряда
И. М. Пискарев *
Научно-исследовательский институт ядерной физики им. Д.В. Скобельцына, Московский государственный университет им. М.В. Ломоносова, (НИИЯФ МГУ)
119234 Москва, Ленинские горы, 1, стр. 2, Россия
* E-mail: i.m.piskarev@gmail.com
Поступила в редакцию 15.10.2019
После доработки 09.12.2019
Принята к публикации 27.12.2019
Аннотация
Исследовался механизм образования озоно-гидроксильной смеси и ее свойства. Основным каналом расходования гидроксильных радикалов является накопление перекиси водорода. В отсутствие озона почти все образовавшиеся радикалы OH• превращаются в перекись водорода. Когда озон есть, в реакции O3 + H2O2 снова образуются гидроксильные радикалы. Концентрация радикалов OH• поддерживается до тех пор, пока не израсходуются озон и перекись водорода. Это позволяет транспортировать гидроксильные радикалы на расстояние до 45 см из реактора. Результаты подтверждаются экспериментом по окислению щавелевой кислоты.
ВВЕДЕНИЕ
Электрический разряд часто используется для получения плазмы, в которой генерируются химически активные частицы [1]. Состав активных частиц зависит от характеристик разряда и состава газа, в среде которого происходит разряд. Если в составе газовой фазы есть кислород, то при разряде может образовываться озон. Озон является долгоживущей частицей, но его химическая активность относительно мала, так что озон является селективным окислителем [2]. Гидроксильные радикалы с высокой вероятностью гибнут во взаимодействиях между собой, образуя более стабильные, но менее активные частицы. Поэтому действие гидроксильных радикалов проявляется на небольших расстояниях от места их образования.
Концентрация гидроксильных радикалов на разных расстояниях от места их образования в аргоновой плазме с парами воды исследовалась в работе [3]. Кислорода и озона в области разряда не было. Диаметр области с максимальной концентрацией радикалов составлял около 2 мм. Гидроксильные радикалы находятся преимущественно в основном состоянии и не наблюдаемы по спектру излучения. Визуализация гидроксильных радикалов осуществлялась путем их возбуждения импульсом излучения лазера. Концентрация гидроксильных радикалов после прохождения импульса лазера уменьшается до уровня фона за 150 нс. Эта цифра позволяет судить о времени жизни гидроксильных радикалов.
В работе [4] рассмотрена возможность транспортирования гидроксильных радикалов за пределы реактора при условии, что в реакторе кроме гидроксильных радикалов генерируется озон. Показано, что в этих условиях радикалы OH• могут существовать до 1 с, но их концентрация уменьшается в несколько раз.
В данной работе в качестве детектирующего раствора выбрана щавелевая кислота, которая может окисляться только гидроксильными радикалами [2]. Работа посвящена изучению разложения щавелевой кислоты продуктами, образующимися при вспышечном коронном электрическом разряде, и транспортируемыми по трубке на расстояние до 45 см. В рамках кинетической модели процесса анализируются свойства озоно-гидроксильной смеси, образующейся в реакторе вспышечного коронного разряда в атмосфере воздуха, насыщенной парами воды.
МЕТОДИКА ЭКСПЕРИМЕНТА
Блок-схема эксперимента представлена на рис. 1. Вспышечный коронный электрический разряд, в котором образовывался широкий спектр активных частиц, включающий озон, перекись водорода и гидроксильные радикалы, происходил в разрядной камере 1, заполненной воздухом. Корпус разрядной камеры алюминиевый, верхняя крышка из фторопласта. Через отверстия в крышке внутрь камеры вводились разрядные электроды 2. Электроды выполнены из нержавеющей стали, диаметр электрода 2 мм, длина 40 мм, количество электродов 24. Расстояние между электродами 25 мм. Разрядные электроды 2 располагались на высоте 6.5 мм от земляного электрода 3. Высокое напряжение отрицательной полярности подавалось от источника питания 11 кВ через RC-матрицу. Каждый электрод соединялся с источником питания через балластный резистор R = 20 МОм, и каждый электрод соединялся с землей через конденсатор C = 32 пФ. С учетом падения напряжения на балластном резисторе напряжение на электроде составляло 9.6 кВ. Выбранная конструкция и схема питания разрядных электродов обеспечивала формирование на каждом электроде импульсов Тричела [5]. Частота повторения импульсов Тричела ~100 кГц, ток в импульсе до 2 мА, средний ток с каждого электрода 70 мкА, полный ток на всех 24 электродах 1.7 мА.
Рис. 1.
Блок-схема экспериментальной установки. 1 – разрядная камера, 2 – разрядные электроды, 3 – земляной электрод, 4 – обрабатываемая жидкость, 5 – эжектор, 6 – водяное охлаждение, M – циркуляционный насос, HV 11 kV – источник питания, RC-matrix – RC-матрица, L – всасывающая трубка, Sample – отбор проб жидкости.
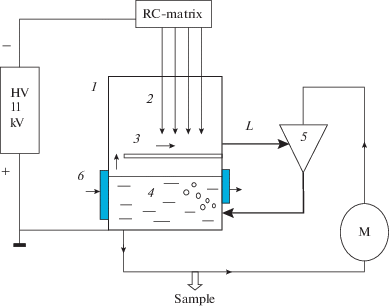
Внизу разрядной камеры ниже уровня земляного электрода наливали обрабатываемую жидкость 4. Полный объем обрабатываемой жидкости составлял 0.5 л. Нижняя часть разрядной камеры, где находилась жидкость, охлаждалась проточной водой. Температура обрабатываемой жидкости поддерживалась на уровне 20–22°C. Активные частицы, образовавшиеся в разрядной камере, высасывались через трубку L эжектором 5. Длина трубки L варьировалась от 1 до 45 см. Диаметр отверстия трубки 4 мм. На эжектор подавалась жидкость, откачиваемая из разрядной камеры насосом M. Давление, создаваемое насосом на входе эжектора, составляло 3 атм. Поток жидкости через эжектор 160 л/ч. Соотношение потоков жидкости и всасываемого газа составляло 1 : 1. Скорость потока отсасываемого по трубке L из разрядной камеры газа 353 см/с, время движения по трубке длиной 45 см составляло 0.125 с. Из эжектора вода возвращалась в камеру 1. Таким образом, жидкость циклически обрабатывалась. В газовой фазе разрядной камеры устанавливалась стационарная концентрация активных частиц. Для взятия проб обрабатываемой жидкости в процессе обработки, на трубке, соединенной с всасывающим насосом, имелся заборный кран.
В качестве пробных жидкостей использовались 100 ммоль/л водный раствор щавелевой кислоты и чистая вода. В процессе обработки в чистой воде накапливался растворенный озон и перекись водорода. Пробы обработанной воды периодически отбирались, в них определялись концентрации озона и перекиси водорода. Концентрация озона определялась иодометрическим методом. Объем отбираемой пробы воды 30 мл, в нее вводили 30 мл раствора KI концентрацией 5 г/л. Концентрация окисленного I2 определялась титрованием 0.02N тиосульфатом натрия в кислой среде. Концентрацию перекиси водорода определяли по линии 410 нм комплекса, образующегося при введении в пробу обработанной воды свежеприготовленного TiCl4 [6].
Щавелевая кислота использовалась как детектор гидроксильных радикалов. Для оценки времени жизни активных частиц измерялось уменьшение концентрации щавелевой кислоты после обработки в течение 24 ч в зависимости от длины высасывающей трубки L. Концентрацию щавелевой кислоты определяли титрованием 0.05N раствором перманганата калия в кислой среде при температуре 80°C. Озон, накапливающийся в процессе обработки, разрушался при температуре 80°C и не влиял на результат титрования. Перекись водорода также не влияла на результат, т.к. ее концентрация мала. Для экспериментов использовалась дважды дистиллированная вода, pH 6.5 и химически чистые реактивы. Спектры поглощения измерялись спектрофотометром СФ-102 фирмы “Аквилон”, Россия.
Выполнен расчет кинетики реакций взаимодействия всех активных форм кислорода, которые могли образоваться под действием электрического разряда. Расчет выполнен на основе схемы 30 реакций между активными частицами. Система 11 дифференциальных уравнений, описывающая образование и расходование активных форм кислорода, решалась с помощью пакета программ Mathcad-14.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Озон нарабатывается в электрическом разряде и диффундирует в воду. Его концентрация в газовой полости и в воде со временем обработки повышается и достигает стационарной концентрации через 30 мин. Стационарная концентрация перекиси водорода устанавливается через 20 мин. Поскольку время обработки щавелевой кислоты составляло 24 ч, то можно считать, что из реактора всегда отсасывалась газовая смесь с активными частицами в стационарном состоянии. Стационарная концентрация озона в воде составляла (5.8 ± ± 0.3) × 10−5 моль/л. Константа Генри для озона в воде равна 1.7 [2], поэтому концентрация в газовой фазе [O3] = (9.9 ± 0.4) × 10−5 моль/л. Стационарная концентрация перекиси водорода (1.8 ± ± 0.3) × 10−5 моль/л.
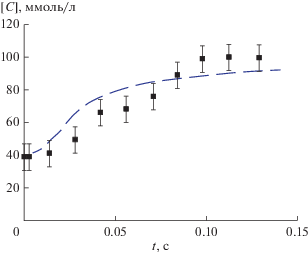
Зависимость концентрации щавелевой кислоты от времени движения газовой смеси по отсасывающей трубке представлена на рис. 2. Время движения по трубке длиной 45 см составляло 0.125 с. При минимальной длине трубки 1 см и времени движения смеси по ней 0.003 с наблюдается сильное уменьшение концентрации щавелевой кислоты со 100 до 40 ± 7 ммоль/л. Такое уменьшение соответствует концентрации гидроксильных радикалов в газовой смеси 1.4 × 10−7 моль/л. Полный ток разряда составлял 1.7 мА. Отсюда выход гидроксильных радикалов равен (20 ± 3) моль радикалов ОН• на 1 моль прошедших в разрядной цепи электронов. Высокое напряжение, прикладываемое к электродам, составляет 9.6 кВ. Отсюда энергетические затраты на образование одного гидроксильного радикала составляют (480 ± 70) эВ. Из рис. 2 видно, что за время около 0.1 с смесь активных частиц, извлеченная из реактора, практически полностью теряет свою активность и щавелевая кислота перестает окисляться. Это означает, что за время движения смеси 0.1 с концентрация гидроксильных радикалов уменьшается до уровня, когда изменение концентрации щавелевой кислоты по сравнению с исходным значением лежит в пределах ошибки измерений.
Рис. 2.
Зависимость концентрации щавелевой кислоты [C], ммоль/л для проб щавелевой кислоты исходной концентрацией 100 ммоль/л, обработанной в течение 24 ч озоно-гидроксильной смесью от времени дрейфа смеси из разрядной камеры t, с. Экспериментальные данные – точки с ошибками, пунктирная линия – расчет.
На основании литературных данных была составлена схема взаимодействий активных форм кислорода, которые могли образовываться при вспышечном коронном электрическом разряде в среде воздуха. Активные формы азота не принимались во внимание, так как их выход при электрическом разряде данного типа в среде воздуха мал [7]. Схема реакций представлена в табл. 1. Во время действия разряда устанавливается стационарное состояние, при этом нарабатываются все активные частицы.
Таблица 1.
Схема реакций активных форм кислорода. M – третья частица
| № | Реакция | к л(мол с)−1 | Ссылка |
|---|---|---|---|
| 1 | OH• + OH• + M → H2O2 + M | 1.3 × 1010 | [2] |
| 2 | OH• + OH• → H2O + O• | 1.1 × 109 | [2] |
| 3 | OH• + O• → O2 + H• | 2 × 1010 | [2] |
| 4 | OH• + O• + M → ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + M | 2.2 × 109 | [2] |
| 5 | OH• + H• + M → H2O + M | 1.1 × 1010 | [2] |
| 6 | OH• + H2O2 → ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + H2O | 4.1 × 107 | [2] |
| 7 | OH• + ${\text{HO}}_{{\text{2}}}^{\centerdot }$ → O2 + H2O | 6.6 × 1010 | [2] |
| 8 | OH• + H2 → H• + H2O | 4 × 106 | [2] |
| 9 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + ${\text{HO}}_{{\text{2}}}^{\centerdot }$ → H2O2 + O2 | 1.3 × 108 | [2] |
| 10 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + H2O → H3O+ + ${\text{O}}_{{\text{2}}}^{{ \bullet - }}$ | 1.2 × 102 | [8] |
| 11 | H3O+ + ${\text{O}}_{{\text{2}}}^{{\centerdot - }}$ → ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + H2O | 7.5 × 106 | [8] |
| 12 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + H• → H2 + O2 | 3.3 × 109 | [8] |
| 13 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + H• → OH• + OH• | 4.3 × 1010 | [9] |
| 14 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + O• → OH• + O2 | 3.5 × 1010 | [2] |
| 15 | H• + O2 + M → ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + M | 4.5 × 1010 | [2] |
| 16 | H• + H• + M → H2 + M | 1 × 109 | [2] |
| 17 | H• + H2O2 → OH• + H2O | 2.2 × 107 | [2] |
| 18 | H• + H2O2 → H2 + ${\text{HO}}_{{\text{2}}}^{\centerdot }$ | 2.6 × 106 | [2] |
| 19 | O• + H2O2 → OH• + HO2 | 1 × 106 | [2] |
| 20 | ${\text{O}}_{{\text{2}}}^{{\centerdot - }}$ + ${\text{HO}}_{{\text{2}}}^{\centerdot }$ → ${\text{HO}}_{{\text{2}}}^{ - }$ + O2 | 8 × 107 | [8] |
| 21 | ${\text{HO}}_{{\text{2}}}^{ - }$ + H3O+ → H2O2 + H2O | 105 | [8] |
| 22 | H2 + O• → OH• + H• | 4 × 103 | [9] |
| 23 | ${\text{O}}_{{\text{2}}}^{{\centerdot - }}$ + OH• → H2O + ${\text{O}}_{{\text{2}}}^{{\text{S}}}$ | 1010 | [8] |
| 24 | ${\text{O}}_{{\text{2}}}^{{\centerdot - }}$ + H+ → ½ H2O2 + ½ ${\text{O}}_{{\text{2}}}^{{\text{S}}}$ | 103 | [11] |
| 25 | ${\text{O}}_{{\text{2}}}^{{\text{S}}}$ → Decay | ln2/t1/2 = 2.9 × 10−4 s. | [11] |
| 26 | ${\text{O}}_{{\text{2}}}^{{\text{S}}}$ + ${\text{O}}_{{\text{2}}}^{{\text{S}}}$ → Products | 1011 | [11] |
| 27 | H2O2 + ${\text{O}}_{{\text{2}}}^{{\centerdot - }}$ → OH− + OH• + O2 | 0.13 | [8] |
| 28 | OH• + O3 → ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + O2 | 4 × 107 | [10] |
| 29 | ${\text{HO}}_{{\text{2}}}^{\centerdot }$ + O3 → OH• + 2O2 | 1.2 × 106 | [10] |
| 30 | H2O2 + 2O3 → 2OH• + 3O2 | 5.5 × 106 | [10] |
Расчет стационарного состояния в рамках схемы реакций, приведенной в таблице, показал, что основным стабильным продуктом является перекись водорода. В расчет были заложены скорости генерации гидроксильных радикалов в области разряда 3 × 10−4 моль(л сек)−1 и озона 5 × 10−4 моль(л с)−1, при которых в стационарном состоянии достигаются концентрации активных частиц (гидроксильных радикалов, перекиси водорода и озона) соответствующие экспериментальным значениям. Время установления стационарной концентрации составило 150 с. Стационарные концентрации активных частиц: [OH•] = 1.4 × 10−7; [Н${\text{O}}_{2}^{\centerdot }$] = 1.4 × × 10−8; [О•] = 5.8 × 10−9; [Н] = 1.8 × 10−14; [Н2] = 3 × × 10−12; [Н2О2] = 1.8 × 10−5; [${\text{O}}_{2}^{{\centerdot - }}$] = 1.2 × 10−9; [Н${\text{O}}_{2}^{ - }$] = 1 × 10−7; [О2S] = 2.9 × 10−9; [О3] = 9.9 × × 10−5 моль/л. Полученные концентрации гидроксильных радикалов, перекиси водорода и озона соответствовали экспериментально наблюдаемым. Молекулярный кислород образовывался как конечный продукт ряда реакций, но он не участвовал в дальнейших превращениях активных частиц, поэтому его концентрация не задавалась. Молекулярный кислород и пары воды, находящиеся в области разряда, определяли выход гидроксильных радикалов и озона, но механизм их образования не рассматривался, выход OH• и озона задавался как параметр.
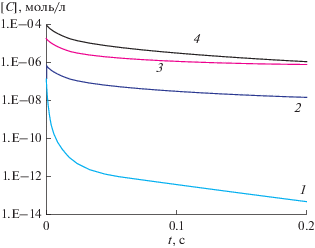
Рассчитанные концентрации гидроксильных радикалов для гипотетических случаев (с озоном и без) в зависимости от времени транспортировки до 0.2 сек представлены на рис. 3. Из рисунка видно, что без озона концентрация гидроксильных радикалов через 0.2 с дрейфа уменьшается до 4.9 × 10−14 моль/л (рис. 3, кривая 1), а в присутствии озона [OH•] = 1.5 × 10−8 моль/л (рис. 3, кривая 2). На поддержание концентрации гидроксильных радикалов расходуются перекись водорода и озон в реакции 30 (см. табл. 1).
Рис. 3.
Концентрации активных частиц [C], моль/л, транспортируемых из области генерации в течение времени t, s. Начальные концентрации соответствуют стационарному состоянию в области генерации, которое установилось через 150 с. Цифрами обозначены: 1 – концентрация радикалов OH• при отсутствии в системе озона; 2 – концентрация радикалов OH• при наличии в смеси озона; 3 – концентрация перекиси водорода; 4 – концентрация озона.
Значения концентрации гидроксильных радикалов (рис. 3, кривая 2) были использованы для расчета концентрации щавелевой кислоты после обработки в течение 24 ч в зависимости от времени дрейфа в трубке. Результаты для сравнения с экспериментальными данными представлены на рис. 2 пунктирной линией. Видно, что расчетные значения описывают экспериментальные данные. Тем самым подтверждается механизм образования озоно-гидроксильной смеси, рассмотренный выше.
ЗАКЛЮЧЕНИЕ
Полученные результаты показывают, что в реакторе вспышечного коронного электрического разряда образуется озоно-гидроксильная смесь. Образование такой смеси дает возможность транспортировать гидроксильные радикалы из реактора на расстояние до 40 см. Концентрация гидроксильных радикалов пополняется за счет расходования накопленной перекиси водорода в реакции с озоном. Это позволяет создавать устройства для обработки гидроксильными радикалами сточной и питьевой воды. Концентрация гидроксильных радикалов, извлеченных их реактора и окисляющих примеси воды, близка к концентрации в самом реакторе.
Список литературы
Bruggeman P.J., Kushner M.J., Locke B.R. et al. (41 authors) // Plasma Sources Sci. Technol. 2016. V. 25. 053002 (59 pp).
Handbook of Chemistry and Physics. Haynes William M. Editor-in-Chief. CRC Press. 97 Editions. 2016–2017 Years.
Li L., Nikiforov A., Xiong Q., Britun N., Snyders R. et al. // Phys. Plasmas. 2013. V. 20. P. 093502.
Аристова Н.А., Пискарев И.М. // ЖФХ. 2003. Т. 77(5). С. 813.
Райзер Ю.П. Физика газового разряда. М.: Наука. Физ.-мат. лит. 1987. 592 с.
Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Ч. 2. М.: Химия. 1969. С. 1032.
Пискарев И.М. // ЖФХ. 2001. Т. 75(11). С. 1997.
Pastina B., LaVerne J.A. // J. Phys. Chem. A. 2001. 105. P. 9316.
Westley F. Tables of recommended rate constants for chemical reactions occurring in combustion. 1980. NBS. US. Washington, D.C. 20234.
Hoigne J., Bader H., Haag W.R., Staehelin J. // Water Res. 1985. V. 19(8). P. 993.
Kulagin Y.A., Shelepin L.A., Yarygina V.N. Kinetics of processes in the gas media containing metastable oxygen. 1994. Lebedev FIAN. 218. P. 166.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


