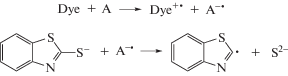Химия высоких энергий, 2020, T. 54, № 4, стр. 283-287
Влияние акцепторов и доноров электрона на фотосенсибилизированную красителями реакцию распада 2-меркаптобензотиазола
В. Л. Иванов a, *, С. Ю. Ляшкевич a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: fotochem@yandex.ru
Поступила в редакцию 14.01.2020
После доработки 14.01.2020
Принята к публикации 21.02.2020
Аннотация
Показано, что при облучении красителей в присутствии акцепторов электрона наблюдается увеличение квантового выхода фотосенсибилизированного красителями распада 2-меркаптобензотиазола (MBT) в водных растворах. В присутствии доноров электрона квантовые выходы фотосенсибилизированной реакции распада MBT либо остаются неизменными, либо уменьшаются. Исключением являются доноры роданид- и иодид-ионы, что связано в этом случае с образованием анион-радикалов в последующей реакции радикалов иода и роданида с их анионами соответственно. Предложен механизм фотосенсибилизации распада 2-меркаптобензотиазола красителями в присутствии акцепторов и доноров электрона.
2-Меркаптобензотиазол (MBT) и его производные используются в качестве фунгицидов и гербицидов в сельском хозяйстве [1, 2]. MBT, являясь хорошим инициатором радикальных реакций, применяется при производстве полимерных материалов [3], а также используется при вулканизации каучука [4]. MBT является перспективным ингибитором коррозии [5]. В связи с широким использованием MBT в промышленности и сельском хозяйстве большое его количество попадает в окружающую среду. Он был обнаружен в поверхностных водах и в сточных водах очистных сооружений [6, 7]. Поскольку MBT обладает канцерогенными свойствами [8], а его отходы попадают в окружающую среду, встает вопрос о его дезактивации. Одним из способов дезактивации MBT является его фотохимическое разложение. В работе [9] было показано, что красители разных классов при их облучении сенсибилизируют распад MBT в водных растворах. Целью данной работы является изучение фотосенсибилизированного красителями распада MBT в водных растворах в присутствии акцепторов и доноров электрона.
МЕТОДИКА ЭКСПЕРИМЕНТА
2-Меркаптобензотиазол, C7H5NS2 (97%), Sigma-Aldrich Co., красители, а также акцепторы и доноры электрона использовали марки “ч. д. а.”. Все эксперименты проводили в дистиллированной воде при pH 9.2 в присутствии буры (0.05 М).
Растворы MBT с красителями в зависимости от их спектров поглощения облучали в видимой области спектра либо светом ртутной лампы ДРШ-500 с фильтрами для выделения ртутных линий, либо светом галогенной лампы с фильтрами ЖС17 + СЗС22 или ЖС11 + СЗС22. Для облучения образцов использовали кварцевые кюветы 10 × 10 мм. За кинетикой фотохимической реакции (распад MBT) следили по спектрам поглощения. Спектры поглощения растворов регистрировали на спектрофотометре “Shimadzu UV-2101PC”. Установка импульсного фотолиза описана в [10]. Эксперименты по импульсному фотолизу проводили после предварительного продува раствора спектрально чистым аргоном в течение 30 мин.
Квантовые выходы фотохимической реакции определяли по расходованию MBT от дозы поглощенного света с помощью программы Mathcad 15. Точность определения квантовых выходов составляла 10%. Интенсивность поглощенного света при использовании ртутной лампы определяли с помощью фотоэлемента Ф 4, прокалиброванного ферриоксалатным актинометром [11]. Интенсивность света галогенной лампы с комбинацией светофильтров СС5 + ЖС4 определили с помощью фотореакции рибофлавина в растворе буры (0.05 М) с квантовым выходом 0.032 при облучении светом ртутной лампы 436 нм с известной интенсивностью и светом галогенной лампы с светофильтрами СС5 + ЖС4. Интенсивность света галогенной лампы с другими светофильтрами определили с учетом данных для светофильтров СС5 + ЖС4 и зависимости интенсивности света галогенной лампы от длины волны, измеренной с помощью флуориметра Perkin Elmer LS55.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе [9] было показано, что при облучении красителей видимым светом в присутствии 2‑меркаптобензотиазола как в нейтральном (pH 6), так и в щелочном (pH 9.2) водном растворе наблюдается распад MBT. В данной работе было изучено влияние акцепторов и доноров электрона на фотосенсибилизированную красителями разных классов: ксантеновых (эозин, эритрозин, роза бенгальская), родаминовых (родамин С, родамин 6Ж), тиазиновых (метиленовый синий), реакцию распада MBT. Обнаружено, что в присутствии акцепторов электрона (м-динитробензол, п-динитротолуол, персульфат-ион, ферроцианид калия) наблюдается значительный рост квантового выхода фотосенсибилизированного красителями распада MBT (рис. 1). Следует отметить, что квантовый выход реакции не зависит ни от интенсивности света, ни от концентрации красителя. При этом красители при их облучении в присутствии MBT и акцепторов электрона не расходуются (рис. 2).
Рис. 1.
Зависимость квантового выхода распада фотосенсибилизированного эозином MBT от концентрации м-динитробензола (1) и персульфат-иона (2) в водном растворе при pH 9.2.
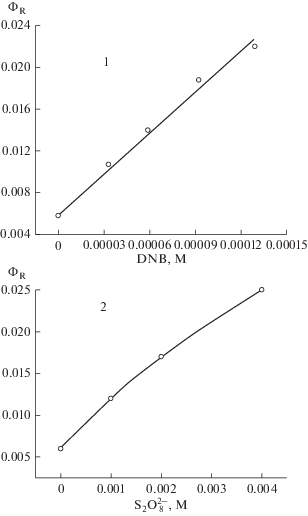
Рис. 2.
Фотолиз MBT при облучении эозина галогенной лампой с фильтрами ЖС17 + СЗС22 в присутствии м-динитробензола (6 × 10–5 М) : 0, 60, 120, 240, 360, 480 с.
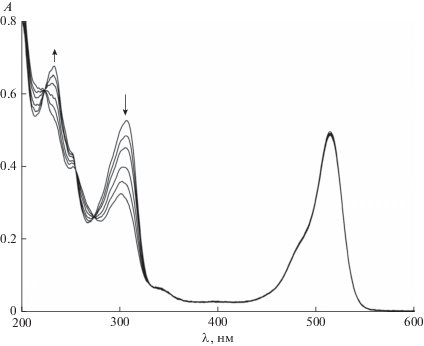
В отличие от акцепторов электрона в присутствии доноров электрона квантовый выход фотосенсибилизированной красителями реакции MBT либо остается неизменным (Ф0/Ф = 1), либо уменьшается (табл. 1), что связано с тушением триплетных состояний красителей донорами электрона. В работах [12–14] были определены константы тушения триплетов красителей акцепторами и донорами электрона. Исключением из общего правила являются два донора электрона: роданид-ион и иодид-ион, в их присутствии квантовый выход фотосенсибилизированной реакции MBT увеличивается (рис. 3).
Таблица 1.
Влияние доноров электрона на квантовый выход фотосенсибилизированной реакции распада 2-меркаптобензтиазола (Ф0 – в отсутствие донора, Ф – в присутствии донора)
| Донор электрона | Эозин | Метиленовый синий | ||
|---|---|---|---|---|
| Концентрация донора, М | Ф0/Ф | Концентрация донора, М | Ф0/Ф | |
| ЭДТА | 0.01 | 1 | 0.01 | 2 |
| Аскорбиновая кислота | 0.001 | 1.2 | 0.001 | 1 |
| ${\text{NO}}_{2}^{{2 - }}$ | 0.2 | 1 | 0.2 | 1 |
| ${\text{N}}_{3}^{ - }$ | 0.001 | 4 | 0.001 | 4 |
| ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2 - }}}}$ | 0.1 | 2 | 0.1 | 3 |
| ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ | 0.0025 | 1 | 0.001 | 1.5 |
| Желтая кровяная соль | 0.001 | 1.5 | 0.001 | 1.2 |
Рис. 3.
Зависимость квантового выхода распада фотосенсибилизированного эозином MBT от концентрации роданида (1) и иодида (2) калия в водном растворе при pH 9.2.
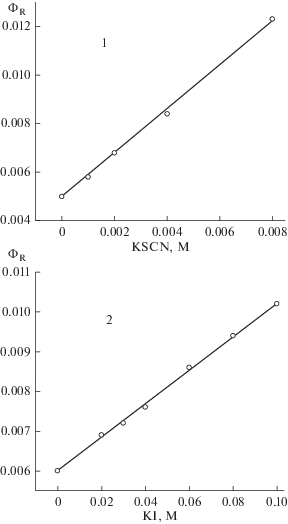
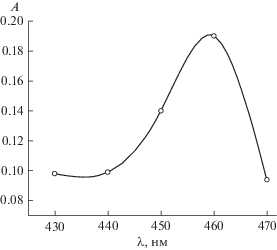
С помощью импульсного фотолиза мы изучили тушение триплетных состояний красителей акцепторами электрона. Константы скорости тушения триплетов ксантеновых красителей (эозин, эритрозин, роза бенгальская) акцепторами электрона (м-динитробензол, персуоьфат-ион) близки к диффузионным константам скорости. При импульсном фотолизе эозина в присутствии акцепторов электрона наблюдается образование короткоживущего продукта поглощения, спектр которого представлен на рис. 4. Максимум спектра поглощения соответствует окисленной форме эозина [15].
Рис. 4.
Спектр восстановленной формы эозина, полученной с помощью импульсного фотолиза в присутствии красной кровяной соли (0.01 М).
Увеличение квантового выхода фотосенсибилизированной красителями реакции MBT в присутствии акцепторов электрона обусловлено образованием анион-радикалов акцепторов, которые взаимодействуют с молекулами MBT. В результате этого образуется анион-радикал MBT, который распадается с образованием углеродного радикала и аниона серы (схема 1 ). Углеродный радикал MBT, образующийся в результате разрыва связи C–S, вступает либо в реакцию рекомбинации, либо в реакцию с органическими молекулами, если они присутствуют в растворе. Наличие изобестических точек в спектрах поглощения в ходе фотолиза в присутствии акцепторов электрона (рис. 2) в данном случае свидетельствует о протекании в основном одной реакции.
Схема 1
Увеличение квантового выхода фотосенсибилизированного красителями распада MBT роданид- и иодид-ионами связано с образованием анион радикалов роданида $({\text{SCN}})_{2}^{{ - \bullet }}$ и иодида ${\text{I}}_{2}^{{ - \bullet }}$ в результате следующих реакций:
Затем атом роданида или иода реагирует с роданид- и иодид-анионом, соответственно, с образованием анион-радикалов [16–19]
Образующиеся по этой реакции анион-радикалы $({\text{SCN}})_{2}^{{ - \bullet }}$ и ${\text{I}}_{2}^{{ - \bullet }}$ реагируют с MBT аналогично анион-радикалам акцепторов электрона (схема 1 ).
Таким образом, показано, что в присутствии акцепторов электрона наблюдается увеличение квантового выхода фотосенсибилизированного красителями распада 2-меркаптобензотиазола. Механизм реакции связан с реакциями переноса электрона. Доноры электрона либо не влияют, либо уменьшают квантовые выходы фотосенсибилизированного красителями распада MBT. Исключением являются роданид-ион и иодид-ион, что связано с образованием анион-радикалов роданида $({\text{SCN}})_{2}^{{ - \bullet }}$ и иода ${\text{I}}_{2}^{{ - \bullet }}$ при взаимодействии первично образующихся радикалов с соответствующими анионами.
Список литературы
Malouki M.A., Giry G., Besse P., Combourieu B., Sancelme M., Bonnemoy F., Richard C., Delort A.-M. // Environ. Toxicol. Chem. 2003. V. 22. № 9. P. 2013.
De Wever H., Besse P., Verachtert H. // Appl. Microbiol. Biotechnol. 2001. V. 57. № 5. P. 620.
Suzuki S., Emilie P., Urano T., Takahara S., Yamaoka T. // Polymer. 2005. V. 46. № 7. P. 2238.
Stephensen E., Adolfsson-Erici M., Hulander M., Parkkonen J., Forlin L. // Aquatic Toxicology. 2005. V. 75. № 2. P. 136.
Yang H., Sun Y., Ji J., Song W., Zhu X., Yao Y., Zhang Z. // Corros. Sci. 2008. V. 50. № 11. P. 3160.
Antonopoulou M., Evgenidou E., Lambropoulou D., Konstantinou I. // Water research. 2014. V. 53. P. 215.
Fries E., Gocht T., Klasmeier J. // J. Environ. Monit. 2011. V. 13. № 10. P. 2838.
Sorahan T. // Occup. Environ. Med. 2009. V. 66. № 4. P. 269.
Ivanov V.L., Lyashkevich S.Yu. // High Energy Chemistry. 2018. V. 52. № 6. P. 451.
Иванов В.Л., Артюхин А.Б. // Химия высоких энергий. 1998. Т. 32. № 5. С. 372.
Экспериментальные методы химии высоких энергий. Под общ. ред. Мельникова М.Я., М.: Изд-во МГУ, 2009. 824 с.
Коробов В.Е., Чибисов А.К. // Успехи химии. 1983. Т. 52. Вып. 1. С. 43.
Gorner H. // Photochem. Photobiol. Sci. 2008. V. 7. P. 371.
Kraljic I., Lindqvist L. // Photochemistry and Photobiology. 1974. V. 20. P. 351.
Neckers D.C., Valdes-Aguilera O.M. // Advances in Photochemistry. 1933. V. 18. P. 315.
Milosavljevic B.H., LaVerne J.A. // J. Phys. Chem. A. 2005. V. 109. P. 165.
Yu X.-Y., Barker J.R. // J. Phys. Chem. A. 2003. V. 107. P. 1325.
Schwarz H.A., Bielski B.H.J. // J. Phys. Chem. 1986. V. 90. P. 1445.
Behar D., Bevan P.L.T., Scholes G. // J. Phys. Chem. 1972. V. 76. № 11. P. 1537.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий