Химия высоких энергий, 2021, T. 55, № 2, стр. 145-149
Химические превращения водных растворов при дистанционном воздействии плазменного искрового разряда в воздухе, азоте и кислороде
И. М. Пискарев *
Научно-исследовательский институт ядерной физики им. Д.В. Скобельцына, Московский государственный университет им. М.В. Ломоносова, (НИИЯФ МГУ)
119234 Москва, Россия
* E-mail: i.m.piskarev@gmail.com
Поступила в редакцию 04.03.2020
После доработки 23.10.2020
Принята к публикации 26.10.2020
Аннотация
Исследована роль излучения в окислительно-восстановительных процессах под действием дистанционного искрового разряда. Для этого измерены выходы реакций при разряде в среде чистого азота и чистого кислорода. Результаты сравниваются с разрядом в среде воздуха. В качестве пробных веществ использовались соль Мора и марганцовокислый калий. Анализ результатов позволяет утверждать, что вклад продуктов, образовавшихся в области разряда, и диффундировавших к поверхности пробы, не превышает 15% и основную роль в инициировании химических процессов в жидкости играет излучение.
ВВЕДЕНИЕ
Холодная плазма и плазмой активированная вода (ПАВ) имеют большие перспективы для их широкого применения и поэтому интенсивно исследуются [1–3]. При получении ПАВ плазма непосредственно контактирует с водой. В работах [4–6] установлен сильный химический эффект, создаваемый искровым электрическим разрядом на воздухе, в водных растворах, не контактирующих с плазмой. Действующими факторами разряда могут быть как излучение плазмы, так и окислы азота, диффундирующие из области разряда к поверхности пробы. В работах [4–6] предполагалось, что основным фактором является излучение, но это не было доказано.
Важно определить роль факторов: излучения и окислов азота. Для этого нами дополнительно выполнены эксперименты с искровым электрическим разрядом в среде газов: отдельно в азоте и в кислороде. При разряде в чистом азоте или в чистом кислороде механизм Зельдовича образования окислов азота не работает, и весь эффект в обрабатываемой жидкости будет определяться излучением плазмы.
Цель работы: определение роли излучения в химических превращениях водных растворов при дистанционном воздействии искрового разряда на пробу.
МЕТОДИКА ЭКСПЕРИМЕНТА
Источником импульсного излучения служил генератор искрового разряда ИР50 [4, 5]. Активными факторами генератора ИР50 были излучение плазмы и окислы азота, образующиеся в области разряда.
Блок-схема эксперимента представлена на рис. 1. Искровой разряд происходил между твердыми электродами, соединенными с разрядным конденсатором С = 680 пф. На конденсатор через балластное сопротивление R = 8 МОм подавалось высокое напряжение 11 кВ. Полная длительность импульса тока разряда 5 мкс, передний фронт 50 нс, энергия разряда в импульсе 8.1 × 10−3 Дж, частота повторения импульсов 50 Гц, мощность разряда 0.4 Дж/с.
Рис. 1.
Блок-схема экспериментальной установки. HV – источник высокого напряжения 11 кВ; CD, RD – разрядная емкость и балластное сопротивление; 1 – разрядные электроды; 2 – место установки кварцевого стекла; 3 – чашка Петри с обрабатываемым раствором; 4 – продув газом (азот или кислород), при разряде в среде воздуха продув не производился.
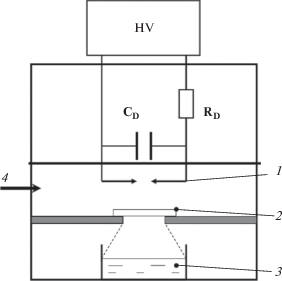
Искровой шнур излучал как черное тело с максимумом спектра 220 нм. Линии в области 250–600 нм, испускаемые возбужденными атомами газа, не создавали заметного химического эффекта [5]. Толщина слоя полного поглощения излучения в воде 30 мм [4]. Количество поглощенных пробой фотонов определялось ферриоксалатным актинометром [7]. Поглощенная энергия рассчитывалась в предположении, что средняя длина волны фотона 220 нм. Мощность поглощенной дозы в пробе объемом 5 мл 1.3 × 10−3 Дж/с.
Использовались три режима, разряд на воздухе, в среде N2 или O2. Разрядная полость и полость с обрабатываемым раствором были разделены фторопластовой перегородкой с круглым отверстием диаметром 20 мм (см. рис. 1). Расстояние от области разряда до поверхности обрабатываемой жидкости составляло 30 мм. Световое пятно от излучения разряда на поверхности пробы имело диаметр 40 мм. Пробы обрабатывались в чашках Петри диаметром 40 мм (объем 5 мл, поверхность 12.5 см2, толщина слоя жидкости 4 мм). В отдельном эксперименте на выходе из разрядной полости устанавливалось кварцевое стекло (позиция 2, рис. 1). Оптическая плотность кварцевого стекла в диапазоне 200–250 нм А ~ 0.19 [5].
В этом случае газовые полости были полностью разделены, из полости разряда выходило только излучение. При разряде в среде воздуха дополнительной подачи газа не производилось, проба жидкости была насыщена растворенным воздухом (азот и кислород). При разряде в среде N2 или O2 осуществлялся продув этими газами реакционной полости и полости с обрабатываемым раствором. При этом проба жидкости была насыщена растворенным газом, который применялся для продува. Для продува использовались технический азот (чистота 99.6%) и технический кислород (чистота 99.7%) из баллона. Время продува газом перед включением разряда составляло 16 мин.
Сравнивалось прямое и косвенное действие генератора ИР50 на образец. Прямое действие: генератор воздействует на образец, активные частицы могут сразу взаимодействовать с растворенным пробным веществом. Косвенное действие: генератор воздействует только на воду. При косвенном действии активные частицы образуются и накапливаются в воде. Через 30 с после обработки, воду смешивали с раствором пробного вещества, где начинались реакции накопившихся активных частиц с пробным веществом.
Химический эффект определялся в окислительно-восстановительных реакциях с пробными веществами. В качестве пробных веществ применялись водные растворы соли Мора и марганцовокислого калия. Выход окислительных эквивалентов определялся по окислению двухвалентного железа в соли Мора Fe2+ → Fe3+. Выход восстановительных эквивалентов определялся по восстановлению марганца Mn7+ → Mn2+ в растворе марганцовокислого калия.
Концентрация соли Мора составляла 20 г/л, [Fe2+] = 5.1 × 10−2 моль/л. В раствор добавляли 21 мл/л концентрированной серной кислоты (0.4 М). Кислотность раствора pH 0.8. Концентрацию окисленного Fe3+ определяли по оптической плотности полосы 304 нм, ε = 2100 ± 50 л (моль см)−1. Коэффициент экстинкции определялся непосредственно по калиброванному раствору. Учитывалось фоновое изменение оптической плотности этой полосы в исходном растворе за время после обработки. Для наблюдения пиков поглощения при длинах волн 250–400 нм пробы разбавляли 0.4 М серной кислотой в 100 раз.
Концентрация марганцовокислого калия составляла 1.58 г/л (0.05 Н). В раствор добавляли 21 мл/л концентрированной серной кислоты (0.4 М). Для наблюдения пиков поглощения в районе 400–650 нм исходный и обработанный растворы разбавляли 0.4 М серной кислотой в 10 раз. Концентрацию марганцовокислого калия определяли по оптической плотности полосы 527 нм. Коэффициент экстинкции полосы 527 нм в кислой среде, измеренный непосредственно для калиброванного раствора, составлял ε = 2160 ± 50 л (моль см)−1.
Спектры поглощения проб измерялись спектрофотометром СФ-102 фирмы АКВИЛОН, Россия. Толщина кюветы 10 мм. Оптическая плотность (absorbance) $A = \lg ({{{{I}_{0}}} \mathord{\left/ {\vphantom {{{{I}_{0}}} {I)}}} \right. \kern-0em} {I)}}$ (Бел) определялась относительно дистиллированной воды. Величина рН измерялась прибором Эксперт-001 фирмы ЭКОНИКС, Москва, Россия. Использовалась дважды дистиллированная вода рН 6.5 и химически чистые реактивы. Для каждого режима нарабатывали 10 проб, результаты усреднялись.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Накопление продуктов в чистой воде. Основным продуктом, накапливающимся в чистой воде под действием генератора ИР50 при искровом разряде в среде воздуха и идентифицированным ранее по спектру поглощения, является азотистая кислота [5]. Спектры поглощения проб воды после обработки в течение 3 минут представлены на рис. 2. Видно, что при разряде в среде воздуха образуется азотистая кислота (кривая 1), кислотность пробы pH 2.47. При разряде в среде азота или кислорода следов азотистой кислоты не видно (кривые 3 и 4), кислотность проб остается на уровне исходной, pH 6.5. Отсутствие азотистой кислоты в этих условиях связано с двумя обстоятельствами. Во-первых, в области разряда не образуются окислы азота. Во-вторых, так как в пробе воды содержатся только растворенный азот, или только растворенный кислород, механизм образования азотсодержащих соединений под действием излучения в жидкости, содержащей растворенные азот и кислород, рассмотренный в работе [5], также не работает.
Рис. 2.
Спектры поглощения проб воды объемом 5 мл после обработки дистанционным плазменным разрядом генератора ИР50 в течение 3 мин, поглощенная доза 0.24 Дж: 1 – разряд в среде воздуха; 2 – разряд в среде воздуха, выход излучения через кварцевое стекло; 3 – разряд в среде азота; 4 – разряд в среде кислорода. (См. текст).
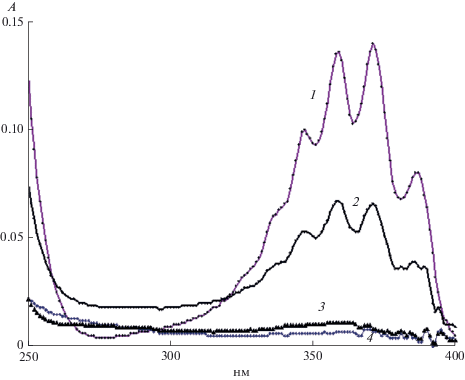
Отдельно проба воды обрабатывалась через кварцевое стекло. В этом случае продукты, образующиеся в области разряда, не могли попадать к поверхности пробы. Проба находилась на воздухе, поэтому в самой воде содержался растворенный кислород и азот. Спектр поглощения пробы после 3 мин обработки представлен на рис. 2, кривая 2. Видно, что в этом случае образуется азотистая кислота, но ее оптическая плотность примерно в два раза меньше. Это может быть связано с поглощением излучения кварцевым стеклом, а также с тем, что окислы азота, образовавшиеся в области разряда, не могут давать вклад в образование азотистой кислоты.
Для того, чтобы рассчитать выходы окисления и восстановления, рассмотрим механизмы окислительно-восстановительных реакций пробных веществ с продуктами, образующимися под действием генератора ИР50.
Механизмы окислительно-восстановительных реакций. Основные продукты, определяющие активность растворов после обработки излучением плазмы, могут проявлять как окислительные, так и восстановительные свойства. Это продукты: ${{{\text{HO}}_{{\text{2}}}^{ \bullet }} \mathord{\left/ {\vphantom {{{\text{HO}}_{{\text{2}}}^{ \bullet }} {{\text{O}}_{{\text{2}}}^{{ \bullet - }}}}} \right. \kern-0em} {{\text{O}}_{{\text{2}}}^{{ \bullet - }}}}$ (pKa = 4.8), азотистая кислота ${{{\text{HN}}{{{\text{O}}}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{\text{HN}}{{{\text{O}}}_{{\text{2}}}}} {{\text{NO}}_{{\text{2}}}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{{\text{2}}}^{ - }}}$ (pKa = = 3.4) и ONOOH/ONOO− (pKa = 6.8) [8].
Реакции с радикалом ${{{\mathbf{HO}}_{{\mathbf{2}}}^{ \bullet }} \mathord{\left/ {\vphantom {{{\mathbf{HO}}_{{\mathbf{2}}}^{ \bullet }} {{\mathbf{O}}_{{\mathbf{2}}}^{{ \bullet - }}}}} \right. \kern-0em} {{\mathbf{O}}_{{\mathbf{2}}}^{{ \bullet - }}}}.$ Растворы пробных веществ готовились в кислой среде, поэтому радикал ${{{\text{HO}}_{{\text{2}}}^{ \bullet }} \mathord{\left/ {\vphantom {{{\text{HO}}_{{\text{2}}}^{ \bullet }} {{\text{O}}_{{\text{2}}}^{{ \bullet - }}}}} \right. \kern-0em} {{\text{O}}_{{\text{2}}}^{{ \bullet - }}}}$ в данных условиях эксперимента можетпроявлятьтолько окислительные свойства. Взаимодействие двухвалентного железа в кислой среде с радикалами ${\text{HO}}_{{\text{2}}}^{ \bullet }$ описывается реакциями:
(1)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{HO}}_{2}^{\centerdot } + {{{\text{H}}}^{ + }} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}\,\,\,\,\,\,{{k}_{1}} = 1.5 \times {{10}^{6}}\,\,{\text{л}}{{\left( {{\text{моль с}}} \right)}^{{ - 1}}},$(2)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{O}}{{{\text{H}}}^{\centerdot }} + {\text{O}}{{{\text{H}}}^{ - }}\,\,\,\,\,\,{{k}_{2}} = 56{\text{ л}}{{\left( {{\text{моль с}}} \right)}^{{ - 1}}},$(3)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{O}}{{{\text{H}}}^{\centerdot }} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{O}}{{{\text{H}}}^{ - }}\,\,\,\,\,\,{{k}_{3}} = {{10}^{9}}\,\,{\text{л}}{{\left( {{\text{моль с}}} \right)}^{{ - 1}}},$(4)
${\text{HO}}_{2}^{\centerdot } + {\text{HO}}_{2}^{\centerdot } \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}}\,\,\,\,\,{{k}_{4}} = {\text{ }}9.6 \times {{10}^{8}}\,\,{\text{л}}{{\left( {{\text{моль с}}} \right)}^{{ - 1}}},$Здесь и далее использованы данные по константам скорости реакций из справочника [9]. Из реакций (1)–(4) видно, что на один первичный радикал ${\text{HO}}_{{\text{2}}}^{ \bullet }$ образуются три молекулы трехвалентного железа. При этом мы пренебрегаем расходованием образующейся перекиси водорода под действием первичного УФ-С излучения.
С раствором марганцовокислого калия радикалы ${\text{HO}}_{{\text{2}}}^{ \bullet }$ непосредственно не взаимодействуют [10], восстановительными свойствами может обладать перекись водорода, образующаяся в реакции 4 [11].
Реакции с азотистой кислотой. Азотистая кислота в условиях эксперимента может проявлять как окислительные, так и восстановительные свойства [12, 13].
Окисление двухвалентного железа азотистой кислотой:
(5)
$\begin{gathered} 2{\text{HN}}{{{\text{O}}}_{2}} + 2{\text{FeS}}{{{\text{O}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{3}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O }} + 2{\text{N}}{{{\text{O}}}^{\centerdot }}. \\ \end{gathered} $Одна молекула азотистой кислоты окисляет 1 молекулу Fe2+.
Восстановление марганца в кислой среде:
(6)
$\begin{gathered} 5{\text{HN}}{{{\text{O}}}_{2}} + 2{\text{KMn}}{{{\text{O}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} \to 2{\text{Mn}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + \\ + \,\,{{{\text{K}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{HN}}{{{\text{O}}}_{3}}. \\ \end{gathered} $На восстановление двух молекул марганца расходуется 5 молекул азотистой кислоты. Реакция с азотистой кислотой медленная [6, 14], продолжается двое суток.
Реакции с пероксиазотистой кислотой. Соединение ONOOH/ONOO− в кислой среде, которая используется для обработки проб генератором ИР50, существует в виде пероксиазотистой кислоты [7].
Реакция окисления Fe2+ с пероксиазотистой кислотой в кислой среде:
(7)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{ONOOH}} + {{{\text{H}}}^{ + }} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{NO}}_{2}^{\centerdot } + {{{\text{H}}}_{{\text{2}}}}{\text{O,}}$(8)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{NO}}_{2}^{\centerdot } \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{NO}}_{2}^{ - }.$На одну молекулу азотистой кислоты окисляются две молекулы двухвалентного железа.
Возможная реакция восстановление марганца пероксиазотистой кислотой:
(9)
$\begin{gathered} 2{\text{KMn}}{{{\text{O}}}_{4}} + 5{\text{ONOOH}} + 2{{{\text{H}}}^{ + }} \to \\ \to \,\,2{\text{MnO}} + 2{\text{KN}}{{{\text{O}}}_{3}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{{{\text{O}}}_{2}} + 3{\text{HN}}{{{\text{O}}}_{3}}. \\ \end{gathered} $На восстановление двух молекул марганца расходуются 5 молекул пероксиазотистой кислоты. Реакция с пероксиазотистой кислотой также занимает не менее двух суток [14]. С учетом малой скорости реакций окисления и восстановления, выход реакций определялся через три дня после обработки.
Выходы окисления и восстановления. С учетом стехиометрии реакций рассчитаны выходы окисления и восстановления, приводимые в таблице. Из табл. 1 видно, что в случае разряда на воздухе выходы окисления и восстановления при прямом и косвенном действии одинаковы. Равенство выходов означает, что активные частицы сначала нарабатываются в воде, а потом взаимодействуют с пробным веществом, непосредственно содержащимся в растворе, либо вводимым после обработки.
Таблица 1.
Выходы окисления и восстановления в растворах пробных жидкостей под действием генератора ИР50, 1(100 эВ)−1
| Условия разряда | Прямое действие | Косвенное действие | ||
|---|---|---|---|---|
| Окисление | Восстановление | Окисление | Восстановление | |
| Разряд на воздухе | 5.7 ± 0.9 | 6.2 ± 1 | 6.1 ± 0.9 | 5.6 ± 0.9 |
| Разряд в азоте | 3.7 ± 0.7 | 0.47 ± 0.05 | 5.7 ± 0.9 | 0.27 ± 0.03 |
| Разряд в кислороде | 1.35 ± 0.3 | 0.5 ± 0.1 | 4.53 ± 0.8 | 0.1 ± 0.015 |
Выходы окисления при разряде в среде азота для прямого и косвенного действия меньше, чем при разряде в среде воздуха на ~15%. Это означает, что роль азотсодержащих соединений, образующихся в области разряда в среде воздуха и диффундирующих к поверхности пробы, невелика и не превышает ~15%.
Выход окисления при разряде в среде кислорода для прямого действия составляет 1.35 ± ± 0.3 1(100 эВ)−1, а для косвенного действия 4.53 ± ± 0.8 1(100 эВ)−1. Малый выход для прямого действия может означать, что первичные радикалы ${\text{HO}}_{{\text{2}}}^{ \bullet }$ расходуются на взаимодействия с атомами O•, так как концентрация растворенного кислорода в 5 раз больше, чем при разряде на воздухе, и выход атомов O• должен быть больше.
Выход восстановления для разряда в среде азота или кислорода во всех режимах обработки почти на порядок меньше, чем окисления. Особенности реакций в этих случаях могут быть связаны с тем, что в водном растворе есть только кислород или только азот, и в воде не могут образовываться окислы азота [5]. Отсюда следует, что образующиеся из них азотсодержащие соединения в случае разряда на воздухе играют большую роль в окислительно-восстановительных процессах.
Список литературы
Bruggeman P.J., Kushner M.J., Locke B.R. et al. // Plasma Sources Sci. Technol. 2016. V. 25. 053002 (59pp).
Kolb J., Simek M., Holub M., Locke B.R. et al. // Plasma Processes and Polymers. 2018. V. 16(1). 1800118.
Thirumdas R., Kothakota A., Annapure U. et al. // Trends in Food Science & Technology. 2018. V. 77. P. 21.
Пискарев И.М., Трофимова С.В., Иванова И.П., Аристова Н.А. // Химия высоких энергий. 2012. Т. 40. № 5. С. 406.
Piskarev I.M., Ivanova I.P. // Plasma Sources Sci. Technol. 2019. V. 28. № 8. 085008 (10pp).
Пискарев И.М., Иванова И.П., Трофимова С.В., Ичеткина А.А., Бурхина О.Е. // Химия высоких энергий. 2014. Т. 48. № 3. С. 253.
Hatchard C.G, C.A. Parker C.A. // Proc. Roy. Soc. 1956. V. 235. P. 518.
Лобачев В.Л., Рудаков Е.С. // Успехи химии. 2006. Т. 78. № 5. С. 422.
Handbook of Chemistry and Physics. Haynes William M. Editor-in-Chief. CRC Press. 97 Editions. 2016–2017 Years.
De Grey A.D.N.J. // DNA and Cell Biology. 2002. V. 21. № 4. P. 251.
Xiong R., Nikiforov A., Vanraes P., Leys C. // J. Adv. Ox-id. Technol. 2012. V. 15. № 1. P. 197.
Parkt J.-Y., Lee Y.-N. // J. Phys. Chem. 1988. V. 92. P. 6294.
Tarabova B., Lukes P. Janda M., Hensel K., Sikurova L., Machala Z. // Plasma Process. Polym. 2018. el800030.
Piskarev I.M. // Research Journal of Pharmaceutical, Biological and Chemical Science. 2015. V. 6. № 6. P. 1136.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


