Химия высоких энергий, 2021, T. 55, № 3, стр. 215-218
Фотоокислительная деструкция формальдегида в водной среде
Н. А. Иванцова *
Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская площадь, 9, Россия
* E-mail: ivantsova.natalya@gmail.com
Поступила в редакцию 22.12.2020
После доработки 25.12.2020
Принята к публикации 10.01.2021
Аннотация
Исследованы процессы окисления формальдегида в водной среде при индивидуальном и совместном воздействии ультрафиолетового излучения и пероксида водорода. Установлено, что максимальные степени и скорости окисления наблюдаются при фотоокислении в присутствии пероксида водорода и достигают 99%. Доказано, что на получение высоких степеней окисления оказывают влияние исходные концентрации формальдегида и пероксида водорода. Предложен возможный механизм окисления формальдегида при фотолизе его водного раствора.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Все чаще отмечается и обсуждается пагубное влияние формальдегида на окружающую среду. Это вещество вызывает серьезные загрязнения и отравляет живые организмы. Также, учитывая тот факт, что данное соединение внесено в список веществ, представляющих канцерогенную опасность для человека, разработка новых методов очистки, направленных на предотвращение поступления формальдегида в окружающую среду, имеет актуальное значение.
Традиционные методы очистки природных и сточных вод, содержащих микрозагрязнители (в частности формальдегид) в большинстве случаев малоэффективны, а такие методы как, например, сорбция обладают избирательной эффективностью [1].
В связи с этим, эффективными следует признать способы очистки воды от формальдегида, основанные на процессах окислительной деструкции. Усовершенствованные окислительные методы (Advanced Oxidation Methods – AOMs) [2, 3] в последнее время находят широкое применение в решении проблем очистки сточных вод от органических соединений. В основе таких процессов лежат реакции окислительной деструкции, инициированные гидроксильными радикалами [4], которые, в свою очередь, или дополнительно увеличивают скорость реакции окисления или, наоборот, выступают в качестве поглотителей радикалов и существенно снижают эффективность деструкции органического соединения. К AOMs относится совместное действие ультразвука с УФ-излучением, пероксидом водорода, озоном, сочетание О3/H2O2, О3/УФ, УФ/H2O2, H2O2 + катализатор, электрохимическое действие совместно с озонированием, каталитическое, фотокаталитическое озонирование, гетерогенные фотокаталитические процессы, а также различные комбинации этих методов [2–5].
Кроме того, для оценки перспективы использования AOMs технологий необходимо расширить базу данных (как теоретических, так и экспериментальных) относительно условий получения максимальных синергетических эффектов действия индивидуальных окислителей (в частности, например, пероксида водорода и УФ-излучения) на органические примеси, способов их сочетания в одном технологическом процессе, положения метода в технологической схеме [6].
При окислении большинства сложных органических соединений (в частности фенола) происходит образование формальдегида как одного из основных продуктов деструкции. Природа продуктов деструкции представляет особый интерес, поскольку даже при полном разложении основного вещества они будут определять качество очистки [7]. В большинстве работ по окислению любого рода органических соединений в большей степени уделяют внимание деструктивной способности его, нежели изучению образующихся продуктов разложения. Но в работах [7–11] показано, что при окислительной деструкции, например, фенола или поверхностно-активных веществ (ПАВ) или активных фармацевтических субстанций (АФС) в водных растворах, с течением времени происходит накопление одноосновных карбоновых кислот и формальдегида.
Целью данной работы было исследование деструкции формальдегида в водном растворе при индивидуальном воздействии ультрафиолетового излучения и комбинации ультрафиолетового излучения и пероксида водорода и сравнение этих результатов с данными работы [8] по деструкции фенола в идентичных условиях с целью выяснения механизмов протекающих процессов.
МЕТОДИКА ЭКСПЕРИМЕНТА
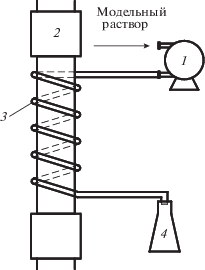
Исследования по окислительной деструкции модельных растворов формальдегида (СНОН) проводили на лабораторной установке, принципиальная схема которой представлена на рис. 1 и подробно описана в работе [8]. С помощью перистальтического насоса раствор формальдегида (концентрация варьировалась в диапазоне 0.095–1.1 мг/л, т.е. 0.0032–0.0367 ммоль/л) поступает в УФ-установку, где он проходит по кварцевому спиралевидному змеевику вокруг лампы ДРБ-8 и очищенный раствор попадает в приемник. Минимальная интенсивность излучения УФ-лампы на длине волны 254 нм составляет Emin = = 0.02535 Вт/см2. Время контакта жидкости с зоной облучения (τ, с) варьировали в диапазоне от 2 до 20 с. Для интенсификации процесса фотоокисления в обрабатываемые растворы вводили микродобавки пероксида водорода с концентрацией в пробе в диапазоне от 0.176 до 3.52 ммоль/л.
Рис. 1.
Схема лабораторной установки: 1 – перистальтический насос; 2 – УФ-лампа ДРБ-8; 3 – кварцевый змеевиковый фотореактор; 4 – приемник.
Массовую концентрацию формальдегида определяли фотометрическим методом, который основан на образовании в присутствии ионов аммония окрашенного в желтый цвет продукта реакции формальдегида с ацетилацетоном [12]. Концентрацию одноосновных карбоновых кислот (в пересчете на муравьиную кислоту) определяли по цветной реакции данных соединений с м-ванадат аммония [13]. Для нахождения скоростей окислительной деструкции формальдегида проводилась обработка кинетических кривых разложения с использованием программного обеспечения пакета Origin 8.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее в работе [8] выявлен предположительный механизм окисления фенола при совместном воздействии ультрафиолетового излучения и пероксида водорода (УФ/Н2О2), из которого следует, что основными продуктами окислительной деструкции фенола являются формальдегид и одноосновные карбоновые кислоты, причем, вероятно, формальдегид (в дополнение к ${\text{HCO}}_{3}^{ - }$) является конечным продуктом деструкции.
Экспериментально определено, что окислительная деструкция формальдегида при синергетическом воздействии УФ-излучения и пероксида водорода (УФ/Н2О2) (табл. 1) значительно выше, чем при индивидуальном воздействии. Уже в начальный момент времени степень окисления (α) возрастает почти до 100%.
Таблица 1.
Максимальные степени окисления формальдегида (Сн=varior) при различных типах воздействия; [Н2О2] = 3.52 ммоль/л
| Исходная концентрация формальдегида, мкмоль/л | Тип воздействия | ||
|---|---|---|---|
| только Н2О2 | только УФ | УФ/Н2О2 | |
| 3.3 | 14 | 55 | 99 |
| 10 | 9 | 42 | 97 |
| 20 | 7 | 35 | 95 |
Концентрация (доза) реагентов оказывает существенное влияние на любой процесс очистки воды, в том, числе на процессы окисления. Найдено (рис. 2 и табл. 2), что при увеличении концентрации пероксида водорода максимальные степень и скорость окисления формальдегида возрастают.
Рис. 2.
Зависимость степени окисления формальдегида (Сн = 20 мкмоль/л) при совместном воздействии пероксида водорода и УФ-излучения. 1 – [Н2О2] = = 3.52 ммоль/л; 2 – [Н2О2] = 1.76 ммоль/л; 3 – [Н2О2] = = 0.88 ммоль/л; 4 – [Н2О2] = 0.44 ммоль/л; 5 – [Н2О2] = 0.18 ммоль/л.
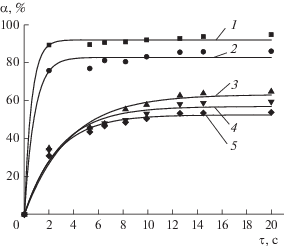
Таблица 2.
Максимальные степени и скорости окисления формальдегида (Сн = 20 мкмоль/л) при различных дозах пероксида водорода при воздействии УФ/Н2О2
| Концентрация Н2О2, ммоль/л | Максимальная степень окисления, % | Скорость окисления, мкмоль/л ∙ с |
|---|---|---|
| 0.18 | 54 | 3.2 |
| 0.44 | 60 | 3.8 |
| 0.88 | 65 | 3.6 |
| 1.76 | 86 | 20.2 |
| 3.52 | 95 | 32.4 |
При концентрации пероксида водорода меньше 1 ммоль/л, возрастание степени окисления во времени происходит постепенно. При концентрациях, превышающих 1 ммоль/л, степень окисления резко увеличивается в течение первых секунд, что говорит о быстрой деструкции формальдегида.
Согласно стехиометрической реакции концентрация пероксида водорода, необходимая для полного окисления формальдегида до диоксида углерода и воды с концентрацией 20 мкмоль/л равна 0.08 ммоль/л.
Доказано, что стехиометрической концентрации пероксида водорода недостаточно для полного окисления формальдегида. В связи с этим, необходимо создание избыточной концентрации пероксида водорода, что позволит увеличить выход гидроксильных радикалов (ОН•).
При использовании технологии УФ/Н2О2 на образование радикалов ОН• и окисление расходуется около 10% от введенной дозы пероксида водорода. Избыточная концентрация Н2О2 необходима для повышения вероятности поглощения УФ-излучения молекулами Н2О2. В свою очередь оставшийся пероксид водорода необходимо удалять до уровня концентраций ≤0.1 мг/л, например, с помощью фильтрации через активированный уголь.
Процесс разложения органических соединений различен. Состав промежуточных продуктов окисления того или иного органического соединения зависит от строения молекулы. Так, например, при окислении фенола во всех случаях первой стадией является отрыв атома водорода от окси-группы фенола с последующим раскрытием ароматического ядра и образованием сравнительно малотоксичных производных непредельных альдегидов и кислот [14]. Также, например, при окислении ПАВ происходит ряд последовательных реакций с образованием кислот, спиртов и альдегидов, например, при озонировании алкилбензолсульфонатов согласно [10, 14] происходит образование озонидов, формальдегидов, органических кислот (в том числе муравьиной) и углекислот.
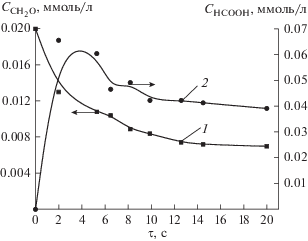
Таким образом, механизм окисления формальдегида имеет важное представление. Экспериментально обнаружено (рис. 3), что при совместном воздействии УФ-излучения и пероксида водорода кинетика образования суммы одноосновных карбоновых кислот (в пересчете на муравьиную кислоту) описывается кривой с выраженным максимумом. Экстремальный характер зависимости может быть связан с тем, что карбоновые кислоты не являются конечными продуктами деструкции в системе УФ/Н2О2.
Рис. 3.
Кинетика деструкции формальдегида (1) и образования одноосновных карбоновых кислот (в пересчета на муравьиную кислоту) (2) при совместном воздействии УФ/Н2О2 ([Н2О2] = 0.88 ммоль/л).
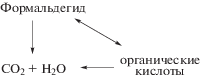
Предположительный механизм окисления формальдегида при совместном воздействии УФ-излучения и перокисда водорода, схематично можно представить следующим образом:
Из схемы видно, что часть формальдегида окисляется до углекислоты и воды, часть до одноосновной карбоновой кислоты, которая, в свою очередь, может либо перейти обратно в формальдегид, либо окислиться до диоксида углерода и воды, которые являются конечными продуктами окислительной деструкции формальдегида. Реакционно это может выглядеть следующим образом:
Таким образом, соотнеся данные в работе [8] с полученными результатами по окислению формальдегида в системе УФ/Н2О2 полная деструкции фенола до диоксида углерода и воды происходит через образование промежуточных продуктов – одноосновных карбоновых кислот и формальдегида, при этом формальдегид в большей степени является конечным продуктом окисления. Процесс трансформации кислот в альдегиды при окислении фенола не наблюдали, вероятно, так как, система УФ/Н2О2 является проточной и основное количество активных радикалов расходуется на реакции с исходным веществом, который разлагается более эффективно и непрерывно вводится в систему.
ВЫВОДЫ
Совокупность представленных данных показывают несомненные преимущества применения для окисления формальдегида систему УФ/Н2О2 по сравнению с индивидуальным воздействием. При фотоокислении водного раствора формальдегида в присутствии пероксида водорода принимают участие активные частицы, которые позволяют увеличить скорости процессов деструкции, т.е. снизить энергозатраты и повысить эффективность очистки. Особую роль в окислительных процессах формальдегида играет концентрация введенных микродобавок, таких как пероксида водорода. Экспериментально обнаружено, что при фотоокислении формальдегида происходит образование промежуточных продуктов – одноосновных карбоновых кислот, которые в свою очередь при соблюдении условий: высокие концентрации активных частиц и большее время воздействия, деструктируют в диоксид углерода и воду.
Список литературы
Кармазинов Ф.В. Ультрафиолетовые технологии в современном мире. Долгопрудный: Издательский Дом “Интеллект”, 2012. 392 с.
Poyatos J.M., Hontoria E., Osorio E. // Water Air and Soil Pollution. 2010. V. 205. № 1–4. P. 187.
Glaze W.H., Kang J.W., Chapin D.H. // Ozone Science and Engineering. 1987. V. 9. P. 335.
Желовицкая А.В., Ермолаева Е.А., Дресвянников А.Ф. // Вестник Казанского технологического университета. 2008. № 6. С. 211.
Tufail A., Price W.E., Hai F.I. // Chemosphere. Elsevier Ltd. 2020. V. 260. P. 127.
Гончарук В.В. Наука о воде. Киев.: НПП “Издательство “Наукова думка” НАН Украины”, 2010. 511 с.
Гриневич В.И., Пластинина Н.А., Рыбкин В.В., Бубнов А.Г. // Химия высоких энергий. 2009. Т. 43. № 2. С. 182.
Иванцова Н.А., Паничева Д.А., Кузнецов О.Ю. // Химия высоких энергий. 2020. Т. 54. № 1. С. 13.
Иванцова Н.А., Петрищева М.С. // Вода: Химия и Экология. 2013. № 10. С. 90.
Иванцова Н.А., Шепелева О.Н. // Водоочистка. 2013. № 2. С. 27.
Иванцова Н.А., Емжина В.В., Кручинина Н.Е., Ахтямова А.И. // Вода. Химия и экология. 2017. № 7. С. 81.
ПНД Ф 14.1;2.97-97. Количественный химический анализ вод. Методика выполнения измерений массовой концентрации формальдегида в пробах природных и очищенных сточных вод. Москва. 1997. 11 с.
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия, 1984. 448 с.
Шевченко А.И., Марченко П.В., Таран П.Н., Лизунов В.В. Окислители в технологии водообработки. Киев.: Наукова Думка, 1978. 177 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий