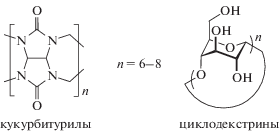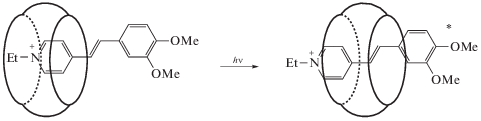Химия высоких энергий, 2022, T. 56, № 1, стр. 5-15
Разработка мультихромофорных супрамолекулярных устройств и машин
С. П. Громов a, b, *, М. В. Алфимов a, b, А. К. Чибисов a, b
a Центр фотохимии РАН, ФНИЦ “Кристаллография и фотоника” РАН,
119421 Москва, ул. Новаторов, 7а, корп. 1, Россия
b Московский физико-технический институт (государственный университет)
141701 Московская обл., Долгопрудный, Институтский пер., Россия
* E-mail: spgromov@mail.ru
Поступила в редакцию 24.06.2021
После доработки 24.08.2021
Принята к публикации 28.08.2021
- EDN: TMKRNW
- DOI: 10.31857/S0023119322010065
Аннотация
Среди различных направлений в науке о фотоактивных органических соединениях дизайн, создание и изучение мультихромофорных супрамолекулярных устройств и машин привлекают особое внимание, поскольку на этом пути можно открыть новые подходы к построению сложных иерархических “умных” материалов.
В настоящее время стало очевидным, что основное направление в развитии техносферы цивилизации связано с миниатюризацией устройств и машин. Существует две основные стратегии создания наноразмерных архитектур: “снизу вверх” и “сверху вниз”. В рамках стратегии “сверху вниз” наночастицы и наноразмерные системы получают в результате измельчения более крупных объектов. Стратегия “снизу вверх” может быть реализована, прежде всего, с помощью органического синтеза и супрамолекулярной самосборки.
В настоящее время в нанотехнологии “снизу вверх” сформировалось новое направление – инженерия супрамолекулярных устройств и машин различного назначения. Супрамолекулярными устройствами называют структурно-организованные и функционально-интегрированные химические системы. К супрамолекулярным машинам обычно относят устройства, в которых реализация функции происходит в результате механического перемещения компонентов относительно друг друга [1]. И первые, и вторые могут быть использованы при создании устройств для генерации, преобразования и передачи энергии и устройств перемещения на наноуровнях, при разработке инструментов для контроля, диагностики наноколичеств материалов и веществ [2–5].
Управлять супрамолекулярными устройствами и машинами можно разными способами (например, с помощь термического, химического или электрохимического воздействия), но самый удобный агент – свет, который легко регулируется как по длине волны, так и по интенсивности [6].
В живой природе фотоактивные супрамолекулярные системы обеспечивают фотосинтез и фототропизм у растений, зрительное восприятие у человека и животных, фототаксис у бактерий: поглощая фотон, молекулы хлорофилла и ретиналя претерпевают перестройки, из-за чего меняется их реакционная способность. В этих системах свет приводит в действие целый ряд жизненно важных процессов. Основные фотопроцессы, которые при этом происходят, – включают флуоресценцию, интеркомбинационный переход в триплетное состояние, перенос энергии и электрона, а также вызванные светом структурные изменения.
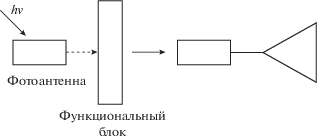
Таким образом, молекулы, составляющие фотоактивные супрамолекулярные системы, должны поглощать свет, приводящий к структурной перестройке и к изменению реакционной способности. Важной является способность фотоактивных супрамолекулярных систем обладать свойствами ф-отоантенн.
Создать искусственные фотоактивные супрамолекулярные системы различной степени сложности, которые, с одной стороны, обладали бы наиболее ценными свойствами природных объектов, а с другой – предоставляли бы возможности для новых применений, пытались уже давно.
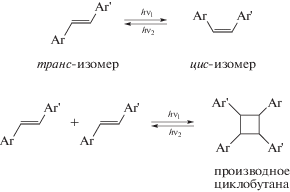
В качестве фотоантенн в супрамолекулярных устройствах и машинах изучали фотохромные производные антрацена и спиросоединений, но чаще всего использовали производные азобензола, содержащие N=N-связь. Однако принципиальным недостатком азобензолов является то, что они способны вступать только в реакции транс-цис- и цис-транс-фотоизомеризации.
В этом отношении соединения, содержащие углерод-углеродную двойную связь (непредельные или ненасыщенные соединения), имеют ряд преимуществ, главное из которых состоит в способности вступать не только в реакцию фотоизомеризации, но и в другие обратимые фотореакции, приводящие к значительным структурным изменениям, например, в реакцию [2 + 2]-фотоциклоприсоединения с образованием производных циклобутана.
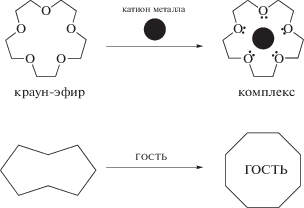
В качестве функционального блока (фрагментов), реагирующих на изменение структуры молекулы при фотопереключении, наиболее часто используют краун-соединения. Это макроциклические соединения, содержащие гетероатомы с неподеленными электронными парами, которые способны к образованию координационных связей с ионом металла. Одним из фундаментальных свойств этих молекул является их способность в растворах к самосборке вместе с ионами или другими молекулами (гостями) в системы высокой степени сложности, которая сильно зависит от химического и пространственного строения [7].
Если связать ковалентными связями фрагменты краун-соединения и фотоактивного соединения так, чтобы один или два гетероатома макроцикла находились в сопряжении с хромофором, то это приведет к нарушению аддитивности в проявлении специфических свойств краунсодержащих фотоактивных соединений. При этом превращения фотоактивного фрагмента под действием света приведут к изменению эффективности связывания катионов металлов краун-эфирным фрагментом, а самосборка в свою очередь должна изменить спектральные и фотохимические характеристики фотоактивного фрагмента.
Сопряженные реакции этого типа происходят в супрамолекулярных структурах, образованных в результате самосборки с участием молекул краунсодержащего фотоактивного соединения и ионов металла, что используется для разработки и создания фотопереключаемых супрамолекулярных устройств.
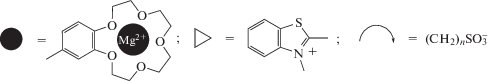
Таким образом, фотопереключаемые супрамолекулярные устройства на основе непредельных соединений и краун-соединений схематично могут быть представлены следующим образом (рис. 1): это гибридные молекулы (КНС), содержащие непредельный фрагмент в качестве фотоантенны и один или два краун-эфирных фрагмента, способных связывать ион металла [8]. В этом случае самосборка в фотопереключаемые супрамолекулярные устройства позволит изменять спектральные и фотохимические характеристики непредельного фрагмента молекулы, а с помощью света, в свою очередь, можно будет управлять самосборкой таких краунсодержащих молекул.
Рис. 1.
Схематичное представление фотопереключаемых супрамолекулярных устройств на основе краунсодержащих непредельных соединений (КНС).

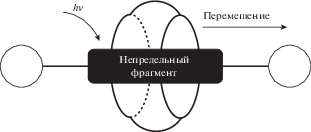
Прототипами фотоуправляемых супрамолекулярных машин, в которых компоненты могут механически перемещаться относительно друг друга (рис. 2), могут быть напоминающие челнок псе-вдоротаксановые комплексы с участием непредельных соединений (оси) и макроциклических кукурбитурилов или циклодекстринов (роторы). Для этого они не должны быть соединены прочными химическими связями.
Рис. 2.
Схематичное представление фотоуправляемых супрамолекулярных машин на основе непредельных соединений и кукурбитурилов или циклодекстринов.
Кукурбитурилы, которые используются в качестве ротора в псевдоротаксановых комплексах, представляют собой макроциклические соединения типа (C6H6N4O2)n, их строение напоминает тыкву (латинское название cucurbita) или бочку. Размеры их внутренней полости позволяют включать “гостей” – органические молекулы – с формированием комплексов. В областях дна и крышки такой бочки располагаются атомы кислорода сильно поляризованных карбонильных групп [9].
Это облегчает образование комплексов включения, особенно с положительно заряженными молекулами-гостями, к которым относится большинство фотоактивных непредельных соединений.
Форма молекул циклодекстринов представляет собой тор, также напоминающий полый усеченный конус. Данная форма стабилизирована водородными связями между OH-группами, а также α‑D-1,4-гликозидными связями. Все ОН-группы в циклодекстринах находятся на внешней поверхности молекулы. Поэтому внутренняя полость циклодекстринов является гидрофобной и способна образовывать в водных растворах комплексы включения с фотоактивными органическими молекулами.
В живой природе огромное многообразие с-упрамолекулярных архитектур создается на основе ограниченных наборов компонентов. Примерами таких молекулярных конструкторов могут служить нуклеотиды, которые используются природой для построения нуклеиновых кислот различных степеней иерархии.
Универсальным приемом построения в нанотехнологии “снизу вверх” мультихромофорных супрамолекулярных устройств и машин с заданной архитектурой и разнообразными свойствами может стать использование методологии супрамолекулярного конструктора. Однако такие подходы в нанотехнологии не разработаны.
Были синтезированы и изучены КНС, имеющие в качестве фотоантенны связь C=C и при ней арильный и гетарильный остатки [10]. Это позволило осуществлять фотопереключение молекул, используя видимый свет. Одновременно были разработаны методы синтеза ряда соединений, неописанных ранее, весьма перспективных для различных типов фотоактивных супрамолекулярных устройств: производных краун-эфиров, в том числе труднодоступных, например содержащих в макроцикле атомы N, O, S в различных сочетаниях. Можно было предположить, что в результате самосборки молекул КНС и катионов металлов получатся сложные надмолекулярные структуры — супрамолекулярные комплексы, тоже обладающие способностью к фотопереключению.
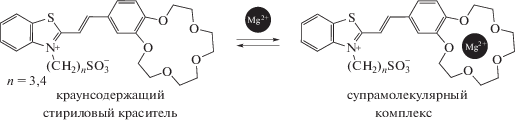
Было обнаружено, что среди КНС наиболее перспективными для создания фотопереключаемых супрамолекулярных устройств являются краунсодержащие стириловые красители, имеющие способную к координации концевую анионную группу ${\text{SO}}_{3}^{ - }$. Путем самосборки удалось получить из этих красителей и катионов металлов супрамолекулярные комплексы [11, 12]:
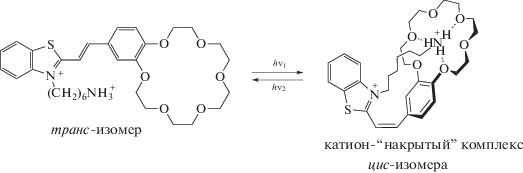
В зависимости от длины волны актиничного света такие комплексы могут “надевать” и “снимать” свою анионную “шапочку” (группу ${\text{SO}}_{3}^{ - }$), т.е. способны к супрамолекулярному фотопереключению [11].
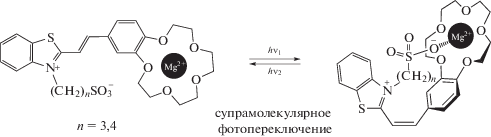
Было также показано, что цис-изомеры представленных выше стириловых красителей образуют намного более прочные комплексы по сравнению с транс-изомерами (отношение констант устойчивости достигает 500). Это значит, что с помощью света можно менять сродство этих КНС к катиону металла, т.е. управлять процессом образования комплекса. Такие супермолекулы принято называть фотопереключаемыми супрамолекулярными устройствами. Таким образом, впервые были получены на основе краунсодержащих стириловых красителей фотопереключаемые супрамолекулярные устройства [13–15].
Супрамолекулярные комплексы на основе КНС открывают возможности для создания и более сложных мультихромофорных супрамолекулярных устройств.
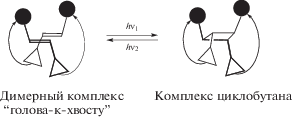
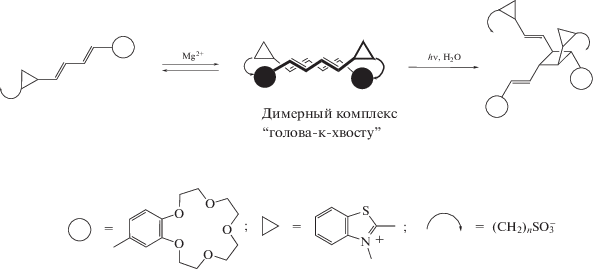
Судя по данным фотохимических исследований, в присутствии катионов металлов молекулы краунсодержащих стириловых красителей способны к самосборке в фотоактивные сэндвичевые структуры (димеры “голова-к-хвосту”), в которых С=С-связи располагаются одна над другой. Если облучать растворы супрамолекулярных димерных комплексов светом с определенной длиной волны, то с высокой эффективностью происходит реакция фотоциклоприсоединения с образованием производных циклобутана [16–18].
Здесь использованы следующие обозначения
Если удалить катион, то действием света более короткой длиной волны можно превратить циклобутан в исходный стириловый краситель, а затем повторить процесс образования димерного комплекса. Кроме того, выяснилось, что полученные производные циклобутана связывают катион металла намного лучше, чем исходные красители. Таким образом, и в этом случае можно управлять процессом образования комплекса с помощью света, т.е. димерные комплексы также представляют собой фотопереключаемые супрамолекулярные устройства [8, 19].
Следует заметить, что в результате супрамолекулярного фотоциклоприсоединения образуется единственный из 11 теоретически возможных изомеров циклобутана, иначе говоря, данная реакция протекает стереоспецифически [20]. Это дает возможность целенаправленно создавать фотопереключаемые супрамолекулярные устройства строго определенного строения.
Полученные в настоящее время данные позволяют утверждать, что катионы металлов в димерных комплексах КНС не оказывают прямого влияния на протекание реакции фотоциклоприсоединения, они исполняют роль “молекулярного клея”, сближая молекулы на расстояние, на котором реакция становится возможной, и одновременно обеспечивая благоприятную для реакции взаимную ориентацию С=С-связей [20, 21].
В отличие от комплексов с анионной “шапочкой” (анион-“накрытых” комплексов) продукты фотоциклоприсоединения – краунсодержащие циклобутаны – без ионов металла представляют собой новый тип фотопереключаемых молекул-хозяев, обладающих двумя местами связывания катионов. Краун-эфирные фрагменты в этих молекулах расположены таким образом, что можно предвидеть возможность их одновременного участия в образовании комплекса сэндвичевого типа с катионом металла большого диаметра, например, Ba2+ или Cs+, или с небольшим органическим катионом.
Таким образом, фотопереключаемые мультихромофорные супрамолекулярные устройства с заданными характеристиками могут быть получены из двух молекул КНС и двух катионов металлов путем самосборки в растворе супрамолекулярных димерных комплексов с последующей фотоконверсией в краунсодержащие циклобутаны, обладающие иными комплексообразующими свойствами. При необходимости можно “разобрать” циклобутаны на исходные соединения путем облучения светом с более короткой длиной волны [8].
Представляло интерес исследовать, как влияет наличие дополнительной C=C-связи в краунсодержащих бутадиенильных красителях на их комплексообразующие и фотохимические свойства [22, 23]. Если у атома азота гетероциклического остатка бутадиенильного красителя находится заместитель с терминальной сульфонатной группой, добавление ионов магния вызывает образование димерного комплекса. Облучение светом этого комплекса приводит к регио- и стереоспецифической реакции [2 + 2]-фотоциклоприсоединения. Она идет с участием только одной двойной связи бутадиенильного красителя. При этом образуется единственный из многих возможных изомеров циклобутана. Реакция протекает с квантовыми выходами, достигающими 0.35, существенно более высокими, чем в случае стириловых красителей [24].
Супрамолекулярное устройство, характеризующееся фотопереключаемым внутримолекулярным комплексообразованием с участием водородных связей в отсутствии катионов металлов, было получено путем введения длинного N-аммонийалкильного заместителя в гетероциклический остаток стирилового красителя [25].
В отличие от комплексов с катионной “шапочкой” (катион-“накрытых” комплексов) стириловые красители, имеющие более короткие аммонийалкильные заместители у атома азота гетероциклического остатка, способны образовывать в растворе димерные комплексы путем спонтанной супрамолекулярной самосборки с участием водородных связей [26, 27].
Было установлено, что хромофорные фрагменты двух молекул в этих комплексах расположены на близком расстоянии и практически параллельны друг другу, при этом взаимная ориентация центральных С=С-связей благоприятна для протекания реакции [2 + 2]-фотоциклоприсоединения [26]. Неудивительно, что в этом случае удалось осуществить в растворе стереоспецифические реакции [2 + 2]-фотоциклоприсоединения с необычно высокими квантовыми выходами.
Обнаруженное свойство позволяет рассчитывать на использование этих новых фотопереключаемых мультихромофорных супрамолекулярных устройств в технологии оптической записи и хранения информации [26].
Важным направлением исследований стала самосборка фотоуправляемых супрамолекулярных машин на основе фотоактивных непредельных соединений и кукурбитурилов [8, 20]. Оказалось, что кукурбитурилы образуют с положительно заряженными непредельными соединениями достаточно устойчивые комплексы включения типа “гость–хозяин”.
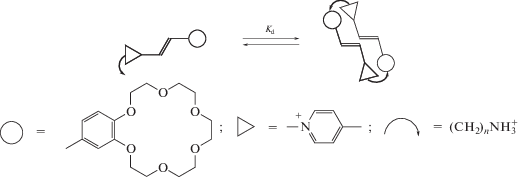
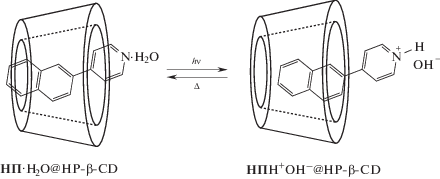
Представляло интерес исследовать возможность фотоуправления в супрамолекулярных машинах механическими перемещениями. Простейший вариант такой супрамолекулярной машины удалось создать на основе комплекса включения нафтилпиридина (НП) с β-циклодекстрином (HP-β-CD). В этом случае фотооблучение приводит к обратимому протонированию и как следствие к механическому смещению молекулы гостя в полости макроцикла [28].
Простейшая быстрая фотоуправляемая су-прамолекулярная машина была получена на основе ком-плекса включения стирилового кра-сителя и ку-курбит[7]урила. Оказалось, что значительное ув-еличение времени жизни флу-оресценции крас-ителя связано с механическим смещением электрон-но-возбужденного катиона красителя вглубь полости молекулы-хозяина в первые н-есколько пикосекунд [29, 30].
Более сложный вариант фотоуправляемой супрамолекулярной машиныбылсоздан на основе псевдоротаксанового комплекса кукурбит[8]урила с производным дихинолилэтилена. В этом случае облучение светом вызывает обратимую транс-цис-фотоизомеризацию гостевой молекулы непредельного соединения (рис. 3) [31].
Рис. 3.
Фотоуправляемая супрамолекулярная машина на основе псевдоротаксанового комплекса включения производного дихинолилэтилена с кукурбит[8]урилом.
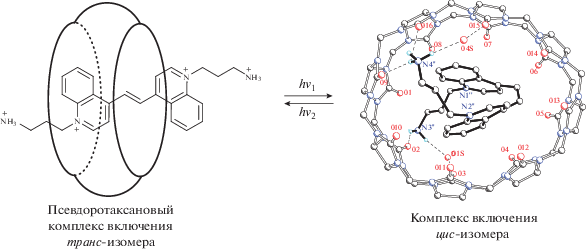
Пространственное строение этой супрамолекулярной машины после облучения светом, определенное методом рентгеноструктурного анализа (см. правую часть рис. 3), показывает, что сложное механическое перемещение молекулы-гостя в полости макроцикла-хозяина, напоминающее свертывание в клубок, легко может быть осуществимо.
Оказалось, что в полости кукурбит[8]урила способны разместиться две молекулы стирилового красителя. На рис. 4 представлена структура соответствующего супрамолекулярного псевдоротаксанового комплекса включения [32]. Взаимное расположение непредельных фрагментов двух молекул красителя в этом комплексе оказалось благоприятным для осуществления реакции фотоциклоприсоединения. Исследования показали, что образовавшийся циклобутан связан с кукурбитурилом менее прочно, чем исходные компоненты, т.е. появляется возможность управлять не только механическими перемещениями фотоактивных молекул внутри макроцикла, но и прочностью связывания компонентов.
Рис. 4.
Расположение двух молекул стирилового красителя в полости кукурбит[8]урила в псевдоротаксановом комплексе включения.
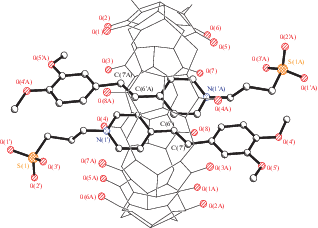
Благодаря этим свойствам удалось создать на основе кукурбит[8]урила фотоуправляемый мультихромофорный супрамолекулярный ассемблер [32]. Ассемблерами называют супрамолекулярные машины, способные направлять химические реакции за счет позиционирования молекул (т.е. “движущейся частью механизма” в данном случае являются молекулы-гости). В живой природе примером ассемблера, предназначенного для синтеза клеточных белков из аминокислот, служит рибосома. В нашем случае присутствие всего пяти мольных процентов кукурбитурила позволяет осуществить при облучении светом полное стереоспецифическое превращение исходных стириловых красителей в производные циклобутана (функционирование фотоуправляемого мультихромофорного супрамолекулярного ассемблера представлено на рис. 5).
Рис. 5.
Фотоуправляемый мультихромофорный супрамолекулярный ассемблер на основе кукурбит[8]урила для сборки производных циклобутана из стириловых красителей.
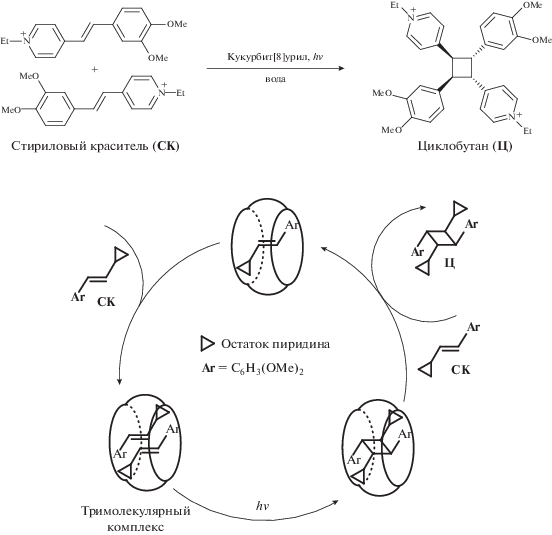
Таким образом, с помощью кукурбитурила можно собирать тримолекулярные псевдоротаксановые комплексы, осуществлять в этих комплексах реакцию фотоциклоприсоединения и повторять этот цикл превращений необходимое число раз.
В созданных супрамолекулярных системах можно реализовать все основные типы фотопроцессов [8, 20, 33–35].
Все это позволяет говорить о создании на основе непредельных и макроциклических соединений супрамолекулярного конструктора мульти-хромофорных супрамолекулярных устройств и машин, обладающего уникальным комплексом необходимых характеристик [8]: 1) доступностью с точки зрения органического синтеза, 2) склонностью к самопроизвольной организации в разнообразные супрамолекулярные архитектуры, 3) свойством в зависимости от структуры претерпевать различные типы фотохимических превращений, 4) способностью к молекулярному фотопереключению с высокой эффективностью. Указанные характеристики дают возможность собирать в растворе, на границе раздела фаз и в твердой фазе фотопереключаемые супрамолекулярные устройства, фотоуправляемые супрамолекулярные машины, мультихромофорные супрамолекулярные системы с заданной архитектурой и разнообразными свойствами.
Следует обратить внимание на прикладной потенциал проведенных исследований, поскольку они дают новую методологию построения материалов для супрамолекулярной и нанофотоники, что было продемонстрировано, прежде всего, на примере создания фотопереключаемых супрамолекулярных устройств, фотоуправляемых су-прамолекулярных машин, супрамолекулярных переключателей, оптических хемосенсорных материалов, сред для оптической записи и хранения информации [8, 20].
Результаты представленные в обзоре были получены главным образом в Центре фотохимии РАН. В то же время в этих исследованиях приняли участие целый ряд Российских научно-исследовательских организаций и университетов Великобритании, Германии, США, Швеции и Италии.
Исследования проводились при финансовой поддержке Российского научного фонда, Министерства образования и науки РФ, РФФИ, Российской академии наук, Московского правительства, фондов Royal Society, INTAS, CRDF, DFG и фонда Сороса.
Список литературы
Лен Ж.-М. Супрамолекулярная химия. Концепции и перспективы. Новосибирск: Наука, 1998. 334 с.
Брень В.А. // Успехи химии. 2001. Т. 70. № 12. С. 1152.
Минкин В.И. // Изв. АН. Сер. хим. 2008. Т. 57. № 4. С. 673.
Будыка М.Ф. // Изв. АН. Сер. хим. 2014. Т. 63. № 8. P. 1656.
Martynov A.G., Safonova E.A., Tsivadze A.Yu., Gorbunova Y.G. // Coordination Chem. Rev. 2019. V. 387. P. 325.
Минкин В.И. // Успехи химии. 2013. Т. 82. № 1. С. 1.
Химия комплексов “гость-хозяин”. Синтез, структуры и применения. / Под ред. Фёгтле Ф., Вебер Э. М.: Мир, 1988. 511 с.
Громов С.П. // Изв. АН. Сер. хим. 2008. Т. 57. № 7. С. 1299.
Герасько О.А., Коваленко Е.А., Федин В.П. // Успехи химии. 2016. Т. 85. № 8. С. 795.
Громов С.П., Алфимов М.В. // Изв. РАН. Сер. хим. 1997. Т. 46. № 4. С. 641.
Ушаков Е.Н., Алфимов М.В., Громов С.П. // Успехи химии. 2008. Т. 77. № 1. С. 39.
Alfimov M.V., Fedorova O.A., Gromov S.P. // J. Photochem. Photobiol., A. 2003. V. 158. P. 183.
Громов С.П., Федорова О.А., Ушаков Е.Н., Станиславский О.Б., Леднев И.К., Алфимов М.В. // ДАН СССР. 1991. Т. 317. № 5. С. 1134.
Громов С.П., Федорова О.А., Ушаков Е.Н., Станиславский О.Б., Алфимов М.В. // ДАН СССР. 1991. Т. 321. № 1. С. 104.
Громов С.П., Ушаков Е.Н., Федорова О.А., Солдатенкова В.А., Алфимов М.В. // Изв. АН. Сер. хим. 1997. Т. 46. № 6. С. 1192.
Громов С.П. // Обзорный журн. по химии. 2011. Т. 1. № 1. С. 3.
Алфимов М.В., Громов С.П., Станиславский О.Б., Ушаков Е.Н., Федорова О.А. // Изв. РАН. Сер. хим. 1993. Т. 42. № 8. С. 1449.
Громов С.П., Федорова О.А., Ушаков Е.Н., Буевич А.В., Алфимов М.В. // Изв. РАН. Сер. хим. 1995. Т. 44. № 11. С. 2225.
Ushakov E.N., Gromov S.P., Buevich A.V., Baskin I.I., Fedorova O.A., Vedernikov A.I., Alfimov M.V., Eliasson B., Edlund U. // J. Chem. Soc., Perkin Trans. 2. 1999. № 3. P. 601.
Ушаков Е.Н., Громов С.П. // Успехи химии. 2015. Т. 84. № 8. С. 787.
Gromov S.P., Vedernikov A.I., Lobova N.A., Kuz’mina L.G., Basok S.S., Strelenko Y.A., Alfimov M.V., Howard J.A.K. // New J. Chem. 2011 V. 35. P. 724.
Громов С.П., Сергеев С.А., Дружинин С.И., Русалов М.В., Ужинов Б.М., Кузьмина Л.Г., Чураков А.В., Ховард Дж.А.К., Алфимов М.В. // Изв. АН. Сер. хим. 1999. Т. 48. № 3. С. 530.
Русалов М.В., Ужинов Б.М., Алфимов М.В., Громов С.П. // Успехи химии. 2010. Т. 79. № 12. С. 1193.
Ushakov E.N., Vedernikov A.I., Alfimov M.V., Gromov S.P. // Photochem. Photobiol. Sci. 2011. V. 10. № 1. P. 15.
Vedernikov A.I., Kondratuk D.V., Lobova N.A., Valova T.M., Barachevsky V.A., Alfimov M.V., Gromov S.P. // Mendeleev Commun. 2007. V. 17. № 5. P. 264.
Gromov S.P., Vedernikov A.I., Lobova N.A., Kuz’mina L.G., Dmitrieva S.N., Strelenko Yu.A., Howard J.A.K. // J. Org. Chem. 2014. V. 79. № 23. P. 11416.
Ushakov E.N., Vedernikov A.I., Lobova N.A., Dmitrieva S.N., Kuz’mina L.G., Moiseeva A.A., Howard J.A.K., Alfimov M.V., Gromov S.P. // J. Phys. Chem. A. 2015. V. 119. № 52. P. 13025.
Gromov S.P., Nazarov V.B., Avakyan V.G., Fomina M.V., Vedernikov A.I., Kuz’mina L.G., Vershinnikova T.G., Lobova N.A., Rudyak V.Yu., Alfimov M.V., Howard J.A.K. // J. Photochem. Photobiol. A. 2011. V. 217. P. 87.
Ivanov D.A., Petrov N.Kh., Nikitina E.A., Basilevsky M.V., Vedernikov A.V., Gromov S.P., Alfimov M.V. // J. Phys. Chem. A. 2011. V. 115. № 17. P. 4505.
Petrov N.Kh., Ivanov D.A., Shandarov Yu.A., Kryukov I.V., Ivanov A.A., Alfimov M.V., Lobova N.A., Gromov S.P. // Chem. Phys. Lett. 2016. V. 647. P. 157.
Kuz’mina L.G., Vedernikov A.I., Lobova N.A., Howard J.A.K., Strelenko Y.A., Fedin V.P., Alfimov M.V., Gromov S.P. // New J. Chem. 2006. V. 30. № 3. P. 458.
Gromov S.P., Vedernikov A.I., Kuz’mina L.G., Kondratuk D.V., Sazonov S.K., Strelenko Y.A., Alfimov M.V., Howard J.A.K. // Eur. J. Org. Chem. 2010. № 13. P. 2587.
Kuz’mina L.G., Vedernikov A.I., Lobova N.A., Churakov A.V., Howard J.A.K., Alfimov M.V., Gromov S.P. // New J. Chem. 2007. V. 31. № 5. P. 980.
Chibisov A.K., Shvedov S.V., Goerner H.J. // J. Photochem. Photobiol. A. 2001. V. 141. № 1. P. 39.
Chibisov A.K., Zakharova G.V. // Photochem. Photobiol. Sci. 2012. V. 11. № 6. P. 893.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий