Химия высоких энергий, 2022, T. 56, № 1, стр. 45-49
Неорганический рутениевый катализатор фотоиндуцированного окисления воды в искусственом фотосинтезе
В. Ю. Ильященко a, b, З. М. Джабиева b, Т. А. Савиных b, Л. В. Авдеева b, Т. С. Джабиев b, *
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
* E-mail: dzhabiev@icp.ac.ru
Поступила в редакцию 26.07.2021
После доработки 23.08.2021
Принята к публикации 28.08.2021
- EDN: VRQBCX
- DOI: 10.31857/S0023119322010077
Аннотация
Изучена реакция фотокаталитического окисления воды персульфатом калия в присутствии фотосенсибилизатора bpy3RuCl2·6H2O и нитридного комплекса рутения Li3[Ru2(µ-N)Cl8·2H2O]. Кинетическим и ESI–масс-спектрометрическим методами установлено, что катализатором процесса является тетрарутениевый комплекс ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{5}^{ + }$ с молекулярной массой 512.28 а. е. м. Эффективность каталитической системы (число оборотов TON = 360, квантовый выход О2 Ф = 0.51) выше, чем у его кислородного аналога Li4[Ru2(µ-N)Cl10·2H2O] (TON = 240 и Ф = 0.2).
В связи с экологическими проблемами XXI век станет веком перехода от углеводородной энергетики к другим видам энергоносителей, поэтому весьма важным становится поиск новых альтернативных источников энергии. Такой альтернативой является солнечная энергия (СЭ). Один из многообещающих путей преобразования СЭ – биомиметическая утилизация ее, основанная на возможности фотоиндуцированного разложения воды на кислород и водород, т.е. на искусственном фотосинтезе (ИФС). Исследования в этой области во всем мире идут целенаправленно и широко. Наиболее трудной каталитической стадией искусственного фотосинтеза является формирование многоэлектронных продуктов окисления воды одноэлектронными окислителями. Одноэлектронные окислители (и восстановители) образуются в фотохимической стадии фотосинтеза после поглощения квантов света. В качестве таких окислителей в природном фотосинтезе выступают катион-радикалы Р680+·, а катализатором – марганцовый кофактор (Mn4CaO5), в координационной сфере которого образуется молекула О2 по реакции: 4Р680+· + 2Н2О = 4Р680 + О2 + 4Н+. В искусственном фотосинтезе для этой цели используют кластеры других переходных металлов, включая рутений.
Исследования последних лет показали, что по-лиядерные комплексы рутения представляют интерес как перспективные высокоэффективные катализаторы окисления воды в искусственном фотосинтезе с целью создания в будущем фотокаталитических преобразователей солнечной энергии в энергию химического топлива [1–5]. Однако эти катализаторы далеки от совершенства, поскольку не обладают достаточной активностью. К тому же имеется ряд проблем, связанных с использованием их в модельных системах. Большинство из них содержит органические лиганды, которые окисляются легче, чем вода, а также лабильные связи Ru–O–Ru, приводящие к дезактивации катализатора [6–10]. Установлено, что замена кислородного мостика между ядрами Ru в комплексе (Ru–O 1.86 Å) на азотный (Ru–N 1.72 Å), а также использование в синтезах неорганических лигандов и различных противокатионов (Li+, K+, Rb+, Cs+), при замене которых стехиометрический состав комплекса может изменяться определяющим образом влияет на стабильность и активность катализаторов окисления воды [11–15].
В данной работе приведены результаты исследования фотокаталитического окисления воды персульфатом калия в присутствии фотосенсибилизатора bpy3RuCl2·6H2O и биядерного нитридного комплекса рутения с литиевыми противокатионами Li3[Ru2(µ-N)Cl8·2H2O] (1).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по синтезу комплекса Li3[Ru2(µ-N)Cl8·2H2O] проводили на воздухе. Реагенты, используемые в работе, – коммерческие (Fluka). Синтез комплекса и его РСА описаны в работе [15]. ИК-спектры снимали на ИК-Фурье – спектрометре Bruker INVENIO R (Германия) в диапазоне 6000–80 см–1, образец для анализа готовили в виде таблетки с KBr. Для установления состава и строения образованного in situ тетраядерного катализатора фотоокисления воды использовали метод ESI-масс-спектрометрии. Масс-спектр получен на жидкостном хромато-масс-спектрометре LCM-2020 (Shimadzu Corporation, Япония).
Кинетические кривые образования О2 снимали на стеклянной вакуумной установке. В качестве источника света использовали ртутную лампу сверхвысокого давления ДРШ-1000. Для выделения нужной длины волны использовали интерференционный фильтр с λ = 450 нм. Интенсивность света (I0) определяли с помощью ферриоксалатного актинометра в тех же условиях, в которых проводили фотолиз исследуемых образцов (Io (450 нм) = 1.9 × 10–7 Эйнштейн/с) [16]. Квантовый выход кислорода (Ф) определяли по формуле Ф = Wo/Io, где Wo – начальная скорость образования кислорода. Перед облучением в кварцевый реактор, защищенный от света алюминиевой фольгой, загружали растворы bpy3RuCl2, K2S2O8 и комплекса 1, быстро продували азотом особой чистоты, дегазировали в вакууме. После каждого облучения количество образовавшегося О2 определяли с помощью калиброванного манометра. Газообразные продукты реакции собирали в масс-спектрометрическую ампулу и анализировали на масс-спектрометре МИ-1201 (ООО “Селми”, Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В разбавленных водных растворах ионы Cl− в комплексе 1 частично замещаются на Н2О и ОН-группы, однако фрагмент Ru–N–Ru сохраняется, на что указывает частота его валентных колебаний νas = 1075 см–1 в ИК-спектре. В кислых растворах комплекс 1 устойчив. Каталитическое окисление воды церийаммонийнитратом (NH4)2Ce(NO3)6 в присутствии 1 осуществляется по четырехэлектронному механизму по реакции (I) [15]:
(1)
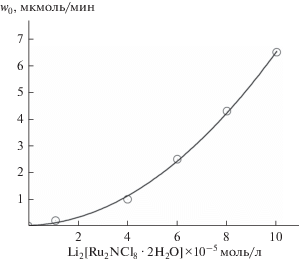
$4{\text{C}}{{{\text{e}}}^{{{\text{IV}}}}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 4{\text{C}}{{{\text{e}}}^{{{\text{III}}}}} + {{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }}.$Изучена кинетика образования О2 в зависимости от концентрации комплекса 1, окислителя K2S2O8 и фотосенсибилизатора bpy3RuCl2·6H2O. На рис. 1 приведены кинетические кривые образования О2 от концентрации комплекса 1. Они имеют обычный вид с максимальной скоростью в начале, которая со временем уменьшается. Связано это, очевидно, с расходованием “жертвенного” акцептора электронов ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }}.$
Рис. 1.
Кинетика фотокаталитического образования О2 при разных концентрациях Li3[Ru2NCl8· 2H2O]. Условия: лампа ДРШ-1000, интерференционный светофильтр λ = 450 нм, dреактора = 3.7 см, V = 25 мл, 3 М HCl, bpy3RuCl2 1.0 × 10–3 моль/л, K2S2O8 5 × 10–2 моль/л, Li3[Ru2NCl8·2H2O] (10‒5 моль/л): 1 – 3, 2 – 6, 3 – 10.
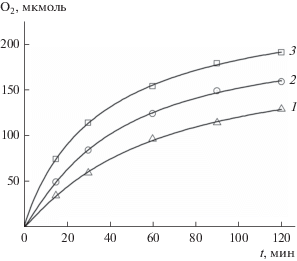
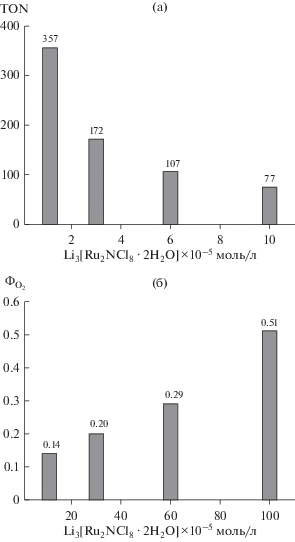
Зависимость начальной скорости процесса w0 от концентрации комплекса 1 представляет собой S-образную кривую, которая при низких концентрациях (от 1.1 × 10–5 до 10–4 моль/л) хорошо описывается параболическим законом (рис. 2). Это указывает на то, что каталитически активная частица образуется из двух биядерных нитридных комплексов 1 и представляет собой тетраядерный кластер рутения. Методом ESI масс-спектрометрии установлен состав тетраядерного комплекса рутения. В масс-спектре продуктов реакции фо-токаталитического окисления воды, изображенном на рис. 3, в изотопном распределении присутствует максимальный пик m/z = 512.28, соответствующий тетрарутениевому динитридному катиону ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{5}^{ + },$ который согласуется с рассчитанным (m/z = 512.30). Эффективность фотокаталитической системы в зависимости от концентрации комплекса 1 представлена на рис. 4, из которого видно, что максимальное число оборотов катализатора TON = 360 при [1] = 1.1 × × 10–5 моль/л (рис. 4а), квантовый выход О2 Ф = = 0.51 при [1] = 1.1 × 10–4 моль/л (рис. 4б).
Рис. 3.
ESI – масс-спектр катализатора реакции окисления воды в смеси: CH3CN : H2O : HCOOH = 29 : : 70 : 1, (1 – эксперимент, 2 – расчет).
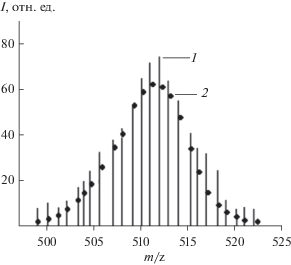
Рис. 4.
Зависимость числа оборотов катализатора TON (а) и квантового выхода О2 Ф (б) от концентрации Li3[Ru2NCl8·2H2O].
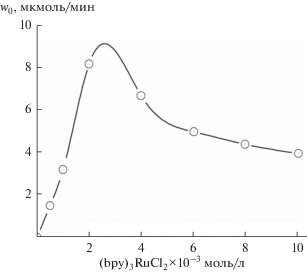
Начальная скорость образования О2 при увеличении концентрации “жертвенного” окислителя K2S2O8 также имеет вид S-образной кривой, что также указывает на расходование в ходе реакции двух акцепторов. После перехода через точку перегиба кривой (5 × 10–2 моль/л) скорость резко уменьшается и переходит к почти постоянной величине. В табл. 1 приведены выход кислорода (Q) за 2 ч реакции, число оборотов катализатора (TON) и квантовый выход О2 (Ф) в зависимости от концентрации K2S2O8. Зависимость начальной скорости фотоокисления Н2О от концентрации фотосенсибилизатора приведена на рис. 5. Она представляет собой экстремальную кривую с максимумом при [bpy3RuCl2·6H2O] = 2 × 10–3 моль/л. В этом случае концентрационное самотушение фотосенсибилизатора объясняется переносом энергии возбуждения не к мономерной молекуле ${\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + }},$ а к нефлюоресцирующему димеру ${{\left( {{\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + }}} \right)}_{{\text{2}}}},$ который рассеивает энергию возбуждения в тепло [17].
Таблица 1.
Зависимость выхода О2$\left( {{{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right),$ число оборотов катализатора (TON) за 2 ч и квантового выхода $\left( {{{\Phi }_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right)$ от концентрации K2S2O8
| [K2S2O8] × 10–2 моль/л | ${{Q}_{{{{{\text{O}}}_{2}}}}}$ | TON | ${{\Phi }_{{{{{\text{O}}}_{2}}}}}$ |
|---|---|---|---|
| 2.5 | 0.36 | 45 | 0.17 |
| 5.0 | 0.31 | 77 | 0.34 |
| 10.0 | 0.17 | 87 | 0.64 |
TON = выход O2 за 2 ч/ [1]; ${{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = выход О2 за 2 ч/K2S2O8/2; ${{\Phi }_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = w0/I0.
Рис. 5.
Изменение начальной скорости процесса (w0) от концентрации фотосенсибилизатора bpy3RuCl2. Условия: Li3[Ru2NCl8·2H2O] 1 × 10–4 моль/л, K2S2O8 5 × 10–2 моль/л, bpy3RuCl2 (10–3 моль/л): 1 – 0.5, 2 – 1, 3 – 2, 4 – 4, 5 – 10.
Фотогенерацию одноэлектронных окислителей ${\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{3 + }}$ можно представить реакциями (2)–(4):
(2)
${\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + }} + h\nu \to {\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + *}},$(3)
$\begin{gathered} {\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + *}} + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} = \\ = \,\,{\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{3 + }} + {\text{SO}}_{4}^{{ - \centerdot }} + {\text{SO}}_{4}^{{2 - }}, \\ \end{gathered} $Таким образом, при поглощении кванта света две молекулы ${\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{2 + }}$ окисляются в две молекулы ${\text{bp}}{{{\text{y}}}_{{\text{3}}}}{\text{RuCl}}_{2}^{{3 + }},$ а персульфат-анион восстанавливается в два сульфат-аниона по реакции (5):
В табл. 2 приведена активность каталитической системы в зависимости от концентрации фотосенсибилизатора.
Таблица 2.
Зависимость выхода О2$\left( {{{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right),$ числа оборотов (TON) за 2 ч реакции и квантового выхода $\left( {{{\Phi }_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right)$ от [bpy3RuCl2]
| [bpy3RuCl2] × 10–3 моль/л | ${{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ | TON | ${{\Phi }_{{{{{\text{O}}}_{{\text{2}}}}}}}$ |
|---|---|---|---|
| 0.5 | 0.125 | 32 | 0.13 |
| 1.0 | 0.31 | 78 | 0.27 |
| 2.0 | 0.36 | 91 | 0.77 |
| 4.0 | 0.34 | 87 | 0.47 |
| 10.0 | 0.26 | 65 | 0.36 |
Таким образом, при фотокаталитическом окислении воды персульфатом калия катализатором является тетраядерный динитридный комплекс рутения ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{5}^{ + },$ который образуется в результате димеризации двух исходных биядерных комплексов 1. Эффективность каталитической системы (TON = 360 и Ф = 0.51) выше, чем у его кислородного аналога Li4[Ru2OCl10·2H2O] (TON = 250 и Ф = 0.2).
Список литературы
Джабиев Т.С., Шилов А.Е. // Успехи химии. 2012. Т. 81. № 12. С. 1146. https://doi.org/10.1070/RC2012v081n
Kärkäs M.D., Verho O., Johnston E.V., Âkermark B. // Chem. Rev. 2014. V. 114. P. 11863. https://doi.org/10.1021/cr400572
Sartorel A., Bonchio M., Campagna S., Scandola F. // Chem. Soc. Rev. 2013. V. 42. P. 2262.
Geletii Y.V., Huang Zh., Hou Yu. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 7522. https://doi.org/10.1021/ja901373m
Umena Y., Kawakami K., Shen Y.R., Kamiya M. // Nature. 2011. V. 473. P. 55. https://doi.org/10.1038/nature09913
Hurst J.K. // Science. 2010. V. 328. P. 315. https://doi.org/10.1126/science.1187721
Gersten S.W., Samuels G.J., Meyer T.J. // J. Am. Chem.Soc. 1982. V. 104. P. 4029. https://doi.org/10.1021/ja00378a053
Yagi M., Kaneko M. // Chem. Rev. 2001. V. 101. P. 21. https://doi.org/10.1021/cr9801081
Sens C., Romero I., Rodriguez M. et al. // J. Am. Chem. Soc. 2004. V. 126. P. 7798. https://doi.org/10.1021/ja0486824
Suess-Fink G. // Angew. Chem. Int. Ed. 2008. V. 47. P. 5888. https://doi.org/10.1002/anie.200801121
Sartorel A., Carraro M., Scorrano G. et al. // J. Am. Chem. Soc. 2008. V. 130. P. 5006. https://doi.org/10.1021/ja0778371
Geletii Y.V., Botar B., Koegerler P. et al. // Angew. Chem. Int. Ed. 2008. V. 47. P. 3896. https://doi.org/10.1002/anie.200705652
Джабиева З.М., Шилов Г.В., Ткаченко В.Ю. и др. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 724. https://doi.org/10.1134/S003602361606005X
Джабиева З.М., Ткаченко В.Ю., Джабиев Т.С. // Химия высоких энергий. 2017. Т. 51. № 3. С. 230. https://doi.org/10.1134/S0018143917030043
Ткаченко В.Ю., Джабиева З.М., Шилов Г.В., Авдеева Л.В., Добрыгин В.В., Джабиев Т.С. // Журн. неорг. химии. 2021. Т. 66. № 3. С. 350. https://doi.org/10.31857/S0044457X21030181
Hatchard C.G., Parker C.A. Proc. Roy. Soc. London, Ser. A. 1956. V. 235. № 1203. P. 518.
Теренин А.Н. Фотоника молекул красителей и родственных органических соединений. Л.: Изд-во “Наука”, 1967. С. 474.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий