Химия высоких энергий, 2022, T. 56, № 3, стр. 245-250
Особенности окисления пропилена углекислым газом в барьерном разряде
А. Ю. Рябов a, *, С. В. Кудряшов a, А. Н. Очередько a
a Федеральное государственное бюджетное учреждение науки Институт химии нефти Сибирского отделения РАН
634055 Томск-55, просп. Академический, 4, Россия
* E-mail: andrey@ipc.tsc.ru
Поступила в редакцию 09.12.2021
После доработки 10.01.2022
Принята к публикации 14.01.2022
- EDN: QMWKUI
- DOI: 10.31857/S0023119322030093
Аннотация
Исследование продолжает цикл работ по окислению пропилена в плазме барьерного разряда до окиси пропилена и соответствующих гидроксильных и карбонильных соединений. Сравнение экспериментальных данных по превращению пропилена в воздухе и углекислом газе позволило выявить особенности протекания процесса.
ВВЕДЕНИЕ
Ранее показано, что окисление пропилена кислородом или воздухом в плазме барьерного разряда (БР) в присутствии воды, приводит к образованию окиси пропилена, гидроксильных и карбонильных соединений [1]. На основании экспериментальных данных и теоретических расчетов установлено, что наличие молекул азота в исходной смеси не оказывает заметное влияние на состав и механизм образования продуктов реакции. Основной вклад в образование окиси пропилена вносят процессы с участием атомарного кислорода. Молекулы кислорода так же принимают участие в окислении пропилена, приводя к образованию гидроксильных и карбонильных соединений.
Известно, что диссоциация молекул кислорода [2] и углекислого газа [3] в БР приводит к образованию атомов кислорода, но в случае с углекислым газом в реакционной смеси отсутствуeт молекулярный кислород. Сравнение экспериментальных и расчетных данных по окислению пропилена в воздухе и углекислом газе позволит уточнить возможный механизм образования кислородсодержащих продуктов с общей формулой С3НnО: окись пропилена, пропаналь, ацетон, аллиловый спирт, акролеин, изопропанол, пропанол.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Исследование проведено на экспериментальной установке, представленной ранее в работе [4]. Поток пропилена и воздуха или углекислого газа при комнатной температуре смешивается с водой, далее газожидкостная смесь направляется в реактор, где подвергается воздействию БР.
Плазмохимический реактор выполнен из дюраль алюминия и представляет собой планарную конструкцию с одним диэлектрическим барьером (стеклотекстолит, толщиной 1 мм). Зазор в разрядной зоне составляет 1 мм, площадь разрядной зоны равна 48 см2. Во всех экспериментах амплитуда высоковольтных импульсов напряжения не превышала 9 кВ, частота их повторения равнялась 400 Гц. Активная мощность разряда составляла 1.9 и 2.5 Вт, соответственно для смесей пропилена с воздухом и углекислым газом. Объемный расход газовой смеси составлял 60 см3/мин, воды – 0.3 см3/мин. Анализ газообразных и жидких продуктов реакции проводился с помощью газового хроматографа, оборудованного детектором по теплопроводности и пламенно-ионизационным детектором.
Расчет содержания основных химически-активных частиц в реакционной смеси, образующихся на стадии разрядного инициирования реакции выполнен с применением программного пакета Kintecus [5], согласно представленной ранее методике [4]. Необходимые для этого данные о потерях энергии электронов БР в смесях пропилен–воздух и пропилен–кислород, а также значения констант скорости электронно-молекулярных реакций и дрейфовой скорости электронов получены с использованием программного пакета Bolsig+ [6], сечения рассеяния электронов молекулами взяты из базы данных [7]. Расчет значений констант скорости электронно-молекулярных реакций выполнен с учетом данных [3, 8].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены продукты превращения пропилена в среде углекислого газа в сравнении с воздухом [1]. Видно, что состав и содержание продуктов заметно отличаются. Не образуются метанол, акролеин, уксусная и пропионовая кислоты. Доля газообразных углеводородов (метан, этан, этилен, ацетилен) уменьшилась ~ в 2 раза, а содержание продуктов, представленных в основном непредельными углеводородами С4–С6 (строка “другие”, табл. 1), увеличилось ~ в 2 раза.
Таблица 1.
Состав продуктов окисления пропилена в БР различными газами. Состав реакционной смеси: [С3Н6] = 9%, [Н2О] = 2%, [Воздух/СО2] = 89%
| Соединение | Содержание, мас. % | |
|---|---|---|
| С3Н6−воздух [1] | С3Н6–СО2 | |
| Газообразные углеводороды | 11.9 | 5.1 |
| Метанол | 2.7 | – |
| Ацетальдегид | 8.7 | 13.5 |
| Окись пропилена | 15.6 | 16.9 |
| Акролеин | 11.9 | – |
| Пропаналь | 11.1 | 18.7 |
| Ацетон | 10.7 | 6.8 |
| Изопропанол | 4.8 | 4.7 |
| Аллиловый спирт | 5.8 | 3.2 |
| Пропанол | 0.8 | 2.9 |
| Уксусная кислота | 0.8 | – |
| Пропионовая кислота | 0.4 | – |
| Другие | 14.7 | 27.9 |
| Конверсия, % | 16.9 | 23.6 |
| Энергозатраты, эВ · молекула–1 | 24.9 | 21.4 |
Энергозатраты на превращение пропилена в обоих случаях сравнимы, но конверсия с СО2 выше за счет большей активной мощности разряда. На рис. 1 представлена вольт-кулоновская характеристика (ВКХ) разряда для смесей пропилена с воздухом и СО2. Расчет электрических характеристик БР по ВКХ осуществляли графическим способом [4]. Напряжение горение разряда (Udis) определяли по выражению:
(1)
${{U}_{i}} = {{C}_{b}} \times {{U}_{{{\text{min}}}}} \div {{C}_{b}} + \left( {{{C}_{b}} \times {{C}_{g}} \div ({{C}_{b}} - {{C}_{g}})} \right),$Рис. 1.
Вольт-кулоновская характеристика БР в смеси пропилен углекислый газ и воздух в присутствии воды. Umin – минимальное внешнее напряжение, при котором наблюдаются микроразряды в разрядном промежутке, линии АВ и ВС – соответствуют емкости диэлектрического барьера и разрядного промежутка, q – величина переносимого заряда за один импульс.
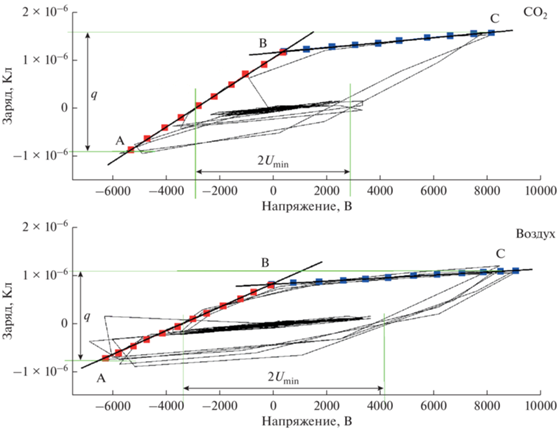
Полученные значения Udis равны ~3300 и 2500 В, соответственно для экспериментов с воздухом и СО2. Видно, что в случае с СО2 появление микроразрядов в реакторе происходит при меньшем внешнем напряжении, а переносимый в импульсе заряд больше, и соответствует значениям 1.8 и 2.4 × 10–6 Кл (рис. 1).
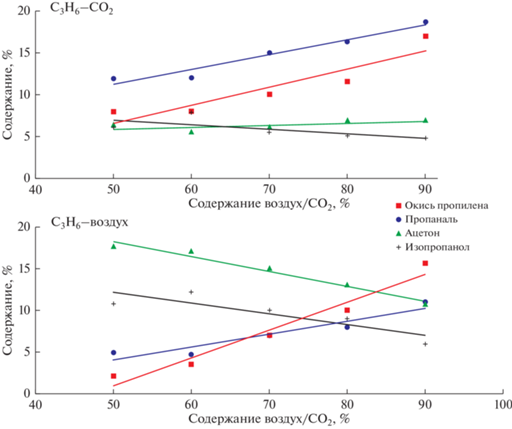
На рис. 2 приведено содержание кислородсодержащих продуктов с общей формулой C3HnО в зависимости от начальной концентрации воздуха или СО2 в исходной смеси. Видно, что для обоих смесей наблюдается общий тренд в образование продуктов реакции с уменьшением концентрации пропилена в исходной смеси – увеличивается содержание окиси пропилена и пропаналя, снижается количество – ацетона и изопропанола. Общие закономерности свидетельствует о схожем механизме образования веществ при разном составе исходной смеси.
Рис. 2.
Содержание кислородсодержащих продуктов с общей формулой C3HnО в зависимости от содержания воздух/СО2 в исходной смеси.
На рис. 3 представлен расчeтный состав основных химически-активных частиц, образующихся на стадии разрядного инициирования реакции для смесей, пропилен–воздух–вода и пропилен–СО2–вода в БР за один высоковольтный импульс напряжения.
Рис. 3.
Расчетный состав химически-активных частиц, образующихся на стадии разрядного инициирования реакции для смесей, пропилен–воздух–вода и пропилен–СО2–вода в БР за один высоковольтный импульс напряжения.
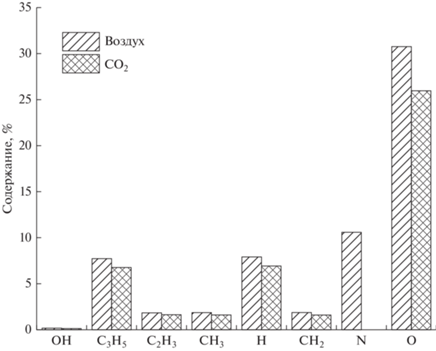
Оценка верхних границ выхода атомов и радикалов в результате электронно-возбужденной диссоциации молекул определялась на основании пороговых энергий диссоциации, имеющие значения для пропилена ~3.6 эВ, СО2 ~ 7.0 эВ, О2 ~ 4.5 эВ, N2 ~ 8.9 эВ, Н2О ~ 7.0 эВ.
Под действием БР на исходную смесь образуются преимущественно атомы кислорода и углеводородные радикалы – продукты распада пропилена. Видно, что в следствии более низкой энергии диссоциации молекулярного кислорода атомов кислорода в смеси пропилен–воздух образуется больше, чем при использовании CO2. В случае воздействия на смесь пропилен–воздух появляется атомарный азот.
Образовывание атомов кислорода и азота происходит по реакциям [2, 3, 10, 11]:
Как показано ранее [1], наличие молекул азота в исходной смеси не оказывает заметного влияния на образование кислородсодержащих продуктов при окислении пропилена. Наиболее вероятно атомы азота взаимодействуют с молекулярным кислородом и в дальнейшим это приводит к образованию различных оксидов азота [2, 12].
Согласно данным [8, 9], электронно-возбужденные молекулы пропилена диссоциируют с образованием газообразных углеводородов и различных радикалов по реакциям:
(5)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {\text{e}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{5}} + {\text{H}} + {\text{e}},$(6)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {\text{e}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{4}} + {{{\text{H}}}_{2}} + {\text{e}},$(7)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {\text{e}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{2}} + {\text{С}}{{{\text{Н}}}_{4}} + {\text{e}},$(8)
$~{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{e}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{4}} + {\text{С}}{{{\text{Н}}}_{2}} + {\text{e}}.$Необходимо отметить, что содержание углеводородных радикалов и водорода для обоих смесей составляет сравнимое количество (рис. 3). Таким образом можно предположить, что механизм окисления пропилена воздухом или СО2 включает в себя два канала появления основных радикалов – образование атомарного кислорода и деструкция олефина. Существенным отличием является участие молекулярного кислорода в образовании продуктов реакции при окислении пропилена воздухом.
Известно, что атомы кислорода взаимодействуют с двойной связью олефина образуя аддукт, который перегруппировывается в конечные продукты путем замыкания кольца (образуется окись) или миграцией атома водорода или алкильной группы от атома углерода, при котором находится атом кислорода, к другому атому углерода исходной двойной связи (образуются карбонильные соединения). Основными продуктами реакции пропилена с атомом О являются окись пропилена, пропаналь и ацетон, с общей формулой C3H6О:
(9)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {\text{О}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{О}}\,\,\,\,\,\left[ {13} \right].$Из табл. 1 видно, что содержание в продуктах реакции окиси пропилена в обоих случаях имеет близкие значения, соответственно 15.6 и 16.9% для экспериментов с воздухом и СО2. Для пропаналя и ацетона значения различаются и могут объясняться дополнительными реакциям их образования в механизме окисления пропилена.
При окислении пропилена воздухом, взаимодействие пропильного радикала с молекулой кислорода приводит к появлению ацетона и спирта (изопропанола или пропанола) в составе продуктов реакции. А образование пропильного радикала возможно в результате гидрирования молекул пропилена атомами водорода:
(10)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{6}} + {\text{H}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}},~\,\,\,\,\,\,\,\,\left[ {13} \right]$(11)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}} + {{{\text{О}}}_{2}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{ОО}},\,\,\,\,\,\,\,\left[ {15} \right]$(12)
$\begin{gathered} {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{ОО}} + {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{ОО}} \to \\ \to \,\,{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{О}} + {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{\text{ОН}} + {{{\text{О}}}_{2}}.\,\,\,\,\,\left[ {16} \right] \\ \end{gathered} $В случае превращения пропилена в атмосфере СО2 образование ацетона или пропаналя возможно в результате взаимодействия атома кислорода с пропильным радикалом:
(13)
$\begin{gathered} {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}} + {\text{О}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}{\text{О}}\,\,\left( {{\text{Пропаналь, Ацетон}}} \right) + \\ + \,{\text{Н}}\,\,\,\left[ {14} \right]. \\ \end{gathered} $Следовательно, в экспериментах с воздухом пропильные радикалы преимущественно взаимодействуют с молекулами кислорода по реакциям (11) и (12), увеличивая содержание ацетона в продуктах реакции. В углекислой среде пропильные радикалы могут взаимодействовать с атомами кислорода по реакции (13), увеличивая содержание пропаналя в смеси, либо взаимодействуя с другими углеводородным радикалами и повышая содержание непредельных углеводородов С4–С6 в продуктах реакции (строка “Другие”, табл. 1):
(14)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}} + {{{\text{С}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{12}}}}},\,\,\,\,\,\left[ 9 \right]$(15)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}} + {\text{С}}{{{\text{H}}}_{3}} \to {{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{10}}},~\,\,\,\,\,\,\,\left[ {14} \right]$(16)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{7}} + {{{\text{С}}}_{{\text{3}}}}{{{\text{H}}}_{7}} \to {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{14}}}.\,\,\,\,\,\,\,\left[ {14} \right]$Данные табл. 1 показывают, что образование акролеина, уксусной и пропионовой кислот происходит только при наличии молекулярного кислорода в исходной смеси.
Из данных расчета состава химически-активных частиц, образующихся на стадии разрядного инициирования реакции (рис. 2) следует, что содержание пропенильных радикалов в экспериментах с воздухом и углекислым газом сравнимо, следовательно их взаимодействие с молекулярным кислородом, образует соответствующие перекисные радикалы, аналогично реакциям (11) и (12), дальнейшее превращение которых приводит к появлению непредельных спирта и альдегида (аллилового спирта и акролеина):
(17)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{5}} + {{{\text{О}}}_{2}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ОО}},$(18)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ОО}} + {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ОО}} \to {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{О}} + {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ОН}} + {{{\text{О}}}_{2}}.$Подробное исследованиe механизма образования продуктов окисления пропилена возможно при изучении кинетической модели окисления пропилена, что является отдельной и трудоемкой задачей.
ЗАКЛЮЧЕНИЕ
Сравнение экспериментальных данных по превращению пропилена в углекислом газе и воздухе [1] позволило выявить особенности протекания процесса:
1. появление разряда в экспериментах с участием СО2 происходит при меньшем внешнем напряжении, а переносимый в импульсе заряд имеет большее значение в сравнении с теми же параметрами с воздухом;
2. энергозатраты на превращение пропилена близкие, но выше конверсия за проход;
3. общая селективность процесса в СО2 выше – образуется меньше продуктов реакции;
4. наблюдаются общие тренды в образовании кислородсодержащих продуктов с общей формулой С3НnО. Выход окиси пропилена и пропаналя зависит от количества атомов кислорода в реакционной смеси, а образование углеводородов С2‒С6, ацетона, спиртов связано с активацией молекулы пропилена в БР;
5. для образования метанола, акролеина, уксусной и пропионовой кислот необходимо наличие молекулярного кислорода в исходной смеси.
Список литературы
Рябов А.Ю., Кудряшов С.В., Очередько А.Н. // Химия высоких энергий. 2021. Т. 22. № 3. С. 237.
Самойлович В.Г., Гибалов В.И., Козлов К.В. Физическая химия барьерного разряда. М.: МГУ. 1989. 174 с.
Itikawa Y. // J. Phys. Chem. Ref. Data. 2002. V. 31. № 3. P. 749.
Kudryashov S., Ryabov A., Shchyogoleva G.S. // J. Phys. D: Appl. Phys. 2016. V. 49. P. 025205.
Ianni J.C. Kintecus V5.5. 2015. http://www.kintecus.com
Hagelaar G.J.M., Pitchford L.C. // Plasma Sources Sci. Technol. 2005. V. 14. № 4. P. 722.
Viehland database. http://www.lxcat.net
Janev R.K., Reiter D. // Phys. Plasmas. 2004. V. 11. P. 780.
Tsang W. // J. Phys. Chem. Ref. Data. 1991. V. 20. P. 221.
Ponduri S., Becker M.M., Welzel S. et al. // J. Appl. Phys. 2016. V. 119. 093301.
Cosby P.C. // J. Chern. Phys. 1993. V. 98. P. 9544.
Herron J.T. // J. Phys. Chem. Ref. Data. 1999. V. 28. P. 1453.
Kurylo M.J. // Chem. Phys. Lett. 1972. V. 14.
Tsang W. // J. Phys. Chem. Ref. Data. 1988. V. 17. P. 1.
Atkinson R., Baulch D.L., Cox R.A. et al. // J. Phys. Chem. Ref. Data. 1997. V. 26. P. 521.
Wallington T.J., Dagaut P., Kurylo M.J. // Chem. Ref. 1998. V. 92. P. 667.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


