Химия высоких энергий, 2023, T. 57, № 2, стр. 100-107
Фотопроцессы в комплексах “гость–хозяин” тиопроизводного стирилового красителя с кукурбитурилами
А. Д. Свирида a, Д. А. Иванов a, *, И. В. Крюков a, Н. Х. Петров a, Н. А. Александрова a, В. Г. Авакян a, С. П. Громов a, b
a Центр фотохимии РАН Федерального научно-исследовательского центра
“Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, 7А-1, Россия
b Химический факультет, Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, ГСП-1, Россия
* E-mail: ivanovd@photonics.ru
Поступила в редакцию 26.09.2022
После доработки 07.11.2022
Принята к публикации 10.11.2022
- EDN: NHPEJK
- DOI: 10.31857/S0023119323020146
Аннотация
Методами стационарной и времяразрешенной оптической спектроскопии были исследованы фотопроцессы в водных растворах стирилового красителя перхлорат 1-этил-4-{(E)-2-[4(метилтио)фенил]винил}пиридиния (1) и его комплексов с кукурбит[n]урилами (CB[n], n = 6–8). В 1 : 1 комплексах 1 и СВ[6] интенсивность флуоресценции увеличивается приблизительно в 3 раза; СВ[7] практически не влияет на интенсивность флуоресценции. В 2 : 1 комплексах с СВ[8] реакция фотоциклоприсоединения не идет, при этом сильное тушение флуоресценции ассоциируется с образованием нереакционноспособных димеров. Кинетика затухания флуоресценции 1 имеет два характерных времени 1.4 пс и ~130 пс и мало меняется в комплексах. При внутримолекулярном фотопереносе заряда в 1 его величина на порядок меньше, чем в хорошо известном красителе DASPI.
ВВЕДЕНИЕ
Кукурбит[n]урилы (CB[n]) являются полыми макроциклическими кавитандами, состоящими из n гликольурильных звеньев (обычно n = 5–8), связанных парами метиленовых групп [1]. Благодаря своей форме, тривиальное название эти молекулы получили от латинского слова “cucurbitus”, что в переводе означает “тыква” (см. рис. 1). В торцах молекул кукурбитурильного ряда, обрамляя входы (порталы) в полость, находятся атомы кислорода карбонильных групп, несущие частичный отрицательный заряд. Это способствует связыванию кукурбитурилов с относительно небольшими органическими катионами, в результате которого образуются комплексы включения типа “гость–хозяин”. Таким образом кукурбитурилы являются привлекательными соединениями для построения новых супрамолекулярных систем [2].
Инкапсулирование молекулы “гостя” в полость кукурбитурила приводит, как правило, к значительным изменениям фотофизических свойств “гостя” [3], в частности, к увеличению интенсивности флуоресценции. Так результаты, полученные Ли с сотрудниками в работе [4] показывают, что добавление CB[6] в водные растворы типичного стирилового красителя иодида 4-{(E)-2-[4-(диметиламино)фенил]винил}-1-метилпиридиния (DA-SPI), структура которого показана на рис. 1, приводит к увеличению интенсивности флуоресценции в 270 раз. Квантово-химические расчеты, результаты которых согласуются с данными ЯМР, показывают, что при образовании комплексов минимальная энергия комплекса включения достигается, когда в полости кукурбитурила находится только остаток пиридиния. Константа связывания комплексов состава 1 : 1, определенная методом флуоресцентного титрования, равна 105 л/моль. Увеличение интенсивности флуоресценции приписывается затруднению внутримолекулярных вращений катиона красителя при образовании комплекса и отчасти его ион-дипольным взаимодействиям с карбонильными группами CB[6].
Влияние размера полости кукурбитурила на фотофизические и фотохимические свойства супрамолекулярных комплексов изучалось в работе [5] для перхлората 4-[(E)-2-(3,4-диметоксифенил)винил]-1-этилпиридиния. Было показано, что чем меньше полость кавитанда CB[n], тем выше интенсивность флуоресценции комплекса. Эта закономерность согласуется с результатами изучения сверхбыстрой динамики затухания флуоресценции стириловых красителей [6], которые показали, что, чем больше полость кавитанда, тем короче время жизни флуоресценции комплекса.
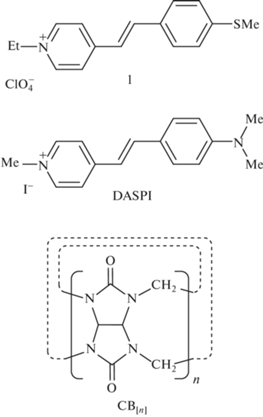
Ранее синтезированный нами краситель перхлорат 1-этил-4-{(E)-2-[4-(метилтио)фенил]винил}пиридиния (1) [7] является аналогом DASPI, отличие состоит в том, что вместо атома азота, входящего в стириловый фрагмент DASPI, 1 содержит атом серы (рис. 1). Он также является молекулярным катионом и по аналогии должен образовывать комплексы включения с кукурбитурилами, физикохимические свойства которых не были изучены. Цель этой работы детальное изучение фотопроцессов с участием комплексов 1 с CB[n] (n = 6–8).
МЕТОДИКА ЭКСПЕРИМЕНТА И РАСЧЕТОВ
Для приготовления растворов использовалась вода Millipore Simplicity. Кукурбитурилы, СВ[6], CB[7] и CB[8] (Sigma-Aldrich) использовались без дальнейшей очистки. Стириловый краситель перхлорат 1-этил-4-{(E)-2-[4(метилтио)фенил]винил}пиридиния (1) был синтезирован по методике, описанной ранее [7]. Структурные формулы используемых в работе веществ показаны на рис. 1.
Для определения параметров комплексообразования красителя 1 с CB[n], проводилось титрование красителя кукурбитурилами. При титровании с CB[7] и CB[8] концентрация красителя составляла 10–5 моль/л, с CB[6] – 5 × 10–6 моль/л. Концентрации CB[n] варьировались в пределах от 0 до 10– моль/л для CB[7] и CB[8] и до 2 × 10–5 моль/л для CB[6], в силу низкой растворимости последнего. Обозначим символом n отношение концентраций кукурбитурила и красителя в растворе, т.е. титрования проводились до значения n равного 4, 10 и 10 для комплексов с CB[6], CB[7] и CB[8] соответственно.
Приготовление растворов стирилового красителя 1 проводилось в затемненном помещении для того, чтобы избежать влияния на результаты измерений транс–цис-фотоизомеризации и процессов фотодеградации красителя. Стационарные оптические измерения проводились в пластиковых одноразовых кюветах с длиной оптического пути 1 см, производства Sigma-Aldrich. На каждую точку титрования готовился новый образец.
Спектры поглощения снимались на спектрофотометре “Shimadzu UVmini 1240”. Спектры флуоресценции измерялись на спектрофлуорометре “Fluorolog 3 Tau”. Флуоресценция возбуждалась на длине волны 410 нм в образцах с CB[6], на 400 нм с CB[7] и на 424 нм с CB[8]. Выбор длин волн возбуждения флуоресценции обусловлен изобестическими точками в спектрах поглощения 1 : 1 комплексов 1 с CB[6] и 1 с CB[7], а также некой равновесной точкой с общей для всех комплексов 1 c CB[8] оптической плотностью.
Для исследования сверхбыстрой кинетики флуоресценции использовался метод апконверсии на основе фемтосекундного лазера на кристалле хром-форстерита (длительность импульса – 90 фс, частота следования импульсов – 95 МГц, энергия в импульсе ~7.4 нДж, центральная длина волны 1250 нм) [8]. Возбуждение флуоресценции образцов проводилось на длине волны третьей гармоники – 417 нм в двухмиллиметровой проточной кювете. Экспериментальные данные описывались набором экспоненциальных функций при помощи программного обеспечения FluoFit (Picoquant) и Origin.
Равновесная геометрия 1 в основном S0 и возбужденном S1 состояниях рассчитана с помощью программного пакета ORCA 5.0.3 [9] методами DFT/B3LYP+D3 и TD DFT/B3LYP+D3, соответственно, в базисе def2-SVP/C [10, 11]. Для сравнения тем же методом рассчитан DASPI в S0 и S1 состояниях. Для равновесных геометрий 1 в основном S0 и возбужденном S1 состояниях проведено вычисление частот колебаний в гармоническом приближении, среди которых мнимых частот не обнаружено. Это свидетельствует о том, что все структуры находятся в минимуме энергии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спектры оптического поглощения и флуоресценции стирилового красителя 1 в присутствии кукурбит[6]урила представлены на рис. 2 (а, б) соответственно. Пик поглощения свободного 1 находится на длине волны 377 нм, а пик флуоресценции — на 545 нм. При добавлении CB[6] к раствору 1 максимум поглощения сдвигается на 5 нм в длинноволновую область, и наблюдается изобестическая точка на 410 нм. Полоса флуоресценции испытывает гипсохромный сдвиг на 40 нм и увеличение интенсивности в 3 раза. При этом изменение спектров перестает наблюдаться уже при n = 1, т.е. при эквимолярных концентрациях красителя 1 и CB[6].
Рис. 2.
Спектры поглощения и флуоресценции комплексов стирилового красителя 1 с кукурбит[n]урилами. а, б – 5 × × 10–6 моль/л кр. 1, 0–2 × 10–5 моль/л CB [6]; в, г – 10–5 моль/л кр. 1, 0–10–4 моль/л CB[7]; д, е – 10–5 моль/л кр. 1, 0–10–4 моль/л CB[8] (стрелки указывают увеличение концентрации кукурбитурилов).
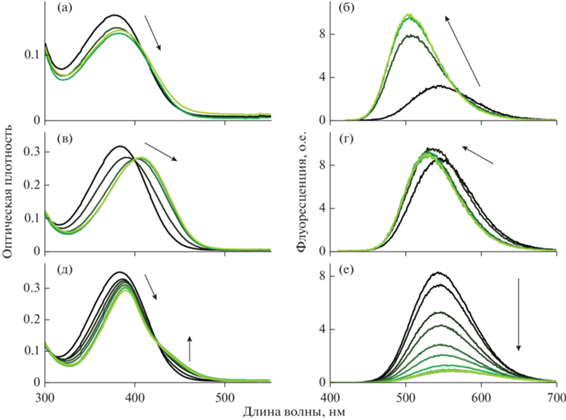
Рис. 2 (в, г) — спектры поглощения и флуоресценции 1 в присутствии CB[7] соответственно. В спектре поглощения наблюдается батохромный сдвиг на 20 нм при добавлении CB[7] к 1. Также наблюдается изобестическая точка на длине волны 400 нм. Интенсивность флуоресценции сначала незначительно растет, затем незначительно падает. Все изменения интенсивности находятся в пределах 10%. Максимум интенсивности флуоресценции сдвигается на 10 нм в коротковолновую область. После n = 4 изменения спектров не наблюдаются.
На рис. 2д приведены спектры поглощения 10‒5 моль/л раствора красителя 1 в присутствии CB[8] от 0 до 2.3 × 10–5 моль/л, т. е. до n = 2.3. При добавлении CB[8] максимум поглощения сдвигается в длинноволновую область до 390 нм. Его интенсивность при этом уменьшается на 17%. Следует отметить, что на длине волны 424 нм все спектры поглощения имеют практически равную интенсивность. Данная длина волны не является истинной изобестической точкой, т.к. в растворе присутствуют комплексы состава 1 : 1 и 2 : 1, что следует из наблюдения спектров флуоресценции. Однако, длина волны 424 нм является наиболее подходящей для возбуждения флуоресценции в образце, в силу одинаковой оптической плотности при любой концентрации CB[8].
Присутствие CB[8] в растворе 1 уменьшает интенсивность флуоресценции (рис. 2е). При добавлении CB[8] происходит гипсохромный сдвиг до 561 нм, и вместе с тем интенсивность флуоресценции резко падает. При дальнейшем добавлении кукурбитурила интенсивность флуоресценции остается практически на одном уровне.
Для комплексообразования 1 с CB[8] было проведено флуоресцентное титрование в широком диапазоне концентраций кукурбитурила. Спектры флуоресценции снимались при концентрации красителя 10–5 моль/л и концентрации CB [8] от 0 до 10–4 моль/л (т. е. наибольшее мольное отношение CB[8] к красителю было n = 10). На рис. 3 представлена кривая такого титрования, т.е. максимумы интенсивности флуоресценции образца в зависимости от отношения n концентраций CB[8] и красителя 1. Красными точками на рис. 3 отмечены экспериментальные максимумы флуоресценции. Данные приведены в относительных единицах, размерность которых соответствует концентрации. Для этого экспериментальные данные были нормированы на наибольшую интенсивность во всей серии титрования, т.е. на интенсивность свободного красителя. После чего нормированные безразмерные данные были умножены на коэффициент, равный концентрации свободного красителя, т.е. 10–5 моль/л.
Рис. 3.
Максимумы интенсивности флуоресценции комплексов красителя 1 с CB[8] от мольного отношения n кукурбитурила к красителю (красные точки). Интенсивность флуоресценции приведена к размерности концентрации. Концентрация красителя 10–5 моль/л. Синяя кривая – аппроксимация экспериментальных данных при помощи выбранной модели образования комплексов состава 2 : 1 (см. в тексте).
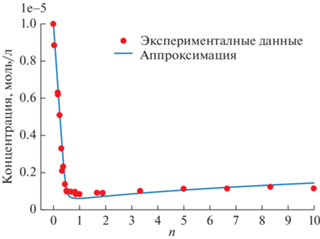
На рис. 3 видно, что достаточно добавить только 0.5 эквив. CB[8] к раствору красителя 1, чтобы флуоресценция снизилась почти в 10 раз. Такое поведение флуоресценции в комплексах с CB[8] является типичным для сходных по строению красителей стирилового ряда [12, 13] и связано с включением двух молекул красителя в полость кукурбит[8]урила (комплекс состава 2 : 1). Тесное расположение молекул красителя в полости кавитанда значительно увеличивает эффективность безызлучательной релаксации возбужденного состояния, что и способствует снижению интенсивности флуоресценции.
Характерной особенностью комплексообразования 1 с CB[8] является то, что после резкого падения интенсивности при n = 0.5 дальнейшее увеличение концентрации кукурбитурила в образце приводит к очень незначительному росту флуоресценции. Ранее мы наблюдали [13], что после достижения локального минимума в районе n = 0.5, интенсивность флуоресценции начинает расти, а к n = 10 достигает уровня сигнала свободного красителя или даже превосходит ее.
Принято считать, что флуоресценция комплексов 2 : 1 сильно потушена в результате так называемого концентрационного тушения. Таким образом, рост флуоресценции с ростом концентрации CB[8] должен свидетельствовать об образовании комплексов состава 1 : 1 в растворе, и, соответственно, об уменьшении числа комплексов 2 : 1. Равновесные концентрации комплексов различной стехиометрии определяются константами связывания. Проблема определения констант в данном случае состоит в том, что при добавлении CB[8] к раствору 1 спектры поглощения и флуоресценции мало изменяются. Тем не менее, при помощи метода, описанного далее, удается сделать оценку констант равновесия.
Будем считать, что в основном состоянии образуются только комплексы включения 1 : 1 и 2 : 1, и равновесие описывается следующей системой уравнений:
(1)
$\left\{ \begin{gathered} {{K}_{1}} = \frac{{AB}}{{A \times B}} \hfill \\ {{K}_{2}} = \frac{{{{A}_{2}}B}}{{A \times AB}} \hfill \\ {{B}_{0}} = B + AB + {{A}_{2}}B \hfill \\ {{A}_{0}} = A + AB + 2{{A}_{2}}B. \hfill \\ \end{gathered} \right.$Здесь A – концентрация свободного красителя 1, B – концентрация свободного CB[8], AB – концентрация комплекса 1 : 1, A2B – концентрация комплекса 2 : 1, K1 – константа связывания для комплекса 1 : 1, K2 – константа связывания для комплекса 2 : 1.
Таблица 1.
Относительные величины предэкспоненциальных множителей Ai и характерные времена затухания флуоресценции τi на длине волны 545 нм водных растворов красителя 1 и растворов красителя 1 в присутствии CB[6], CB[7] и CB[8]
| τ1, пс | A1, % | τ2, пс | A2, % | |
|---|---|---|---|---|
| 1 | 1.4 | 39 | 127 | 61 |
| 1 + CB[6] | 1.4 | 25 | 157 | 75 |
| 1 + CB[7] | 1.6 | 32 | 154 | 68 |
| 1 + CB[8] | 1.4 | 48 | 121 | 52 |
Третье и четвертое уравнение в системе (1) – это уравнения материального баланса, где A0 и B0 – начальные концентрации 1 и CB[8], соответственно, которые определяются условиями эксперимента, причем B0= nA0. Система уравнений (1) – система из четырех уравнений с четырьмя неизвестными и двумя параметрами K1 и K2, т.е. система имеет решение и можно найти величины A, AB и A2B как функции n и параметров K1 и K2. Для поиска численных решений системы (1) была написана программа на языке программирования Python.
В разбавленном растворе в предположении, что флуоресценция комплексов 2 : 1 стириловых красителей с CB[8] потушена полностью, а флуоресцируют только комплексы 1 : 1 и свободный краситель, интенсивность флуоресценция F определяется следующим уравнением:
Здесь I – интенсивность возбуждающего света; φ – квантовый выход, (который предполагается приблизительно одинаковым для свободного красителя и комплекса 1 : 1); ε – коэффициент экстинкции (флуоресценция возбуждалась в точку 424 нм, где коэффициенты экстинкции всех компонентов совпадают), l – длина оптического пути; A и AB – концентрации свободного красителя и его комплекса состава 1 : 1 соответственно.
Абсолютное значение коэффициента пропорциональности в формуле (2) не играет роли и его можно положить равным единице. С учетом этого, подставляя решение системы (1) в формулу (2), найдем функцию, которая описывает экспериментальную кривую флуоресцентного титрования:
В результате аппроксимации экспериментальных данных функцией (3) по методу наименьших квадратов, были определены значения констант связывания K1 = 2 × 105 и K2 = 5 × 107 л/моль. Ошибка определения составила около 30% для каждой константы, но поскольку значения K1 и K2 отличаются на два порядка, такую оценку можно считать удовлетворительной. Итак, можно видеть, что комплексы состава 1 : 1 в растворе красителя 1 с CB[8] почти не образуются, т.е. практически все молекулы 1 связаны попарно в комплексы включения 2 : 1.
Причиной тушения флуоресценции в комплексах включения состава 2 : 1 некоторых стириловых красителей с CB[8] может быть реакция [2 + 2] фотоциклоприсоединения, например, для производного стирилового красителя с двумя метоксигруппами в стириловом фрагменте [14, 15]. В комплексах 2 : 1 красителя 1 с CB[8] не наблюдается признаков реакции [2 + 2] фотоциклоприсоединения. При этом в твердой фазе такая реакция протекает достаточно эффективно [7].
Таким образом, более вероятной причиной концентрационного тушения является образование молекулами 1 димеров, о чем косвенно свидетельствует появление плеча в спектрах поглощения в области 450 нм при добавлении CB[8]. Димеры красителей при определенных условиях возникают в водных растворах красителей различных классов и могут быть эффективным каналом безызлучательной релаксации [16, 17].
Кинетика затухания флуоресценции в пикосекундном диапазоне, измеренная методом апконверсии, удовлетворительно описывается суммой двух экспонент
(4)
$F = \mathop \sum \limits_{i = 1}^2 {{A}_{i}}{\kern 1pt} {\text{exp}}\left( { - \frac{t}{{{{\tau }_{i}}}}} \right),$где τi – время затухания флуоресценции, Ai – амплитуда i-й компоненты. Результаты подгонки с помощью этой функции представлены в табл. 1 .
Для свободного красителя 1 и всех его комплексов с кукурбитурилами наблюдается характерное время τ1 порядка 1.4 пс (см. табл. 1 ), связанное с перестройкой сольватной (гидратной) оболочки в возбужденном состоянии. Перестройка, фактически поворот диполей молекулы воды из ближайшего окружения катиона красителя, вызвана перераспределением электронной плотности красителя при фотовозбуждении и происходит в таком временном диапазоне для всех стириловых красителей и их комплексов с CB[n], исследованных ранее [18].
Второе время определяется процессами безызлучательной релаксации возбужденного состояния. Для свободного красителя время τ2 составляет 127 пс, и оно заметно меньше аналогичных времен (157 и 154 пс) для 1 : 1 комплексов 1 и CB[6] и 1 : 1 комплексов 1 и CB[7] соответственно. Как упоминалось ранее, внутримолекулярное вращение красителя в полости кукурбитурила затруднено, что снижает эффективность одного из каналов безызлучательной потери энергии возбуждения. В растворах свободного красителя и красителя в присутствии CB[8], напротив, времена τ2 практически совпадают. Учитывая концентрации 1 и CB[8] в образце, а также найденные выше константы комплексообразования K1 и K2, можно утверждать, что около 95% всех молекул красителя находятся в комплексах состава 2 : 1. При этом флуоресценция в комплексах 2 : 1 тушится весьма эффективно так, что она, по-видимому, пренебрежимо мала на фоне флуоресценции свободного красителя и комплексов состава 1 : 1. Комплексы состава 1 : 1 с CB[8] мало отличаются от свободного красителя в отношении флуоресценции, так как полость CB[8] слишком велика для того, чтобы существенно препятствовать внутримолекулярным движениям красителя 1. Таким образом, данные полученные методами пикосекундой флуоресцентной спектроскопии подтверждают описанную выше модель фотопроцессов с участием красителя 1.
Квантово-химические расчеты показывают, что в основном состоянии скелет катиона плоский за исключением Ме-S и N-Et группировок (рис. 4).
Рис. 4.
Длины связей и диэдральные углы χ (С7–С6–С9–С10) 1 в основном S0 (а) и возбужденном S1 (б) состояниях. (а) χ = 0°. (б) χ = 90.3°. Пунктирная стрелка показывает связь, вокруг которой осуществляется внутренне вращение, а обычная стрелка показывает направление внутримолекулярного переноса положительного заряда.
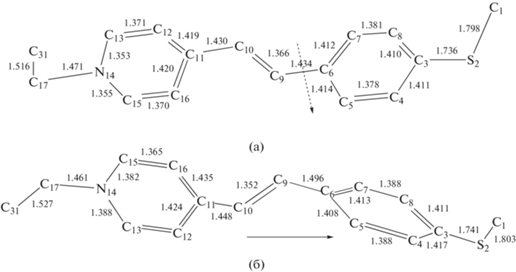
При фотовозбуждении 1 как и большинство подобных красителей (включая DASPI), в соответствии с принципом Франка–Кондона, переходят в состояние локального возбуждения LE, в котором геометрия молекулы сохраняет плоскую конформацию (рис. 4а). Затем следует конформационный переход с поворотом вокруг диэдрического угла χ (С7–С6–С9–С10) на 90°, сопровождаемый внутримолекулярным переносом заряда и образованием, так называемого TICT состояния, которое, согласно расчету, по энергии расположено на 0.3 эВ ниже LE состояния (рис. 4б). На рис. 2 это проявляется в наличии большого стоксового сдвига между полосами поглощения и флуоресценции.
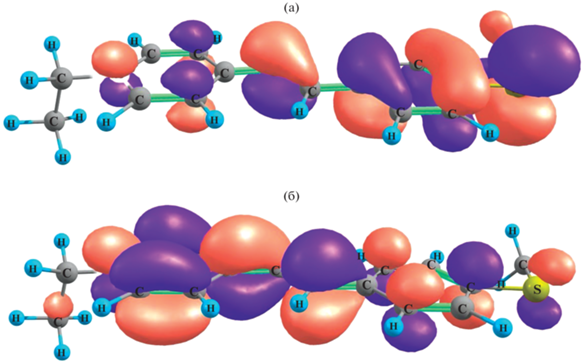
Расчет показывает, что электронный переход S0 → S1 осуществляется за счет переноса электрона с верхней занятой МО (HOMO) на нижнюю вакантную орбиталь (LUMO), структура которых показана на рис. 5.
Из рис. 5 следует, что электронная плотность на HOMO в основном сосредоточена на метилтиофенильном (МТФ)-остатке, тогда как электронная плотность на LUMO – на винилэтилпиридиниевом (ВЭП)-остатке, т.е. в качестве электронодонорной группы выступает тиофенильный остаток с неподеленными парами электронами на атоме серы. В этом отношении 1 и DASPI являются аналогами.
Краситель 1 является однозарядным катионом с суммарным зарядом +1, при этом в состоянии S0 МТФ-остаток имеет заряд q = 0.361${{\bar {e}}}$, а ВЭП-остаток – q = 0.639${{\bar {e}}}$. В состоянии S1q МТФ = 0.306${{\bar {e}}}$, а qВЭП = 0.694${{\bar {e}}}$ (здесь и далее ē – заряд электрона). Сравнивая заряды на указанных остатках в 1, видим, что внутримолекулярный перенос заряда при переходе из основного состояния S0 в возбужденное S1 составляет Δq = 0.055ē. При этом МТФ-остаток в TICT состоянии становится более электроотрицательным (снижается положительный заряд), тогда как ВЭП-остаток – более электроположительным. Направление переноса (от ВЭП – к МТФ-остатку) показано стрелкой на рис. 4б.
Аналогичный расчет для DASPI дает совершенно иную картину по направлению и величине переноса заряда при переходе красителя в TICT состояние. DASPI также является однозарядным катионом и его можно разделить на два остатка, диметиланилиновый (ДМА) и винилметилпиридиниевый (ВМП). В основном состоянии первый имеет заряд qДМА = 0.38${{\bar {e}}}$, второй – qВМП = 0.62${{\bar {e}}}$. В TICT состоянии qДМА = 0.837 ē, а qВМП = 0.163${{\bar {e}}}$.
Таким образом, величина переноса составляет Δq = 0.457${{\bar {e}}}$, что почти на порядок больше, чем в 1, и направление переноса ДМА → ВМП – обратное по сравнению с 1. Предположительно это объясняется разными электронными донорно-акцепторными свойствами диметиламиногруппы по сравнению с метилтиогруппой, причем первая является более сильным донором электронов по сравнению со второй.
Мы рассчитываем, что пролить дополнительный свет на механизмы фотопроцессов с участием тиопроизводного стирилового красителя позволят данные по структуре, энергетике, и распределению заряда в комплексах 1 с кукурбитурилами, расчеты которых планируется представить в последующих публикациях.
ЗАКЛЮЧЕНИЕ
Образование комплексов тиопроизводного стирилового красителя 1 типа “гость–хозяин” с кукурбитурилом CB[6] состава 1 : 1 приводит к трехкратному возрастанию интенсивности флуоресценции тиопроизводного стирилового красителя 1, тогда как присутствие CB[7], имеющего больший объем полости, практически не влияет на флуоресценцию. В случае CB[8] в комплексах состава 2 : 1 наблюдается сильное тушение флуоресценции, при этом не обнаружено признаков реакции [2 + 2] фотоциклоприсодинения красителя 1, обуславливающей тушение флуоресценции у других подобных красителей. Другими словами, эти комплексы являются нереакционноспособными димерами. Методом флуоресцентного титрования определены последовательные константы связывания комплексов состава 2 : 1 K1 = 2 × 105 и K2 = 5 × 107 л/моль.
Затухание флуоресценции во всех случаях удовлетворительно описывается суммой двух экспонент: в водном растворе свободного 1 характерное время τ1 составляет 1.4 пс, тогда как в присутствии CB[6] и CB[7] τ2 ∼ 130 пс. Первое время ассоциируется с формированием сольватной оболочки и практически не изменяется, а второе – незначительно увеличивается.
При фотовозбуждении 1 внутримолекулярный фотоперенос заряда составляет Δq = 0.055${{\bar {e}}}$, что почти на порядок величины меньше, чем в хорошо известном красителе DASPI.
Список литературы
Lee J.W., Samal S., Selvapalam N., Kim H.-J., Kim K. // Acc. Chem. Res. 2003. V. 36. P. 621.
Masson E., Ling X., Joseph R., Kyeremeh-Mensah L., Lu X. // RSC Advances. 2012. V. 2. P. 1213.
Dsouza R.N., Pischel U., Nau W.M. // Chem. Rev. 2011. V. 111. P. 7941.
Li Z., Sun S., Liu F., Pang Y., Fan J., Song F., Peng X. // Dyes and Pigments. 2012. V. 93. № 1–3. P. 1401.
Свирида А.Д., Иванов Д.А., Петров Н.Х., Ведерников А.В., Громов С.П., Алфимов М.В. // Химия высоких энергий. 2016. Т. 50. № 1. С. 23.
Petrov N.Kh., Ivanov D.A., Alfimov M.V. // ACS Omega. 2019. V. 4. P. 11500.
Ведерников А.И., Кузьмина Л.Г., Сазонов С.К., Лобова Н.А., Логинов П.С., Чураков А.В., Стреленко Ю.А., Ховард Дж.А.К., Алфимов М.В., Громов С.П. // Изв. АН, Сер. хим. 2007. № 9. С. 1797.
Шандаров Ю.А., Крюков И.В., Иванов Д.А., Иванов А.А., Петров Н.Х., Алфимов М.В. // Приборы и техника эксперимента. 2018. Т. 4. С. 90.
Neese F. // WIREs Computational Molecular Science, 2022, n/a, e1606.
Becke A.D. // The Journal of Chemical Physics. 1993. V. 98. P. 5648.
Grimme S., Ehrlich S., Goerigk L. // Journal of Computational Chemistry. 2011. V. 32. P. 1456.
Иванов Д.А., Петров Н.Х., Алфимов М.В., Ведерников А.И., Громов С.П. // Химия высоких энергий. 2014. Т. 48. № 4. С. 295.
Свирида А.Д., Иванов Д.А., Крюков И.В., Шандаров Ю.А., Петров Н.Х., Алфимов М.В., Александрова Н.А., Сазонов С.К., Ведерников А.И., Громов С.П. // Химия высоких энергий. 2019. Т. 53. № 3. С. 199.
Иванов Д.А., Свирида А.Д., Петров Н.Х. // Химия высоких энергий. 2022. Т. 56. № 3. С. 171.
Ушаков Е.Н., Громов С.П. // Усп. хим. 2015. Т. 84. № 8. С. 787.
Enoki M., Katoh R. // Photochem. Photobiol. Sci. 2018. 17. P. 793.
Чибисов А.К., Алфимов М.В., Захарова Г.В., Авакян В.Г., Федотова Т.В., Гутров В.Н. // Известия Академии наук. Серия химическая. 2022. № 2. С. 199.
Petrov N.K., Ivanov D.A., Kryukov I.V., Svirida A.D., Shandarov Y.A., Alfimov M.V. // J. Fluoresc. 2018. № 28. P. 883.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий