Физикохимия поверхности и защита материалов, 2019, T. 55, № 1, стр. 11-17
Адсорбция метана в металлорганической каркасной структуре MOF Al-BTC
М. К. Князева 1, *, А. Ю. Цивадзе 1, О. В. Соловцова 1, А. А. Фомкин 1, А. А. Прибылов 1, А. В. Школин 1, А. Л. Пулин 1, И. Е. Меньщиков 1
1 ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, стр. 4, Россия
* E-mail: batrakovamk@mail.ru
Поступила в редакцию 20.06.2018
После доработки 09.07.2018
Принята к публикации 25.07.2018
Аннотация
На синтезированном металлорганическом каркасе MOF Al-BTC с удельной площадью поверхности SБЭТ = 1422 м2/г, исследована адсорбция природного газа метана при давлениях до 40 МПа и температурах 303, 313, 323, 333 K. Максимальная адсорбция метана при температуре 303 K и давлении 40 МПа на Al-BTC достигает 10.36 ммоль/г; начальная теплота адсорбции ~14 кДж/моль. В наиболее востребованной области давлений аккумулирования метана 3.5–10.0 МПа, количество аккумулированного метана в системе с Al-BTC достигает 120–130 м3(н. т. д.)/м3. Количество метана, запасаемого в системе с адсорбентом Al-BTC и без адсорбента при 3.5 МПа различается примерно в 2 раза; при 7.0 и 20.0 МПа различие практически отсутствует; при 40 МПа емкость без адсорбента содержит газа больше чем с адсорбентом: для Al-BTC на 25%. Для адсорбционного аккумулирования метана на MOF-структуре Al-BTC наиболее эффективен интервал давлений 3.5–6 МПа. Абсолютная эффективность адсорбционного аккумулирования метана растет с понижением температуры.
ВВЕДЕНИЕ
Общемировое уменьшение природных запасов нефти и нарастание отрицательного воздействия на природу применения тяжелых углеводородных топлив в энергетических установках обуславливает тенденции разработки и применения новых видов энергоносителей. Природный газ метан по энергоемкости, экологичности продуктов сгорания, а также широкой распространенности, является конкурентным видом топлива, способным занять ведущую позицию среди источников энергии в ближайшем будущем [1].
Основной проблемой при использовании природного газа в различных энергетических установках является разработка систем его хранения в концентрированном состоянии. Традиционные способы хранения и транспортировки природного газа в компримированном виде (КПГ) или сжиженном виде (СПГ) отличаются высокой пожаро-, взрывоопасностью, необходимостью использования специализированного энергозатратного оборудовании [2]. Как альтернативные способы хранения природного газа разрабатываются газогидратный [3, 4] и метод растворения в различных углеводородных средах [5]. Газогидратный способ существенно ограничен по температурному интервалу (0–40°С) и не приемлем для общепромышленного требованиям. При его использовании возникают трудности создания специальных термобарических условий образования и использования газогидратов. Метод растворения метана – технически трудно реализуемый и высокозатратный метод, требующий дополнительной очистки метана от паров растворителя.
Наиболее перспективным среди альтернативных способов хранения и транспортировки природного газа может быть адсорбционный (АПГ). Метод АПГ позволяет, при использовании специальных микропористых адсорбентов, существенно увеличить плотность метана, вплоть до плотности близкой к плотности жидкости. Такое состояние адсорбированного газа в микропорах является следствием наложения потенциальных полей противоположных стенок микропор твердого тела при их размерах до 3.0–3.2 нм, соизмеримых с размерами сорбируемых молекул [6]. В микропорах адсорбированный метан находится в особом, нанодиспергированном состоянии (НДС). Высокие энергии взаимодействия “адсорбент–метан” и “метан–метан” в микропорах приводят, в результате к уменьшению давлений заправки при хранения метана, также улучшаются показатели энергоэффективности, пожаро- и взрывобезопасности систем хранения АПГ. Свойства адсорбента, таким образом, определяют эффективность АПГ-технологии. Отсутствие у молекул метана – основного компонента природного газа, дипольного и квадрупольного моментов, уменьшает энергию адсорбционного взаимодействия. Поэтому важную роль играют структурно-энергетические свойства адсорбента. Наряду с микропористыми углеродными адсорбентами для аккумулирования природного газа метана в последнее десятилетие перспективными рассматриваются пористые металлоорганические каркасные структуры (MOF-структуры; MOF – Metal Organic Frameworks) [7]. MOF-структуры часто включает в себя катионы металлов Cu2+, Zn2+, Со2+, Ni2+, Mn2+, Al3+, Fe3+, Mo3+, Cr3+, а также лантаноиды [8, 9] или металлсодержащие кластеры, связанные полиорганическими лигандами (линкерами). Образуются пространственные 3d-сети с порами разных размеров и форм. Органические линкеры, как правило, ди-, три- или тетрадентатные лиганды, представляют собой органические карбоновые кислоты или гетероциклы. Измеренная поверхность по методу БЭТ может достигать нескольких тысяч м2/г. MOF-структуры характеризуются набором уникальных физических и химических свойств, которые не наблюдаются у других пористых неорганических материалов, таких как, активированные угли и цеолиты. К этим свойствам относятся высокая пористость и удельная поверхность, регулярная кристаллическая структура, узкое распределение пор по размерам и форме, наличие катионов на поверхности пор, высокая энергетическая гетерогенность [10]. Эти свойства и определили широкий интерес к MOF-структурам, как к перспективным аккумуляторам метана. В [11] описаны структурно-энергетические свойства синтезированной новой MOF-структуры Al-BTC с высокой удельной поверхностью 1422 м2/г, которая по оценкам [12] может быть перспективной для аккумулирования природного газа метана. В связи с этим представлялось важным и актуальным исследовать адсорбцию метана на таком адсорбенте.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Адсорбент
Металл-органическая каркасная пористая структура MOF Al-BTC синтезирована на основе тримезиновой кислоты (1,3,5 – бензолтрикарбоновая кислота (Н3ВТС)), кристаллогидрата нитрата алюминия Al(NO3)3 · 9H2O и растворителя N,N-диметилформамида [11]. Структурно-энергетические характеристики синтезированной высокоактивной металлорганической каркасной структуры Al-BTC представлены в табл. 1.
Таблица 1.
Структурно-энергетические характеристики адсорбента Al-BTC
| Характеристика, размерность | Значение |
|---|---|
| Удельная площадь поверхности, SБЭТ, м2/г | 1422 |
| Удельный объeм микропор, W0, см3/г | 0.59 |
| Эффективный радиус микропор по Дубинину, х0, нм | 0.82 |
| Предельная величина адсорбции в микропорах , а0, ммоль/г | 17.00 |
| Характеристическая энергия адсорбции азота, Е, кДж/моль | 4.83 |
| Характеристическая энергия адсорбции бензола, Е0, кДж/моль | 14.6 |
| Суммарный объем пор, Ws, см3/г | 1.17 |
| Объем мезопор, Wme, см3/г | 0.58 |
| Поверхность мезопор, Sme, м2/г | 436 |
Наличие значительного объема микропор W0 = 0.59 см3/г, при величине удельной поверхности SБЭТ = 1422 м2/г и высокой стандартной характеристической энергии адсорбции Е0 = = 14.6 кДж/моль, создает хорошие перспективы использования Al-BTC для адсорбционного аккумулирования метана. Благоприятным фактором для увеличения скорости адсорбции-десорбции в таких системах является большой объем мезопор с диаметрами ~5.0 нм.
Адсорбат
Метан (CH4) по данным [13] обладает следующими физико-химическими свойствами: молекулярная масса: µ = 16.0426 г/моль; нормальная температура кипения Tb = 111.66 K; критическая температура Tс = 190.77 K; критическое давление Pс = 4.626 МПа.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Изотермы адсорбции
Адсорбцию метана на MOF-структуре Al-BTC измеряли объемно-весовым методом на оригинальной установке ИФХЭ РАН [14] при температурах 303, 313, 323, 333 K и давлениях от 0.1 до 40 МПа. Погрешности измерений по давлению и температуре составили ±0.015 МПа и ±0.3 K соответственно, по адсорбции ±4 × 10–4 г. В экспериментах определяли избыточную адсорбцию
(1)
$\Gamma = \frac{{\left( {V - {{V}_{a}}} \right)\rho \left( {p,T} \right)}}{{{{m}_{{\text{0}}}}}},$Абсолютную адсорбцию, как полное содержание вещества в микропорах определяли по (2):
где a – адсорбция полного содержания при заданных давлении и температуре, [ммоль/г]; Г – избыточная адсорбция, [ммоль/г]; W0 – удельный объем микропор адсорбента, [см3/г]; ρ(р, Т) – плотность газовой фазы при заданных давлении и температуре, [ммоль/см3]. Зависимости адсорбции полного содержания метана на MOF-структуре Al-BTC от давления при температурах 303, 313, 323 и 333 K представлены на рис. 1 в координатах а = f(lnP).Рис. 1.
Изотермы полного содержания адсорбции СН4 на MOF-структурe Al-BTC при температурах, K: 1 – 303, 2 – 313, 3 – 323, 4 – 333.
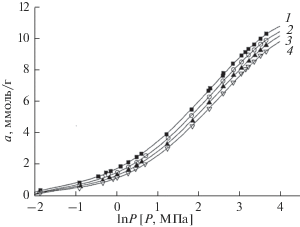
Из рис. 1 следует, что адсорбция метана во всем интервале измеренных давлений растет вплоть до давлений 40 МПа. Максимальная адсорбция метана 10.36 ммоль/г достигается при температуре 303 K. В табл. 2 представлены величины адсорбции метана при 303 K и характерных давлениях, используемых для сравнения в литературе, для оценки эффективности адсорбционного аккумулирования метана [12, 15]. Здесь же, для сравнения, представлены данные по адсорбции метана на MOF-структуре А520 фирмы БАСФ, близкой по составу к MOF-структуре Al-BTC [16].
Таблица 2.
Зависимость адсорбции метана (ммоль/г) от давления при 303 K на MOF-структуре Al-BTC и А520 (БАСФ)
| Адсорбент | Адсорбция метана, ммоль/г | SБЭТ, м2/г | W0, см3/г | |||
|---|---|---|---|---|---|---|
| давление, МПа | 3.5 | 7.0 | 20 | 40 | ||
| Al-BTC | 4.3 | 6.5 | 8.7 | 10.4 | 1422 | 0.59 |
| A520 | 4.5 | 6.1 | 7.2 | 7.6 | 1033 | 0.49 |
Из табл. 2 следует, что величины адсорбции на обеих MOF-структурах близки вплоть до 20 МПа. Заметные различия наблюдаются лишь при 40 МПа вероятно из-за более высокого объема микропор у Al-BTC.
ДИФФЕРЕНЦИАЛЬНАЯ МОЛЬНАЯ ИЗОСТЕРИЧЕСКАЯ ТЕПЛОТА АДСОРБЦИИ
Энергетика адсорбции отражает межмолекулярные взаимодействия между молекулами адсорбата и поверхностью твердого тела, а также взаимодействия между адсорбированными молекулами. По определению [17, 18] дифференциальная мольная изостерическая теплота адсорбции (qst) является разностью между мольной энтальпией равновесного газа hg и дифференциальной мольной изостерической энтальпией системы “адсорбент–адсорбат” (∂H1/∂a)T
(3)
${{q}_{{st}}} = {{h}_{g}}--{{\left( {{{\partial {{H}_{1}}} \mathord{\left/ {\vphantom {{\partial {{H}_{1}}} {\partial a}}} \right. \kern-0em} {\partial a}}} \right)}_{T}}.$С учетом неидеальности газовой фазы и инертности адсорбента, теплота адсорбции qst, вычисляется по (4):
(4)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial \left( {\ln p} \right)}}{{\partial \left( {{1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T}} \right)}}} \right)}_{a}}\left( {1 - {{{{{\left( {\frac{{\partial \nu (a)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{{{{\left( {\frac{{\partial \nu (a)}}{{\partial a}}} \right)}}_{T}}} {{{\nu }_{g}}}}} \right. \kern-0em} {{{\nu }_{g}}}}} \right) - \\ - \,\,{{\left( {\frac{{\partial p}}{{\partial a}}} \right)}_{T}}\left( {{{\nu }_{0}} - T{{{\left( {\frac{{\partial \nu (a)}}{{\partial T}}} \right)}}_{a}}} \right), \\ \end{gathered} $Из (3) следует, что теплота адсорбции зависит не только от наклона изостеры адсорбции (∂lnp/∂(1/T))a, но и от неидеальности газовой фазы z, деформации системы – адсорбционной (∂ν(a)/∂a)T и термической (∂ν(a)/∂T)a, крутизны наклона изотермы (∂p/∂a)T. Считая адсорбционную деформацию адсорбентов пренебрежимо малой, получаем окончательное уравнение для расчета дифференциальной мольной изостерической теплоты адсорбции:
(5)
${{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln p)}}{{\partial \left( {{1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T}} \right)}}} \right)}_{a}} - {{\left( {\frac{{\partial p}}{{\partial a}}} \right)}_{T}}{{\nu }_{0}}.$Для расчета теплоты адсорбции по экспериментальным данным построили изостеры адсорбции в координатах lnP–1/Т при a = const. Они в хорошем приближении оказались линейными. На основании (4) рассчитали дифференциальные мольные изостерические теплоты адсорбции метана на MOF – структуре Al-BTC при температурах 303, 313, 323, 333 K. Полученные зависимости в координатах qst = f(a)Т представлены на рис. 2.
Рис. 2.
Дифференциальные теплоты адсорбции СН4 на MOF-структуре Al-BTC при температурах, K: 1 – 303, 2 – 313, 3 – 323, 4 – 333.

Как следует из рис. 2, изостерические теплоты адсорбции метана на MOF-структуре Al-BTC в зависимости от величины адсорбции падают с ростом адсорбции. Аналогично ведут себя и теплоты адсорбции метана на MOF-структуре А520 (БАСФ) [16]. Падение изостерической теплоты адсорбции метана на MOF-структуре Al-BTC обусловлено энергетической гетерогенностью этого адсорбента. Начальная теплота адсорбции метана на Al-BTC – 14 кДж/моль заметно ниже по сравнению с А520 (22 кДж/моль), что и определяет более высокую адсорбцию метана на А520 при 3.5 МПа (табл. 2). С ростом давления и температуры на теплоту адсорбции сильное влияние начинают оказывать сжимаемость неидеальной газовой фазы z(P,T) и производная (∂p/∂a)T, растущая с ростом давления и уменьшения крутизны изотермы адсорбции. Веер кривых дифференциальной мольной изостерической теплоты адсорбции от величины адсорбции метана отражает действие всех этих факторов.
УДЕЛЬНАЯ ОБЪЕМНАЯ ЕМКОСТЬ АККУМУЛИРОВАНИЯ МЕТАНА
Удельная объемная емкость адсорбционной системы хранения складывается из объема газа находящегося в микропорах адсорбента и газовом состоянии в мезопорах и в межзерновом пространстве адсорбента.
Эффективность адсорбционного аккумулирования газа определяется количеством аккумулированного газа в системе с адсорбентом Vуд при определенных Р и Т в кубическом метре системы хранения [м3(н. т. д)/м3]11. На рис. 3 представлены зависимости удельных объемных емкостей аккумулирования метана на MOF-структуре Al-BTC от давления при температурах 303, 313, 323, 333 K.
Рис. 3.
Удельная объемная емкость аккумулирования метана в системе хранения от давления при температурах, K: 1 – 303, 2 – 313, 3 – 323, 4 – 333.

Как следует из рис. 3 удельная объемная емкость аккумулирования метана на MOF-структуре Al-BTC при температурах 303, 313, 323, 333 K и давлении 40 МПа составляет 250–270 м3(н. т. д)/м3. В табл. 3 представлены величины удельных объемных емкостей адсорбционного аккумулирования метана на MOF-структуре Al-BTC и А520 (БАСФ) при 303 K и характерных давлениях, используемых для сравнения в литературе [15, 16].
Таблица 3.
Зависимость удельной объемной емкости аккумулирования метана (м3(нтд)/м3) от давления при 303 K на MOF-структурах Al-BTC и А520(БАСФ)
| Адсорбент | Удельная объемная емкость аккумулирования метана, м3(нтд)/м3 | Насыпная плотность, d, г/см3 | |||
|---|---|---|---|---|---|
| Давление, Р, МПа | 3.5 | 7.0 | 20 | 40 | |
| Al-BTC | 65 | 80 | 205 | 270 | 0.436 |
| A520 | 55 | 72 | 210 | 325 | 0.201 |
| Без адсорбента | 36 | 74 | 210 | 350 | |
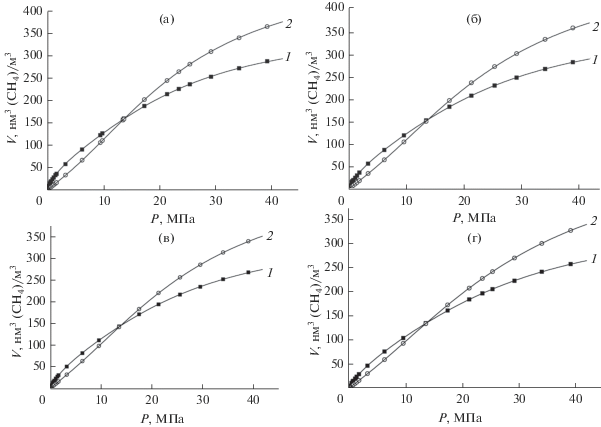
Из табл. 3 следует, что удельная объемная емкость аккумулирования метана у MOF-структур Al-BTC и A520 примерно одинакова при давлениях до 20 МПа. Количество метана, запасаемого в системе с адсорбентом Al-BTC и без адсорбента при 3.5 МПа различается примерно в 2 раза; при 7.0 и 20.0 МПа различие практически отсутствует; при 40 МПа емкость без адсорбента содержит газа больше чем с адсорбентом: для Al-BTC ~25%, для A520 – 7%. Увеличение насыпные плотности адсорбентов d за счет технологических приемов, может существенно увеличить удельную объемную емкость аккумулирования метана. На рис. 4а,б,в,г представлены зависимости удельных объемных емкостей аккумулирования метана на MOF-структуре Al-BTC и в емкости без адсорбента при давлениях до 40 МПа и температурах 303, 313, 323, 333 K.
Как следует из рис. 4а, б, в, г заполнение адсорбентом MOF-структурой Al-BTC приводит к увеличению количества аккумулируемого метана в системе хранения при давлениях до ~13–15 МПа. При более высоких давлениях изотермы адсорбции стремятся к насыщению и адсорбционная активность адсорбента не компенсирует эффект вытеснения газа из-за его присутствия.
Из рис. 4 следует, что в наиболее востребованной области давлений аккумулирования метана 3.5–10 МПа, количество аккумулированного метана в системе с Al-BTC может достигать 120–130 м3(н.т.д.)/м3, что создает возможности достижения значений 150 м3(н.т.д.)/м3, установленных требованиями [19].
Рис. 4.
(а) Удельная объемная емкость аккумулирования метана в системе хранения от давления при температуре 303 K: 1 – с MOF-структурой Al-BTC; 2 – без адсорбента, (б) удельная объемная емкость аккумулирования метана в системе хранения от давления при температуре 313 K: 1 – с MOF-структурой Al-BTC; 2 – без адсорбента, (в) удельная объемная емкость аккумулирования метана в системе хранения от давления при температуре 323 K: 1 – с MOF-структурой Al-BTC; 2 – без адсорбента, (г) удельная объемная емкость аккумулирования метана в системе хранения от давления при температуре 333 K: 1 – с MOF-структурой Al-BTC; 2 – без адсорбента.
АБСОЛЮТНАЯ АДСОРБЦИОННАЯ ЭФФЕКТИВНОСТЬ АДСОРБЦИОННОГО АККУМУЛИРОВАНИЯ ГАЗА
Абсолютная эффективность адсорбционного аккумулирования газа определяется как разность между удельной объемной емкостью в системе хранения с адсорбентом Vad (Al-BTC) и без адсорбента Vgas. На рис. 5 эта разность представлена в зависимости от давления.
Рис. 5.
Абсолютная адсорбционная эффективность адсорбционного аккумулирования метана на MOF-структуре Al-BTC при температурах, K: 1 – 303, 2 – 313, 3 – 323, 4 – 333.

Как следует из рис. 5 абсолютная адсорбционная эффективность адсорбционного аккумулирования метана в зависимости от давления проходит через максимум ~5 МПа. Для адсорбционного аккумулирования метана на MOF-структуре Al-BTC наиболее эффективен интервал давлений 3.5–6 МПа. Абсолютная эффективность адсорбционного аккумулирования метана растет с понижением температуры. Аналогичные выводы были сделаны также в результате исследования адсорбции метана на углеродных микропористых адсорбентах [20].
В заключение следует отметить, что максимальная адсорбция метана при температуре 303 K и давлении 40 МПа на синтезированной MOF-структуре Al-BTC достигает 10.36 ммоль/г. Начальная теплота адсорбции метана на Al-BTC ~14 кДж/моль. В наиболее востребованной области давлений аккумулирования метана 3.5–10.0 МПа, количество аккумулированного метана в системе с Al-BTC может достигать 120–130 м3(н.т.д.)/м3. Количество метана, запасаемого в системе с адсорбентом Al-BTC и без адсорбента при 3.5 МПа различается примерно в 2 раза; при 7.0 и 20.0 МПа различие практически отсутствует; при 40 МПа емкость без адсорбента содержит газа больше чем с адсорбентом: при использовании Al-BTC ~25%; при использовании A520 (БАСФ) – 7%. Для адсорбционного аккумулирования метана на MOF-структуре Al-BTC наиболее эффективен интервал давлений 3.5–6 МПа. Абсолютная эффективность адсорбционного аккумулирования метана растет с понижением температуры.
Список литературы
Solar C., Blanco A.G., Vallone A., Sapag K. // Natural Gas. 2010. P. 205–244. ISBN 978-953-307-112-1.
Васильев Ю.Н., Гриценко А.И., Чириков К.Ю. Газозаправка транспорта. М.: “Недра”, 1995. 435 с.
Yevi G.Y., Rogers R.E. // J. Energy Resour. Technol. 1996. V. 118. P. 209–213.
Koh C.A. Towards a fundamental understanding of natural gas hydrates // The Royal Society of Chemistry, 2002.
Wang L., Gardeler H., Gmehling J. // Sep. Purif. Technol. 1997. V. 12. P. 35–41.
Dubinin M.M. // Progress Surface Membrane Sci., 1975. V. 9. P. 1–70
Furukawa H., Cordova K.E., O’Keeffe M., Yaghi O.M. // Science. 2013. V. 341. P. 974.
Macgillivray L.R. Metal-organic frameworks: design and application. – John Wiley & Sons, 2010.
Zhang Y., Fang D., Liu R., Zhao S., Xiao X., Wang C., Cao Y., Xu W. // Dyes and Pigments. 2016. V. 130. P. 129.
Corma A., Garcıá H., Llabrés i Xamena F.X. // Chem. Rev. 2010. V. 110. P. 4606–4655.
Батракова М.К., Соловцова О.В., Фомкин А.А., Цивадзе А.Ю., Школин А.В., Ширяев А.А., Высоцкий В.В. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 6. С. 563–568.
Аксютин О.Е., Ишков А.Г., Романов К.В., Тетеревлев Р.В., Фомкин А.А., Школин А.В., Прибылов А.А., Меньщиков И.Е., Мюллер У., Арнольд Л., Пионтек М. // Наука и техника в газовой промышленности. 2016. Т. 68. № 4. С. 67.
Сычев В.В., Вассерман А.А., Загорученко В.А., Козлов А.Д., Спиридонов Г.А., Цымарный В.А. Термодинамические свойства метана. М.: Издательство стандартов, 1979. 348 с.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233–1238.
Duren T., Sarkisov L., Yaghi O.M., Snurr R.Q. // Langmuir. 2004. V. 20. P. 2683.
Fomkin A.A., Tsivadze A.Yu., Aksyutin O.E., Ishkov A.G., Pribylov A.A., Shkolin A.V., Men’shchikov I.E., Romanov K.V., Teterevlev R.V., Müller U., Arnold L., Piontek M. // Protection of Metals and Physical Chemistry of Surfaces. 2018. V. 54. № 6. P. 347–353.
Бакаев В.А. // Изв. АН СССР. Сер. хим. 1971. № 12. С. 2648.
Fomkin A.A. // Adsorption, 2005. V. 11. № 3/4. P. 425–436.
Atlanta Gas Light Adsorbent Research Group (AGLARG). GRI Report: Adsorbed Natural Gas. Report to US Dept. of Energy, Contract 466590, 1997.
Men’shchikov I.E., Fomkin A.A., Tsivadze A.Yu., Shkolin A.V., Strizhenov E.M., Khozina E.V. Adsorption accumulation of natural gas based on microporous carbon adsorbents of different origin// Adsorption. 2017. doi 10.1007/s10450-016-9854-1
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


