Физикохимия поверхности и защита материалов, 2019, T. 55, № 3, стр. 267-272
Особенности анодного поведения комбинированного железоалюминиевого электрода и физико-химические свойства продуктов его растворения
А. Ф. Дресвянников 1, *, Я. В. Ившин 1, Л. Р. Хайруллина 1, Ю. С. Печенина 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
Казань, Россия
* E-mail: a.dresvyannikov@mail.ru
Поступила в редакцию 23.04.2018
После доработки 01.11.2018
Принята к публикации 14.11.2018
Аннотация
Исследовано электрохимическое поведение комбинированного электрода железо-алюминий в водных растворах хлорида натрия. Показано, что, в условиях разомкнутой цепи комбинированный электрод представляет собой короткозамкнутый элемент, поверхность которого практически эквипотенциальна и характеризуется значением потенциала, находящегося между величинами коррозионных потенциалов алюминиевого и железного электродов. При малой внешней поляризации почти весь анодный ток протекает через поверхность алюминиевой составляющей комбинированного электрода, далее при росте внешней поляризации его доля уменьшается и стабилизируется при значении примерно в два раза выше, чем доля тока железной составляющей анода. Это позволяет регулировать скорости растворения алюминия и железа при их совместном окислении в процессе синтеза прекурсоров оксидов металлов заданного фазового состава путем изменения соотношения площадей электродов.
ВВЕДЕНИЕ
Исследование распределения тока и потенциала по поверхности комбинированного электрода при совместном окислении железа и алюминия имеет определенный теоретический интерес, а также позволяет определить характеристики коррозионного процесса в условиях анодной поляризации двух разнородных металлов, находящихся в контакте друг с другом. Кроме того, такие исследования позволяют установить характеристики процесса получения прекурсоров бинарных оксидных систем металлов, содержащих их заданное количественное соотношение [1–3].
Однако, число опубликованных результатов исследований по данной тематике крайне невелико.
Поэтому целью настоящей работы является изучение электрохимического поведения алюминия и железа, находящихся в контакте друг с другом и погруженных в раствор хлорида натрия разной концентрации, а также установление закономерностей совместного анодного растворения этих металлов.
Как известно, хлорид-ионы являются активаторами поверхности металла, способствующими его анодному растворению [4]. Согласно [4, 5], активирующее действие хлорид-ионов, связанное с трансформацией оксидной пленки металла и обусловлено адсорбцией на поверхности электрода хлорид-ионов, полностью или частично вытесняющих пассивирующий кислород. В результате этого металл приобретает способность переходить в раствор в виде хлоридного комплекса [4, 6, 7]. Хемосорбционные соединения металлов гидролизуются, причем продукты гидролиза способствуют разрушению поверхностного слоя и депассивации металла.
МЕТОДИКА ЭКСПЕРИМЕНТА
Измерения проводили в прямоугольной ячейке объемом 200 см3. С целью обеспечения равномерного распределения тока анод и катод располагались параллельно друг другу и полностью перекрывали сечение ячейки. Комбинированный анод состоит из пластин алюминия А5 и железа – Армко с рабочей поверхностью размером 12.5 см2 каждая. Составляющие анода располагались рядом в одной плоскости и имели электрический контакт между собой. Электроды проходили стандартную предварительную подготовку: поверхность механически полировали алмазной пастой, обезжиривали этиловым спиртом и промывали бидистиллированной водой.
Ступенчатая анодная гальваностатическая поляризация анода осуществлялась с помощью электрохимической станции Zive SP2. Длительность поляризации током заданной величины составляла 1 мин. Силу тока, протекающего через составные части комбинированного электрода, измеряли путем измерения напряжения на включенных последовательно в анодную цепь сопротивлениях величиной 1 Ом. В качестве электрода сравнения применяли хлоридсеребряный электрод марки ЭВЛ-1М3. Капилляр Луггина–Габера ориентировали относительно трех точек поверхности железной и алюминиевой составляющих анода (по краям и центру) посередине вертикального сечения электрода. Вспомогательный электрод из нержавеющей стали 18ХН10Т размещали у противоположной стенки прямоугольной ячейки на расстоянии 20 см от анода.
Кроме того, выделившийся в процессе поляризации осадок отфильтровывали, высушивали при температуре 60°C и подвергали термообработке при температуре 1100°C (2 ч).
Рентгенофазовый анализ образцов проводили стандартным методом на дифрактометре D2 PHASER с использованием монохроматизированного CoKα-излучения (30 кВ, 10 мА) в режиме шагового сканирования (шаг сканирования – 2θ = 0.05°, интервал съемки – 2θ = 3°–130°). Расчет значений межплоскостных расстояний дифракционных рефлексов производился автоматически с помощью программного пакета DIFFRAC.EVA. Идентификацию кристаллических фаз осуществляли путем сопоставления полученных экспериментальных значений межплоскостных расстояний и относительных интенсивностей с эталонными.
Микроскопические исследования состояния поверхности анода после поляризации проводили на сканирующем электронном микроскопе EVEX Mini SEM SX-3000 (15 кВ, 10 мкА) с приставкой локального элементного анализа.
Элементный анализ полученных дисперсных систем проводили на портативном рентгенофлуоресцентном спектрометре S1 TITAN с максимальным напряжением 50 кВ, с использованием программного пакета GeoChem General.
Микросъемку дисперсных образцов осуществляли на сканирующем электронном микроскопе AURIGA CrossBeam с энергодисперсионным спектрометром INCA X-MAX с использованием режимов SE2 (вторичных электронов) (20 кВ, 800 пА) и InLens (высокоразрешающий режим вторичных электронов) (15 кВ, 180 пА). На исследуемые образцы с помощью установки Quorum Q150T ES предварительно наносили слой золото-палладий (60 : 40) толщиной 15 нм.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Исследования проводили при плоскопараллельном расположении электродов. Это вызвано тем, что в иных условиях на распределение тока в процессе совместного растворения металлов влияет геометрия расположения электродов и наблюдаемая картина процесса усложняется (рис. 1).
Рис. 1.
Поляризационные кривые Al и Fe электродов площадью 1 см2 в растворе 10–1 М NaCl, вспомогательный электрод расположен между анодами: (1) Al; (2) Fe; (3) комбинированный Al + Fe анод (измерение потенциала на Al); (4) комбинированный Fe + Al анод (измерение потенциала на Fe).

Полученные результаты имеют крайне низкую степень воспроизводимости, форма и взаимное расположение кривых меняется по сложным закономерностям. Анализ результатов измерений позволяет предположить причины наблюдаемых явлений: во-первых, распределение тока и потенциала в электролизере и по поверхности анода неравномерно, во-вторых, взаимоположение составляющих комбинированного анода и электрода сравнения зафиксировано недостаточно точно, расстояние между ними может изменяться, как в процессе одного эксперимента, так и отличаться в параллельных опытах. Это отражается и на результатах гравиметрических измерений (рис. 2).
Рис. 2.
Удельная потеря массы электрода контактной пары Al-Fe в условиях анодной поляризации в растворе 10–1 М NaCl (Sраб = 8 см2, S(Al): S(Fe) = 1 : 1).

Комбинированный электрод Al-Fe представляет собой короткозамкнутый гальванический элемент, измеренное значение плотности тока которого оценивалось величиной 0.3 мА/см2 [8]. Это значение близко к рассчитанной величине предельного тока диффузии кислорода в растворе (0.5 мА/см2). Последнее свидетельствует о том, что процесс анодного растворения алюминия контролируется реакцией катодного восстановления кислорода [9]. В данном случае, вследствие относительно малого размера электродов и высокой проводимости электролита в отсутствии внешнего тока, поверхность комбинированного электрода практически эквипотенциальна (рис. 3, кривая 0). При протекании внешнего тока и росте его значения наблюдается увеличение разности потенциалов поверхности алюминиевой и железной составляющих анода (рис. 3).
Рис. 3.
Распределение потенциала по поверхности комбинированного электрода в зависимости от силы тока, протекающего в 1.0 M растворе NaCl. Слева – железо, справа – алюминий. Цифрами обозначены значения величины поляризующего силы тока, мА.

Проводили сопоставление поляризационных диаграмм индивидуальных алюминиевого и железного электродов с измеренными значениями на различных участках поверхности составляющих комбинированного электрода. По мере возрастания силы внешнего тока потенциал поверхности алюминия комбинированного электрода приближается к значениям потенциала индивидуального алюминиевого электрода, и, аналогично, потенциал поверхности железной составляющей комбинированного анода к значениям потенциала индивидуального железного электрода (рис. 4). При снижении концентрации электролита потенциал поверхности алюминиевой (Al-Fe) и железной (Fe-Al) составляющих комбинированного анода сближается с потенциалом соответствующего индивидуального электрода при значительно меньших значениях внешнего поляризующего тока. По всей вероятности, это связано с уменьшением проводимости раствора, что способствует увеличению разности потенциалов между составляющими комбинированного электрода (рис. 5).
Рис. 4.
Зависимость потенциала индивидуальных железного (1) и алюминиевого (2) электродов и поверхности железной (3) и алюминиевой (4) составляющих комбинированного анода в зависимости от общего поляризующего тока в 1.0 M (а) и 0.1 M (б) растворе NaCl.
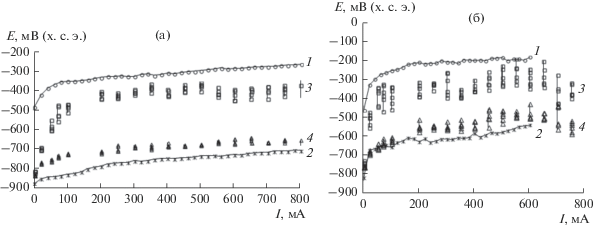
Рис. 5.
Поляризационные диаграммы индивидуальных алюминиевого (Al) – кривая 4 - и железного (Fe) – кривая 1 – электродов. Зависимость потенциала от парциального тока поверхности алюминиевой (Al-Fe) – кривая 3 – и железной (Fe-Al) – кривая 2 – составляющих комбинированного анода. Раствор – 1.0 M NaCl, соотношение поверхностей SFe : SAl = 1 : 1.

Для получения поляризационных диаграмм электродов строили зависимости потенциала электрода от значения тока, протекающего через каждую составляющую комбинированного анода (рис. 5). Можно отметить, что с ростом поляризующего тока достаточно быстро происходит сближение поляризационных кривых индивидуального и соответствующей составляющей комбинированного электрода.
Далее, с целью определения характеристик процесса получения гидроксидов указанных металлов, строили зависимость доли тока составляющих комбинированного электрода от величины общего поляризующего тока (рис. 6).
Рис. 6.
Доля парциальных токов алюминиевой (Al, кривая 1) и железной (Fe, кривая 2) составляющих комбинированного электрода в зависимости от общего поляризующего тока в растворе 1,0 M NaCl.

Можно отметить, что при малой внешней поляризации почти весь анодный ток протекает через поверхность алюминиевой составляющей комбинированного электрода, далее при росте внешней поляризации его доля уменьшается и стабилизируется при значении примерно в два раза выше, чем доля тока железной составляющей анода. Последнее отражается на состоянии поверхности составляющих комбинированного электрода (рис. 7).
Рис. 7.
Состояние поверхности алюминиевой (а, б) и железной (в, г) составляющих комбинированного электрода после электролиза в растворе 0.1 M NaCl при силе тока 2 А в течение двух часов.

Эквивалентную электрическую схему совместного анодного растворения, комбинированного Al-Fe электрода можно представить, как состоящую из двух параллельных цепей, каждая из которых содержит последовательно соединенные сопротивление электролита и поляризационное сопротивление на границе электрод–раствор. Величина сопротивления электролита постоянна и от силы тока не зависит. Поскольку потенциал алюминиевого электрода в короткозамкнутом элементе значительно (почти на 1.0 В) положительнее равновесного значения, его анодное растворение лимитируется диффузией ионов через оксидную пленку. При этом зависимость потенциала от тока близка к прямолинейной [10, 11], а поляризационное сопротивление Rр = dE/dj практически постоянно.
Потенциал железного электрода в короткозамкнутом элементе близок к его равновесному значению, его анодное растворение происходит в кинетическом режиме [11, 12]. При этом зависимость потенциала от тока носит логарифмический характер, а поляризационное сопротивление Rр = dE/dj обратно пропорционально величине тока. При малых значениях последнего поляризационное сопротивление велико, а с ростом тока уменьшается.
Согласно закону Кирхгофа, значения тока в параллельных цепях обратно пропорциональны значению их сопротивлений. Поэтому при малой внешней поляризации почти весь анодный ток протекает через поверхность алюминиевой составляющей комбинированного анода. При росте тока уменьшается поляризационное сопротивление железной составляющей комбинированного электрода, доля протекающего через нее тока увеличивается. При дальнейшем росте значений внешнего тока имеет место некоторая стабилизация парциальных токов, протекающих через железную и алюминиевую составляющие комбинированного анода (соотношение площадей 1 : 2 соответственно).
По результатам рентгенофлуоресцентного и рентгенофазового анализа состав формирующегося в процессе поляризации комбинированного железоалюминиевого анода осадка соответствует содержанию гидроксидов алюминия и железа: нордстрандит, байерит, гидроксид железа – гетит, маггемит – С. В результате термического воздействия при 1100°С осадок трансформируется в смесь оксидов α-Al2O3–α-Fe2O3 (рис. 8).
Рис. 8.
Рентгеновская дифрактограмма продукта анодного растворения комбинированного анода “алюминий-железо” в растворе 0.1 M NaCl при плотности постоянного тока 0.025 А/см2 после термического воздействия, температура: а) 60°С; б) 1100°С.

Очевидно, что продукт электролиза представляет собой совокупность агрегатов неправильной, преимущественно продолговатой формы, сформированных частицами сферической или близкой к ней форм (рис. 9). Образцы, синтезированные при постоянном токе и подвергнутые термообработке при температуре 1100°С, состоят из наночастиц с размерами в диапазоне 30–70 нм.
Рис. 9.
Электронные микрофотографии продукта, полученного при электролизе Al-Fe (1 : 1) в растворе 0.1 M NaCl при силе тока 2 А в течение двух часов и прокаленного при 1100°С.

Очевидным является факт малых размеров частиц в исследуемых образцах, даже после термообработки при высокой температуре. Это говорит о потенциальной возможности их использования в процессах получения керамики и композиционных материалов.
ВЫВОДЫ
1. Анодное поведение исследованного комбинированного Al-Fe электрода носит сложный характер и отличается от такового для индивидуальных металлических электродов вследствие различной природы (соответственно, поляризационного сопротивления) поверхностей алюминия и железа, погруженных в хлоридсодержащий электролит.
2. При отсутствии внешней поляризации комбинированный электрод представляет собой короткозамкнутый элемент, поверхность которого практически эквипотенциальна и характеризуется значением потенциала, находящегося между величинами коррозионных потенциалов алюминиевого и железного электродов вследствие большой проводимости электролита и относительно малых размерах электрода.
3. При внешней поляризации значения потенциалов поверхности алюминиевой и железной составляющих комбинированного анода различны; эта разница возрастает с увеличением внешнего тока и при больших его значениях способствует приближению поляризационных кривых составляющих анода к поляризационным кривым индивидуальных электродов.
4. При малой внешней поляризации почти весь анодный ток протекает через поверхность алюминиевой составляющей комбинированного электрода, далее при росте внешней поляризации его доля уменьшается и стабилизируется при соотношении 2 : 1 площадей алюминиевой и железной составляющей комбинированного электрода. Это позволяет регулировать скорости растворения алюминия и железа при их совместном окислении в процессе синтеза прекурсоров оксидов металлов заданного фазового состава путем изменения соотношения площадей электродов.
5. Методом рентгенофазового анализа доказано, что осадок, формирующийся в процессе анодной поляризации комбинированного железоалюминиевым электрода, представляет собой смесь гидроксидов алюминия – нордстрандита, байерита, гидроксидов железа – гетита, маггемита – С, который в процессе термообработки при 1100°С превращается в смесь оксидов α-Al2O3–α-Fe2O3 с достаточно развитой поверхностью.
Работа выполнена на оборудовании Центра коллективного пользования научным оборудованием по получению и исследованию наночастиц металлов, оксидов металлов и полимеров “Наноматериалы и нанотехнологии” в рамках государственного задания № 4.5784.2017/8.9 на 2017–2019 гг.
Список литературы
Михайлов В.И., Масленникова Т.П., Кривошапкин П.В. // Физика и химия стекла. 2014. Т. 40. № 6. С. 846–853.
Alexadias V.I., Verykios X.E. // Materials Chemistry and Physics. 2009. V. 117. P. 528–535.
Gulshan F., Kameshima Yo., Nakajima A., Okada K. // J. Hazardous Materials. 2009. V. 169. P. 697–702.
Попов Ю.А. Теория взаимодействия металлов и сплавов с коррозионно-активной средой. М.: Наука, 1995. 200 с.
Чернова Г.П., Корниенко Л.П. // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 6. С. 651–656.
Amokrane S. // J. Solid State Electrochemistry. 2007. V. 11. № 12. P. 1655–1661.
Борисенкова Т.А., Калужина С.А. // Конденсированные среды и межфазные границы. 2009. Т. 11. № 2. С. 106–110.
Иоссель Ю.Я. Математические методы расчета электрохимической коррозии и защиты металлов / Ю.Я. Иоссель, Г.Э. Кленов. М.: Металлургия, 1984. 272 с.
Полянский Л.Н., Горшков В.С., Кравченко Т.А. // Журн. физической химии. 2012. Т. 86. № 1. С. 121–123.
Герасимов В.В. Коррозия алюминия и его сплавов. М.: Металлургия. 1967. 116 с.
Решетников С.М., Рылкина М.В. // Защита металлов. 2001. 37. № 5. С. 517–520.
Зарцын И.Д., Федянин Д.О. // Конденсированные среды и межфазные границы. 2011. Т. 13. № 3. С. 260–265.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


