Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 488-495
Изучение сорбционного извлечения никеля(II) из водных растворов
Г. Н. Дударева 1, *, Н. В. Иринчинова 1, В. И. Дударев 1, Г. А. Петухова 2, **
1 Федеральное государственное бюджетное образовательное учреждение ВПО Иркутский национальный исследовательский технический университет
664074 Иркутск, ул. Лермонтова, 83, Россия
2 Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр., 31, корп. 4, Россия
* E-mail: gndudareva@mail.ru
** E-mail: petukhova@phyche.ac.ru
Поступила в редакцию 15.11.2018
После доработки 12.04.2019
Принята к публикации 15.04.2019
Аннотация
Представлены результаты изучения сорбции ионов никеля(II) из водных растворов мелкопористым углеродным адсорбентом и его модифицированными аналогами. В качестве модифицирующих агентов использованы селективные органические реагенты на никель(II). Получены изотермы адсорбции при различных температурных режимах. Рассчитаны термодинамические параметры адсорбции. Установлено возрастание величин предельной сорбционной емкости и констант сорбционного равновесия модифицированных образцов по сравнению с исходным.
ВВЕДЕНИЕ
В результате деятельности крупных промышленных предприятий возникает серьезная проблема разрушающего воздействия на природу, связанная с технически разрешенными, но реально завышенными нормативами выбросов, опасных для окружающей среды [1]. В связи с этим чрезвычайно остро встает вопрос очистки производственных и сточных вод, в частности, от ионов тяжелых металлов. Одним из таких металлов является никель, использование которого как защитного и декоративного покрытия металлов во многих странах уже законодательно запрещено [2]. Никель является причиной возникновения у человека респираторных заболеваний, сердечно-сосудистой системы, аллергии. Повышенные концентрации никеля, являющегося катализатором биохимических процессов, ведут к нарушению жизненно важных процессов [3]. Однако запрещать производство никеля нецелесообразно, так как он является стратегическим сырьем для получения целого ряда сплавов типа мельхиора, нейзильбера и др., является ценнейшей добавкой для производства стали. Он продолжает использоваться в нашей стране для получения индивидуальных и комбинированных гальванических покрытий химическим и электрохимическим способами [4–7].
Одним из путей минимизации никелевой проблемы является применение сорбционного способа очистки, являющегося удобным и эффективным процессом при использовании углеродных адсорбентов [8]. Углеродные адсорбенты (УС) способны выдерживать действие агрессивных сред, высоких температур, механическое воздействие. При достаточно высокой селективности и емкости адсорбенты можно регенерировать химическими и термохимическими процессами и многократно использовать. Кроме того, эти процессы не вносят вторичных загрязнений, экономичны, легко поддаются контролю и автоматизации [9]. Сорбционным способом возможно концентрирование никеля из большого объема производственных стоков в концентрат, пригодный для прямого повторного использования [10]. Несмотря на многочисленные исследования по извлечению никеля из различных производственных растворов и сред необходимость и актуальность применения углеродных адсорбентов, разработки эффективных способов извлечения и концентрирования никеля сохраняется [1]. Вопросы, связанные с извлечением металла из промышленных растворов путем сорбции на углеродных адсорбентах, остаются актуальными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение сорбции никеля из растворов проводили в статических и динамических условиях. Сорбционную способность оценивали по изотермам сорбции при температурах 298, 318 и 338 К для пяти различных навесок сорбентов. Статическую сорбционную емкость вычисляли по формуле: А = (Со– С) · V/m , где Со, С – исходная и конечная равновесная концентрации металла в растворе, мг/дм3; V – объем раствора, дм3; m – навеска сорбента, г; А – емкость сорбента, мг/г. Объем раствора составлял 0.1 дм3.
Определение количества сорбированного никеля проводили параллельно методом мокрого кислотного разложения навески сорбента. Среднее содержание никеля в 1 г сорбента при количестве опытов n = 4 было равно 32.21 мг.
В работе использовали углеродный адсорбент (УС), разработанный в ИРНИТУ [11]. Он представляет собой черные гранулы неправильной формы со средним размером частиц от 0.5 до 2 мм. Характеристические параметры адсорбента отражены в табл. 1. Одним из значимых качеств углеродного адсорбента является его способность извлекать ионы никеля(II) в нейтральной и слабощелочной средах.
Таблица 1.
Физико-химические свойства углеродных адсорбентов
| Параметр | Углеродный адсорбент | ||
|---|---|---|---|
| исходный | модиф. ДМГ | модиф. АГ | |
| Удельная поверхность, ГОСТ 23401-78, м2/г | 550 | 500 | 520 |
| Механическая прочность, ГОСТ 16188-70, % | 82 | 85 | 83 |
| Суммарный объем пор, ГОСТ 17219-71, см3/г | 0.61 | 0.55 | 0.53 |
| Сорбционная активность по иоду, ГОСТ 17823.2-72, % | 84 | 77 | 78 |
| Статическая ионообменная емкость, ГОСТ 20255.1-84, мг-экв/г: ${{{\text{q}}}_{{{{{\text{н}}}^{ + }}}}}$ ${{{\text{q}}}_{{{\text{о}}{{{\text{н}}}^{ - }}}}}$ |
0.92 7.52 |
1.84 9.46 |
1.62 8.89 |
| Насыпная плотность, ГОСТ 16190-70, г/дм3 | 550 | 560 | 560 |
Для изучения поверхности углеродного адсорбента проведено его исследование методом рентгеноспектрального электронно-зондового микроанализа (РСМА) на микроанализаторе Superprobe JXA-8200 (JEOL Ltd., Япония). На рис. 1 приведено изображение гранулы адсорбента в обратно рассеянных электронах при увеличении в 100 раз, которое отражает неоднородно пористый характер его поверхности.
Известно, что никель способен связывается в координационные соединения, имеющие в своем составе атомы кислорода и азота [12]. Для улучшения сорбционных характеристик УС подвергали модифицированию органическими реагентами.
Модифицирование адсорбента диметилглиоксимом (ДМГ) [13] и ацетгидразидином (АГ) [14] проводили из 10%-ного раствора NaOH и 96%-ного этилового спирта. При модифицировании использовали стандартный прием пропитки и последующей сушки образцов до постоянного веса. При модифицировании ДМГ и АГ его удельная поверхность уменьшается до 520–500 м2/г, но при этом возрастает механическая прочность. Наилучшей статической ионообменной емкостью (${{q}_{{{{{\text{н}}}^{ + }}}}}$ = 1.84 мг-экв/г, ${{q}_{{{\text{о}}{{{\text{н}}}^{ - }}}}}$ = 9.46 мг-экв/г) характеризуется модифицированный ДМГ образец адсорбента.
С целью обнаружения различий между исходными образцами сорбента и его модифицированными аналогами были исследованы их образцы на рентгеновском дифрактометре “Shimadzu XRD-7000”. Для проведения исследований образцы истирались в порошок в агатовой ступке до пылеобразного состояния. Съемка проводилась с медным излучением (трубка с медным анодом) в диапазоне углов 2θ от 3° до 80° с шагом сканирования 0.05 и экспозицией 60 с на шаг (1 образец – 26 ч) (рис. 2). Исходный адсорбент, полученный из природного угля, является аморфным. Его спектр имеет широкий пик, свидетельствующий об отсутствии кристаллической структуры дальнего порядка. Он содержит примесь кварца (рис. 2).
Результаты эксперимента можно представить следующими выводами: между исходными и модифицированными образцами внутри линий “УС–УС модифицированный–УС модифицированный после сорбции никеля” значимых структурных различий не обнаружено, т.е. внутри линий они идентичны. Модифицирование образцов не приводит к структурным изменениям.
Поглотительная способность адсорбентов обусловлена наличием пор различного размера. Поровые характеристики УС изучали двумя методами. Объем пор, средний радиус пор, распределение пор по размерам определяли методом низкотемпературной адсорбции азота (рис. 3а). Для сравнения приведен график (рис. 3б), отражающий распределение пор в мезопористом адсорбенте.
Рис. 3.
Определение объема пор, среднего радиуса пор методом низкотемпературной сорбции азота: (а) исходный адсорбент, (б) мезопористый адсорбент.

Параметры микропор и наличие мезопор изучали также методом равновесного насыщения образцов парами бензола. Результаты определения объема адсорбционного пространства по равновесному насыщению материала сорбента парами бензола приведены в табл. 2 и 3.
Таблица 2.
Параметры пористой структуры образцов адсорбента
| Образец | W0, см3/г | E0, кДж/моль | xo, нм | Vме, см3/г | VS, см3/г | Sме, м2/г |
|---|---|---|---|---|---|---|
| УС УС модиф. УС модиф. + Ni |
0.19 0.17 0.17 |
15.25 18.03 17.40 |
0.66 0.55 0.57 |
0.07 0.06 0.10 |
0.26 0.23 0.27 |
70 50 60 |
Таблица 3.
Параметры микропор по уравнению Дубинина–Стекли
| Образец | Параметры микропор, определенные по уравнению Дубинина–Стекли | |||
|---|---|---|---|---|
| $W_{0}^{0},$ см3/г | E0, кДж/моль | x0, нм | δ, нм | |
| УС исх. УС модиф. УС модиф. + Ni |
0.17 0.17 0.18 |
16.36 17.06 16.15 |
0.61 0.59 0.62 |
0.0697 0.1309 0.1345 |
W0, см3/г – предельный объем адсорбционного пространства; E0, кДж/моль – характеристическая энергия адсорбции пара (обычно бензола); xo, нм – полуширина микропор; Vме, см3/г – объем мезопор; VS, см3/г – суммарный объем пор (микро-, мезо-, макро-); Sме, м2/г – площадь поверхности микропор; $W_{0}^{0},$ см3/г – общий объем микропор (микропор и супермикропор); X0, нм – полуширина микропор для максимума кривой распределения; δ, нм – дисперсия, характеризующая интервал распределения пор.
Результаты изучения пористости двумя методами подтверждают, что у исходного адсорбента из 0.26 см3/г – доля мезопор составляет лишь 0.07 см3/г, поэтому его следует отнести к преимущественно микропористым адсорбентам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Зависимость сорбции никеля от кислотности растворов изучали в диапазоне рН 3–12. Полученная зависимость А = f (pH) носит ступенчатый характер. В кислой среде никель практически не сорбируется. В нейтральной среде сорбируется незначительно. При рН > 9.5 происходит резкое увеличение сорбции металла, что может быть связано с изменением свойств поверхности сорбентов, а также с изменением состояния адсорбата в растворе.
Кинетику сорбции никеля(II) УС изучали методом переменных навесок и ограниченного объема раствора. Из рис. 4 следует, что время установления равновесия составляет от 1 до 2 ч в зависимости от массы навесок сорбентов. Видно, что сорбционная емкость модифицированных сорбентов больше, чем у исходных сорбентов.
Рис. 4.
Кинетические зависимости сорбции ионов никеля(II) при 298 К: (a) исходный адсорбент; (б) модифицированный ДМГ; (в) модифицированный АГ; Cр – равновесная концентрация никеля(II) в растворе, мг/дм3; t – время сорбции, ч.

Константы скорости рассчитывали из графических зависимостей lg (Co/Cp) = f(t) по углу наклона tg α при различных температурах.
Энергию активации рассчитывали по классической формуле:
Таблица 4.
Кинетические характеристики сорбции никеля исходным и модифицированными сорбентами
| Параметр/температура | Исходный адсорбент | Адсорбент модифицированный ДМГ | Адсорбент модифицированный АГ |
|
|---|---|---|---|---|
| K1 | 298 К | 0.204 0.229 0.287 |
0.243 0.273 0.352 |
0.307 0.411 0.471 |
| K2 | 318 К | |||
| K3 | 338 К | |||
| Ea, кДж/моль | 7.10 | 6.78 | 6.25 | |
Изотермы сорбции ионов никеля(II) исходным адсорбентом и модифицированными образцами при температурах 298, 318, 338 К приведены на рис. 5. Полученные изотермы по характеру зависимости можно отнести к изотермам мономолекулярной сорбции. Высокая сорбционная емкость углеродных адсорбентов объясняется существованием на поверхности пор активных центров, усиливающих катионообменные свойства сорбента. Изотермы имеют форму изотермы Лэнгмюра [15], относятся к I типу по классификации Брунауэра, характеризуются монотонным приближением адсорбции к некоторому предельному значению, соответствующему заполненному монослою. Такая форма кривых часто является следствием неоднородности поверхности и различные адсорбаты (возможно, комплексы между адсорбатом и адсорбентом) могут претерпевать фазовые переходы, которые, однако, четко проявляются лишь на очень однородных поверхностях. Высокая сорбционная емкость углеродных сорбентов объясняется существованием на поверхности пор активных центров, усиливающих катионообменные свойства сорбента. Сорбционная емкость модифицированных адсорбентов возрастает, вероятно, вследствие увеличения числа функциональных активных групп (ФАГ) на поверхности углеродных адсорбентов и за счет молекул модификаторов, закрепившихся в порах адсорбентов.
Рис. 5.
Изотермы сорбции ионов никеля(II): (a) исходный адсорбент; (б) адсорбент модифицированный ДМГ; (в) адсорбент модифицированный АГ; 1 – 338 К, 2 – 318 К, 3 – 298 К; Cр – равновесная концентрация никеля(II) в растворе, мг/дм3; Ау – концентрация ионов никеля(II) на сорбенте, мг/г.
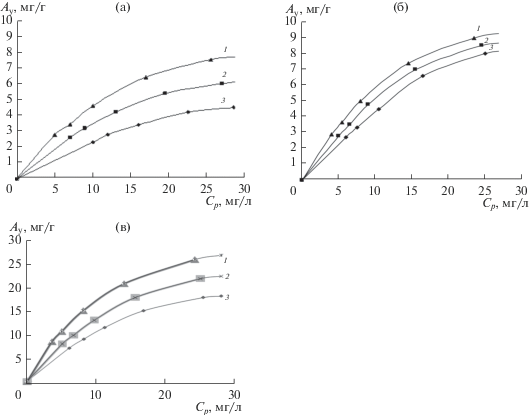
Ранее проведенными исследованиями установлена преобладающая в используемых условиях ионная форма [Ni(OH)]+ [5]. С учетом состава растворов, значения рН и сольватации ионов растворителем форму нахождения никеля в растворе можно предположить как [Ni(NH3)5(OH)]+. Вероятно, сорбционное поглощение ионов никеля из раствора идет по ионообменному типу с обменом ионов никеля из раствора на протоны в твердой фазе сорбента, о чем свидетельствует понижение равновесного значения рН в процессе сорбции.
Максимальную величину предельной адсорбционной емкости монослоя рассчитывали по уравнению Ленгмюра в преобразованном виде: $\frac{1}{А} = \frac{1}{{{{А}_{\infty }}}}$ + $\frac{1}{{{{А}_{\infty }}{{К}_{p}}}}\frac{1}{С},$ которое позволяет графическим способом найти постоянные А∞ и Kp (рис. 6). Результаты расчетов свидетельствуют о том, что с ростом температуры предельная величина адсорбции и константа сорбционного равновесия увеличиваются. У модифицированных сорбентов предельная величина адсорбции больше, чем у исходных сорбентов. Максимальная предельная величина адсорбции достигает в случае модифицированного сорбента АД.
Рис. 6.
Зависимости адсорбции никеля(II) исходными образцами АД (а, б, в) в координатах Ленгмюра при (а) 298 K, (б) 318 K, (в) 338 K.
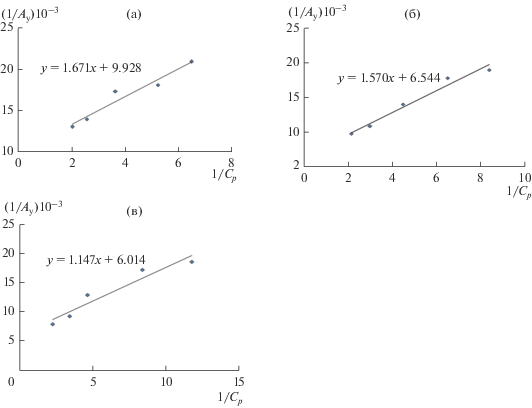
Таблица 5.
Константы адсорбции
| Константы | Исходный УС | УС, модиф. ДМГ | УС, модиф. АГ | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 298 К | 318 К | 338 К | 298 К | 318 К | 338 К | 298 К | 318 К | 338 К | |
| A∞10–4 , моль/г | 1.01 | 1.53 | 1.66 | 2.87 | 3.10 | 4.38 | 4.61 | 5.62 | 6.40 |
| Kp | 394 | 416 | 524 | 1132 | 2310 | 3040 | 2418 | 2795 | 3380 |
Энергию Гиббса процесса адсорбции рассчитывали по фундаментальному уравнению:
где ∆G – энергия Гиббса, кДж/моль; R – молярная газовая постоянная, равная 8.314 Дж/моль К; Т – температура реакции, К; Kр – константа равновесия (табл. 6). Из табл. 6 видно, что с увеличением температуры энергия Гиббса уменьшается.Таблица 6.
Энергия Гиббса сорбционного процесса
| Константы | Исходный УС | УС, модиф. ДМГ | УС, модиф. АГ | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 298 К | 318 К | 338 К | 298 К | 318 К | 338 К | 298 К | 318 К | 338 К | |
| Kp | 394 | 416 | 524 | 1132 | 2310 | 3040 | 2418 | 2795 | 3380 |
| ΔG, кДж/моль | –20.51 | –22.04 | –24.07 | –17.42 | –20.48 | –22.54 | –19.30 | –20.98 | –22.81 |
Энергия Гиббса является индикатором самопроизвольного протекания адсорбции. Полученные результаты показывают, что во всех изучаемых процессах происходит активизация адсорбции с повышением температуры. В случае исходного УС наблюдается некоторое уменьщение энергии Гиббса в результате модифицирования. Все это свидетельствует об активной роли модификаторов – диметилглиоксима и ацетгидразидина в процессах адсорбции ионов никеля.
Производные от изотермы сорбции lnC = = f(1/T), отражающие взаимосвязь равновесных температур и концентрации при постоянной емкости сорбента, использовали для расчета изостерических теплот сорбции в соответствии с уравнением Клаузиуса–Клапейрона:
Откуда:
Для большинства адсорбентов теплота сорбции по всей поверхности изменяется. Молекулы адсорбируются в первую очередь на самых активных местах поверхности, теплота сорбции при этом имеет наибольшее значение. По мере заполнения самых активных точек в процесс вступают менее активные и теплота сорбции постепенно падает. По углам наклона изостер рассчитали дифференциальные теплоты сорбции никеля(II) (табл. 7).
ЗАКЛЮЧЕНИЕ
Процесс сорбции является многофакторным и зависит от ряда исходных установочных параметров. Количественные характеристики, полученные в процессе изучения сорбции показывают, что модифицированные сорбенты обладают большей сорбционной активностью по сравнению с исходными адсорбентами. Молекулы модификаторов облегчают процесс закрепления ионов никеля на поверхности сорбентов, подобно процессу катализа обеспечивая понижение энергетического барьера в процессе сорбции.
Анализ термодинамических характеристик сорбции показывает, что константа скорости у модифицированных углеродных адсорбентов больше константы скорости исходного адсорбента. Максимальная энергия Гиббса ΔG при 298 К составляет –19.3 кДж/моль. Теплота сорбции Q достигает максимального значения также в случае модифицированного АД. Предельная сорбция A∞ увеличивается с повышением константы равновесия Kp. Большие значения предельной статической адсорбционной емкости у модифицированных образцов АД указывает на активное участие модификаторов в сорбции ионов никеля(II). Этот факт отражается и на значениях свободной энергии Гиббса, имеющей меньшие значения у модифицированных образцов адсорбентов.
Список литературы
Healy J.P., Pletcher D. // J. Electroanal. Chem. 1992. V. 338. P. 155.
Bolduan K.U. // Galvanotechnik. 2008. V. 99. № 6. P. 1539–1541.
Сидоренко Г.И., Ицкова А.И. // Никель: гигиенические аспекты охраны окружающей среды. М.: Медицина, 1980. 176 с.
Xiuulian R., Qiifeng W., Zhe L., Jun L. // Trans. Nonferrous. Met. Soc. China. 2012. V. 22. P. 467.
Coman V., Robotin B., Ilea P. // Res. Conserv. Recycling. 2013. V. 73. P. 229.
Ma C., Wang S.C., Walsh F.C. // Trans. Inst. Met. Finish. 2015. V. 93. P. 275.
Pramod Kumar U., Joseph Kennady C., Zhou Q. // Surf. Coat. Technol. 2015. V. 283. P. 148.
Дударева Г.Н. // Сорбционное концентрирование и аналитическое определение никеля. Иркутск, 2015. 156 с.
Леонов С.Б., Елшин В.В., Дударев В.И. и др. // Углеродные сорбенты на основе ископаемых углей. Иркутск. 2000. 268 с.
Дударев В.И., Филатова Е.Г., Дударева Г.Н. и др. // Заводская лаборатория. Диагностика материалов. 2015. Т. 81. № 1. С. 16–23.
Патент № 2064335 РФ, МКИ С 01 В 31/08, В 01 J 20/20 Способ получения сорбента / С.Б. Леонов, В.В. Елшин, В.И. Дударев, В.А. Домрачева. № 5018171/26; Заявлено 23.12.91; Опуб. 27.07.96, Бюл. № 21.
Donnet J.B., Guilpain G. // Carbon 1989. V. 27. № 5. P. 749.
Дударева Г.Н., Долгорев А.В., Китаев Ю.П. и др. // Журн. аналит. химии. 1984. № 7. С. 1285–1291.
Dudareva G.N., Petukhova G.A., Nguen A.T.N., Syrykh Yu.S. // Protection of Metals and Physical Chemistry of Surfaces. 2013. V. 49. № 4. P. 413–420.
Adamson A.W., Gast A.P. // Physical chemistry of surfaces. 6th ed. p. cm. “A Wiley-Interscience Publication.” 1997. 784 p.
Morris D.E., Reed G.L., Short E.L., Slater D.N., Waters D.N. // J. Inorg. Nucl. Chem. 1965. V. 27. P. 377.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов




