Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 496-506
Особенности сорбции ионов меди(II) модифицированным кератином шерсти
Т. Е. Никифорова 1, *, В. А. Козлов 1, А. Н. Сионихина 1
1 Ивановский государственный химико-технологический университет
153000 Иваново, пр. Шереметевский, 7, Россия
* E-mail: tatianaenik@mail.ru
Поступила в редакцию 21.12.2018
После доработки 16.01.2019
Принята к публикации 21.01.2019
Аннотация
Представлены результаты исследования равновесия и кинетики сорбции ионов Cu2+ из водных растворов исходным и модифицированным кератином шерсти. Высокие сорбционные свойства модифицированного сорбента обусловлены образованием на его поверхности гидроксамовых кислотных групп при сохранении карбоксильных групп исходного кератина. Резкое изменение сорбции кератином шерсти в области изоэлектрической точки связано с изменением степени диссоциации карбоксильных групп. Приведены ИК-спектры и СЭМ-фотографии образцов исходного и модифицированного сорбентов, которые свидетельствуют об изменениях в структуре, обусловленных иммобилизацией на поверхности кератина шерсти новых функциональных групп.
ВВЕДЕНИЕ
Разработка эффективных биосорбентов и создание ресурсосберегающих технологий, позволяющих эффективно извлекать ионы тяжелых металлов из водных сред, а также обоснование механизма хемосорбции модифицированными биосорбентами является актуальной задачей.
Одним из таких биополимеров, способных связывать ионы различных тяжелых металлов, таких как медь, хром, ртуть, свинец и др., является кератин шерсти [1, 2].
Кератин – один из самых распространенных и в основном неиспользуемых непищевых белков, являющийся основным компонентом шерсти, шелка, перьев и др. Несмотря на их ценные свойства, кератиновые отходы довольно сложно утилизировать. Общее количество кератина, включая побочные продукты из шерсти в текстильной промышленности, оценивается во всем мире более чем в 5 млн тонн в год.
Кератин шерсти рассматривается как потенциальный эффективный сорбент для извлечения токсичных химических соединений и ионов металлов благодаря наличию функциональных групп с кислотными и основными свойствами, а также большому количеству отходов, образующихся при переработке шерстяного волокна, в том числе коротких волокон, которые не могут быть использованы в текстильной промышленности) [3]. Белковые молекулы содержат определенный набор аминокислот с уникальными свойствами и характерными функциональными группами, такими как карбоксильные, аминогруппы и дисульфидные мостики. Это определяет способность кератина шерсти к селективному связыванию ионов различных металлов, а также органических соединений и, таким образом, открывает возможность нетрадиционного использования шерсти в различных технологических процессах.
Однако в настоящее время его широкое применение ограничивается невысокими кинетическими характеристиками и более низкой, по сравнению с полисахаридными сорбентами, сорбционной емкостью.
Для сокращения времени достижения равновесия и увеличения сорбционной емкости шерстяного волокна применяют физические, химические и комбинированные способы модифицирования. Перспективно проводить измельчение шерстяных волокон для получения порошков, содержащих микрочастицы, сохраняющие присущую белку шерсти микроструктуру, кристалличность и пористость. Так, сорбция ионов Co2+ порошками шерсти с размером частиц ∼5 мкм возросла примерно в 4 раза по сравнению с исходным шерстяным волокном [4].
Методы, использующие плазму, коронный разряд или СВЧ-излучение, изменяют поверхность шерсти. Химическая модификация проводится путем введения новых функциональных групп для увеличения количества активных центров сорбции [5–7].
Обработка порошков шерсти натриевой солью дихлоризоциануровой кислоты [8] позволила получить сорбенты, превосходящие по своим свойствам как шерстяное волокно, так и промышленные ионообменные материалы. Скорость поглощения ионов меди порошками шерсти была значительно (примерно в 40 раз) выше по сравнению с волокном шерсти, а по сравнению с промышленными катионообменными смолами порошки шерсти показали более высокую (от 2 до 9 раз) сорбционную емкость по отношению к ионам металлов. В работе [9] шерстяное волокно было модифицировано методом привитой сополимеризации с акрилонитрилом с использованием окислительно-восстановительной системы KMnO4/щавелевая кислота. Дальнейшая модификация заключалась в превращении нитрильных групп (–CN) привитого сополимера путем их последовательного взаимодействия с гидразин гидратом, этилцианоацетатом и образовании сополимера кератина с полицианоуксусной кислотой и аминоакрилгидразидом. Предельная, или максимальная, сорбционная емкость полученных хелатных волокон по отношению к ионам Hg(II), Cu(II) и Co(II), определенная по модели Ленгмюра, составила, соответственно, 154.32, 110.49 и 72.88 мг/г.
В ряде исследований методами ИК-спектроскопии [10], ЭПР [11, 12] показано, что во взаимодействии кератина шерсти с ионами Cu(II) принимают участие, главным образом, карбоксильные группы. Так, модификация кератина шерсти, приводящая к увеличению количества карбоксильных групп (обработка йодуксусной кислотой), вызывает рост сорбции ионов серебра и подтверждает предположение о том, что основными сорбционными центрами шерсти являются карбоксильные группы [13]. Снижение максимума сорбции ионов Ag+ образцами восстановленной и ацетилированной шерсти свидетельствует о том, что солевые связи между свободными амино- и свободными карбоксильными группами гораздо сильнее, чем в немодифицированной шерсти и что ионы серебра не способны их разрушить. Это объясняет снижение числа доступных центров сорбции, несмотря на то, что центры, которые остаются “доступными”, обладают повышенным сродством по отношению к ионам серебра.
В пользу ионообменного механизма сорбции свидетельствует характер влияния рН раствора на этот процесс (конкуренция протонов и катионов металлов за сорбционные центры кератина), а также значение средней свободной энергии адсорбции (E) 8–16 кДж/моль [14]. Однако наряду с ионообменным механизмом сорбции металлов на карбоксильных группах кератина шерсти, взаимодействие ионов тяжелых металлов, по мнению авторов [15, 16], осуществляется за счет хемосорбции с такими функциональными группами кератина шерсти как –SH, –SO3H, –OSO3H, а также дисульфидными мостиками.
Ряд работ свидетельствует о том, что изотермы сорбции ионов металлов хорошо описываются в рамках модели Ленгмюра [9, 17, 18]. Это указывает на формирование в процессе сорбции на поверхности сорбента монослоя сорбата в результате взаимодействия катионов металлов со специфическими центрами сорбции кератина шерсти. Есть также мнение [19], что на сорбционный процесс оказывает влияние наличие в сорбенте микропор, захватывающих и удерживающих ионы тяжелых металлов как эффективный биофильтр. В этом случае можно говорить о физическом механизме сорбции ионов металлов. Таким образом, можно рассматривать весь процесс сорбции как комбинацию хемосорбции и физической адсорбции. На эффективность процесса сорбции также влияют условия проведения процесса, такие как рН водного раствора. Показано, что сорбция ионов металлов возрастает с увеличением рН раствора [20, 21].
Одним из наиболее эффективных методов улучшения сорбционных характеристик кератина является химическая модификация поверхности шерсти с помощью химических реагентов [10, 22, 23]. Так, обработка шерсти ЭДТА способствует увеличению сорбционной емкости по ионам Co2+ более чем в 5 раз, с 0.12 до 0.61 ммоль/г. Методом ИК- спектроскопии определено, что взаимодействие ионов Co(II) происходит за счет хемосорбции с функциональными группами шерсть и ЭДТА [22]. Также для повышения сорбционной емкости шерсть обрабатывали альгинатом, в результате чего извлечение ионов меди возрастало в два раза [23].
Новые возможности применения модифицированных шерстяных волокон включают сорбцию ионов тяжелых металлов из промышленных сточных вод, очистку загрязненной воды, извлечение ионов благородных металлов из жидких отходов и их возвращение в производство [24].
Целью настоящей работы является создание эффективного сорбента на основе кератина шерсти путем его направленного модифицирования, установление закономерностей и обоснование особенностей механизма сорбции ионов меди(II) из водно-кислотных сред.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При выполнении экспериментальной части работы в качестве сорбента использовали волокно шерсти мериноса.
Химические реактивы марки “х. ч.”, используемые в экспериментах: CuSO4 ⋅ 5H2O, Н2SO4, NаОН, Н2О2, FeSO4 · (NH4)2SO4 · 6H2O, CH2=CHC(O)NH2, NH2OH ⋅ HCl, Na2CO3.
Шерстяное волокно подвергали предварительной обработке водным раствором соды кальцинированной, которую проводили при 35–40°С в течение 20 мин. Затем шерсть промывали теплой водой и высушивали до постоянной массы.
Кинетику сорбции ионов Cu2+ исследовали в статических условиях методом ограниченного объема раствора. Для получения кинетических кривых в серию пробирок помещали навески сорбента массой (m) по 0.1 г, заливали их 10 мл водного раствора сульфата меди с начальной концентрацией ионов Cu2+ 1.5 × 10–4 моль/л и выдерживали от 15 мин до 24 ч. Через определенные промежутки времени раствор отделяли от сорбента фильтрованием и определяли в нем начальную (С0) и текущую концентрацию ионов меди (Сτ) методом атомно-абсорбционной спектроскопии.
Для исследования влияния концентрации металла в растворе на равновесие в ионообменной системе были получены изотермы сорбции. Для снятия изотерм процесс сорбции проводили следующим образом: в серию пробирок помещали навески сорбента массой по 0.10 г и заливали их 10 мл (V) водного раствора сульфата меди с концентрациями Cu2+ в интервале 1.5 × 10–4–5 × 10–2 моль/л и выдерживали до установления состояния равновесия (время достижения сорбционного равновесия было определено при исследовании кинетики сорбции). Затем раствор отделяли от сорбента фильтрованием и определяли в нем равновесную концентрацию ионов меди (Се) методом атомно-абсорбционной спектроскопии.
Сорбционную емкость сорбента в каждый конкретный момент времени τ (Аτ) рассчитывали по формуле:
При снятии изотермы сорбции в условиях установившегося равновесия в системе определяли равновесную концентрацию ионов металла в растворе (Се) и рассчитывали равновесную сорбционную емкость:
где А – равновесная сорбционная емкость, моль/кг; Се – равновесная концентрация ионов металла в растворе, моль/л.Степень извлечения α определяли следующим образом:
Коэффициент распределения KD рассчитывали как отношение концентрации ионов металла в фазе полимера (Ссорб) к его содержанию в растворе:
При исследовании влияния рН раствора на процесс сорбции ионов Cu2+ серию пробирок с одинаковыми навесками сорбента по 0.10 г заливали 10 мл водного раствора сульфата металла с концентрацией 1.5 × 10–4 моль/л с различными значениями рН в интервале рН 1–6. Для каждого опыта использовали свежеприготовленные растворы. Необходимую величину рН создавали, используя серную кислоту. Величину рН контролировали по рН-метру до начала сорбции и после достижения равновесия. При достижении сорбционного равновесия растворы отфильтровывали и определяли в фильтрате остаточную концентрацию ионов меди методом атомно-абсорбционной спектроскопии и рассчитывали сорбционную емкость сорбента и степень извлечения ионов металла.
Относительная погрешность экспериментов рассчитывалась на основании результатов опытов, в которых каждая точка представляет собой среднее значение из двух параллельных опытов. Погрешность эксперимента не превышала 10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Главными функциональными группами кератина шерсти являются концевые и боковые кислотные карбоксильные (–СООН) и основные аминогруппы (–NH2). Содержание карбоксильных групп в кератине превышает содержание аминогрупп, в результате этого изоэлектрическая точка сдвинута в кислотную область (рНI 4.7) водного раствора. Оба типа функциональных групп в основной форме (анионной –СОО– и –NH2) способны извлекать катионы тяжелых металлов из водно-кислотных сред, а в Н-форме (–СООН) и катионной Н-форме $\left( {--{\text{NH}}_{3}^{ + }} \right)$ они эту способность теряют. В зависимости от кислотности водной фазы функциональные группы полимера могут находиться в активной основной анионной форме (Н2N–W–СОО–), электронейтральной, цвиттер-ионной (Н3N+–)nW(–СОО–)n, в анионной форме с избыточными карбоксильными группами (Н3N+–)nW(–СОО–)(n+m), в электронейтральной форме с избыточными карбоксильными группами в Н-форме (Н3N+–)nW(–СОО–)n(–СООН)m и в катионной Н-форме (Н3N+–)nW(–СООН)n+m. Для обоснования механизма сорбции/протодесорбции ионов М2+ кератином из водно-кислотных сред необходимо провести направленную модификацию путем иммобилизации дополнительного количества кислотных групп на его поверхности и сопоставить сорбционные свойства исходного и модифицированного сорбента в зависимости от рН водной фазы и других факторов.
С целью улучшения сорбционных свойств шерстяного волокна проводили его модифицирование. В работе был использован способ модификации кератина шерсти с помощью синтеза привитых сополимеров [25], который основан на реакции свободно радикальной полимеризации. В результате реакции образуется привитый сополимер, у которого основная цепь макромолекулы состоит из полипептидной цепи, а привитые боковые цепи состоят из структурных единиц другого полимера.
Для образования цепочек полимера обычно используют винильные мономеры (CH2=CHR) в виде акрилонитрила, акриловой и метакриловой кислот, стирола, акриламида и других.
Инициирование реакции цепной полимеризации осуществляют с помощью химических реагентов (окислительно-восстановительные системы).
Предварительная стадия подготовки мономера связана с заменой в акриламидном мономере карбамидной группы на гидроксамовую. Для этого готовят раствор акриламида, гидроксида натрия и гидроксиламина солянокислого в мольном соотношении 1 : 1 : 1 и проводят реакцию.
Шерстяное волокно обрабатывают при модуле М = 50 водным раствором, содержащим 0.03–0.5 г/л соли Мора при 20°С и рН 5–5.5 в течение 1.5–2 ч, после чего тщательно отмывают дистиллированной водой до отсутствия в промывных водах ионов двухвалентного железа. Затем шерсть помещают в раствор, содержащий 10 г/л акриламида, по 12.5 г/л гидроксида натрия и гидроксиламина солянокислого и выдерживают в течение 30 мин при 70°С и добавляют 0.2 г/л 30% Н2О2.
Обработанное шерстяное волокно промывают дистиллированной водой и высушивают до постоянного веса.
Модификация сорбента виниловым мономером (CH2=CH–CONHOH) проходит в три стадии: (I) инициирование – образование макрорадикала на поверхности сорбента, (II) рост и развитие радикальной цепи и (III) обрыв цепи радикальных реакций. Сначала идет образование свободных макрорадикалов на полипептидных цепях, которые инициируют реакцию полимеризации, и полимерная цепь оказывается закрепленной на этих участках сорбента. Для образования свободных макрорадикалов кератин шерсти обрабатывают перекисью водорода в присутствии ионов Fe2+ (соль Мора) закрепленных (сорбированных) на ее поверхности. При распаде инициатора (Н2О2 ↔ НО∙ + ∙ОН) возникают радикалы, которые в слабощелочной среде могут непосредственно атаковать цепи кератина по сульфгидрильным группам (W–SH) с образованием макрорадикалов (W–S) на отдельных участках полипептидной цепи, которые, в свою очередь, инициируют реакцию полимеризации. В дальнейшем происходит присоединение винильных мономеров (CH2=CH–CONHOH) к макрорадикалам на поверхности кератина. Рост, развитие полимерной цепи прекращается за счет обрыва реакции полимеризации винильного мономера, параллельно ей может проходить побочная реакция образования свободного гомополимера, не вступившего в реакцию с кератином, который в заключительных стадиях процесса удаляется промывкой.
Стадии модификации кератинового сорбента виниловым мономером методом окислительно-восстановительной радикальной полимеризации:
(I) Зарождение радикальной цепи на поверхности сорбента.
Шерстяное волокно обрабатывают при модуле М = 50 водным раствором соли Мора (Fe2+, при 20°С, рН 5–5.5, в течение 1.5–2 ч). При снижении рН замедляется сорбция ионов железа волокном, а при повышении — ускоряется процесс окисления железа кислородом воздуха с образованием макрорадикала.
(II) Рост, развитие цепи последовательных радикальных реакций.
Шерсть выдерживают в приготовленном растворе в течение 30 мин при 70°С и М = 50 и добавляют перекись водорода:
(III) Обрыв развития цепи радикальных реакций в результате рекомбинации или диспропорционирования свободных радикалов и ингибирования.
Исследование кинетики сорбции ионов Cu2+ из водных растворов их солей шерстяным волокном, а также кератином шерсти с привитыми гидроксамовыми кислотными группами показало, что время достижения равновесия в системе водный раствор – модифицированный сорбент по сравнению с немодифицированным несколько сокращается и составляет 60 мин против 75 мин, а степень извлечения ионов металла увеличивается и достигает 90–92%.
Кинетика сорбции ионов Cu2+ для исходного и модифицированного сорбента на основе кератина шерсти представлена на рис. 1.
В результате модификации поверхность сорбента имеет два типа слабокислотных, одноосновных центров сорбции. К имеющимся на поверхности кератина карбокcильным группам в исходном сорбенте W(–COO−H3N+–)W(–COOH)n, участвующим в сорбции катионов, добавляются привитые гидроксамовые (–СONHOH)m слабокислотные группы. В этом случае предельная сорбционная емкость (А∞) по отношению к ионам М2+ должна соотноситься с кислотными центрами сорбции в исходном и модифицированном сорбентах. Заполнение ионами М2+ кислотных групп на поверхности такого полифункционального ионита на завершающим участке изотермы сорбции происходит в соответствии с количеством центров сорбции и их основностью. В исходном и модифицированном сорбенте присутствуют одноосновные кислотные группы. Амидные (–СОNH–) и солевые, цвиттерионные ($--{\text{NН}}_{3}^{ + }$ –ООC–) группы не могут участвовать в ионном обмене катионов по причине их низкой основности (электронодонорной способности). За ионный обмен (хемосорбцию и протодесорбцию) катионов М2+ должны отвечать кислотные группы сорбентов в анионной форме.
Введение гидроксамовых кислотных групп в состав модифицированных образцов увеличивает количество кислотных центров сорбции на поверхности биополимера, способных образовывать с ионами d-металлов металлокомплексы, усиливает гидрофильные свойства и набухаемость сорбента, что увеличивает сорбционную емкость сорбента и способствует сокращению времени установления равновесия в таких гетерофазных системах.
Установление эффективности процесса модификации было проведено путем сравнения величин предельной сорбционной емкости образцов исходного и модифицированного кератина шерсти по отношению к ионам Cu2+. Для определения предельной сорбционной емкости исходного и модифицированного сорбентов были получены изотермы сорбции ионов меди из водных растворов сульфатов при 293 К (рис. 2).
Рис. 2.
Изотермы сорбции ионов меди образцами модифицированного (1) и исходного (2) шерстяного волокна.

Заполнение таких моно- и полифункционального ионитов начинается с заполнения слабокислотных центров сорбции в анионной W(–COO−)n форме катионами М2+. В этом случае карбоксильные и гидроксамовые группы можно рассматривать как одноосновные, и их заполнение многозарядными катионами (Сu2+) будет проходить по однотипному ионообменному механизму в анионной форме с образованием сшивок полимерных молекул:
– с участием карбоксильных групп сорбентов
– с участием гидроксамовых групп сорбентов.
Практически одинаковая константа Ленгмюра (КL) для исходного и модифицированного сорбента (табл. 1) и превышение предельной сорбции ионов меди модифицированным сорбентом по сравнению с исходным практически в три раза свидетельствует об однотипности заполнения центров сорбции с карбоксильными и гидроксамовыми кислотными группами. Это позволяет представить соотношение активных центров сорбции в сравниваемых сорбентах как (m + n)/n = = (2 + 1)/(1) = 3/1.
Таблица 1.
Параметры обработки изотерм сорбции ионов меди исходным и модифицированным образцами шерсти по модели Ленгмюра
| Наименование образца | 1/(А∞KL) | 1/А∞ | Коэффициент корреляции | KL | А∞, моль/кг |
|---|---|---|---|---|---|
| Исходный образец | 0.007 ± 3 × 10–4 | 1.672 ± 0.085 | 0.99 | 238 | 0.59 |
| Модифицированный образец | 0.002 ± 4.9 × 10–4 | 0.558 ± 0.023 | 0.99 | 279 | 1.79 |
Экспериментальные данные можно описать уравнением изотермы адсорбции Ленгмюра:
где К – концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, л моль–1; А∞ – предельная, или максимальная сорбционная емкость полимера по данному металлу, моль/кг; С – равновесная концентрация сорбата, моль/л.Линеаризация изотермы сорбции позволяет графически определить в уравнении Ленгмюра величины А∞ и КL из опытных данных по распределению исследуемого сорбата в гетерофазной системе “водный раствор–белковый сорбент”.
Результаты обработки изотерм сорбции ионов меди исходным и модифицированным шерстяным волокном по модели Ленгмюра представлены в табл. 1.
Увеличение предельной сорбции модифицированного сорбента по сравнению с исходным в три раза (табл. 1) при однотипности их центров сорбции и близких значениях констант Ленгмюра (${{К_{{\text{L}}}^{'}} \mathord{\left/ {\vphantom {{К_{{\text{L}}}^{'}} {{{К}_{{\text{L}}}}}}} \right. \kern-0em} {{{К}_{{\text{L}}}}}}$ = 279/238 = 1.17) может произойти только за счет количественного увеличения слабокислотных, одноосновных центров сорбции.
Таким образом, экспериментальные данные по сорбции ионов меди на волокнах шерсти хорошо аппроксимируются уравнением Ленгмюра, а из значений величин предельной сорбции (А∞) (табл. 1), полученных в ходе обработки изотерм сорбции с использованием этого уравнения, следует, что модифицированный образец обладает сравнительно высокой связывающей способностью по отношению к ионам меди.
В исходном кератине количество карбоксильных кислотных групп превышает количество основных аминогрупп. Избыточные карбоксильные слабокислотные, одноосновные группы в исходном сорбенте дополняются в поверхностном слое модифицированного сорбента одноосновными слабокислотными гидроксамовыми группами. В итоге модификация проходит с увеличением количества слабокислотных центров сорбции при практическом сохранении исходных слабокислотных центров сорбции. Поскольку суммарная величина центров сорбции (m + n) оказывается в три раза больше исходных (n), следовательно, новых центров сорбции в модифицированном сорбенте практически в два раза больше чем карбоксильных групп в исходном сорбенте.
Значительное влияние на величину равновесной обменной емкости оказывает кислотность (рН) раствора. Существует некоторое оптимальное для данной гетерофазной системы “водный раствор соли металла–шерстяное волокно” значение рН = рНопт, при котором сорбционная емкость кератина шерсти достигает максимума. Для определения оптимального диапазона значений рН было изучено влияние кислотности раствора сульфата меди на сорбцию ионов Cu(II) шерстяным волокном. Результаты представлены на рис. 3.
Белки, как амфотерные соединения, в водных растворах в зависимости от рН могут существовать в следующих формах:
Образование электронейтральной промежуточной формы (II) с эквивалентным количеством амино- и карбоксильных групп определяется кислотностью водной фазы с учетом рКа кислотных групп (рКа-СООН ≈ 4.5 и ${\text{р}}{{{\text{К}}}_{{{\text{а - }}}}}_{{{\text{NH}}_{3}^{ + }}}$ ≈ 9.5) рНI = = (1/2)(рКа-СООН + ${\text{р}}{{{\text{К}}}_{{{\text{а - }}}}}_{{{\text{NH}}_{3}^{ + }}}$) ≈ 7. В кератине, благодаря избытку карбоксильных групп, изоэлектрическая точка смещена в кислую область. Именно избыточные W(–СОО–)n карбоксильные группы кератина шерсти (–СОО–${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–СОО–)n в анионной форме ответственны за сорбцию катионов металлов (М2+) в кислой области водных растворов при рН < 7. Катионная (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–COOH)m и цвиттерионная (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–СОО–)(m) формы практически не могут участвовать в ионообменной сорбции М2+, поскольку не имеют избыточных электронодонорных (NH2–) или анионных (–СОО–) функциональных групп. В связи с этим при увеличении кислотности раствора от нейтрального значения рН (рН 7) и приближении к изоэлектрической точке должна резко уменьшиться сорбционная емкость кератина шерсти, что и подтверждает эксперимент (рис. 3). Такой механизм подавления сорбции катионов М2+ на карбоксильных группах кератина в области рН от 3.3 до 5.5 можно объяснить конкуренцией между катионом металла и протоном (М2+/2Н+) за электроноакцепторные карбоксильные группы кератина шерсти в анионной форме. При протодесорбции наблюдается преобладающая сорбция протона, которая с увеличением кислотности (с уменьшением рН водной фазы) практически полностью подавляет сорбцию катионов металла на одноосновных кислотных группах.
Суммарный процесс сорбции/протодесорбции катионов М2+
Сорбционные свойства кератина шерсти по отношению к протону (Н+) и катиону металла (М2+) будут обусловлены, главным образом, –СОО– группами, которые могут выступать в качестве одноосновных центров сорбции.
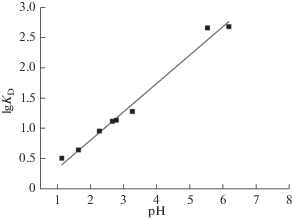
Из рис. 3 видно, что зависимость степени извлечения ионов металла от рН водного раствора имеет резкий скачок в области изоэлектрической точки кератина и кислотности в области полупревращения карбоксильных групп при переходе из анионной в Н-сопряженную форму (рН1/2 = рКа-СООН ≈ 4.5), отмечается повышенная сорбция на избыточных карбоксильных группах в анионной форме (–СОО–) при рН 5.5–6.2 и пониженная сорбция в области повышенной кислотности (при рН < 3), когда практически все электронодонорные центры сорбции находятся в кислой, неактивной Н-форме (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$– и –СООН).
В интервале рН 3–5.5 резкий рост сорбции согласуется с данными [8], свидетельствующими о практически линейной зависимости сорбции ионов меди на шерсти от кислотности раствора в этой области рН с участием в сорбции карбоксильных групп сорбента в анионной форме (‒СОО–)n. Цвиттер-ионная форма (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–COO–)m (внутренняя средняя соль), как и катионная (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–COOН)m+ n, не активна в сорбции катионов металлов.
При рН 6.5–7 отмечается максимум извлечения ионов металла, обусловленный сорбцией анионной формой сорбента (${\text{NH}}_{{\text{3}}}^{{\text{ + }}}$–)mW(–COO–)m+n с участием в качестве монодентатных центров сорбции карбоксильных групп (аминогруппа в протонированной форме не должна проявлять дентатных свойств) [26]. Ограничение интервала рН 6.2 связано с началом выпадения в осадок гидроксида меди ↓Сu(ОН)2. Несмотря на то, что карбоксильные и аминогруппы сорбента в щелочной области рН находятся в основной, электронодонорной форме (NH2–)nW(–COO–)n+m с повышенной сорбционной активностью к протону и катионам металла, они не участвует в сорбции катионов d-металлов. В щелочной области рН протонов практически нет, а избыточные гидроксид- ионы среды образуют трудно растворимые гидроксиды и оксиды металлов и переходят в осадок.
Наибольшее изменение рН равновесного раствора до и после сорбции наблюдается в интервале рН 3–7. В данном интервале кислотности исходного раствора рН увеличивается в процессе сорбции на 1.8–2.7 единиц. Причиной изменения рН в исследуемой системе может быть сорбция ионов водорода в кислой области исходного раствора.
Процесс сорбции почти всегда можно описывать как обычную, хотя и двухфазную, химическую реакцию. К сорбционным системам применим закон распределения. Сорбционные равновесия характеризуются коэффициентом распределения КD, представляющим собой отношение общей концентрации вещества в фазе сорбента к его общей концентрации в растворе:
Как видно из табл. 2 и рис. 4, тангенс угла наклона линейной зависимости lg KD–рН для двухзарядных катионов (Cu2+) намного меньше единицы и составляет: tg α = 0.47 ± 0.029. Это свидетельствует о том, что сорбции катионов металла проходит на фоне конкурентной сорбции протонов на одних и тех же электронодонорных центрах сорбции в эквивалентном соотношении М2+/2Н+. С увеличением кислотности протон вытесняет катионы металла с центров сорбции и сорбция катионов металла в области рН < 6 проходит в форме конкурентной сорбции/протодесорбции.
Таблица 2.
Параметры уравнения lg KD = const + n(pH) для системы “водный раствор H2SO4–CuSO4–модифицированное шерстяное волокно”
| Ион металла | const | n | Коэффициент корреляции |
|---|---|---|---|
| Сu2+ | –0.12 ± 0.11 | 0.47 ± 0.029 | 0.98 |
Величина кислотности в точке полусорбции свидетельствует о том, что в обратимой протодесорбции участвуют анионные дентатные центры сорбции, в качестве которых на белковом сорбенте выступают карбоксильные группы, для которых точка полунейтрализациии рН1/2 = рКα-СOOH ≈ 4.5 [10] и которые смещают точку изонейтральности кератина в кислую область рНI ≈ 4.7.
ИК-спектры шерстяного волокна до и после проведения модифицирования акриламидом с гидроксиламином солянокислым представлены на рис. 5. Шерстяное волокно представляет собой полимер – белок, содержащий различные функциональные группы, такие как карбоксильная, амидная и аминогруппа, тиоловые группы, дисульфидные мостики, которые способны связывать катионы металлов [9].
В ИК-спектрах кератина шерсти, в первую очередь, следует отметить полосы амид I (1780–1600 см–1, где проявляются валентные колебания карбонильной группы для амидов), амид II (1650–1450 см–1, деформационные колебания связи N–Н в аминах и амидах) и амид III (1300–1250 см–1, валентные колебания связи С–N в амидах) [27]. Как видно из рис. 5, в ИК-спектре модифицированного шерстяного волокна наблюдаются изменения в этих областях, а также в области 2900–2950 см–1, для которой характерны интенсивные валентные колебания атомов Н, присоединенных к атомам С, О, N и S. Отмечается заметное изменение конфигурации пиков в спектре модифицированного сорбента, а также смещение положений полос поглощения относительно спектра исходного кератина шерсти. Так, наблюдается смещение полосы из положения 1456 см–1 в спектре исходного шерстяного волокна в положение в 1447 см–1 в спектре модифицированного шерстяного волокна. Наблюдаемые изменения в ИК-спектрах наглядно свидетельствуют о том, что модификация кератина акриламидом с гидроксиламином солянокислым позволила получить новый сорбент для извлечения ионов тяжелых металлов из водных растворов.
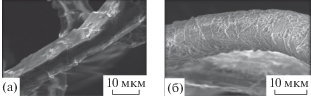
Улучшение сорбционных свойств можно объяснить тем, что в результате функционализации кератина шерсти в структуре волокон появляются гидроксамовые кислотные группы, способные эффективно связывать ионы тяжелых металлов. Изображения образцов шерсти до и после модифицирования, полученные с помощью сканирующего электронного микроскопа “VEGA 3 SB”, представлены на рис. 6а, 6б.
Немодифицированный кератин шерсти представляет собой гладкую структуру с четкими перекрывающимися черепичными краями. На модифицированном образце наблюдаются существенные поверхностные изменения – увеличение шероховатости. Это связано с введением в структуру кератина функциональных групп 2-пропен гидроксамовой кислоты.
ЗАКЛЮЧЕНИЕ
Исследованы сорбционные свойства кератина шерсти по отношению к ионам Cu2+. Обнаружено, что исходный сорбент обладает сравнительно невысокой сорбционной емкостью. Зависимость степени извлечения ионов меди шерстяным волокном от кислотности водной фазы имеет резкое изменение в области изоэлектрической точки, что обусловлено изменением степени диссоциации избыточных карбоксильных групп сорбента.
Выполнено химическое модифицирование шерстяного волокна акриламидом/гидроксиламином солянокислым с образованием на его поверхности гидроксамовых кислотных групп при сохранении избыточных карбоксильных групп исходного кератина.
Определены равновесно-кинетические характеристики сорбента. Время достижения равновесия в гетерофазной системе “водный раствор CuSO4–сорбент” несколько сокращается для модифицированного кератина по сравнению с немодифицированным и составляет 60 мин против 75 мин. Экспериментальные данные по сорбции ионов меди на шерстяном волокне хорошо аппроксимируются уравнением Ленгмюра. Значения предельной сорбционной емкости, полученные при обработке изотерм сорбции, свидетельствуют, что модифицированный кератин шерсти обладает высокой связывающей способностью по отношению к ионам меди. При использовании модифицированного сорбента величина предельной сорбции увеличивается практически в 3 раза по сравнению с исходным образцом, что согласуется с отношением количества слабокислотных одноосновных центров сорбции в модифицированном сорбенте [(НООС–)nW(–CONHOH)2n] к количеству слабокислотных одноосновных центров сорбции в немодифицированном сорбенте [(НООС–)nW] как (n + 2n)/n = 3/1.
Увеличение предельной сорбционной емкости шерстяного волокна в результате модифицирования обусловлено появлением в его структуре новых сорбционно-активных групп, что подтверждается данными ИК-спектроскопии и сканирующей электронной микроскопии.
Предложенный способ модифицирования кератина шерсти позволяет получить новый сорбент с слабокислотными функциональными группами (–COOH, –CONHOH), способный эффективно извлекать ионы тяжелых металлов из слабокислых водных сред.
Статья выполнена при поддержке гранта РФФИ № 18-03-00221.
Исследование проведено с использованием ресурсов Центра коллективного пользования научным оборудованием ФГБОУ ВО ИГХТУ.
Список литературы
Ki C.S., Gang E.H., Um I.C., Park Y.H. // J. Membrane Science. 2007. V. 302. P. 20.
Aluigi A., Vineis C., Tonin, C. et al. // J. Biobased Materials and Bioenergy. 2009. V. 3. P. 311.
Barone J.R., Schmidt W.F., Liebner C.F. // J. Applied Polymer Science. 2005. V. 97. P. 1644.
Wen G., Naik R., Cookson P.G. et al. // Powder Technology. 2010. V. 197. P. 235.
Zhang R., Wang A. // Journal of Cleaner Production. 2015. V. 87. P. 961.
Park M., Kim H.-Y., Jin F.-L. et al. // J. Industrial and Engineering Chemistry. 2014. V. 20. P. 179.
Hanzlíková Z., Braniša J., Jomová K. et al. // Separation and Purification Technology. 2018. V. 193. P. 345.
Naik R., Wen G., M.S.D. et al. // J. Applied Polymer Science. 2010. V. 115, P. 1642. https://doi.org/10.1002/app.31206
Monier M., Nawar N., Abdel-Latif D.A. // J. Hazardous Materials. 2010. V. 184. P. 118.
Taddei P., Monti P., Freddi G. et al. // J. Molecular Structure. 2003. V. 650. P. 105.
Kokot S., Feughelman M., Golding R.M. // Textile Res. J. 1973. V. 43(3). P. 146. https://doi.org/10.1177/004051757304300305
Kokot S., Feughelman M., Golding R.M. // Textile Res. J. 1972. V. 42(12). P. 704.
Simpson W.S., Mason P.C.R. // Textile Research J. 1969. P. 434.
Aluigi A., Tonetti C., Vineis C. et al. // J. Nanoscience and Nanotechnology. 2012. V. 12(9). P. 7250.
Perineau F., Farag K., Gaset A., Constant G. // J. Chemical Technology and Biotechnology. 1981. V. 31(1). P. 602.
Simpson W.S., Mason P.C.R. // Textile Research J. 1969. V. 39. P. 434.
Aluigi A., Corbellini A., Rombaldoni F., Mazzuchetti G. // Textile Research J. 2013. V. 83. № 15. P. 1574.
Yin Z., Chen M., Hu S., Cheng H. // Desalination and Water Treatment. 2016. V. 57. № 37. 17367.
Kar P., Misra M. // J. Chemical Technology & Biotechnology. 2004. V. 79. P. 1313.
Patil K., Smith S.V., Rajkhowa R. et al. // Powder Technology. 2012. V. 218. P. 162.
Никифорова Т.Е., Козлов В.А., Родионова М.В. // Журн. Прикл. Химии. 2010. Т. 83. Вып. 7. С. 1073.
Taddei P., Monti P., Freddi G. et al. // J. Molecular Structure. 2003. V. 650. P. 105.
Heliopoulos N.S., Papageorgiou S.K., Galeou A. et al. // Surface & Coatings Technology. 2013. V. 235. P. 24.
Шайхиев И.Г. // Вестник технологического университета. 2017. Т. 20. № 21. С. 139.
Khosa M.A., Ullah A. // J. Hazard. Mater. 2014. № 278. P. 360.
Альберт А., Сержент Е. Константы ионизации кислот и оснований. М.–Л.: Химия, 1964. 180 с.
Гордон А., Форд Р. Спутник химика. Физико-химические свойства, методики, библиография. Пер. с англ. канд. хим. наук Розенберга Е.Л. и канд. хим. наук Коппель С.И. М.: Мир, 1976. 641 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов