Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 461-466
Анализ адсорбции газов и паров на углеродных поверхностях методом молекулярной динамики
А. М. Толмачев 1, *, П. Е. Фоменков 1, Т. А. Кузнецова 1, А. С. Павлюченков 1
1 Московский государственный университет имени М.В. Ломоносова. Химический факультет
199992 Москва, Ленинские Горы, дом 1, строение 3, Россия
* E-mail: amtolmach@yandex.ru
Поступила в редакцию 22.02.2019
После доработки 21.03.2019
Принята к публикации 15.04.2019
Аннотация
Проведен молекулярно-динамический эксперимент для анализа изотерм адсорбции на поверхности графена при температурах ниже и выше критических для адсорбтивов. Показана возможность описания мономолекулярных изотерм адсорбции газов на плоских углеродных поверхностях уравнениями решеточной модели и уравнениями теории объемного заполнения микропор. Полученные результаты сравнены с данными об адсорбции в микропорах активных углей. При описании изотерм полимолекулярной адсорбции уравнениями БЭТ и Арановича проведен анализ заполнения каждого из слоев.
ВВЕДЕНИЕ
Современные адсорбционные технологии часто требуют использования высоких температур и давлений. Для разработки соответствующих процессов необходимы данные об абсолютных изотермах адсорбции газов. Если в случае микропористых адсорбентов имеются как экспериментальные изотермы [1], так и уравнения для их количественного описания [2, 3], то в случае макропористых адсорбентов экспериментальных избыточных изотерм при температурах выше критических, требующих использования высоких давлений, немного [4, 5], а их пересчет в абсолютные изотермы практически не проводился. Соответственно уравнений для их описания, позволяющих получать характеристики таких адсорбционных систем, практически нет. В этой связи разработка численных методов получения экспериментальных изотерм и методов их описания является важной задачей. В случае полимолекулярной адсорбции при температурах ниже критической значительный интерес представляет анализ последовательного заполнения слоев адсорбатом. В настоящей работе рассмотрен метод получения абсолютных изотерм адсорбции газов и паров на поверхности графена на основе молекулярно-динамического эксперимента и показана возможность их количественного анализа и описания уравнениями решеточной модели, теории объемного заполнения микропор (ТОЗМ) [6], БЭТ [7] и Арановича [8].
МЕТОДИКА ЭКСПЕРИМЕНТА
Моделирование проводилось в ячейке (12 × × 12 × 12 нм) с подвижными стенками и периодическими граничными условиями, в которую помещалась щелевидная микропора шириной h, ограниченная квадратными пластинами графена размером 5 × 5 нм (рис. 1).
Рис. 1.
Ячейка с микропорой шириной h, образованной двумя графеновыми поверхностями 5 × 5 нм. Атомы водорода на гранях поверхностей не указаны.

Ширина поры была равна 1.1 нм. В этом случае адсорбция осуществлялась как внутри поры, так и на внешних поверхностях. В ячейку добавлялось 10 000 молекул адсорбтива и проводился расчет молекулярно-динамических траекторий. Элементарный шаг интегрирования уравнения движения составил 1 фс. Длина траектории равнялась 1 нс. Координаты системы сохранялись каждую пикосекунду. Анализ траекторий проводился по последним 500 пикосекундам. Постоянная температура поддерживалась за счет коллизионного термостата [9], а давление поддерживалось с помощью баростата Ланжевена [10]. Обрезание кулоновских и ван-дер-ваальсовских взаимодействий происходило, если расстояние между атомами составляло больше 1.2 нм. Учет электростатических взаимодействий дальнего порядка не производился из-за незначительного вклада электростатики в общую энергию системы. При расчетах выше критических температур для адсорбтивов мгновенный снимок равновесного распределения метана в ячейке приведен на рис. 2. На рис. 3 приведены распределения плотностей в ячейке для температур выше и ниже критической.
Рис. 2.
Мгновенный снимок равновесного распределения метана в ячейке с микропорой при температуре выше критической (303 К).

Рис. 3.
Распределение при Т > Tкр плотностей в ячейке: (а) метана (пора 1.1 нм) при 370 К и давлениях (бар) в ячейке: 70 (▲), 200 (◆), 633 (◼); (б) этана (пора 1.0 нм) при 400 К и 200 бар; (в) метана (пора 1.1 нм) при 170 К (Т < Ткр) Пунктирные линии обозначают графеновые поверхности.

Из рис. 2, 3а, 3б видно, что при Т $ \gg $ Ткр адсорбция (конденсация) метана в поре 1.2 нм и этана в поре 1.0 нм сопровождается при относительно низких давлениях практически мономолекулярной адсорбцией на двух внешних поверхностях поры. Однако, как и при адсорбции в микропорах, наличие адсорбционного поля приводит к “конденсации” адсорбата и во втором слое при относительно высоких давлениях. На основании этих данных получали равновесные значения чисел молекул в микропорах и в первом слое на внешней поверхности поры m(P) и соответствующие равновесные давления, т.е. изотермы адсорбции в микропорах и изотермы монослойной адсорбции на углеродной поверхности.
Данные рис. 3в позволяли проанализировать изотерму полимолекулярной адсорбции и последовательное заполнение слоев адсорбата.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работах [11–14] было показано, что изотермы адсорбции в микропорах активных углей, рассчитанные методом молекулярной динамики, количественно совпадают с изотермами, полученными в физическом эксперименте. При этом для количественного описания экспериментальных (и рассчитанных) изотерм на микропористых активных углях при температурах выше критических для адсорбтива можно использовать уравнения теории объемного заполнения микропор (ТОЗМ) и систему уравнений абсолютной адсорбции Толмачева–Арановича, полученных в рамках решеточной модели, с заменой давления насыщенных паров адсорбтивов (Рs), используемых в качестве стандартных давлений при температурах ниже критических, на стандартные давления (Р*), которые находятся линейной экстраполяцией зависимостей логарифма давления насыщенного пара адсорбтива от обратной температуры в закритическую область температур.
Соответствующие уравнения представлены ниже [12, 13]:
(1)
$\ln a = \ln {{a}_{0}} - {{\left( {\frac{{RT}}{{{{E}_{0}}}}} \right)}^{2}}{{\ln }^{2}}\frac{{P{\text{*}}(T)}}{P}.$В большинстве случаев реальные размеры микропор допускают размещение в них 1-го или 2-х слоев адсорбата, и уравнения в рамках вакансионной модели для одно-(2,4,5) и двухслойного заполнения (3,4,5) имеют вид [13]:
(2)
$\begin{gathered} {\text{ln}}\frac{{{{X}_{{\text{1}}}}{\text{ (}}n{\text{)[1}} - {{Y}_{{\text{1}}}}{\text{ ]}}}}{{{{Y}_{{\text{1}}}}{\text{[1}} - {{X}_{{\text{1}}}}{\text{(}}n{\text{)]}}}} + {\text{2}}\frac{{{{\varepsilon }_{{{\text{01}}}}}}}{{kT}} - \frac{{{{\varepsilon }_{{{\text{11}}}}}}}{{kT}}{\text{6}}{{X}_{{\text{1}}}}{\text{(1)}} - \\ - \,\,\frac{{\varepsilon _{{11}}^{*}}}{{kT}}{\text{12}}{{Y}_{{\text{1}}}} = {\text{0,}} \\ \end{gathered} $(3)
$\begin{gathered} {\text{ln}}\frac{{{{X}_{{\text{1}}}}{\text{(}}n{\text{)[1}} - {{Y}_{{\text{1}}}}{\text{ ]}}}}{{{{Y}_{{\text{1}}}}{\text{[1}} - {{X}_{{\text{1}}}}{\text{(}}n{\text{)]}}}} + {\text{1}}{\text{.12}}\frac{{{{\varepsilon }_{{{\text{01}}}}}}}{{kT}} - \\ - \,\,\frac{{{{\varepsilon }_{{{\text{11}}}}}}}{{kT}}{\text{9}}{{X}_{{\text{1}}}}{\text{(1)}} - \frac{{\varepsilon _{{11}}^{*}}}{{kT}}{\text{12}}{{Y}_{{\text{1}}}}{\text{ }} = {\text{0,}} \\ \end{gathered} $В уравнениях (1)–(5) и далее: а, a1, a0 – равновесные при давлении Р и “предельная” при стандартном давлении газа Р* (моль кг–1) величины адсорбции; Е0 (кДж моль–1) – характеристическая энергия адсорбции; $a_{1}^{0}$ –емкость монослоя 1-го компонента (моль кг–1), Y1, X1– мольные доли первого компонента в равновесных объемном (в данном случае – вакансионном [15]) и адсорбционном растворах, ε11, $\varepsilon _{{11}}^{*}{\text{,}}$ ε01 – энергии парного взаимодействия в адсорбтиве, адсорбате и адсорбата с адсорбентом. Отметим, что уравнение (5) определяет мольную долю адсорбтива в объемной фазе, которая рассматривается как бинарный паровой раствор вакансий и адсорбтива. При монослойной адсорбции на внешней поверхности поры в уравнении (2) необходимо убрать коэффициент 2 при ${{{{\varepsilon }_{{01}}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{{01}}}} {kT}}} \right. \kern-0em} {kT}},$ поскольку адсорбат взаимодействует только с одной графитовой поверхностью (уравнение (2а) (2).
Результаты описания изотерм адсорбции метана и этана на углеродных поверхностях уравнениями (1) и (2)–(5) представлены на рис. 4а и 5а, а на рис. 4б, 5б представлены результаты обработки изотерм в соответствии с уравнением Дубинина–Радушкевича.
Рис. 4.
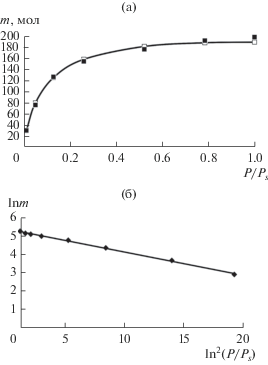
(а) Рассчитанная (сплошная кривая, первый слой) изотерма метана (m молекул) при 303 К на удвоенной углеродной поверхности и ее описани уравнениями (1) (⚪) и (2)–(5) (◼); (б) обработка этой изотермы в координатах уравнения (1).

Хорошо видно, что уравнения (1) и (2)–(5) количественно описывают изотермы монослойной поверхностной адсорбции.
Рис. 5.
(а) Рассчитанная (сплошная кривая, первый слой) изотерма этана при 333 К на удвоенной углеродной поверхности и ее описание уравнениями (1) (◻) и (2)–(5) (◼). (б) Обработка этой изотермы в координатах уравнения (1).
Это подтверждается данными таблиц, приведенными в [16], в которых сравниваются полученные в результате молекулярно-динамических расчетов изотермы адсорбции метана при адсорбции в микропорах (2 слоя) и на двух внешних поверхностях и относительные ошибки их описания уравнениями (1) и (2)–(5). Ошибки описания изотерм невелики и близки в обоих случаях.
В табл. 1, 2 сравниваются значения параметров уравнений при адсорбции метана и этана на поверхности и в микропоре. Наблюдается удовлетворительное соответствие параметров уравнений (1), (2)–(5), характеризующих соответствующие адсорбционные системы. Более пологий ход изотерм на поверхности связан с отсутствия взаимодействия со второй стенкой, что в случае уравнения (1) проявляется в уменьшении значений характеристической энергии.
Таблица 1.
Параметры уравнений (1) и (2)–(5) для адсорбции метана в микропоре и на удвоенной поверхности графена (первые слои)
| Т | 240 К | 303 К | 370 К | |||
|---|---|---|---|---|---|---|
| параметры | пора | поверхность | пора | поверхность | пора | поверхность |
| ms | 255 | 240 | 248 | 235 | 239 | 227 |
| ε0/k | –0.81 | –0.79 | –0.78 | –0.79 | –0.82 | –0.79 |
| Е0 | 10.6 | 7.7 | 11.2 | 8.9 | 12.3 | 10.1 |
Таблица 2.
Параметры уравнений (1) и (2)–(5) при адсорбции этана в микропоре и на удвоенной поверхности графен
| T | 273 K | 293 K | 333 K | |||
|---|---|---|---|---|---|---|
| параметры | пора | поверхность | пора | поверхность | пора | поверхность |
| ms (mol) | 209 | 204 | 203 | 196 | 199 | 185 |
| ε0/k | –0.74 | –0.64 | –0.75 | –0.65 | –0.76 | –0.66 |
| E0 | 9.8 | 9.2 | 10.4 | 9.7 | 10.8 | 9.1 |
Интересно отметить, что в отличие от метана при адсорбции несимметричных молекул этана значения параметра ε0/kT на поверхности меньше аналогичных значений в микропоре за счет разной ориентации молекул этана у поверхности. При этом в соответствии с решеточной моделью [12] значения ε0/k сохраняют постоянные значения при различных температурах. Это означает, что механизмы заполнения монослоя на поверхности и в микропоре аналогичны. Необходимы, конечно, дополнительные сравнительные исследования соответствующих систем.
При температурах ниже критической анализ данных, приведенных на рис. 3в, позволяет определить последовательность заполнения слоев адсорбата и сопоставить результаты обработки полимолекулярных изотерм с данными молекулярно-динамических расчетов. В качестве примера на рис. 6 приведена рассчитанная изотерма полимолекулярной адсорбции метана при Т = 170 К, а в табл. 3 и 4 приведены соответствующие данные для метана и этана.
Рис. 6.
Полимолекулярная изотерма метана (в координатах m, мол- P/Ps) на удвоенной поверхности графена (S = 5000 Å2) при температуре 170 К.
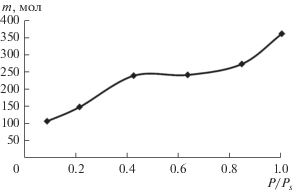
Таблица 3.
Распределение молекул метана на поверхности графена в поверхностных слоях при 170 К
| Р, бар | Количество молекул в слоях | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| 2 | 101 | 4 | 1 |
| 5 | 126 | 18 | 3 |
| 10 | 140 | 70 | 22 |
| 15 | 142 | 72 | 25 |
| 20 | 144 | 88 | 39 |
| 23.7 | 149 | 118 | 92 |
Таблица 4.
Распределение молекул этана в поре и на удвоенной поверхности графена в первом и втором слоях при различных температурах, меньших и больших критической (Ткр = 295 К)
| Т = 273 К | Т = 313 К | Т = 333 К | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| P/P* | a (мол) в поре | a1пов (мол) | a2пов (мол) | P/P* | a (мол) в поре | a1пов (мол) | a2пов (мол) | P/P* | a (мол) в поре | a1пов мол | a2пов мол |
| 0.02 | 159 | 107 | 2 | 0.02 | 49 | 26 | 0 | 0.01 | 30 | 19 | 0 |
| 0.08 | 168 | 115 | 3 | 0.04 | 103 | 54 | 2 | 0.03 | 59 | 39 | 1 |
| 0.21 | 182 | 144 | 7 | 0.09 | 149 | 110 | 5 | 0.06 | 119 | 77 | 3 |
| 0.41 | 199 | 177 | 31 | 0.18 | 170 | 128 | 17 | 0.13 | 148 | 115 | 11 |
| 0.51 | 203 | 184 | 45 | 0.36 | 183 | 159 | 41 | 0.25 | 168 | 142 | 23 |
| 0.62 | 205 | 189 | 64 | 0.53 | 188 | 171 | 64 | 0.38 | 176 | 158 | 48 |
| 0.73 | 206 | 198 | 129 | 0.71 | 193 | 181 | 109 | 0.50 | 183 | 166 | 72 |
| 0.82 | 207 | 202 | 138 | 0.89 | 196 | 189 | 143 | 0.63 | 185 | 174 | 108 |
| 1 | 209 | 204 | 142 | 1 | 196 | 192 | 175 | 1 | 191 | 185 | 169 |
Данные табл. 3 позволяют проследить при каких заполнениях первого слоя начинается заполнение второго и третьего слоев, а при адсорбции этана (табл. 4) интересно сравнить заполнение микропор, первых и вторых слоев при переходе от Т < Ткр к температурам незначительно превышающим критическую для этана (295 К). Отметим, что при температурах, незначительно превышающих критическую для этана, адсорбция во втором слое вносит существенный вклад в общую адсорбцию на поверхности и при относительно низких давлениях, т.е. влияние адсорбционного поля проявляется достаточно заметно.
Результаты описания полимолекулярных изотерм адсорбции метана и этана (двухслойные при Т > Ткр) уравнениями БЭТ [7] и Арановича [8] представлены в табл. 5. Несмотря на то, что определение емкости монослоя (am(мол.)) было недостаточно точным, полученные результаты показывают удовлетворительные соответствия при сравнении заданной в численном эксперименте поверхности с поверхностями, полученными при расчете по обоим уравнениям. При этом адсорбционные площадки молекул, рассчитанные с экспериментальной поверхностью, близки и согласуются с литературными данными.
Таблица 5.
Емкости монослоя am (молекул.), площадки молекул (Sa, Å–2) и поверхности графена S (Å–2), найденные в молекулярно-динамическом эксперименте и рассчитанные с экспериментальными Sa (Å–2) по уравнениям БЭТ и Арановича. Пояснения в тексте
| Метан, 170 К | Этан, 273 К | |||||
|---|---|---|---|---|---|---|
| S = 2500 Å2 | am (мол.) | Sa, Å–2 | S, Å–2 | am (мол.) | Sa, Å–2 | S, Å–2 |
| Эксперимент | 149 | 16.78 | 2500 | 102 | 24.5 | 2500 |
| БЭТ | 146.1 | 17.11 | 2450 | 96.2 | 26.0 | 2360 |
| Аранович | 154.8 | 16.15 | 2597 | 95.1 | 26.3 | 2329 |
| Этан, 313 К | Этан, 333 К | |||||
| Эксперимент | 96 | 26.0 | 2500 | 92.5 | 27.0 | 2500 |
| БЭТ | 93.6 | 26.9 | 2435 | 90.9 | 30.9 | 2275 |
| Аранович | 97.8 | 25.1 | 2542 | 95.5 | 24.4 | 2578 |
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00333.
Список литературы
Толмачев А.М., Годовиков И.А., Кузнецова Т.А., Крюченкова Н.Г. // http://www.adsbank.chem.msu.ru.
Tolmachev A.M. // Adsorption of Gases, Vapors and Liquids. 2012. Publishing Group Ltd. “Granica”. M. P. 214.
Толмачев А.М., Кузнецова Т.А., Крюченкова Н.Г., Фоменков П.Е. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 4. С. 339.
Specouis J., Findenegg G.N. // Ber. Bunsenges. Phys. Chem. 1980. V. 84. № 7. P. 690.
Findenegg G.N., Loring R. // J. Chem. Phys. 1984. V. 81. № 7. P. 3270.
Dubinin M.M. // Progress in surface and membrane Sci. N.Y.: Acad. Press, 1975. V. 9. P. 1.
Brunauer S. // Oxford Univ.Press. 1943.
Аранович Г.Л. // 1988. Журн. физич. химии. Т. 62. № 11. С. 3000.
Grest G.S., Kremer K. // 1986. Phys. Rev. A. V. 33(5). P. 3628.
Feller S.E., Zhang Y., Pastor R.W., Brooks B.R. // J. Chem. Phys. 1995. 103(11). P. 4613.
Толмачев А.М., Анучин К.М., Фоменко П.Е., Гумеров М.Р. // ЖСХ . 2018. Т. 59. № 8. С. 2013.
Толмачев А.М., Анучин К.М., Бибин А.В., Крюченкова Н.Г., Фомкин А.А. // Коллоидный журнал. 2012. Т. 74. № 6. С. 769.
Толмачев А.М., Годовиков И.А., Кузнецова Т.А. // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 2. С. 145.
Фоменков П.Е., Гумеров М.Р., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. С. 374.
Aranovich G.L. // Colloid and Interface Science. 1995. V. 141. № 1. P. 30.
Толмачев А.М., Фоменков П.Е., Кузнецова Т.А., Анучин К.М., Гумеров М.Р. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 5. С. 411.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


