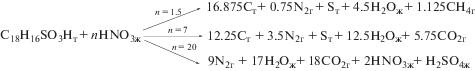Физикохимия поверхности и защита материалов, 2019, T. 55, № 6, стр. 582-587
Термическая стабильность сульфокатионита ку-2*8 в контакте с азотной кислотой в изохорных условиях
А. С. Емельянов 1, 2, А. В. Родин 1, 2, *, Е. В. Белова 2, **, В. Л. Виданов 3
1 ФБУ “Научно-технический центр по ядерной и радиационной безопасности”
107140 Москва, ул. Малая Красносельская, 2/8, корп., Россия
2 ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина
119071 Москва, Ленинский проспект, 31, корп. 4, Россия
3 Акционерное общество “Высокотехнологический научно-исследовательский институт неорганических материалов им. академика А.А. Бочвара”
123098 Москва, ул. Рогова, 5а, Россия
* E-mail: rodin@secnrs.ru
** E-mail: bl174@bk.ru
Поступила в редакцию 12.07.2018
После доработки 17.10.2018
Принята к публикации 24.10.2018
Аннотация
Изучена термическая стабильность смесей катионита КУ-2*8 с 4 и 12 моль/л азотной кислотой в изохорных условиях методом дифференциально-сканирующей калориметрии. Определено, что теплота взаимодействия катионита КУ-2*8 с 4 и 12 моль/л азотной кислотой при температурах менее 200°С составляет 310–320 и 1730–1890 кДж/кг соответственно. Отмечена двустадийность процесса тепловыделения для смесей катионита КУ-2*8 с азотной кислотой в исследуемом диапазоне температур. Показано негативное влияние облучения на термическую стабильность катионита КУ-2*8 в контакте с 4 моль/л азотной кислотой в изохорных условия, приводящее к расширению температурной области протекания экзотермических процессов, 60–180°С при поглощенной дозе 2 МГр, вместо 110–185°С для необлученных образцов, и увеличению значения теплового эффекта до 430 кДж/кг.
ВВЕДЕНИЕ
Катионит КУ-2*8 относится к группе сорбентов-сополимеров стирола с дивинилбензолом (рис. 1) и является сильнокислотным катионитом.
Он широко применяется благодаря химической, механической и термической устойчивости, в частности в качестве перспективного сорбента редкоземельных элементов при переработке апатитовых руд [1, 2]. Также рассматривается возможность применения сульфокатионитов для целей выделения и разделения трансурановых элементов [3–7]. В рамках разрабатываемой технологии переработки СНУП топлива реакторной установки БРЕСТ для разделения Am-Cm предложено использовать вытеснительную хроматографию под давлением [8]. В качестве носителя в хроматографическом процессе используется сильнокислый катионит типа КУ-2*8.
Окислительные процессы с участием органических сорбентов и азотнокислых сред, сопровождаемые выделением газообразных продуктов и повышением давления в сорбционном оборудовании, представляют повышенную пожаровзрывоопасность, они уже не раз являлись причинами аварий на радиохимических предприятиях. Разгерметизация оборудования представляет повышенную опасность в связи с возможным выходом радиоактивных веществ в окружающую среду. Основное количество аварий связано с использованием анионообменных смол [9, 10], меньше – с использованием катионитов [11]. Для обоснования безопасности технологических процессов, в том числе определения безопасных условий при обращении с ионообменными материалами на радиохимических предприятиях необходимы сведения об их термической стабильности, в том числе в контакте с окислителями [12–14].
Термическую стабильность катионитов исследовали ранее как в водородной форме [15–17], так и в контакте с азотной кислотой [18, 19]. Было показано, что при 110°С наблюдается потеря веса сульфокатионитов КУ-1 и КУ-2, обусловленная удалением воды, а также происходит десульфирование с участием остаточной воды в катионите и образование серной кислоты. Повышение температуры до 150 и 185°С приводит к накоплению не только серной, но и сернистой кислот. Было отмечено, что водородные формы катионитов менее устойчивы, чем соответствующие соли [15]. Нагрев в открытом сосуде смесей катионитов (КУ-2,КРФ, DOWEX-HCR-S) с азотной кислотой концентрацией 3–8 моль/л до температур 130–140°С сопровождается слабым газовыделением и незначительным тепловыделением [12].
Данных по устойчивости при повышенных температурах сульфокатионитов в контакте с азотной кислотой в изохорных условиях, необходимых для оценки безопасности хроматографического процесса разделения америция и кюрия, практически нет. В литературе приведены лишь отрывочные сведения, что при нагреве в автоклаве смесей катионитов (КУ-2, его аналога DOWEX-HCR-S и КРФ) с азотной кислотой концентрацией 7.8 моль/л при температурах 130–135°С наблюдались небольшие экзотермические эффекты (саморазогрев на 15–30°С) без резкого повышения давления в реакционном сосуде [12]. Выдержка в закрытой установке при температуре 90–96°С в течение 24 ч смесей органического катионита SuperLig 644 с 5 моль/л азотной кислотой показала отсутствие опасностей, связанных с накоплением твердых частиц, нестабильностью твердых веществ или образованием экзотермических соединений, однако возможна умеренная опасность генерации газа [18]. При проведении процесса разделения Am-Cm сорбент получает значительные радиационные повреждения, которые меняют как его физические, так и химические свойства [4], что также необходимо учитывать при проведении оценки безопасности технологического процесса [13].
С целью изучения окисляющей способности азотной кислоты на сорбент КУ-2*8 в изохорных условиях, в том числе на радиационно-деградированный катионит, и определения тепловых эффектов взаимодействия были проведены эксперименты с использованием дифференциально-сканирующей калориметрии в герметизируемых тиглях.
МЕТОДИКА ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТОВ
Для предварительной оценки потенциальной опасности системы катионит–раствор азотной кислоты в изохорных условиях рассчитана теплота взаимодействия компонентов с применением программного средства CHEETAH [20]. Энтальпию образования мономерного звена сорбента рассчитывали с применением метода групп Бенсона [21]. При этом руководствовались принципом максимальной величины тепловыделения, для чего оптимизировали конечный состав продуктов реакций, позволяющий получить наибольшее значение.
Для исследований термической стабильности сульфокатионита в контакте с азотной кислотой в закрытом аппарате сорбент промывали раствором азотной кислоты (с концентрацией 4 и 12 моль/л) со скоростью 50 колоночных объемов в час в течение 30 мин и после отбирали образец (совместно с водной фазой) из колонки, который помещали в герметизируемый тигель. Термограммы исследуемых образцов в изохорных условиях определяли методом дифференциально-сканирующей калориметрии (ДСК) на калориметре ДСК-500.
Использовали стальные тигли, герметизируемые с помощью тефлоновой и алюминиевой прокладок (рис. 2). Масса тигля вместе с прокладками составляла 1.190–1.220 г, масса навески исследуемой системы – до 20 мг. Образцы нагревали со скоростями: 1 или 5 градусов в минуту в интервале 50–250°С. В качестве образца сравнения (эталона) использовали пустой тигель. Печь ДСК (термоблок) продували воздухом с фиксированным расходом (54 мл/мин). Использовали только данные экспериментов, в которых изменение массы тигля с образцом не превышало 0.5 мг.
Для первичной обработки данных ДСК экспериментов и расчета тепловых эффектов взаимодействия, использовали специализированное программное обеспечение TSS фирмы ЗАО Химинформ [22]. Все экспериментально определенные параметры взаимодействия приведены на единицу массы смеси катионита КУ-2*8 с азотной кислотой соответствующей концентрации.
Для корректного расчета тепловых эффектов были получены экспериментальные базовые линии при нагреве пустого тигля с заданной скоростью. Сигнал измерительного блока калориметра, полученный в этих экспериментах, вычитали из сигнала для исследуемого образца.
Для оценки влияния облучения на термическую стабильность катионита КУ-2*8 использовали ускоритель УЭЛВ-10-10-С-10 (ЦКП ФМИ ИФХЭ РАН) с энергией электронов 8 МэВ. Облучение сорбента проводили в воде. Поглощенная доза составляла 3.2 кГр за один проход пробирки, закрепленной на вращающейся карусели, сквозь вертикально сканирующий пучок электронов. Полная поглощенная доза для исследованного образца составила 2 МГр.
Для дозиметрии использовали пленки сополимера с феназиновым красителем марки СОПД(Ф)Р–5/50 с диапазоном измеряемых поглощенных доз от 5 до 50 кГр фотонного и электронного излучения, изготовленные на ФГУП “ВНИИФТРИ”. Дозиметр размером 10 × 30 мм запаивали в полиэтиленовую пленку и опускали на тонкой проволоке в пробирку с дистиллированной водой. Для набора достаточной для измерения дозы пробирку пропускали сквозь пучок электронов 5–6 раз. Дозу определяли спектрофотометрически по оптической плотности пленки с помощью градуировочной таблицы.
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Для количественной характеристики потенциальной опасности рассчитали максимально возможное тепловыделение при протекании экзотермической реакции взаимодействия катионита КУ-2*8 и раствора азотной кислоты при различных соотношениях. Примеры рассмотренных реакций представлены на уравнении (1).
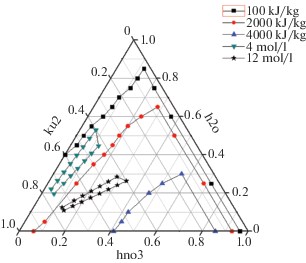
Получены данные по максимально возможному тепловыделению для смесей с различным соотношением компонентов в системе катионит КУ-2*8– азотная кислота–вода. На основании этих результатов построена тройная диаграмма с изолиниями, отвечающим энергиям тепловыделения в 1000, 2000 и 4000 кДж/кг на которую нанесли область предполагаемых составов для смеси катионита с 4 и 12 моль/л азотной кислотой (рис. 3).
Рис. 3.
Тройная диаграмма с изолиниями по энергиям тепловыделения 1000, 2000, 4000 кДж/кг, а также примерный состав исследуемой системы, отвечающий сорбенту, находящемуся в контакте с 4 моль/л азотной кислотой (треугольник вниз) и 12 моль/л азотной кислотой (звезда).
Уравнение 1. Примеры реакций разложения сорбента в контакте с азотной кислотой, при которых выделяется наибольшее количество тепла в зависимости от количества азотной кислоты.
Как видно из представленного графика, эти смеси находятся в областях с потенциально значительным тепловыделением. Принимая во внимание оценочное значение теплоемкости рассматриваемых смесей на уровне 2–4 кДж/кг К, в случае быстрого выделения тепла реакций взаимодействия катионита КУ-2*8 с растворами азотной кислоты (порядка 1500 кДж/кг для смесей с 4 моль/л азотной кислотой и порядка 3000 кДж/кг для смесей с 12 моль/л азотной кислотой) его будет достаточно для разогрева реагирующей смеси более чем на 300–600°С. Это приведет к значительному повышению давления за счет выделения газообразных продуктов реакции и испарения воды, что представляет опасность разрыва колонны. Таким образом эти составы требуют детального экспериментального изучения для установления реальных теплот взаимодействия сорбента КУ-2*8 с азотной кислотой, температурных областей протекания экзотермических процессов, скоростей выделения тепла и оценки возможности протекания неуправляемых экзотермических реакций в условиях их предполагаемого использования.
ИССЛЕДОВАНИЕ ТЕРМИЧЕСКОЙ СТАБИЛЬНОСТИ СУЛЬФОКАТИОНИТА В КОНТАКТЕ С АЗОТНОЙ КИСЛОТОЙ В ЗАКРЫТОМ АППАРАТЕ
Как показала термодинамическая оценка, при контакте сорбента с раствором 4 моль/л азотной кислоты возможно значительное тепловыделение, представляющее опасность для технологического процесса фракционирования Am и Cm. Для оценки пожаровзрывоопасности в условиях закрытого аппарата были проведены исследования методом ДСК сорбента КУ-2*8 в контакте с 4 моль/л азотной кислотой в закрытых тиглях.
Термограммы образцов сорбента КУ-2*8 в контакте с 4 моль/л азотной кислотой в закрытых тиглях при скоростях нагрева 1 и 5 К/мин представлены на рис. 4.
Рис. 4.
Изменение теплового потока при нагреве образцов КУ-2*8 в контакте с 4 моль/л азотной кислотой в закрытом тигле со скоростями 1 и 5 К/мин, изменение скорости теплового потока при скорости сканирования 5 К/мин.
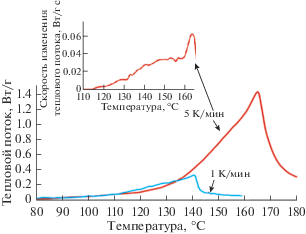
В закрытом тигле для образца сорбента с 4 моль/л азотной кислотой экзотермический эффект начинается при температурах 110–120°С. Значения тепловых эффектов для различных скоростей нагрева очень близкие и составляют 310–320 Дж/г. Предварительно можно сделать вывод о протекании минимум двух последовательных процессов взаимодействия, что наблюдается графически по рис. 4, где для скорости нагрева образца 5 К/мин тепловой поток непрерывно увеличивается с нарастающей скоростью до значений температуры 150–160°С, после чего скорость снижается и снова увеличивается. Также можно прийти к выводу об отсутствии значимого количества параллельных конкурирующих процессов, обладающих различными теплотами, что приводило бы к разнице в определяемой суммарной теплоте взаимодействия при изменении скорости нагрева.
Таким образом можно полагать, что при нарушении температурного режима проведения технологического процесса фракционирования Am и Cm, которое может быть вызвано как подачей в рубашку колонны греющего пара в момент контакта сорбента КУ-2*8 с азотной кислотой на операции перевода катионита в водородную форму, так и наличием не элюированных тепловыделяющих радионуклидов, возможно инициирование процесса окисления катионита азотной кислотой. В результате температура внутри сорбента будет повышаться за счет теплоты химического взаимодействия, при этом суммарный эффект должен зависеть и от характеристик теплообмена реагирующей среды со стенкой колонны.
ИССЛЕДОВАНИЕ ТЕРМИЧЕСКОЙ СТАБИЛЬНОСТИ ОБЛУЧЕННОГО СУЛЬФОКАТИОНИТА В КОНТАКТЕ С АЗОТНОЙ КИСЛОТОЙ В ЗАКРЫТОМ АППАРАТЕ
Как было показано ранее [23, 24], при облучении сорбентов протекают физико-химические процессы, приводящие к их разрушению, при этом продукты деструкции потенциально могут взаимодействовать с окислителем при меньшей температуре, чем исходная смола. В связи с этим был исследован облученный сорбент при контакте с 4 моль/л азотной кислотой в условиях герметичного тигля. Термограмма для облученного до поглощенной дозы 2 МГр ускоренными электронами и необлученного образцов при контакте с 4 моль/л азотной кислотой в условиях герметичного тигля и скорости нагрева 5 К/мин представлена на рис. 5.
Рис. 5.
Изменение теплового потока при нагреве облученного до дозы 2 МГр (пунктирная линия) и необлученного (сплошная линия) образцов монодисперсного сульфокатионита в контакте с 4 моль/л азотной кислотой в закрытом тигле при скорости нагрева 5 К/мин.
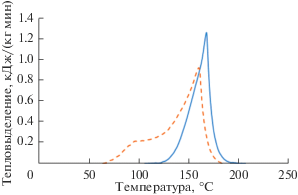
Как видно из приведенной термограммы тепловыделение при нагреве облученного катионита КУ-2*8 происходит в более широком температурном диапазоне, чем для необлученного (рис. 4). Диапазон температур наблюдаемого экзотермического эффекта составляет 60–180°С вместо 110–185°С при скорости 5 К/мин. Пики на термограмме, соответствующие различным скорость-лимитирующим стадиям окислительно-восстановительного процесса, располагаются дальше друг от друга, благодаря чему их легко различить. Значение суммарного количества тепла в случае облученного сорбента примерно на треть выше теплоты реакции для необлученного сорбента, и составляет 430 Дж/г. Температура, при которой отмечается тепловыделения для облученного образца, значительно ближе к условиям предполагаемой нормальной эксплуатации рассматриваемой системы. Таким образом при проведении теплофизического расчета сорбционной колонны тепловыделение за счет взаимодействия азотной кислоты с деградированной смолой обязательно должно быть учтено.
ИССЛЕДОВАНИЕ ТЕРМИЧЕСКОЙ СТАБИЛЬНОСТИ СУЛЬФОКАТИОНИТА В КОНТАКТЕ С КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТОЙ В ЗАКРЫТОМ АППАРАТЕ
Для оценки пожаровзрывоопасности технологического процесса фракционирования Am и Cm с учетом нарушения, связанного с применением концентрированной азотной кислоты (12 моль/л) вместо разбавленной (4 моль/л) на операции перевода сорбента в водородную форму, были проведены эксперименты в герметичном тигле с образцами катионита КУ-2*8 в контакте с 12 моль/л азотной кислотой. Полученные термограммы для образцов катионита в контакте с 12 и 4 моль/л азотной кислотой при скорости нагрева 5 К/мин представлены на рис.6.
Рис. 6.
Изменение теплового потока при нагреве необлученных образцов монодисперсного сульфокатионита в контакте с 4 моль/л (сплошная линия) и 12 моль/л (пунктирная линия) азотной кислотой в закрытом тигле при скорости нагрева 5 К/мин, изменение скорости теплового потока для образца сорбента в контакте с раствором кислоты концентрацией 12 моль/л.
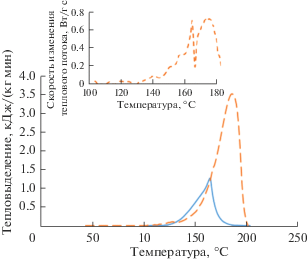
При сравнении данных термограмм можно сделать вывод о сильном влиянии концентрации азотной кислоты на величину интегрального тепловыделения, которое составляет 1730–1890 Дж/г, а также на максимальную скорость тепловыделения. Фиксируемый тепловой поток при нагреве образца со скоростью 5 К/мин увеличивается со значения ~1.39 до ~3.61 кДж/(кг мин), что требует большего теплообмена реагирующей смеси с окружающей средой для предотвращения саморазогрева в случае протекания экзотермического процесса. Температура начала фиксации экзотермического эффекта практически не меняется. На термограмме образца с 12 моль/л азотной кислотой также отмечается характерный излом кривой теплового потока, как и для образца с 4 моль/л кислотой, что можно наблюдать по кривой скорости изменения теплового потока.
ВЫВОДЫ
Проведенные исследования взаимодействия катионита КУ-2*8 с азотной кислотой показывают:
– консервативная термодинамическая оценка теплоты взаимодействия катионита КУ-2*8 с азотной кислотой концентрацией 4 и 12 моль/л составляет ~1500 и 3000 кДж/кг соответственно;
– определенная методом дифференциально-сканирующей калориметрии теплота взаимодействия катионита КУ-2*8 с азотной кислотой концентрацией 4 и 12 моль/л в условиях герметичного тигля при температурах менее 200°С составляет 310–320 и 1730–1890 кДж/кг соответственно;
– отмечена по результатам анализов термограмм образцов катионита КУ-2*8 с азотной кислотой концентрацией 4 и 12 моль/л при скорости нагрева 5 К/мин двустадийность процесса тепловыделения при температуре менее 200°С;
– облучение катионита КУ-2*8 ускоренными электронами до поглощенной дозы 2 МГр приводит к расширению температурной области протекания процесса окисления. Диапазон температур составляет 60–180°С, вместо 110–185°С для необлученных образцов;
– изменение концентрации кислоты со значения 4 до 12 моль/л не приводит к снижению фиксируемой температуры начала тепловыделения, при этом увеличивается максимальная скорость тепловыделения. Наблюдаемый тепловой поток возрастает со значения ~1.39 до ~3.61 кДж/(кг мин).
По результатам исследований можно сделать вывод, что для операции перевода необлученного сорбента КУ-2*8 в водородную форму в случае нарушений возможно протекание экзотермических процессов окисления, представляющих пожаровзрывоопасность. При обращении с облученным сорбентом КУ-2*8 тепловыделение, за счет химического взаимодействия деградированного катионита с азотной кислотой, должно быть учтено в теплофизических расчетах проектируемого оборудования.
Работа выполнена за счет средств Программы Президиума РАН I.34 (проект 0137-2018-0051).
Список литературы
Туманов В.В., Папкова М.В., Михайличенко А.И., Конькова Т.В. // Успехи в химии и химической технологии. 2014. Т. 28. № 6. С. 31–33.
Папкова М.В., Сайкина О.Ю., Михайличенко А.И., Конькова Т.В. // Успехи в химии и химической технологии. 2015. Т. 29. № 3. С. 83–85.
Пономарева М.А. Диссертация на соискание ученой степени к-та хим. наук: 02.00.04 Сп-Б.: ФГБОУ “Горный”. 2014. С. 136.
Гелис В.М., Харитонов О.В., Фирсова Л.А., Милютин В.В. и др. // Вопросы атомной науки и техники. 2014. Т. 76. № 1.С. 81–92.
Харитонов О.В., Милютин В.В., Фирсова Л.А., Козлитин Е.А. и др. // Вопросы радиационной безопасности. Озерск. 2016. Т. 3. № 83. С. 52–60.
Milutin V., Kharitonov O., Firsova L. et al.// International Conference on Fast Reactors and Related Fuel Cycles, 26–29 June 2017, Yekaterinburg, Russian Federation, paper CN245-237.
Gelis V., Kharitonov O., Firsova L. et al. // 13 Information Exchange Meeting, Seoul, Republic of Korea, 23–26 September 2014. P. 335–343.
Шадрин А.Ю., Двоеглазов А.Г., Масленников А.Г // Радиохимия. 2016. Т. 58. № 3. С. 234–241.
Milest F.W. // Isotopes and Radiation Technology. 1969. V. 6. № 4. P. 428–440.
Глаголенко Ю.В. Анализ причин разгерметизации сорбционной колонны на установке по получению плутония-238 радиоизотопного завода ПО “МАЯК”. Радиевый институт им. В.Г. Хлопина, ЦНИИ атоминформ, 1996.
Calmon C. // Chemical Engineering. 1980. V. 87. Iss. 23. P. 271–274.
Назин Е.Р., Зачиняев Г.М. Пожаровзрывобезопасность технологических процессов радиохимических производств. М.: НТЦ ЯРБ. 2009. 195 с.
РБ-060-10 / Положение об оценке пожаровзрывобезопасности технологических процессов радиохимических производств. Ростехнадзор. 2010.
РБ-125-17 / Оценка взрывопожароопасности сорбционных систем при переработке отработавшего ядерного топлива Ростехнадзор. 2017.
Полянский Н.Г., Тулупов П.Е. // Успехи химии. 1971. Т. 40. № 12. С. 2250.
Singare P., Lokhande R., Madyal R. // Open J. Physical Chemistry. 2011. V. 1. № 2. P. 45–54.
Simister C., Caron F., Gedye R. // J. Radioanalytical and Nuclear Chemistry. 2004. V. 261. Iss. 3. P. 523–531.
Nash C.A. SuperLig (TM) 644 Ion Exchange Resin Stability in Nitric Acid at Elevated Temperatures. Westinghouse Savannah River Company. 2001. P. 37.
Татарникова Ю.М. // Дни науки ОТИ НИЯУ МИФИ. Материалы конференции. 2017. С. 204.
Shanley E.S., Melhem G.A. // J. Loss Prevention in the Process Industries. 1995. Vol. 8. Iss. 5. P. 261–264.
Benson S.W., Cruickshank F.R., Golden D.M. et al. // Chem. Rev. 1969. V. 69. № 3. P. 279–324.
www.cisp.spb.ru.
Marsh S. Effects of Ionizing Radiation on Modern Ion Exchange Materials. Los Alamos National Laboratory. Report LA-U655-MS. 1993.
Бартенев С.А., Лазарев Л.Н., Романовский В.Н. и др. // Радиохимия. 2002. Т. 44. № 2. С. 150–153.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов