Физикохимия поверхности и защита материалов, 2020, T. 56, № 1, стр. 58-70
Синтез в обратных мицеллах биметаллических наночастиц Pd и Rh различной морфологии и их каталитические свойства
М. О. Сергеев 1, А. А. Ревина 1, 2, *, О. А. Боева 2, К. Н. Жаворонкова 2, В. И. Золотаревский 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: alex_revina@mail.ru
Поступила в редакцию 11.12.2018
После доработки 16.01.2019
Принята к публикации 30.01.2019
Аннотация
В работе представлены результаты синтеза биметаллических наночастиц (НЧ) на основе переходных металлов Rh и Pd в обратномицеллярном растворе Н2О/AOT/изооктан в присутствии флавоноида кверцетина и молекулярного кислорода. Использованы методы синтеза НЧ морфологии типа “сплав” Rh–Pd и “ядро/оболочка” Pd/Rh и Rh/Pd при мольном соотношении ионов 1 : 1. Показано, что в ОМР при наличии ионов Rh3+ и Pd2+ в первую очередь восстанавливаются ионы палладия, а сформированные НЧ Pd тормозят восстановление ионов родия. Проведены исследования стабильности смеси ОМР НЧ Rh и НЧ Pd. Показано, что в ОМР смесь НЧ со средним диаметром ~2.7 нм является устойчивой на протяжении не менее 25 дней. Полученные катализаторы на основе наночастиц Pd и Rh, адсорбированных на γ-Al2O3, проверялись на каталитическую активность в реакции гомомолекулярного изотопного обмена водорода. Выявлен синергетический эффект усиления каталитической активности для смеси НЧ Rh и НЧ Pd на γ-Al2O3.
ВВЕДЕНИЕ
Биметаллические наночастицы (БМНЧ), также известные как Янус-частицы, JPs [1, 2], все больше привлекают внимание исследователей и инженеров в связи с их оптическими [3, 4], каталитическими [5, 6], электрическими [7], магнитными [8] и другими свойствами. Ряд свойств обусловлен синергетическим эффектом [9, 10] и взаимным соотношением составляющих их элементов [11], которые приводят к возникновению новых свойств у БМНЧ по сравнению со свойствами монометаллических НЧ, что позволяет более широко использовать БМНЧ в различных приложениях. При этом их свойства становятся зависимыми не только от химического состава и размеров, но и от морфологии частиц [12, 13]. Выделяют такие структуры как “ядро/оболочка”, когда один металл полностью покрывается вторым [14], “сплав”, представляющий собой твердый раствор с однородно распределенными атомами одного и второго металла [15–18], интерметаллические НЧ [19, 20], сегментные НЧ, к которым относят сцепленные НЧ, сдвоенные (субкластерные) и многократно сдвоенные частицы, когда НЧ разных металлов имеют одну точку или плоскость/несколько плоскостей соприкосновения [21, 22]. По характеру взаимодействия и свойствам сформированных наноструктур к ним можно отнести монометаллические НЧ, нанесенные на металлическую подложку, и, как крайний случай их взаимодействия – “одноатомные центры на определенной грани другого металла” [23].
Для наноструктур типа “сплав” может возникнуть проблема смешиваемости металлов [24], которая решается изменением метода формирования НЧ, например, использованием импульсной лазерной техники [25], ионных пучков [26]. Но образующиеся частицы могут оказаться метастабильными.
Для случая структуры “ядро/оболочка” выделяют несколько ее подтипов [27]: а) сферические, б) гексагональные, в) НЧ, содержащие малые ядра, покрытые общей оболочкой, г) “наноматрешки”, когда один слой металла сменяется другим несколько раз, д) наличие ядра одного металла в полости замкнутой оболочки другого. Такое многообразие структур до определенной степени затрудняет выбор при решении проблемы получения материалов с заданными свойствами, но впоследствии дает возможность более тонко эти свойства настраивать. Для этого требуется научиться создавать БМНЧ с размерами и морфологией, которые необходимы для каждого конкретного применения.
Существует большое разнообразие методов синтеза НЧ, которое сводится к двум подходам “сверху вниз” и “снизу вверх”. Первый в основном представлен физическими и физико-химическими методами. Ко второму подходу можно отнести химические синтезы НЧ в присутствии полимеров [28–30], термическое разложение органометаллических соединений [31], использование координационных лигандов [32], применение биомолекул, например, ДНК [33], биотина [34], электроосаждение [35, 36], селективное травление [37], темплатный синтез [38], которые до определенной степени могут быть схожи между собой по своему синтетическому подходу. Среди них можно выделить синтез НЧ в обратных мицеллах [39, 40].
Преимущество обратных мицелл заключается в том, что формирование наночастиц происходит в полярном ядре мицеллы с более организованной средой, способствующей зарождению кластеров. Оболочка мицеллы, образованная молекулами ПАВ, ограничивает рост наночастиц, позволяя не только получать частицы, но и сохранять их малый размер. Такие растворители, как н-гексан, н-гептан, н-октан и изооктан не имеют активных функциональных групп, в результате чего не оказывают существенного воздействия на ПАВ, а значит, и на взаимодействие между ПАВ и металлом. При использовании обратных мицелл возможны два способа введения восстановителя в обратномицеллярный раствор (ОМР): 1) внутри первого раствора находится соль металла, внутри второго – восстановитель; 2) введение восстановителя в систему ПАВ/органический растворитель, а затем введение водного раствора соли металла и наоборот. Все это позволяет контролировать формирование НЧ как по размерам, так и по морфологии. Обратные мицеллярные системы характеризуются мольным отношением воды к ПАВ, коэффициентом солюбилизации, с которым напрямую связан размер мицелл: чем выше коэффициент, тем крупнее мицеллы [41]. Применение обратно мицеллярных растворов, прозрачных в широкой области спектра, позволяет использовать современные оптические методы для детектирования и изучения эволюции наночастиц. Обратные мицеллы на основе ионогенных ПАВ с двумя цепями гидрофобной части, подобные AOT, можно рассматривать как прообраз живой клетки.
За последние два десятилетия возросло число исследований наночастиц Pd и Rh. Данные металлы широко используются в качестве катализаторов реакций С–С- и C–N-связывания [42], таких как реакция Хека, Сузуки, реакция кросс-сочетания Нэгиси, реакция Бухвальда–Хартвига, в многочисленных процессах гидрирования [43–45], в автомобильных каталитических конверторах [46, 47], где требуется доокислять CO и оксиды азота [11, 48–51], топливных ячейках [52] и т.п. Пути повышения каталитической активности этих процессов лежат в сочетании чистых металлов Pd и Rh между собой, что приводит к более высоким характеристикам, обусловленным синергетическим эффектом, а также подбором носителя, который играет не последнюю роль в определении конечных свойств катализатора. Катализ, как высокочувствительный процесс по отношению к размерам и структуре наночастиц, может использоваться и в качестве аналитического метода. Формирование биметаллических НЧ способствует повышению их устойчивости в условиях реакции [53–56], что благоприятно сказывается на долговечности катализатора. Получаемые нанокомпозитные системы БМНЧ на основе различных носителей являются перспективными катализаторами в области защиты окружающей среды, биотехнологии и современной энергетики.
Существуют различные способы синтеза БМНЧ на основе Pd и Rh, но литературные данные по их синтезу в ОМР на основе AOT с формированием различной морфологии частиц отсутствуют. Поэтому нашей задачей явилось совершенствование существующих методов синтеза и разработка новых способов формирования Pd, Rh БМНЧ и определение дальнейших перспектив их развития.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В качестве реагентов использовались соль родия RhCl3 ⋅ xH2O (99.9 мас. %, Aldrich), соль палладия PdCl2 (99.9 мас. %, Aldrich), в качестве восстановителя – кверцетин (Qr) (98 мас. %, Merck), в качестве поверхностно-активного вещества – бис(2-этилгексил)сульфосукцинат натрия (АОТ) (96 мас. %, Acros organics, Lot: A0259081) и в качестве дисперсионной среды – изооктан (99.95 мас. %, Эталонный-1, Компонент-реактив). Все реагенты использованы без дальнейшей очистки. Деионизованная вода (тип I по ASTM D1193-06) из системы Milli-Q Advantage Millipore с удельным электросопротивлением 18 МОм см с финишным фильтром LCPak. Носителем активного компонента катализатора служил γ-Al2O3 марки “Трилистник” (Редкинский катализаторный завод) с удельной площадью поверхности 220 м2 г–1, представляющий собой гранулы в форме трилистника размером 3 × 5 мм. Лабораторная посуда из боросиликатного стекла 3.3.
Синтез НЧ. Синтез проводили в обратномицеллярном растворе 0.15 моль л–1 AOT в изооктане с добавлением Qr до концентрации 200 мкмоль л–1. Концентрация исходных водных солей RhCl3 и PdCl2 составляла 0.015 моль л–1. Соотношение мольных количеств металлов составляло 1 : 1 для всех образцов БМНЧ. Были выбраны ОМР с коэффициентами солюбилизации w = [H2O]/[AOT], равными w1 = 2.0 и w2 = 5.0. Концентрации ионов металлов в обратномицеллярном растворе [Pd]омр и [Rh]омр при w = 2.0 составили 40.5 мкмоль л–1, а при w = 5.0–101.25 мкмоль л–1 при постоянном значении концентрации в водном пуле обратной мицеллы, равном 0.0075 моль л–1.
Наночастицы типа “сплав” Rh–Pd готовились методом совместного восстановления ионов металлов в ОМР при одновременном смешивании солей родия и палладия.
Синтез НЧ типа “ядро/оболочка” Rh/Pd проходил по методике, предполагающей предварительное восстановление ионов родия с образованием НЧ Rh и последующее введение ионов палладия и их восстановление на поверхности родиевых частиц. Наночастицы типа “ядро/оболочка” Pd/Rh готовились путем предварительного восстановления ионов палладия с образованием НЧ Pd и последующего восстановления на их поверхности ионов родия.
НЧ Rh + Pd получены путем смешивания заранее синтезированных наночастиц родия и палладия с заданными величинами коэффициентов солюбилизации w1 = 2 и w2 = 5, т.е. в начале синтеза представляют механическую смесь отдельных НЧ металлов.
Температура окружающей среды во время синтеза и инструментальных измерений находилась в интервале 20–25°С.
Приготовление катализаторов. НЧ металлов “методом пропитки” нанесены на поверхность носителя γ-Al2O3. Масса навески носителя составляла 0.500 г. Адсорбция частиц протекала в течение 90 мин. Изменения концентрации НЧ в растворах измерялись методом УФ-спектрофотометрии.
После адсорбции образцы были высушены на воздухе, трехкратно отмыты гексаном и прогреты в муфельной печи при 573 К в течение 2 ч для удаления остатков органики.
Приборы и инструменты. Формирование наночастиц при синтезе и процесс адсорбции НЧ на носитель контролировались методом оптической спектрофотометрии на приборе Hitachi U-3010 в диапазоне длин волн 190–800 нм, с использованием кварцевых кювет с длиной оптического пути 1 мм, в режиме сканирования от длинных волн к коротким. В качестве образца сравнения использовался раствор 0.15 моль л–1 AOT в изооктане.
Размеры НЧ определялись методом атомно-силовой микроскопии на приборах EnviroScope и MultiMode (Bruker) в полуконтактном режиме с использованием кремниевых кантилеверов NSG 01 (NT-MDT). Разрешение по высоте составляло ±0.1 нм. НЧ высаживались на подложку атомарно гладкого слоя слюды. После чего высушивались на воздухе, промывались водой и вновь сушились. Обработка изображений осуществлялась в ПО WSxM 5.0 [57].
Для изучения каталитических свойств полученных нанокомпозитов использовалась установка, которая подробно рассмотрена в статье [58]. Она состоит из стеклянного реактора и датчика по теплопроводности, помещенных в термостат, системы напуска и откачки газов, датчиков давления для адсорбционных измерений и системы обработки данных. В качестве каталитической реакции использовался гомомолекулярный изотопный обмен в системе протий-дейтерий. Исходный газ представлял собой эквимолярную смесь Н2 и D2 (1 : 1 по объему). Рабочий диапазон выбранных температур измерений составлял от 77 до 573 К.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез наночастиц металлов
На рис. 1 представлены спектры экстинкции ОМР (w = 2.0) в процессе формирования НЧ Rh–Pd предполагаемой структуры “сплав”. Здесь и далее приведены спектры в диапазоне 190–590 нм ввиду отсутствия пиков и значимого поглощения при длинах волн 590–800 нм. Поглощение в диапазоне 255–275 нм (зона II) отвечает поглощению A-кольца бензоильной системы кверцетина, а в диапазоне 365–390 нм (зона I) – поглощению B-кольца его циннамоильной системы [59]. В спектрах ОМР Qr наблюдается дублетная структура этих полос – сдвиги на 5–10 нм отвечают поглощению оксокомплексов [Qrδ+…$m{\text{O}}_{2}^{{{\delta } - }}$]. Область 425–460 нм соответствует поглощению тройного комплекса с металлом [Qrδ+…$m{\text{O}}_{2}^{{{\delta } - }}$…$p{\text{Me}}_{{aq}}^{{n + }}$], который, как показано в работе [60], участвует в переносе электрона и способствует восстановлению ионов металла, являясь прекурсором в синтезе НЧ. Наблюдается достаточно медленное возрастание интенсивности поглощения в этой области, которое заканчивается в течение 24 ч. Сложная кинетика изменения содержания Qr и тройного комплекса связана с образованием и последующей трансформацией этого комплекса и формированием НЧ (особенно это проявляется при анализе кинетики для ОМР w = 5.0 (рис. 2)). В самом начале ионы быстро восстанавливаются до атомов, потом скорости этого процесса и процесса формирования НЧ постепенно замедляются, что приводит к увеличению концентрации тройного комплекса. За это время ОМР изменяет свою окраску от светло-желтой до темно-оранжевой. В первые часы синтеза раствор по сравнению с AOT/изооктаном лучше пропускает УФ-излучение в диапазоне 190–225 нм, смещая в течение 120 мин крайнюю правую границу до 235 нм. В дальнейшем при формировании НЧ дальний ультрафиолет (<220 нм) “становится непрозрачным”, так как образующиеся наночастицы d-металлов малых размеров не пропускают излучение в этом диапазоне длин волн [61, 62]. Водные растворы используемых солей металлов также поглощают электромагнитное излучение в этой области спектра, однако в виду малых их концентраций в ОМР они не проявляются и не вносят значимого вклада в общее поглощение. Пик при λ = 204 нм обусловлен поглощением AOT и Qr в ОМР.
Рис. 1.
Спектры оптической экстинкции в процессе синтеза НЧ Rh–Pd из ОМР w = 2.0: (а) за первые 23 ч, на вставке – структурная формула Qr; (б) за период от 23 ч до 52 дн. со вставкой увеличенного участка спектра ОМР в диапазоне 190–220 нм.

Рис. 2.
Спектры экстинкции в процессе синтеза НЧ Rh–Pd из ОМР w = 5.0: (а) за первые 23 ч; (б) за период от 23 ч до 52 дн. На рис. 2б пунктирной линией показаны спектры НЧ, полученные вычитанием из спектров (23 ч и 52 дн.) спектров непрореагировавшего Qr.

В течение 52 дн. происходит уменьшение поглощения в зоне I, что говорит об уменьшении концентрации кверцетина в ходе восстановления ионов металлов из-за его расходования и, возможно, каталитического окисления растворенным кислородом на поверхности наночастиц. Дальний ультрафиолет при этом снижается, но появляются обусловленные локальным поверхностным плазмонным резонансом (ЛППР) полосы поглощения НЧ на 215 нм, смещающиеся с течением времени сначала до 233 нм, потом на 242 нм, что говорит о протекающей трансформации форм НЧ и/или их укрупнении и агломерации.
Рассмотрим механизм формирования биметаллических НЧ типа “сплав”. При сравнении стандартных окислительно-восстановительных потенциалов для Rh и Pd, которые составляют [63, 64]
Отметим, что на фазовой диаграмме состояния Rh–Pd имеется значительная область несмешивания [24] с максимумом на кривой, приходящимся на состав Pd42Rh58. Полная смешиваемость наблюдается при содержании родия <16 ат. % и >89 ат. %. Т.е. эти металлы являются частично смешиваемыми, а образующийся твердый раствор вне этого диапазона является метастабильным. Используемое в данной работе соотношение металлов соответствует этой области. Но, как уже говорилось во введении, в случае перехода к нанометровому диапазону стабильность таких структур возрастает [70]. Поэтому при выбранных условиях синтеза можно ожидать появление устойчивой структуры “сплав”.
В отличие от ОМР с w = 2.0 в обратномицеллярной системе с w = 5.0 (рис. 2) интенсивность поглощения комплекса кверцетина с металлом растет еще медленнее (до 8 дн.), т.е. скорости восстановления ионов металлов и формирования НЧ заметно превышают скорость его образования. Формирование НЧ с последующим их трансформированием/укрупнением протекает аналогично, но интенсивность поглощения в дальнем ультрафиолете выше, что говорит о большей их концентрации, но размеры остаются сравнимыми, о чем свидетельствует наличие максимума поглощения на тех же длинах волн, что и в ОМР с w = 2.0. Результаты АСМ-измерений показали (табл. 1), что средние размеры НЧ ОМР с w = 2.0 составляют ∼2.2 нм, а для w = 5.0 равны ~1.7 нм, что согласуется со спектрофотометрическими данными. В первые 23 часа пик ЛППР НЧ приходился на λ = 215 нм, а на 52 день уже формируются НЧ с характерным пиком поглощения на λ = 234 нм. При этом происходит уширение полосы поглощения в длинноволновую область как это видно (рис. 2б) на спектрах НЧ, полученных вычитанием из общего спектра поглощения спектра поглощения оставшегося кверцетина на 23 ч и 52 дн. Все это указывает на рост размеров частиц и их агломерацию (по характерному уширению в области 290 нм). В этой области также имеются полосы поглощения продуктов окисления кверцетина, которые также обладают восстановительными свойствами и могут принимать участие в восстановлении ионов металлов. Заметим, что ОМР имеют слабое рассеяние света из-за малых размеров НЧ [71], поэтому спектры экстинкции близки к спектрам поглощения.
Таблица 1.
Средние диаметры НЧ в зависимости от коэффициента солюбилизации для исследованных систем
| Образец | Коэффициент солюбилизации, w | |||
|---|---|---|---|---|
| 1.0 | 2.0 | 2.5 | 5.0 | |
| Rh | 2.5 | 2.0 | 1.8 | 3.1 |
| Pd | 1.4 | 2.0 | – | |
| Rh–Pd | – | 2.2 | – | 1.7 |
| Rh/Pd | – | – | 0.7 и 3.0 | |
| Pd/Rh | – | 1.2 | – | 1.6 |
| Rh + Pd | – | 2.0 | – | 2.7 |
В случае синтеза НЧ типа “ядро/оболочка” имеются сходные черты спектров со спектрами НЧ типа “сплав”. На рис. 3а приведены спектры синтеза НЧ Rh/Pd, а на рис. 3б – спектры синтеза НЧ Pd/Rh. Для ОМР c w = 2.0 наблюдается незначительное понижение в зоне II, т.е. восстановитель находится в избытке. Конечные спектры для систем (w = 2.0) Rh/Pd и Pd/Rh идентичны между собой, что может указывать на одинаковую их морфологию и размеры.
Рис. 3.
(а) Спектры экстинкции в процессе синтеза НЧ Rh/Pd w = 2.0 в течение 52 дн., спектр НЧ Rh/Pd w = 5.0 на 38 дн., спектр НЧ w = 5.0, полученный вычитанием спектра кверцетина из спектра НЧ Rh/Pd w = 5.0 на 38 дн., спектр НЧ Pd w = 5.0; (б) спектры экстинкции в процессе синтеза НЧ Pd/Rh с w = 2.0 в течение 52 дн., спектр НЧ Pd/Rh w = 5.0 на 38 дн., спектр НЧ w = 5.0, полученный вычитанием спектра кверцетина из спектра НЧ Pd/Rh w = 5.0 на 38 дн., спектр НЧ Rh w = 5.0. НЧ Pd и Rh в ОМР получены радиационно-химическим методом.

В случае ОМР с w = 5.0 для системы Rh/Pd наблюдается более сильное падение в зоне II по сравнению с падением в системе Pd/Rh. Это связано с различным поглощением электромагнитного спектра хвостовой части НЧ, которое выше для Pd/Rh, что показано на рис. 3б в виде спектральной кривой НЧ w = 5.0 38 дн., полученной вычитанием из общего спектра ОМР спектра оставшегося кверцетина.
В системе Rh/Pd НЧ полоса поглощения наблюдается при λ ~ 233 нм и λ ~ 296 нм. Последнюю полосу поглощения можно связать с агломератами НЧ, плазмонный резонанс которых смещен в длинноволновую область. Наличие оболочки из AOT, образующей замкнутое пространство для частиц, приводит к тому, что НЧ находятся близко друг от друга. Вероятность формирования агломератов НЧ повышается с увеличение диаметра водного пула мицеллы (ростом значения w) и содержания ионов металла, чем и объясняется значительное увеличение поглощения при 296 нм для ОМР с w = 5.0. Этот результат может быть также объяснен образованием НЧ Pd. Ранее было показано, что палладиевые частицы, полученные радиационно-химическим методом в растворах AOT/изооктан, имеют два пика поглощения: в районе 246 нм и при 323 нм (рис. 3а, НЧ Pd Rad w = 5) [72]. Как уже указывалось выше, в области 290 нм поглощают и продукты окисления кверцетина.
Спектр ОМР НЧ Pd/Rh (рис. 3б) имеет интенсивную полосу поглощения при λ ~ 237 нм, но форма спектра схожа со спектром НЧ Rh/Pd. В данном случае содержание наночастиц в ОМР несколько снижено. Средние размеры НЧ в случае ОМР с w = 5.0 составляют для Pd/Rh – 1.6 нм, а для Rh/Pd большая доля НЧ имеет размеры 0.7 нм, но наблюдаются и НЧ со средним диаметром 3.0 нм. Т.е. мы можем предположить, что в образце Rh/Pd содержатся исходные НЧ Rh, размером 3.1 нм и многочисленные НЧ Pd размером 0.7 нм.
Сильное падание интенсивности спектра в УФ-области (до 240 нм) можно связать с перестройкой мицеллярной оболочки AOT при взаимодействии ионов металла с полярными группами AOT: так, когда к ОМР уже сформированных НЧ Rh добавили соль палладия, было зарегистрировано заметное уменьшение поглощения на участке спектра 190–240 нм, в области поглощения ПАВ. По мере восстановления ионов палладия их концентрация упала, что привело к частичному восстановлению спектра соответствующей полосы.
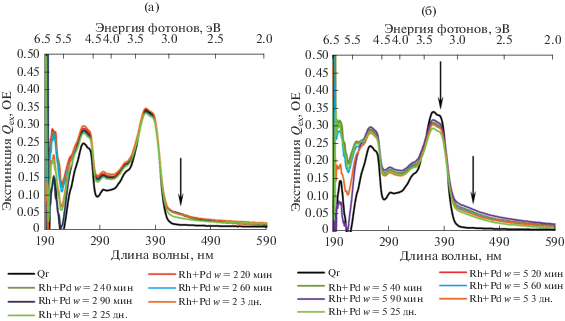
При смешивании растворов с уже сформированными НЧ палладия и родия с соответствующим значением коэффициента солюбилизации получены растворы, представляющие собой их физическую смесь. Наблюдая за изменением спектров этих смесей (рис. 4) в течение 25 дн., можно заключить, что индивидуальные НЧ остаются практически неизменными в этом процессе. Небольшие изменения в области 190–230 нм объясняются взаимной диффузией НЧ между мицеллами до состояния равновесия, в результате которой временно нарушаются оболочки мицелл. Также отмечается снижение концентрации тройного комплекса, обусловленное, по всей видимости, взаимным/перекрестным автокаталитическим усилением восстановления ионов металла, ранее находящихся в состоянии термодинамического равновесия со своими индивидуальными наночастицами. В работе [73] отмечался случай формирования БМНЧ при физическом смешивании монометаллических НЧ Ag и Au. Но в нашем случае для НЧ Rh и Pd данного эффекта не наблюдается. Средние размеры смеси НЧ для ОМР с w = 2.0 составляют 2.0 нм, а в случае w = 5.0–2.7 нм.
Рис. 4.
Эволюция спектров оптической экстинкции смеси НЧ Pd и НЧ Rh w = 2.0 (а) и w = 5.0 (б) в течение 25 дн.
Размеры всех синтезированных НЧ и НЧ промежуточных растворов, использованных для синтеза НЧ типа “ядро/оболочка”, приведены в табл. 1. Распределение по размерам для всех систем остается достаточно узким. На рис. 5 в качестве наглядного примера приведены АСМ-изображения и гистограммы распределения частиц по размерам для НЧ Pd/Rh w = 2.0 и НЧ Rh + НЧ Pd w = 2.0.
Рис. 5.
АСМ-изображения и гистограммы распределения частиц по размерам для (а) НЧ Pd/Rh w = 2.0 и (б) НЧ Rh + + НЧ Pd w = 2.0.

Для НЧ Rh-Pd типа “сплав”, для Rh/Pd и в механической смеси НЧ Pd и Rh также нельзя исключить формирование оболочки из PdO. В работе [74] показано, что стабильность палладиевых частиц при хранении в присутствии воздуха зависит от их размеров. Так 8 нм частицы устойчивы в течение 90 дней, а для крупных частиц (25 нм и выше) образуются НЧ типа ядро/оболочка, где оболочка представляется оксидом металла, в данном случае PdO. Из-за большой разницы в параметрах кристаллических решеток металла и оксида, оксид образует достаточно пористую оболочку. Устойчивость малых наночастиц связывают с эффектом самоограничивающего (напряженно ограничивающего) окисления, заключающегося в быстром формировании тонкого слоя оксида на поверхности металла и возникновением напряжения на межфазной границе между ними. Если напряжение высокое (что характерно для слоев с большой площадью поверхности, т.е. для крупных частиц) то фазы расслаиваются, что и приводит к формированию НЧ типа ядро металла/пористая оболочка оксида. В нашем случае частицы малы, поэтому может сформироваться только мономолекулярный лабильный слой кислорода.
Получение нанокомпозитов
Адсорбционные свойства НЧ по отношению к поверхности γ-Al2O3 исследованы методом UV-VIS-спектрофотометрии. На рис. 6 показаны спектры исходных ОМР НЧ и после контакта с адсорбентом (90 мин). Время выдерживания выбрано исходя из наибольшего изменения интенсивности оптического поглощения НЧ во всем диапазоне спектра. Видно, что интенсивность спектров уменьшается во всем диапазоне длин волн. Сильное уменьшение поглощения в области 190–240 нм обусловлено адсорбцией AOT. Наблюдается почти полная адсорбция восстановителя Qr. Нельзя исключить трансформацию НЧ при адсорбции за счет активных центров на поверхности носителя и формирования более сложных агломератов НЧ. Для ОМР (w = 2.0) НЧ Rh/Pd и НЧ Pd/Rh изменения интенсивности спектров поглощения в ходе адсорбции почти идентичны между собой.
Каталитические свойства
Полученные катализаторы на основе наночастиц Rh и Pd испытаны в реакции гомомолекулярного изотопного обмена в системе протий-дейтерий
в диапазоне температур 77–295 К. Данная реакция позволяет тестировать каталитическую активность НЧ в различных реакциях с участием водорода и является высокочувствительной к структурной организации НЧ. Перед измерением каталитической активности нанокомпозитов проводилось определение площади активной поверхности образцов объемным методом по низкотемпературной адсорбции водорода (77 К). Удельную каталитическую активность выражали в виде скорости реакции, отнесенной к активной поверхности металла, с учетом числа молекул в реакционном объеме при измеряемой температуре реакции – ${{{\text{K}}}_{{{\text{уд}}}}}$ (молекул см–2 c–1): где k0 – константа скорости реакции первого порядка, с–1; S – экспериментально определенная площадь активной поверхности образца, см2; NT – число молекул водорода при температуре Т.Каталитическую активность, измеренную в интервале температур от 77 до 300 К, представляли в аррениусовских координатах lgKуд – $\frac{1}{T},$ где зависимость носит линейный характер.
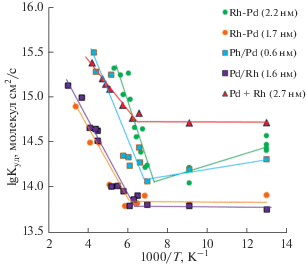
Рассмотрение полученных результатов по каталитическим свойствам различных систем с наночастицами палладия и родия начнем с результатов монометаллических НЧ Rh и НЧ Pd, а также смеси НЧ Rh + Pd (рис. 7). Анализ температурных зависимостей Куд показывает, что НЧ смеси, имеющие средний диаметр ~2.7 нм, проявляют почти такую же каталитическую активность, что и НЧ Rh d ~3.1 нм во всем исследованном температурном интервале. Напомним, что удельная каталитическая активность выражена по отношению к площади активной поверхности обоих металлов данного образца, поэтому только около половины этой площади относится к НЧ Rh. Следовательно, если катализ шел бы независимо от НЧ Pd, то можно было бы ожидать активность образца приблизительно в два раза меньшую наблюдаемой. В данном случае наблюдается синергетический эффект каталитической активности, возможно связанный со спилловером водорода, активируемым палладиевыми наночастицами. Адсорбция водорода на Pd благоприятствует распространению атомарного водорода по поверхности носителя, а также облегчает диссоциативную адсорбцию молекулы водорода на НЧ Rh.
Рис. 7.
Изменение удельной каталитической активности в зависимости от температуры для монометаллических НЧ Rh w = 5.0, Pd w = 1.0 и смеси НЧ Rh + + Pd w = 5.0, адсорбированных на γ-Al2O3. В скобках приведены средние размеры (d) НЧ.

На рис. 8 представлены экспериментальные результаты исследования зависимости удельной каталитической активности бинарных наносистем в реакции дейтеро-водородного обмена. Сравнение активности образцов на основе НЧ Rh–Pd типа “сплав”, ядро/оболочка Pd/Rh и Rh/Pd показывает, что для НЧ Rh-Pd каталитическая активность возрастает с увеличением диаметра частиц и меняется значение энергии активации как в низкотемпературной (от 77 до 140–170 К), так и высокотемпературной области (от 140–170 до 273–373 К). Сравнивая каталитическую активность НЧ Rh–Pd диаметром 1.7 нм с активностью НЧ Pd/Rh диаметром 1.6 нм, видно полное их совпадение, также как и схожесть формы спектров (рис. 2 и 3), которые отличаются друг от друга только интенсивностью, т.е. содержанием НЧ. Почти такую же каталитическую активность проявляют монометаллические НЧ Pd диаметром 1.4 нм. Все это указывает на отсутствие как БМНЧ Rh–Pd, так и восстановленного Rh на поверхности НЧ Pd в образце НЧ Pd/Rh, а также отсутствие индивидуальных НЧ Rh в обоих случаях. Отсюда можно сделать вывод о преимущественном восстановлении ионов Pd2+ по сравнению с Rh3+, и формирования только НЧ Pd.
Рис. 8.
Изменение удельной каталитической активности в зависимости от температуры для НЧ Rh–Pd w = = 2.0 (2.2 нм), Rh–Pd w = 5.0 (1.7 нм), Pd/Rh w = 5.0 и Rh/Pd w = 5.0 и НЧ Pd + Rh w = 5.0, адсорбированных на γ-Al2O3. В скобках приведены средние размеры (d) НЧ.
Объяснение отсутствия восстановленного родия – весьма сложная задача. Возможно, ионы палладия сильней связываются с молекулой Qr, что не позволяет восстанавливаться ионам родия. Вторым объяснением может служить то, что НЧ Pd как сформированные для последующего синтеза НЧ Pdядр/Rhобол, так и те, которые зарождаются в процессе восстановления, расходуют и удерживают молекулярный кислород, участвующий в восстановлении ионов металла [60]. Кислород также может расходоваться на окисление кверцетина на поверхности сформированных НЧ Pd, если предположить большую легкость этой реакции по сравнению с реакцией восстановления ионов Rh3+. Также это могло бы объяснить медленное изменение спектров в течение продолжительного времени: кислород постепенно поступает из атмосферы через неплотности реакционной колбы, растворяясь в ОМР и продолжая реакцию.
Дополнительно укажем, что каталитическая активность Rh выше активности Pd при равных размерах кристаллитов. С увеличением размеров НЧ обоих металлов их активность увеличивается.
В конце рассмотрим результаты каталитической активности образца ядро/оболочка НЧ Rh/Pd. Эти НЧ проявляют каталитическую активность приблизительно в 2 раза меньшую, чем монометаллические НЧ Rh со средним диаметром 3.1 нм, и имеют несколько отличные значения энергии активации. Это объясняется тем, что при приготовлении данного катализатора концентрация (но не количество) исходных НЧ Rh снижается в два раза, что обуславливает соответствующее снижение каталитической активности, а большое количество кластеров палладия (0.7 нм) изменяет энергию активации образца в целом, но при этом не вносит вклада в активность и не проявляет синергетический эффект, как это наблюдается для образца НЧ Rh + Pd.
Отметим уменьшение размеров НЧ с увеличением w для сплава Rh–Pd и Rh/Pd, а также при смешении НЧ Rh с НЧ Pd по отношению к первоначальному размеру НЧ Rh (табл. 1), измеренных методом атомно-силовой микроскопии. Каталитические исследования подтверждают данный факт – наблюдается полная корреляция активности от размера. Но данное явление остается пока до конца неясным.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований сделаны следующие выводы по использованию обратномицеллярной системы Qr/AOT/изооктан для синтеза биметаллических НЧ на основе Rh и Pd. На основе результатов измерения каталитической активности различных видов нанокомпозитов биметаллических и монометаллических частиц Rh и Pd установлено, что в ОМР при исследуемых условиях синтеза биметаллические НЧ не формируются, либо формируются в незначительных количествах. При наличии ионов Rh3+ и Pd2+ в первую очередь восстанавливаются ионы палладия, а сформированные НЧ Pd ингибируют восстановление ионов родия. Смесь НЧ Rh и НЧ Pd диаметром 2.7 нм является стабильной не менее 25 дн. Важно отметить, что каталитическая активность смеси НЧ Rh и НЧ Pd (1 : 1) выше в ~2 раза по сравнению с НЧ Rh тех же размеров, что позволяет сократить содержание дорогостоящего родия в разрабатываемых катализаторах. Наличие синергетического эффекта обусловлено крупными размерами НЧ Pd, роль которых заключается в активации поверхностных форм водорода. С НЧ Pd малых размеров, порядка 0.7 нм, такой эффект не проявляется, но изменяется энергия активации реакции. Медленная кинетика восстановления ионов благородных металлов в обратномицеллярных растворах позволяет регистрировать спектры самых малых частиц и кластеров переходных металлов.
Результаты проведенных экспериментов являются достаточно сложными и требуются дальнейшие исследования в данном направлении.
Список литературы
Walther A., Müller A.H.E. // Chemical Reviews. 2013. V. 113(7). P. 5194–5261. https://doi.org/10.1021/cr300089t
Gilroy K.D., Ruditskiy A., Peng H.-C. et al. // Chemical Reviews. 2016. V. 116(18). P. 10414–10472. https://doi.org/10.1021/acs.chemrev.6b00211
Nishida N., Shiraishi Y., Kobayashi S., Toshima N. // The J. Physical Chemistry C. 2008. V. 112(51). P. 20284–20290. https://doi.org/10.1021/jp807723j
Muller A., Peglow S. // Nanomaterials. 2018. V. 8(7). P. 502. https://doi.org/10.3390/nano8070502
Koh S., Strasser P. // J. American Chemical Society. 2007. V. 129(42). P. 12624–12625. https://doi.org/10.1021/ja0742784
Bonnefont A., Simonov A.N., Pronkin S.N. et al. // Catalysis Today. 2013. V. 202. P. 70–78. https://doi.org/10.1016/j.cattod.2012.03.076
Abdullah H., Naim N.M., Bolhan A. et al. // Arabian J. Science and Engineering. 2014. V. 40 (3). P. 915–922. https://doi.org/10.1007/s13369-014-1557-x
Srinoi P., Chen Y.-T., Vittur V. et al. // Appl. Sci. 2018. V. 8(7). P. 1106. https://doi.org/10.3390/app8071106
Duan H., Zeng Y., Yao X. et al. // Chemistry of Materials. 2017. V. 29(8). P. 3671–3677. https://doi.org/10.1021/acs.chemmater.7b00544
Shi J. // Chemical Reviews. 2013. V. 113(3). P. 2139–2181. https://doi.org/10.1021/cr3002752
Vedyagin A.A., Stoyanovskii V.O., Plyusnin P.E. et al. // J. Alloys and Compounds. 2018. V. 749. P. 155–162. https://doi.org/10.1016/j.jallcom.2018.03.250
Haldar K.K., Kundu S., Patra A. // ACS Applied Materials & Interfaces. 2014. V. 6(24). P. 21946–21953. https://doi.org/10.1021/am507391d
Njoki P.N., Roots M.E.D., Maye M.M. // ACS Appl. Nano Mater. 2018. V. 1(10). P. 5640–5645. https://doi.org/10.1021/acsanm.8b01255
Alayoglu S., Nilekar A.U., Mavrikakis M., Eichhorn B. // Nature Materials. 2008. V. 7(4). P. 333–338. https://doi.org/10.1038/nmat2156
Ferrando R., Jellinek J., Johnston R.L. // Chemical Reviews. 2008. V. 108(3). P. 845–910. https://doi.org/10.1021/cr040090g
Gong Y., Zhong H., Liu W. et al. // ACS Appl. Mater. Interfaces. 2018. V. 10(1). P. 776–786. https://doi.org/10.1021/acsami.7b16794
Bedford N.M., Showalter A.R., Woehl T.J. et al. // ACS Nano. 2016. V. 10(9). P. 8645–8659. https://doi.org/10.1021/acsnano.6b03963
Okazaki T., Seino S., Kugai J. et al. // Mater. Res. Soc. Advanc. 2016. V. 1(6). P. 427–432. https://doi.org/10.1557/adv.2016.30
Wang X.X., Hwang S., Pan Y.-T. et al. // Nano Lett. V. 18(7). P. 4163–4171. https://doi.org/10.1021/acs.nanolett.8b00978
Schaak R.E., Sra A.K., Leonard B.M. et al. // J. American Chemical Society. 2005. V. 127(10). P. 3506–3515. https://doi.org/10.1021/ja043335f
Liu S., Niu W., Firdoz S., Zhang W. // Langmuir. 2017. V. 33(43). P. 12254–12259. https://doi.org/10.1021/acs.langmuir.7b02497
Straney P.J., Diemler N.A., Smith A.M. et al. // Langmuir. 2018. V. 34(3). P. 1084–1091. https://doi.org/10.1021/acs.langmuir.7b03309
Liu L., Corma A. // Chemical Reviews. 2018. V. 118(10). P. 4981–5079. https://doi.org/10.1021/acs.chemrev.7b00776
Shubin Y.V., Plyusnin P.E., Korenev S.V. // J. Alloys and Compounds. 2015. V. 622. P. 1055–1060. https://doi.org/10.1016/j.jallcom.2014.10.187
Swiatkowska-Warkocka Z., Pyatenko A., Krok F. et al. // Scientific Reports. 2015. V. 5. P. 09849. https://doi.org/10.1038/srep09849
Magudapathy P., Srivastava S.K., Gangopadhyay P. et al. // Chemical Physics Letters. 2017. V. 667. P. 38–44. https://doi.org/10.1016/j.cplett.2016.11.041
Ghosh Chaudhuri R., Paria S. // Chem. Rev. 2012. V. 112. P. 2373–2433. https://doi.org/10.1021/cr100449n
Cong C., Nakayama S., Maenosono S., Harada M. // Industrial & Engineering Chemistry Research. 2017. V. 57(1). P. 179–190. https://doi.org/10.1021/acs.iecr.7b03154
Lombardo M.T., Pozzo L.D. // Langmuir. 2015. V. 31(4). P. 1344–1352. https://doi.org/10.1021/la504520p
Codari F., Moscatelli D., Furlan M. et al. // Langmuir. 2014. V. 30(8). P. 2266–2273. https://doi.org/10.1021/la5001039
Kim S.-W., Park J., Jang Y. et al. // Nano Letters. 2003. V. 3(9). P. 1289–1291. https://doi.org/10.1021/nl0343405
Son S.U., Jang Y., Yoon K.Y. et al. // Nano Letters. 2004. V. 4(6). P. 1147–1151. https://doi.org/10.1021/nl049519+
Gugliotti L.A., Feldheim D.L., Eaton B.E. // Science. 2004. V. 304(5672). P. 850–852. https://doi.org/10.1126/science.1095678
Caswell K.K., Wilson J.N., Bunz U.H.F., Murphy C.J.J. // Am. Chem. Soc. 2003. V. 125(46). P. 13914-5. https://doi.org/10.1021/ja037969i
Reginald M. Penner. // MRS Bulletin. 2010. V. 35(10). P. 771–777. https://doi.org/10.1557/mrs2010.506
Cui C.-H., Li H.-H., Yu S.-H. // Chem. Commun. 2010. V. 46. P. 940–942. https://doi.org/10.1039/B920705H
Xiong Y., Wiley B., Chen J. et al. // Angew. Chem. Int. Ed. 2005. V. 44(48). P. 7913-7. https://doi.org/10.1002/anie.200502722
Ding J.H., Gin D.L. // Chem. Mater. 2000. V. 12(1). P. 22–24. https://doi.org/10.1021/cm990603d
Cason J.P., Miller M.E., Thompson J.B., Roberts C.B. // J. Phys. Chem. B. 2001. V. 105(12). P. 2297–2302. https://doi.org/10.1021/jp002127g
Wolf S., Feldmann C. // Angew. Chem. Int. Ed. 2016. 55(51). P. 15728–15752. https://doi.org/10.1002/anie.201604263
Pileni M.P. // J. Phys. Chem. 1993. V. 97(27). P. 6961–6973. https://doi.org/10.1021/j100129a008
Biffis A., Centomo P., Del Zotto A., Zecca M. // Chemical Reviews. 2018. V. 118(4). P. 2249–2295. https://doi.org/10.1021/acs.chemrev.7b00443
Álvarez A., Bansode A., Urakawa A. et al. // Chemical Reviews. 2017. V. 117(14). P. 9804–9838. https://doi.org/10.1021/acs.chemrev.6b00816
Meemken F., Baiker A. // Chemical Reviews. 2017. V. 117(17). P. 11522–11569. https://doi.org/10.1021/acs.chemrev.7b00272
Aiken J.D., Finke R.G. // Chemistry of Materials. 1999. V. 11(4). P. 1035–1047. https://doi.org/10.1021/cm980699w
Turner A., Price S. // Environmental Science & Technology. 2008. V. 42(24). P. 9443–9448. https://doi.org/10.1021/es801189q
Yoon B., Wai C.M. // J. Am. Chem. Soc. 2005. V. 127(49). P. 17174-5. https://doi.org/10.1021/ja055530f
Banerjee S., Narasimhaiah G.M., Mukhopadhyay A., Bhattacharya A. // J. Phys. Chem. C. 2016. V. 120(45). P. 25806–25821. https://doi.org/10.1021/acs.jpcc.6b07719
Montemore M.M., van Spronsen M.A., Madix R.J., Friend C.M. // Chemical Reviews. 2017. V. 118(5). P. 2816–2862. https://doi.org/10.1021/acs.chemrev.7b00217
Jeong H., Lee G., Kim B.-S. et al. // J. Am. Chem. Soc. 2018. V. 140(30). P. 9558–9565. https://doi.org/10.1021/jacs.8b04613
Inderwildi O.R., Jenkins S.J., King D.A. // J. Am. Chem. Soc. 2008. V. 130(7). P. 2213–2220. https://doi.org/10.1021/ja0754913
Narayanamoorthy B., Balaji S., Sita C. et al. // ACS Sustainable Chem. Eng. 2016. V. 4(12). P. 6480–6490. https://doi.org/10.1021/acssuschemeng.6b01257
Wu X., Xu L., Weng D. // Applied Surface Science. 2004. V. 221(1–4). P. 375–383. https://doi.org/10.1016/s0169-4332(03)00938-3
Huang R., Wen Y.-H., Zhu Z.-Z., Sun, S.-G. // J. Phys. Chem. C. 2012. V. 116(15). P. 8664–8671. https://doi.org/10.1021/jp3015639
Kobayashi H., Morita H., Yamauchi M. et al. // Alloys. J. Am. Chem. Soc. 2012. V. 134(30). P. 12390–12393. https://doi.org/10.1021/ja305031y
Ong M.D., Jacobs B.W., Sugar J.D. et al. // Chem. Mater. 2012. V. 24(6). P. 996–1004. https://doi.org/10.1021/cm202688m
Horcas I., Fernandez R., Gomez-Rodriguez J.M. et al. // Rev. Sci. Instrum. 2007. V. 78. P. 013705. https://doi.org/10.1063/1.2432410
Sergeev M.O., Revina A.A., Zavoronkova K.N. et al. // Nanotechnol. Rev. 2014. V. 3(5). P. 515–525. https://doi.org/10.1515/ntrev-2014-0011
Bukhari S.B., Memon S., Mahroof-Tahir M., Bhanger M.I. // Spectrochim. Acta. A Mol. Biomol. Spectrosc. 2009. V. 71(5). P. 1901–1906. https://doi.org/10.1016/j.saa.2008.07.030
Ревина А.А., Зайцев П.М. // Электрохимия. 2012. Т. 48. № 3. С. 1–4.
Weaver J.H. // Phys. Rev. B. 1975. V. 11(4). P. 1416–1425. https://doi.org/10.1103/PhysRevB.11.1416
Alan Creighton J., Desmond G. Eadon. // J. Chem. Soc., Faraday Trans. 1991. V. 87(24). P. 3881–3891. https://doi.org/10.1039/FT9918703881
Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ. Справочник. М.: Дрофа, 2008.
Enghag Per. Encyclopedia of the Elements. Technical Data, History, Processing, Applications. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2004.
Henglein A. // J. Phys. Chem. 1993. V. 97(21). P. 5457–5471. https://doi.org/10.1021/j100123a004
Belloni J. // Current Opinion in Colloid & Interface Science. 1996. V. 1. 184–196. https://doi.org/10.1016/S1359-0294(96)80003-3
Khatouri J., Mostafavi M., Belloni J. // In Proceedings of IS&T's 48th Annual Conference: 1995 May; Washington. Washington: Springfield, 1995. P. 315–317.
Belloni J., Khatouri J., Mostafavi M., Amblard J. // In Ultrafast reaction dynamics and solvent effects. AIP Conference Proceedings. Edited by Gauduel Y. Rossky PJ. Woodbury, N.Y.: AlP Press; 1994. V. 298. P. 541–550. https://doi.org/10.1063/1.45414
Khatouri J., Mostafavi M., Belloni J. // In Photochemistry and Radiation Chemistry: Complementary Methods for the Study of Electron-Transfer. Edited by Wishart J., Nocera D. Washington: ACS Books, 1996.
Vedyagin A.A., Gavrilov M.S., Volodin A.M. et al. // Topics in Catalysis. 2013. V. 56(11). P. 1008–1014. https://doi.org/10.1007/s11244-013-0064-8
Henglein A. // J. Phys. Chem. 1993. V. 97(21). P. 5457–5471. https://doi.org/10.1021/j100123a004
Ревина А.А., Ларионов О.Г., Белякова Л.Д. // Сорбционные и хроматографические процессы. 2006. Т. 6. Вып. 2. С. 265–272.
Zhang H., Haba M., Okumura M. et al. // Langmuir. 2013. V. 29(33). P. 10330–10339. https://doi.org/10.1021/la401878g
Xiong Y., Chen J., Wiley B. et al. // Nano Lett. 2005. V. 5(7). P. 1237–1242. https://doi.org/10.1021/nl0508826
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



