Физикохимия поверхности и защита материалов, 2020, T. 56, № 3, стр. 317-322
Особенности анодного поведения комбинированного электрода “железо–титан” в галогенид-содержащих электролитах
А. Ф. Дресвянников 1, *, Л. Р. Салемгараева 1, Фам Тьен Чонг 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
Казань, Россия
* E-mail: a.dresvyannikov@mail.ru
Поступила в редакцию 25.03.2019
После доработки 07.01.2020
Принята к публикации 10.01.2020
Аннотация
Исследовано электрохимическое поведение комбинированного электрода железо-титан в водных растворах галогенидов. Показано распределение потенциала по поверхности металлов комбинированного анода в условиях внешней поляризации. Установлена возможность изменения скорости анодного растворения титановой и железной составляющей комбинированного электрода при изменении плотности тока и соотношения площадей электродов.
ВВЕДЕНИЕ
В некоторых случаях важным является изучение электрохимического поведения комбинированных электродов, представляющих собой электрическое соединение двух и более проводников (полупроводников), в частности, металлов, в том числе с оксидным слоем на поверхности, контактирующих с электролитом [1–4].
Исследование распределения тока и потенциала по поверхности комбинированного электрода при совместном окислении железа и титана имеет определенный теоретический интерес, а также позволяет определить характеристики коррозионного процесса в условиях анодной поляризации двух разнородных металлов, находящихся в контакте друг с другом и погруженных в раствор, содержащий анионы-активаторы. Кроме того, такие исследования позволяют установить характеристики процесса синтеза прекурсоров бинарных оксидных систем металлов, содержащих их определенное количественное соотношение [5–7].
Однако, число опубликованных результатов исследований по данной тематике незначительно.
Поэтому целью настоящей работы является изучение электрохимического поведения титана и железа, находящихся в контакте друг с другом и погруженных в раствор хлорида натрия с добавлением плавиковой кислоты разной концентрации, а также установление закономерностей совместного анодного растворения этих металлов.
Как известно, галогенид-ионы являются активаторами поверхности металла, способствующими его анодному растворению [8]. Согласно [8, 9], активирующее действие галогенид-ионов связано с трансформацией оксидной пленки металла и обусловлено адсорбцией на поверхности электрода хлорид-ионов, полностью или частично вытесняющих пассивирующий кислород. В результате на поверхности металла формируется галогенидный комплекс [9, 10]. Далее хемосорбционные комплексы металла гидролизуются, причем продукты гидролиза способствуют разрушению поверхностного слоя и депассивации металла [11, 12].
В случае присутствия в растворе активирующих анионов происходит конкурирующее, с залечиванием дефектов, взаимодействие этих ионов с дефектами оксидной пленки. Оно представляет собой некоторую последовательность процессов адсорбции активирующих анионов на дефектных местах, образование химической связи с поверхностными атомами металла и сольватации образовавшихся соединений с последующим их переходом в раствор [13].
МЕТОДИКА ЭКСПЕРИМЕНТА
Измерения проводили в прямоугольной ячейке объемом 200 см3. С целью обеспечения равномерного распределения тока анод и катод располагались параллельно друг другу и полностью перекрывали сечение ячейки. Комбинированный анод состоит из пластин титана ВТ1-0 и железа – Армко с рабочей поверхностью размером 12.5 см2 каждая. Составляющие анода располагались рядом в одной плоскости и имели электрический контакт между собой. Электроды проходили стандартную предварительную подготовку: поверхность механически полировали алмазной пастой, обезжиривали этиловым спиртом и промывали бидистиллированной водой.
Ступенчатая анодная гальваностатическая поляризация анода осуществлялась с помощью электрохимической станции Zive SP2. Длительность поляризации током заданной величины составляла 1 мин. Силу тока, протекающего через составные части комбинированного электрода, измеряли путем измерения напряжения на включенных последовательно в анодную цепь сопротивлениях величиной 1 Ом. В качестве электрода сравнения применяли хлоридсеребряный электрод марки ЭВЛ-1М3. Капилляр Луггина–Габера ориентировали относительно трех точек поверхности железной и титановой составляющих анода (по краям и центру) посередине вертикального сечения электрода. Вспомогательный электрод из нержавеющей стали Х18Н10Т размещали у противоположной стенки прямоугольной ячейки на расстоянии 20 см от анода.
Для апробации выявленных закономерностей анодного растворения комбинированного анода Fe–Ti с целью получения сложных оксидов использовали коаксиальный бездиафрагменный электрохимический реактор с центральным катодом нержавеющей стали Х18Н10Т.
Выделившийся в процессе поляризации в объеме раствора продукт отфильтровывали, высушивали при температуре 80°C и подвергали термообработке при температуре 1100°C (2 ч).
Рентгенофазовый анализ образцов проводили стандартным методом на дифрактометре D2 PHASER с использованием монохроматизированного CoKα-излучения (30 кВ, 10 мА) в режиме шагового сканирования (шаг сканирования – 2θ = 0.05°, интервал съемки – 2θ = 3°–130°). Расчет значений межплоскостных расстояний дифракционных рефлексов производился автоматически с помощью программного пакета DIFFRAC.EVA. Идентификацию кристаллических фаз осуществляли путем сопоставления полученных экспериментальных значений межплоскостных расстояний и относительных интенсивностей с эталонными.
Микроскопические исследования состояния поверхности анода после поляризации осуществляли с помощью сканирующего электронного микроскопа EVEX Mini SEM SX-3000 (15 кВ, 10 мкА) с приставкой локального элементного анализа.
Элементный анализ полученных дисперсных систем проводили на портативном рентгенофлуоресцентном спектрометре S1 TITAN с максимальным напряжением 50 кВ и прилагаемым программным пакетом GeoChem General.
Микросъемку дисперсных образцов осуществляли на сканирующем электронном микроскопе AURIGA CrossBeam с энергодисперсионным спектрометром INCA X-MAX с использованием режимов SE2 (вторичных электронов) (20 кВ, 800 пА) и InLens (высокоразрешающий режим вторичных электронов) (15 кВ, 180 пА). На исследуемые образцы с помощью установки Quorum Q150T ES предварительно наносили слой золото-палладий (60 : 40) толщиной 15 нм.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Исследования проводили при плоскопараллельном расположении электродов. Это вызвано тем, что в иных условиях на распределение электрического поля в процессе совместного растворения металлов влияет геометрия расположения электродов; при этом наблюдаемая картина процесса усложняется (рис. 1).
Рис. 1.
Распределение потенциала по поверхности комбинированного электрода в зависимости от силы тока, протекающего в 1.0 M растворе NaCl с добавлением фтороводородной кислоты с концентрацией, моль/л: (а) 0.05; (б) 0.1; (в) 0.5. Цифрами обозначены значения величины силы поляризующего тока, мА.

Комбинированный электрод Fe–Ti представляет собой короткозамкнутый гальванический элемент. В данном случае, вследствие относительно малого размера электродов и высокой проводимости электролита в отсутствии внешнего тока, поверхность комбинированного электрода условно можно считать эквипотенциальной (рис. 1а, 1б, кривая 0). При протекании внешнего тока и росте его значения наблюдается увеличение разности потенциалов поверхности железной и титановой составляющих анода (рис. 1). При низких концентрациях фтороводородной кислоты в 1.0 M NaCl (рис. 1а) потенциал титановой составляющей с увеличением тока резко смещается в сторону положительных значений, поверхность электрода быстро пассивируется с образованием плотной оксидной пленки. С увеличением концентрации HF до 1.0 моль/л потенциал титана наоборот смещается в сторону более отрицательных значений, имеет место его интенсивное растворение. Электродный потенциал железа в составе комбинированного электрода при этом изменяется незначительно и имеет значение порядка –400–500 мВ (х. с. э.).
Далее, для установления закономерностей процесса сопряженного анодного растворения указанных металлов строили зависимость доли тока составляющих комбинированного электрода от величины общего поляризующего тока (рис. 2).
Рис. 2.
Доля парциальных токов титановой (Ti) и железной (Fe) составляющих комбинированного электрода в зависимости от общего поляризующего тока в растворе 1.0 M NaCl с добавлением HF, моль/л: (а) 0.1; (б) 1.0.

Можно отметить, что при относительно низких концентрациях фтороводородной кислоты (0.1–0.5 моль/л) практически весь анодный ток протекает через поверхность железной составляющей комбинированного электрода, и с ростом поляризации его доля не изменяется. При более высокой концентрации HF (1.0 моль/л и более) наблюдается совершенно иная картина. При малой поляризации и ее увеличении до 500 мА ток протекает преимущественно по поверхности титана. При достижении значения в 500 мА распределение тока по поверхности комбинированного электрода равномерно. Дальнейшее увеличение анодной поляризации приводит к пассивации поверхности титановой составляющей комбинированного электрода и весь анодный ток протекает по поверхности железа. Вероятно, это связано с активирующим действием фторид-ионов, что обусловливает интенсивное растворение титана. Вследствие интенсивного выделения водорода на катоде коаксиального бездиафрагменного электролизера и последующего подщелачивания среды поверхность титана переходит в пассивное состояние, при этом доля тока, протекающая по его поверхности, уменьшается.
Последнее отражается на состоянии поверхности составляющих комбинированного анода (рис. 3).
Рис. 3.
Состояние поверхности титановой (а), (б) и железной (в), (г) составляющих комбинированного анода после электролиза в растворе 1.0 M NaCl с добавлением 0.5 (а), (в) и 1.0 (б), (г) моль/л HF при плотности тока 100 мА/см2 в течение 1 ч.

Эквивалентную электрическую схему совместного анодного растворения, комбинированного Fe–Ti электрода можно представить, как состоящую из двух параллельных цепей, каждая из которых содержит последовательно соединенные сопротивление электролита и поляризационное сопротивление на границе электрод – раствор. Величина сопротивления электролита постоянна и от силы тока не зависит.
Результаты рентгеноструктурного анализа продуктов растворения комбинированного анода Fe–Ti, подвергнутых созреванию в маточном демонстрируют наличие сложных оксидов, например, Fe(FeTi)O4, и оксигидроксидов FeOOH.
Режимы и условия анодного растворения, фазовый состав этих продуктов, подвергнутых прокаливанию при 1100°C, представлены в табл. 1.
Таблица 1.
Условия и результаты получения дисперсных оксигидроксидных и оксидных систем на основе титана и железа, в коаксиальном электролизере с комбинированным анодом Fe–Ti. Раствор 1.0 M NaCl + x M HF
| № | x | SFe : STi | j, мА/см2 | t, мин | Результаты рентгенофазового анализа при температуре обработки 1100°С | ||
|---|---|---|---|---|---|---|---|
| фаза | мас. % | ОКР, Å | |||||
| 1 | 0.1 | 2 : 1 | 100 | 150 | α-Fe2O3 | 100 | 785 |
| 2 | 0.5 | 5 : 1 | 100 | 60 | α-Fe2O3 | 92 | 820 |
| Fe2TiO5 | 8 | 650 | |||||
| 3 | 150 | α-Fe2O3 | 92.4 | 837 | |||
| Fe2TiO5 | 7.6 | 682 | |||||
| 4 | 200 | α-Fe2O3 | 83.2 | 935 | |||
| Fe2TiO5 | 16.8 | 600 | |||||
| 5 | 1.0 | 5 : 1 | 100 | 60 | α-Fe2O3 | 33.3 | 832 |
| Fe2TiO5 | 62.5 | 541 | |||||
| NaF | 4.5 | 683 | |||||
При электрохимическом синтезе предшественников сложных оксидов титана и железа при соотношении площадей железной и титановой составляющих анода 2 : 1 (табл. 1, п. 1), окисление металла с последующим образованием осадка в объеме раствора протекает только на железной составляющей комбинированного электрода. Продукт растворения представлен фазами магнетита и гетита. При прокаливании данные фазы претерпевают термические превращения с образованием хорошо окристаллизованного гематита α-Fe2O3.
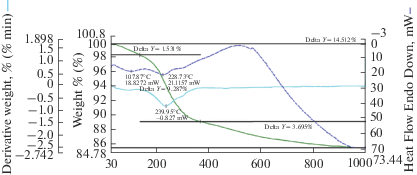
В последующих экспериментах, для интенсификации поверхности титановой составляющей комбинированного анода, увеличивали концентрацию HF в электролите до 1.0 моль/л. В результате совместного растворения титана и железа в продукте электролиза при 80°С формируются гидроксид железа со структурой гетита α-FeOOH и сложный оксид железа и титана со структурой ульвошпинели Fe(FeTi)O4. При высокотемпературной обработке (1100°С) продукта электролиза гидроксид железа переходит в устойчивую фазу оксида со структурой гематита α-Fe2O3, а ульвошпинель – в фазу псевдобрукита Fe2TiO5. Результаты термогравиметрии косвенно подтверждают фазовые превращения образцов, имеющие место при росте температуры (рис. 4). В интервале значений 140–370°С наблюдается максимальный эффект потери массы образца (около 9%), что можно соотнести с переходом фазы гетита α‑FeOOH в устойчивую, хорошо окристаллизованную фазу гематита α-Fe2O3 [14].
Согласно полученным изотермам адсорбции, продукт электролиза – осадок, состоящий из оксигидроксида железа и сложного оксида титана и железа (α-FeOOH – 93.4%, Fe(FeTi)O4 – 6.6%), имеет достаточно развитую поверхность, достигающую 34 м2/г. Однако при термообработке данной системы при 1100°С значение удельной поверхности образца существенно уменьшается (примерно на 2 порядка), что может быть связано со структурными изменениями, а также с объединением частиц в процессе нагревания.
Как показывают результаты исследований, наибольшую роль в процессе образования сложных оксидов железа и титана путем сопряженного анодного растворения соответствующих металлов, играет концентрация фтороводородной кислоты (рис. 5а). Чем она выше, тем большее содержание титаната железа Fe2TiO5 (псевдобрукита) в конечном продукте (рис. 5а).
Рис. 5.
(а) Зависимость содержания фаз в продукте электролиза, термообработанном при 1100°С, от концентрации HF в электролите 1.0 M NaCl (j = 100 мА/см2, SFe : STi = 5 : 1, t = 60 мин); (б) зависимость содержания фаз в продукте электролиза при 80°С от плотности тока (1.0 M NaCl + 0.5 M HF, SFe : STi = 5 : 1, t = 60 мин).
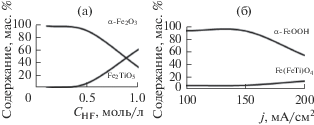
Характеристики режима электролиза, такие как кажущаяся плотность тока, в меньшей степени влияют на фазовый состав осадка (рис. 5б). Содержание фазы ульвошпинели в осадке, высушенном при 80°C, увеличивается примерно в два раза (c 6 до 13%) с ростом плотности тока. Вместе с тем, в осадках, сформированных в процессе электролиза при 80°С, с ростом плотности тока (≥100 мА/см2) появляются побочные продукты, такие как гексафторферраты (Na3FeF6) и гексафтортитанаты (Na3TiF6) натрия. При термическом воздействии эти примеси, по-видимому, разлагаются, что подтверждается отсутствием рефлексов фторсодержащих соединений на рентгеновских дифрактограммах продуктов, подвергнутых высокотемпературной обработке. Увеличение поверхности железной составляющей комбинированного электрода относительно титановой также приводит к росту содержания псевдобрукита в конечном продукте.
Фазообразование сложных оксидов титана и железа при электролизе с использованием комбинированного анода Fe–Ti и последующих высокотемпературных превращениях можно представить в виде условной схемы:
ВЫВОДЫ
1. Анодное поведение исследованного комбинированного Fe–Ti электрода носит сложный характер и отличается от такового для индивидуальных металлических электродов вследствие различной природы (соответственно, поляризационного сопротивления) поверхностей титана и железа, погруженных в галогенидсодержащий электролит.
2. При отсутствии внешней поляризации комбинированный анод представляет собой короткозамкнутый элемент, поверхность которого практически эквипотенциальна и характеризуется значением потенциала, находящегося между величинами коррозионных потенциалов титанового и железного электродов вследствие относительно большой проводимости электролита и малых размеров электрода.
3. При внешней поляризации значения потенциалов поверхности титановой и железной составляющих комбинированного анода различны; эта разница возрастает с увеличением внешнего тока. Большую роль в распределении тока играет и концентрация фтороводородной кислоты, ее повышение способствует росту доли анодного тока на титановой составляющей.
Работа выполнена в рамках государственного задания № 4.5784.2017/8.9 на 2017–2019 гг.
Список литературы
Gomes J.A.G. et al. // J. Hazardous Materials. 2007. V. 139. Is. 2. P. 220–231.
Киселев В.Г., Медяный С.А. // Проблемы энергетики. 2014. № 7–8. С. 89–95.
Коробочкин В.В., Усольцева Н.В., Балмашнов М.А. // Фундаментальные исследования. 2012. № 11. С. 143–147.
Есенин В.Н., Денисович Л.И. // Защита металлов. 2007. Т. 43. № 4. С. 390–395.
Palanisamy B., Babu C.M., Sundaravel B. et al. // J. Hazardous Materials. 2013. V. 252–253. P. 233–242.
Nasirian M., Bustillo-Lecompte C.F., Mehrvar M. // J. Environmental Management. 2017. V. 196. P. 487–498.
Chen L., He B.-Y., He Sh., Wang T.-J., Su Ch.-Li, Jin Y. // Powder Technology. 2012. V. 227. P. 3–8.
Попов Ю.А. // Журн. физической химии. 2007. Т. 81. № 8. С. 1502–1510.
Попов Ю.А. // Успехи химии. 2005. Т. 74. № 5. С. 435–451.
Мирзоев Р.А., Давыдов А.Д.. СПб.: Изд-во Политехн. ун-та, 2013. 382 с.
Schmuki P., // J. Solid. St. Electrochem. 2002. V. 6. P. 145–164.
Решетников С.М., Рылкина М.В. // Защита металлов. 2001. Т. 37. № 5. С. 517–520.
Давыдов А.Д., Земскова О.В. // Электрохимия. 1984. Т. 20. С. 722.
Cornell R.M. The Iron Oxides: Structure, Properties, Reactions, Occurrences, and Uses / Cornell R.M., Schwertmann U. Weinheim, Germany: Wiley, 2003. 703 p.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов