Физикохимия поверхности и защита материалов, 2020, T. 56, № 4, стр. 369-373
Математическое моделирование процесса сорбции ионов меди (Cu2+) на хитин- и хитозановых биокомплексах, выделенных из мицелия гриба Aspergillus niger
Л. В. Новинюк 1, П. З. Велинзон 1, *
1 Всероссийский научно-исследовательский институт пищевых добавок–филиал федерального государственного бюджетного научного учреждения “Федеральный научный центр пищевых систем имени В.М. Горбатова” РАН
191014 Санкт-Петербург, Литейный проспект, 55, Россия
* E-mail: aise50@rambler.ru
Поступила в редакцию 24.07.2019
После доработки 27.07.2019
Принята к публикации 02.08.2019
Аннотация
Исследование сорбции ионов Cu2+ на выделенных из мицелия гриба Aspergillus niger хитин- и хитозанглюкановых комплексах показало, что данные биополимеры обладают достаточно высокой сорбционной способностью. В результате математического моделирования установлено, что теоретические модели Лэнгмюра, Фрейндлиха и Темкина адекватно с высоким коэффициентом детерминации (R2 = 0.97–0.99) описывают равновесную сорбцию Cu2+ на исследованных биокомплексах. Анализ полученных из уравнения регрессии параметров сорбции показывает, что механизм сорбции Cu2+ на хитин- и хитозансодержащих комплексах имеет более сложный характер, отличающийся от теоретических предпосылок классических теорий и, предположительно, основан на процессах ионного обмена и комплексообразования.
ВВЕДЕНИЕ
В последние годы отмечается особенно повышенный интерес к природным полиаминосахаридам – хитину и его деацетилированному производному хитозану, представляющим собой структурные аналоги целлюлозы [1, 2]. Это связано, прежде всего, с широкими возможностями использования их в различных областях биотехнологии, медицины, пищевой промышленности, а также для очистки сточных вод [3–5]. Обращает на себя внимание способность данных биополимеров проявлять сорбционную активность по отношению к тяжелым металлам и радионуклидам [6–8].
В наибольших количествах хитин содержится в покровах (панцирях) ракообразных и насекомых, а также в клеточных стенках грибов и микроорганизмов [9, 10]. Известно, что в клеточной стенке мицелия гриба Aspergillus niger – продуцента лимонной кислоты, хитин содержится в виде хитин-глюканового комплекса [11, 12]. Проведенные нами исследования позволили выделить из мицелиальных отходов хитинглюкановый (ХГК) и хитозанглюкановый (ХТЗ ГК) комплексы [13], оценка сорбционной способности которых представляет научный и практический интерес. Мощным инструментом для понимания сорбционных процессов является математическое моделирование сорбции с привлечением известных теоретических моделей для описания экспериментальных результатов исследований по сорбции и оптимизации [14].
Целью данной работы является изучение и математическое моделирование процессов сорбции ионов Cu2+ на выделенных из мицелиальной биомассы гриба Aspergillus niger хитин- и хитозансодержащих биополимерах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение ХГК основано на проведении щелочного и кислотного гидролиза соответственно на стадиях депротеинизации и деминерализации для удаления сопутствующих белковых соединений, липидов, пигментов и минеральных примесей из мицелиальной биомассы. При деацетилировании ХГК получен ХТЗ ГК, степень деацетилирования которого составляла 82–95%.
Оценку сорбционной способности исследуемых образцов ХГК и ХТЗ ГК проводили в статических условиях при температуре 20 ± 2°С по сорбции ионов Cu2+ из сернокислых растворов солей с различной концентрацией. Выбор сорбата (ионов Cu2+) обусловлен наиболее частым использованием данного объекта в сравнительных исследованиях по изучению процессов сорбции на хитозане. Количество сорбированного металла рассчитывали по разности концентрации ионов Cu2+ в растворе до и после сорбции. Для определения концентрации ионов Cu2+ в растворах использовали метод йодометрического титрования. Статическую равновесную емкость рассчитывали по формуле (1):
где А – статическая равновесная емкость, мг/г; с0 – исходная концентрация ионов Cu2+ в растворе, мг/см3; с1 – остаточная концентрация ионов Cu2+ в растворе после сорбции, мг/см3; m – масса сорбента, г; V – объем раствора сернокислой меди, см3. Погрешность измерений составила 0.02–0.03 мг/см3. Обработку экспериментальных данных проводили с использованием пакета прикладных программ MS Excel и Statistica.Равновесие в сорбционных процессах определяется, в первую очередь, суперпозицией равновесий в фазах раствора и сорбента [15]. Задача равновесия сорбции – описать количество сорбируемого компонента в твердой фазе в зависимости от его равновесной концентрации в жидкой фазе и получить изотермы сорбции. Основные практические задачи – это определение констант равновесия для описания изотерм сорбции и расчет величин равновесной емкости с использованием определенных констант. Получение экспериментальных изотерм сорбции является наиболее подходящим методом для оценки сорбционной емкости адсорбента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
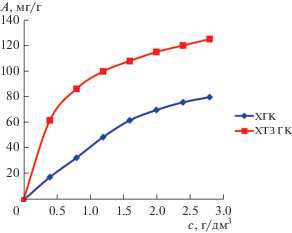
По экспериментальным данным проведенных исследований получены изотермы сорбции, устанавливающие зависимость величины сорбционной емкости А от равновесной концентрации сорбата с (рис. 1). Анализ изотерм сорбции ионов Cu2+ показывает, что сорбционная способность ХТЗ ГК значительно выше ХГК за счет наличия в хитозанглюкановом комплексе деацетилированных первичных аминогрупп (–NH2). Присутствие ацетильных групп в ХГК, возможно, создает стерические затруднения при сорбции ионов Cu2+.
По характеру кривых полученные изотермы сорбции в соответствии с классификацией БДДТ (Бруннауэра, Деминга, Деминга и Теллера) можно отнести к I типу изотерм сорбции [14]. Нами проведена математическая обработка экспериментальных изотерм сорбции ионов Cu2+ на ХГК и ХТЗ ГК с целью оценки возможности использования известных теоретических моделей адсорбции Лэнгмюра, Фрейндлиха и Темкина, наиболее часто используемых для описания равновесных сорбционных процессов [15, 16].
Теория Лэнгмюра характеризует мономолекулярную сорбцию на однородной поверхности твердой фазы, у которой все адсорбционные центры равноценны. Величина сорбционной емкости А при этом определяется из выражения (2):
или в линейной форме (3):(3)
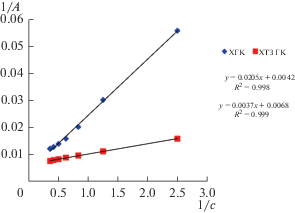
$\frac{1}{A} = \frac{1}{{{{a}_{{\text{L}}}}}} + \frac{1}{{{{a}_{{\text{L}}}}{{K}_{{\text{L}}}}c}},$Уравнение Лэнгмюра, как правило, очень хорошо с высоким коэффициентом корреляции описывает равновесную сорбцию ионов тяжелых металлов на полисахаридных сорбентах, что объясняет наиболее частое его использование [17].
Модель Фрейндлиха достаточно широко применяют для описания адсорбции растворенного вещества из раствора на неоднородной поверхности твердого тела, используя эмпирическое уравнение в виде степенной функции (4):
или в линейной форме: где KF и n – константы уравнения Фрейндлиха.Модель Темкина содержит параметр, учитывающий взаимодействия между адсорбционными центрами и адсорбатом. Кроме того, она предполагает, что снижение теплоты сорбции происходит в большей степени по линейному закону, чем по логарифмическому (6).
(6)
$A = \frac{{RT}}{{{{b}_{{\text{T}}}}}}\ln {{a}_{{\text{T}}}} + \frac{{RT}}{{{{b}_{{\text{T}}}}}}\ln c,$Эти модели легко могут быть линеаризованы для построения изотерм адсорбции в линейной форме и определения констант уравнений, характеризующих параметры процесса сорбции.
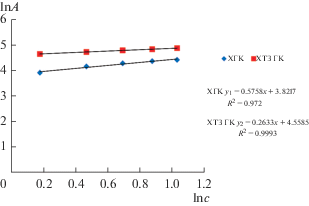
В результате математической обработки экспериментальных данных по сорбции Cu2+ на ХГК и ХТЗ ГК нами получены изотермы в линейной форме, графически представленные в координатах 1/А = f(1/c), lnА = f(lnc) и А = f(lnc) на рис. 2–4. Величина коэффициента детерминации R2 линейных моделей Лэнгмюра составила для ХГК и ХТЗ ГК соответственно 0.998 и 0.999, Фрейндлиха – 0.972 и 0.999, Темкина – 0.999 и 0.986. Из линейных уравнений регрессии определены значения параметров равновесной сорбции Cu2+ на ХГК и ХТЗ ГК (табл. 1).
Таблица 1.
Параметры линейных уравнений регрессии сорбции ионов Сu2+ на ХГК и ХТЗ ГК
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | Модель Темкина | |||
|---|---|---|---|---|---|---|
| аL, мг/г | КL, дм3/г | КF | n | аТ | bT | |
| ХГК | 238.10 | 0.21 | 45.68 | 0.74 | 3.28 | 65.66 |
| ХТЗ ГК | 147.06 | 1.84 | 95.44 | 3.80 | 44.99 | 92.68 |
По полученным параметрам (константам линейных уравнений Лэнгмюра, Фрейндлиха и Темкина) были построены теоретические модельные изотермы, которые практически наложились на экспериментальные кривые. На рис. 5 в качестве примера представлены экспериментальные и теоретические изотермы сорбции ионов Cu2+ на ХГК и ХТЗ ГК по модели Лэнгмюра. Для оценки адекватности теоретически рассчитанных изотерм экспериментально полученным проведена статистическая обработка с использованием дисперсий адекватности (S2) и критерия Фишера (F). Результаты рассчитанных значений дисперсий адекватности и критерия Фишера даны в табл. 2. Анализ значений дисперсий адекватности и критерия Фишера показывает, что наиболее адекватно линейная модель Лэнгмюра описывает процесс сорбции Cu2+ на ХТЗ ГК (Sл = 1.89, Fл = 1.44).
Рис. 5.
Экспериментальные и теоретические изотермы сорбции ионов Cu2+ на хитин- и хитозанглюкановом комплексе по модели Лэнгмюра.

Таблица 2.
Значения дисперсий адекватности и критерия Фишера для математических моделей сорбции ионов Cu2+ на хитин- и хитозанглюкановом комплексах
| Сорбент | Модель Лэнгмюра | Модель Фрейндлиха | Модель Темкина | |||
|---|---|---|---|---|---|---|
| $S_{{\text{л}}}^{2}$ | ${{F}_{{\text{л}}}}$ | $S_{{\text{л}}}^{2}$ | ${{F}_{{\text{л}}}}$ | $S_{{\text{л}}}^{2}$ | ${{F}_{{\text{л}}}}$ | |
| ХГК | 13.53 | 10.35 | 29.99 | 22.93 | 8.96 | 6.85 |
| ХТЗ ГК | 1.89 | 1.44 | 36.20 | 27.68 | 9.86 | 7.54 |
Полученные в рамках классических моделей равновесия параметры важны как для понимания закономерностей сорбции, так и механизма сорбционных процессов, протекающих при сорбции Cu2+ на выделенных из мицелиальной биомассы хитин- и хитозанглюкановых биополимерах. Определенные с использованием параметра KL (модель Лэнгмюра) по уравнению (7) значения коэффициента разделения (${{R}_{{\text{L}}}}$ = 0.91–0.98) меньше 1, что свидетельствует об имеющемся сродстве между адсорбатом-адсорбентом и о благоприятных условиях для сорбции Cu2+ на данных сорбентах.
где с0 – начальная концентрация ионов Cu2+ в растворе, г/ дм3.Несоответствие между теоретическими предельными значениями емкости монослоя ${{a}_{{\text{L}}}}$ и экспериментально полученными величинами максимальной емкости сорбентов указывает на то, что механизм сорбции Cu2+ на ХГК и ХТЗ ГК имеет более сложный характер, отличающийся от мономолекулярной адсорбции на однородной поверхности.
Значения константы Фрейндлиха n, характеризующей интенсивность сорбционного процесса, показывают, что для ХГК n < 1 при этом энергия связи сорбент-сорбат возрастает, в то время, как для ХТЗ ГК n > 1 и энергия связи уменьшается по мере заполнения поверхности. Это говорит о том, что функциональные группы сорбентов не равноценны, и механизм их взаимодействия с сорбатом имеет различный характер.
Параметры ${{a}_{{\text{T}}}}$ и ${{b}_{{\text{T}}}}$ (модель Темкина), учитывающие соответственно максимальную энергию связывания и теплоту адсорбции, при сорбции Cu2+ на ХТЗ ГК выше, чем на ХГК, возможно, за счет наличия деацетилированных первичных аминогрупп, способных образовывать устойчивые структурные связи. Присутствие у хитин- и хитозанглюкановых сорбентов гидроксильных, карбоксильных и высокоактивных аминогрупп позволяет предположить, что механизм взаимодействия их с ионами Cu2+ основан на процессах ионного обмена и комплексообразования.
ЗАКЛЮЧЕНИЕ
Изучение процесса сорбции ионов Cu2+ на хитин- и хитозанглюкановых комплексах показало, что выделенные из мицелия гриба Aspergillus niger биополимеры обладают достаточно высокой сорбционной емкостью. В результате математического моделирования процессов сорбции установлено, что все три теоретические модели (Лэнгмюра, Фрейндлиха и Темкина) адекватно с высоким коэффициентом детерминации (R2 = 0.97–0.99) описывают равновесную сорбцию Cu2+ исследованными биополимерами. Модель Лэнгмюра наилучшим образом (с R2 близким к единице) позволяет описать сорбцию Cu2+ на данных полиаминосахаридных сорбентах, что, в целом, согласуется с закономерностями сорбции тяжелых металлов целлюлозосодержащими материалами [17, 18].
Из полученных уравнений регрессии определены параметры сорбции, анализ которых показывает, что механизм сорбции на ХГК и ХТЗ ГК, имеющих высокоактивные гидроксильные, карбоксильные и аминогруппы, носит несколько иной характер, отличающийся от рассмотренных классических теорий. Предположительно, механизм взаимодействия сорбата с функциональными группами ХГК и ХТЗ ГК основан на процессах ионного обмена и образования хелатных комплексных соединений.
Список литературы
Хитин и хитозан. Получение, свойства и применение / под ред. Скрябина К.Г., Вихоревой Г.А., Варламова В.П. М.: Наука, 2002. С. 368.
Philibert T., Lee B. H., Fabien N. // Applied biochemistry and biotechnology. 2017. V. 181. № 4. P. 1314–1337.
Muxika A. et al. // International J. Biological Macromolecules. 2017. V. 105. № 2. P. 1358–1368.
Elsabee M.Z., Abdou E.S. // Materials Science and Engineering. 2013. V. 33. № 4. P. 1819–1841.
Luo Y., Wang Q. // J. Food Processing & Beverages. 2013. V. 1. № 1. P. 1–13.
Wang J., Chen C. // Bioresource technology. 2014. V. 160. P. 129–141.
Guibal E. // Separation and Purification Technology. 2004. V. 38. № 1. P. 43–74.
Muzzarelli R.A.A. // Carbohydrate Polymers. 2011. V. 84. № 1. P. 54–63.
Younes I., Rinaudo M. // Marine drugs. 2015. V. 13. № 3. P. 1133–1174.
Dhillon G.S. et al. // Critical reviews in biotechnology. 2013. V. 33. № 4. P. 379–403.
Феофилова Е.П. // Прикладная биохимия и микробиология. 2006.V. 42. № 6. P. 624–629.
Zimoch-Korzycka A. et al. // Food Hydrocolloids. 2016. V. 61. P. 338–343.
Новинюк Л.В., Кулев Д.Х., Велинзон П.З. // Пищевая промышленность. 2016. № 11. С. 30–31.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.: Мир. 1984. С. 306.
Дубинин М.М., Заверина Е.Д., Радушкевич Л.В. // ЖФХ. 1991. № 1. С. 9–30.
Gerente C. et al. // Critical Reviews in Environmental Science and Technology. 2007. V. 37. № 1. P. 41–127.
Никифорова Т.Е., Козлов В.А. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 3. С. 243–271.
Алексеева О.В., Багровская Н.А., Носков А.В. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 1. С. 18–24.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов