Физикохимия поверхности и защита материалов, 2020, T. 56, № 5, стр. 459-462
Молекулярно-динамические расчеты адсорбционных равновесий смесей газов в микропорах активных углей и на графеновых поверхностях
М. Р. Гумеров 1, П. Е. Фоменков 1, Т. А. Кузнецова 1, А. М. Толмачев 1, *
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, ГСП-1, Ленинские горы, д. 1, стр. 3, Россия
* E-mail: amtolmach@yandex.ru
Поступила в редакцию 24.10.2019
После доработки 27.11.2019
Принята к публикации 04.12.2019
Аннотация
В дополнение к полученным ранее данным показано, что рассчитанные методом молекулярной динамики изотермы адсорбции компонентов смесей легких углеводородов в микропорах активных углей и на графеновых поверхностях количественно описываются уравнениями решеточной моделей с хорошо согласованными параметрами уравнений.
ВВЕДЕНИЕ
При изучении адсорбции смесей преимущества численного эксперимента над физическим экспериментом проявляются особенно ярко. В численном эксперименте легко осуществлять расчеты при любых постоянных общих степенях насыщения адсорбента или постоянных давлениях смеси, получаются непосредственно абсолютные величины адсорбции, не возникает проблем с определением равновесных составов объемной и адсорбционной фаз. Для изучения адсорбции бинарных смесей газов были взяты смеси основных компонентов природного газа: метан, этан, этилен и пропан.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Молекулярно-динамические расчеты адсорбции смесей проводили при постоянной температуре и предельном или постоянном заполнении микропоры. Соответствующие давления выбирались для каждого компонента с учетом его мольной доли в смеси.
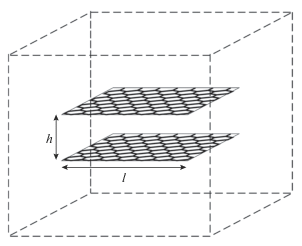
Методика численного эксперимента подробно описана в [1]. Все расчеты проводились в ячейке (12 × 12 × 12 нм) с подвижными стенками и периодическими граничными условиями, в которую помещалась щелевидная микропора, ограниченная квадратными пластинами графена размером 5 × 5 нм (рис. 1).
Ширина пор варьировалась от 0.8 до 1.2 нм. В этом случае адсорбция осуществлялась как внутри пор, так и на их внешней и торцевых поверхностях. Для иллюстрации методики расчета рассмотрим адсорбцию смеси метан/этилен при T = 313 К и постоянной степени заполнения микропоры равной 0.5. Для данной смеси после проведения расчета были получены данные о зависимости мольных долей адсорбатов в микропоре и адсорбтивов в объемной фазе от расстояния от центра поры, представленные на рис. 2. Ширина поры 1 нм.
Рис. 2.
Зависимости мольных долей (Ni = Yi в поре, Ni = Xi в объемной фазе) метана (◆) и этилена (⚪) от расстояния от центра модельной поры при T = 313 K. Пунктиром обозначена граница поры.
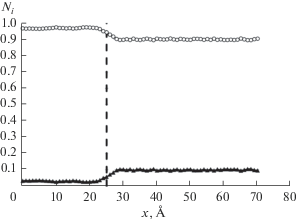
В результате численного эксперимента четко выявляется переходная зона от адсорбированной фазы к газовой фазе. Именно поэтому невозможно точно провести межфазовую границу. В результате этой проблемы Гиббс предложил проводить термодинамический анализ адсорбционных систем без разделения на отдельные фазы в рамках “метода избытков Гиббса” [2, 3]. При переходе к “методу полного содержания”, оперирующего с абсолютными концентрациями адсорбата и адсорбтива в равновесных фазах, адсорбционные системы разделяются на две фазы с приближенным проведением границы раздела фаз [4–7]. В случае микропористых адсорбентов такое разделение можно с большой точностью проводить по границе микропоры [7].
Таблица 1.
Ошибка определения средней плотности в методе полного содержания для смеси метан/этилен
| Исходное содержание метана в смеси, % | Ошибка, % |
|---|---|
| 10 | 1.07 |
| 30 | 1.21 |
| 50 | 1.80 |
| 70 | 1.15 |
| 90 | 1.05 |
Это наглядно демонстрирует приближение метода полного содержания, в котором определяются средние концентрации адсорбата в микропорах. Мы рассчитали ошибки метода в определении средней плотности молекул в микропоре для смесей с разным содержанием компонентов, связанные с этим приближением.
Ошибка максимальна при эквимолярном составе смеси и закономерно уменьшается при переходе к чистым веществам.
Для всех смесей строились фазовые диаграммы – зависимость мольной доли компонентов смеси в газовой фазе (Xi) от мольной доли в адсорбционной фазе (Yi). Примеры таких фазовых диаграмм представлены на рис. 3а, 3б.
Рис. 3.
Фазовые диаграммы для адсорбции смесей: (а) этилена (⚪), пропана (◼) и (б) этана (⚪) и пропана (◼) при предельном заполнении адсорбента и T = 313 K.
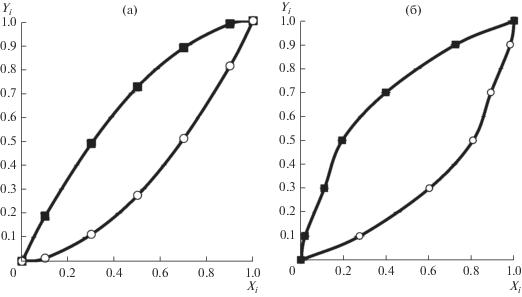
На основании фазовых диаграмм рассчитывались интересные для сравнения и важные с практической точки зрения зависимости коэффициентов разделения от равновесного состава адсорбционной фазы
(1)
$К = \frac{{{{Y}_{i}}\left( {1 - {{X}_{i}}} \right)}}{{{{X}_{i}}\left( {1 - {{Y}_{i}}} \right)}}.$Причем в качестве первого выбирался более сильно адсорбирующийся компонент. Некоторые примеры приведены в табл. 2.
Таблица 2.
Коэффициенты разделения (К) различных смесей при адсорбции в поре и на углеродной поверхности
| Пропан/этан, 313 К | Пропан/этилен, 313 К | Этилен/метан, 313 К | ||||||
|---|---|---|---|---|---|---|---|---|
| доля пропана | пора | поверхность | доля пропана | пора | поверхность | доля этилена | пора | поверхность |
| 0.1 | 3.42 | 1.58 | 0.1 | 2.08 | 1.78 | 0.1 | 5.27 | 1.65 |
| 0.3 | 3.53 | 1.79 | 0.3 | 2.24 | 1.99 | 0.3 | 5.36 | 2.79 |
| 0.5 | 4.17 | 2.20 | 0.5 | 2.65 | 1.89 | 0.5 | 6.12 | 2.56 |
| 0.7 | 3.47 | 2.31 | 0.7 | 3.40 | 2.42 | 0.7 | 4.03 | 2.36 |
| 0.9 | 5.62 | 2.43 | 0.9 | 4.54 | 3.51 | 0.9 | 3.05 | 2.15 |
Отметим, что коэффициенты разделения на поверхности, как и следовало ожидать, меньше коэффициентов разделения в поре из-за меньших энергий взаимодействия адсорбат–адсорбент. Изменение коэффициентов разделения с изменением состава объемных фаз носит сложный характер и зависит от различий энергий взаимодействия компонентов смеси с адсорбентом.
Анализ изотерм адсорбции компонентов смесей рассмотрим на примере смеси пропан–этилен при температуре 313 К.
Для адсорбции из бинарных смесей газов, при условии полного насыщения адсорбционной фазы суммой адсорбатов, уравнения для абсолютной монослойной адсорбции компонентов на графеновых поверхностях и при двухслойной адсорбции в микропорах [8, 9] имеют вид (2), (3):
(2)
$\begin{gathered} {\text{ln}}{{Y}_{1}}(1--{{{{X}_{1}})} \mathord{\left/ {\vphantom {{{{X}_{1}})} {{{X}_{1}}}}} \right. \kern-0em} {{{X}_{1}}}}(1--{{Y}_{1}}))--B + \\ + \,\,{\Delta \mathord{\left/ {\vphantom {\Delta {kT}}} \right. \kern-0em} {kT}}\left( {A{{Y}_{1}}--12{{X}_{1}}} \right) = 0,~ \\ \end{gathered} $(3)
${{Y}_{1}} = {а \mathord{\left/ {\vphantom {а {{\text{N}}{{{\text{a}}}_{{1m}}}}}} \right. \kern-0em} {{\text{N}}{{{\text{a}}}_{{1m}}}}}.$Где: А = 6, N = 1 и А = 9, N = 2 для адсорбции на макро- и микропористых адсорбентах, X, Y – мольные доли компонентов в растворе и в адсорбционной фазе, ${{a}_{{1m}}}$ – емкость монослоя, B, Δ/kT – энергетические константы:
(4)
$\begin{gathered} B{\text{ }} = - [{{\varepsilon }_{{02}}} - {{\varepsilon }_{{01}}} + {{{{z}_{В}}({{\varepsilon }_{{22}}} - {{\varepsilon }_{{12}}})]} \mathord{\left/ {\vphantom {{{{z}_{В}}({{\varepsilon }_{{22}}} - {{\varepsilon }_{{12}}})]} {kT}}} \right. \kern-0em} {kT}}, \\ \Delta = 2{{\varepsilon }_{{12}}} - {{\varepsilon }_{{11}}} - {{\varepsilon }_{{22}}}, \\ \end{gathered} $На рис. 4 и 5 приведены примеры изотерм адсорбции компонентов смеси в поре и на поверхности и результаты их обработки уравнениями решеточной модели.
Рис. 4.
Индивидуальные изотермы адсорбции компонентов смеси пропана (⚪) и этилена (◼) в поре при 313 К и результат их обработки уравнениями решеточной модели (сплошные линии).
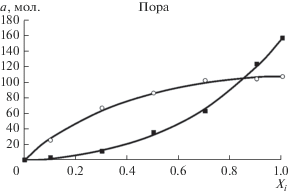
Рис. 5.
Индивидуальные изотермы адсорбции компонентов смеси пропана (⚪) и этилена (◼) на удвоенной поверхности при 313 К и результат их обработки уравнениями решеточной модели (сплошные линии).
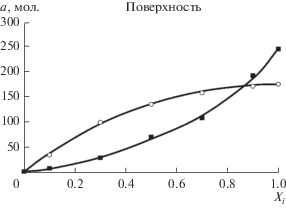
Из рисунков видно, что абсолютные изотермы компонентов смеси количественно описываются уравнениями решеточной модели. Аналогичные данные были получены и для других систем.
Результаты табл. 3 показывают, что параметры уравнений для адсорбции в микропоре и на поверхности удовлетворительно согласуются друг с другом, что подтверждает одинаковый механизм заполнения микропоры и поверхности.
Таблица 3.
Энергетические параметры уравнений решеточной модели для изотерм компонентов смесей газов
| Т = 313 К | ||||
| Параметры | пора | поверхность | ||
| пропан | этан | пропан | этан | |
| B | 0.51 | 0.8 | 0.48 | 0.8 |
| Δ/kT | 1.96 | –0.25 | 1.96 | –0.24 |
| Т = 313 К | ||||
| Параметры | пора | поверхность | ||
| пропан | этилен | пропан | этилен | |
| B | 0.86 | 1.23 | 0.86 | 1.19 |
| Δ/kT | 1.98 | 0.05 | 1.96 | 0.05 |
| Т = 313 К | ||||
| Параметры | пора | поверхность | ||
| метан | этилен | метан | этилен | |
| B | 1.39 | 1.98 | 1.43 | 1.92 |
| Δ/kT | 0.95 | –0.55 | 0.89 | –0.49 |
Таким образом, предложенный ранее способ расчета изотерм адсорбции смесей паров в модельной поре активного угля методом молекулярной динамики может быть применен для количественного расчета изотерм адсорбции компонентов бинарных газовых смесей и их описания уравнениями решеточной модели и при температурах выше критических.
Список литературы
Гумеров М.Р., Фоменков П.Е., Крюченкова Н.Г., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 2. С. 115.
Гиббс Дж.В. // Термодинамика. Статистическая механика. Наука. Москва. 1982.
Лопаткин А.А. // Теоретические основы физической адсорбции. Изд-во МГУ. 1983.
Guggenheim E.A., Adam N.K. // Proc. Roy. Soc. 1933. V. l. A139. P. 218.
Ларионов О.Г. // Дис. д-ра хим. наук. ИФХ АН СССР, Москва. 1975.
Серпинский В.В., Якубов Т.С. // Изв. АН СССР. Сер. хим. 1985. С. 12.
Фомкин А.А. // Дис. д-ра физ-мат. наук. ИФХ РАН, Москва. 1993.
Толмачев А.М., Фирсов Д.А., Крюченкова Н.Г., Кузнецова Т.А. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 3. С. 234.
Толмачев А.М. // Адсорбция газов, паров и растворов. Изд-во Граница. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов