Физикохимия поверхности и защита материалов, 2020, T. 56, № 6, стр. 570-578
Металл-органические нанопористые адсорбенты высокой плотности на основе циркония для аккумулирования метана
О. В. Соловцова 1, *, А. Л. Пулин 1, И. Е. Меньщиков 1, Н. П. Платонова 1, М. К. Князева 1, С. С. Чугаев 1, А. В. Школин 1, А. А. Фомкин 1
1 ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: o.solovtsova@phyche.ac.ru
Поступила в редакцию 09.06.2020
После доработки 01.07.2020
Принята к публикации 08.07.2020
Аннотация
Сольвотермальным методом в органическом растворителе N,N-диметилформамиде синтезирован образец металл-органической каркасной структуры Zr-BDC при при температуре 110°С. Полученный материал характеризуется развитой пористой структурой с удельной поверхностью SBET = 1060 м2/г, объемом микропор W0 = 0.44 см3/г и средним эффективным радиусом микропор х0 = 0.54 нм, что позволяет рассматривать его в качестве потенциально эффективного адсорбента для систем адсорбированного природного газа. Разработаны параметры формования образцов на основе Zr-BDC со связующим (поливиниловый спирт) и без него при различных давлениях прессования. Исследовано влияние давления формования на насыпную плотность полученных образцов и на их структурно-энергетические характеристики. На основе теории объемного заполнения микропор М.М. Дубинина рассчитаны зависимости активной удельной объемной емкости по метану от давления на исходном рассыпном и формованном адсорбенте Zr-BDC при температурах 243, 273 и 303 К и давлениях до 100 бар. Экспериментально измерена активная удельная объемная емкость по метану адсорбционной системы на основе формованного Zr-BDC в указанных термодинамических условиях.
ВВЕДЕНИЕ
Металл-органические каркасные структуры (МОКС) – быстроразвивающийся класс многофункциональных пористых материалов, одним из преимуществ которых является относительно высокая пористость и удельная поверхность в сочетании с четко определенным размером микропор [1, 2]. Некоторые семейства МОКС обладают выдающимися адсорбционными свойствами, в том числе и по отношению к природному газу метану [3, 4]. Однако, на сегодняшний день большинство МОКС имеют недостаточную термическую, химическую и механическую стабильность, что ограничивает их применение в крупномасштабных промышленных производствах [5].
Разработка металлорганических каркасных структур на основе четырехвалентного металла Zr(IV) стало важным этапом в развитии химии МОКС [6]. Структуры UiO-66 [7–9], UiO-67 и UiO-68 представляют собой типичные МОКС на основе Zr с относительно высокой удельной поверхностью (1180–1240 м2/г) и высокой стабильностью. Каркас UiO-66 построен из кластеров Zr6O4(OH)4 и терефталатных (1,4-бензолдикарбоксилатных, BDC) линкеров (рис. 1). Каждый атом циркония является восьмикоординированным, образуя квадратную антипризматическую координацию, состоящую из восьми атомов кислорода. Одна квадратная грань образована атомами кислорода карбоксилатов, а вторая – атомами кислорода, приходящими из групп μ3-O и μ3-OH. В каркасе UiO-66 октаэдрические и тетраэдрические полости имеют свободные диаметры 1.1 и 0.8 нм соответственно (рис. 1), которые связаны с узкими треугольными окнами со свободными диаметрами 0.5–0.7 нм. Такие каркасы относительно устойчивы к гидратации, а также воздействию кислых или основных реагентов [8].
Рис. 1.
Структурa МОКС UiO-66: серым цветом обозначены атомы углерода С, красным – атомы кислорода О, голубым – атомы циркония Zr, белым – атомы водорода. Сферы соответствуют свободным объемам внутри ячеек.
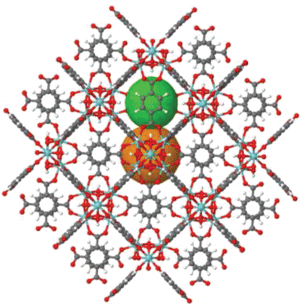
Высокая стабильность UiO-66 обусловлена комбинацией прочных Zr–O-связей, образованных между кластерами и карбоксилатными лигандами, и способностью Zr-кластера реверсивно перестраиваться при удалении или добавлении групп µ3-OH без каких-либо изменений в связывающих карбоксилатах.
Ввиду относительно низкой растворимости терефталевой кислоты (H2BDC) в воде, на сегодняшний день самым эффективным является растворитель N,N-диметилформамид (ДМФА), который дает возможность синтезировать материалы в условиях опытного производства [10]. Для МОКС на основе Zr характерна термическая устойчивость до 500°С. Температура разложения данного МОКС зависит от выбора органического лиганда, даже если он образует структуры с одинаковой топологией. Это подтверждается результатами работы [11], в которой представлены данные термогравиметрического анализа (ТГА) для циркониевой МОКС на основе лигандов BDC (1,4-бензолдикарбоксилат).
Недавние исследования [12] показали стабильность структуры циркониевых МОКС (Zr-BDC) по отношению к приложенному давлению формования. Так прессование под давлением 1000 и 10 000 psi (6.89 и 68.9 МПа, соответственно) по данным Фурье-спектроскопии и рентгенографии, не привело к деградации кристаллической структуры. При этом также не изменяются параметры пористой структуры материала.
Таким образом, насыпную плотность синтезированного порошка МОКС Zr-BDC потенциально можно увеличить без значительной деградации пористой структуры. Это свойство в сочетании с термической и химической стабильностью, а также с оптимальными параметрами пористой структуры делает МОКС Zr-BDC привлекательными адсорбентами для аккумулирования энергетических газов, в том числе для использования в системах адсорбированного природного газа (АПГ). Однако, на данный момент имеется мало информации о сорбционной емкости циркониевых МОКС по отношению к основному компоненту природного газа метану. Так в [13] адсорбция метана на образце порошкообразного исходного МОКС Zr-BDC составила 3.6 ммоль/г при температуре 273 К и давлении 9.8 бар, а расчеты в работе [14] для формованного МОКС показали относительно высокую объемную емкость по метану – 163 м3(НТД11)/м3.
Целью работы является создание стабильного адсорбента с повышенной насыпной плотностью для аккумулирования метана на основе структуры Zr-BDC.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез МОКС Zr-BDC
При синтезе МОКС Zr-BDC 0.34 г терефталевой кислоты (Н2ВDС или C6H4(COOH)2) растворяли в 30 мл органического растворителя ДМФА, затем добавляли к 0.53 г соли ZrCl4 и перемешивали полученный раствор в стеклянной емкости около 15 мин на магнитной мешалке без подогрева, после чего раствор помещали в автоклав. Синтез вели в течение 48 ч при температуре 110°С в сушильном шкафу. Образующийся осадок белого цвета отделяли от исходного раствора методом вакуумного фильтрования, многократно промывая горячим (~60°С) растворителем ДМФА. Образцы сушили при комнатной температуре в течение суток, а затем в печи при температуре 110°С в течение нескольких часов.
Исследование дифракции рентгеновских лучей на синтезированном образце проводили на порошковом дифрактометре Empyrean фирмы Panalytical в диапазоне углов 2θ от 0° до 50°, при этом использовали геометрию фокусировки Брэгга–Брентано и CuKα-фильтрацию рентгеновского излучения. Перед исследованием образец растирали в мелкодисперсный порошок-пудру, смешивали с этиловым спиртом до образования однородной пасты, затем укладывали на специальную пластинку и высушивали, после чего устанавливали пластинку с образцом на столик прибора и производили эксперимент.
На рис. 2 представлена дифрактограмма синтезированного образца адсорбента Zr-BDC. Основные рефлексы при углах около 2θ равных ~7°, 8°, 12° и 25° на рентгеновской дифрактограмме согласуются с рефлексами расчетной дифрактограммы структуры UiO-66, приведенными в [6] и другими литературными данными [13].
Термогравиметрическую кривую (рис. 3) синтезированного образца МОКС Zr-BDC снимали при нагревании со скоростью 10°C/мин до температуры 600°С в потоке аргона.
Рис. 3.
Зависимость изменения массы m = f(t) и дифференциального изменения массы dm/dt = f(T) образца МОКС Zr-BDC с ростом температуры в потоке аргона. Скорость изменения температуры 10°С/мин.

Как следует из рис. 3 процесс потери веса с температурой m = f(t) имеет три характерных области. Первая область потери веса до ~100°С обусловлена испарением адсорбированной на поверхности адсорбента Zr-BDC воды, вторая до ~420°С разложением ДМФА, а третью область до ~500оС можно отнести к термическому разложению МОКС. Из поведения дифференциальной кривой dm/dt = f(T) следует, что наиболее высокая скорость потери веса образца МОКС соответствует температуре ~485°С.
Структурные и адсорбционные свойства МОКС Zr-BDC
Структурно-энергетические характеристики (СЭХ), а именно удельный объем микропор W0, энергия адсорбции стандартного пара азота E, характеристическая энергия адсорбции стандартного пара в перерасчете на бензол Е0, средняя эффективная полуширина микропор x0 образцов в исходном и уплотненном видах были определены согласно теории объемного заполнения микропор (ТОЗМ) [15] по изотермам адсорбции/десорбции стандартного пара азота при 77 К на анализаторе пористой структуры Quantachrome IQ. Насыпная плотность адсорбента в исходном состоянии d0 измерена в соответствии с [16], а удельная площадь поверхности SBET определена по стандартному методу БЭТ [17].
Параметры пористой структуры синтезированного образца МОКС Zr-BDC представлены в табл. 1. Адсорбент характеризуется удельной площадью поверхности по БЭТ равной 1057 м2/г и объемом микропор, составляющим 0.44 см3/г, что позволяет рассматривать его в качестве эффективного адсорбента для хранения метана в системах АПГ [3].
Адсорбат
В качестве адсорбата использовали метан ВЧ, который в соответствии с [18] обладает следующими физико-химическими характеристиками: молярная масса μ = 16.043 г/моль; критическая температура Tcr = 190.56 К; критическое давление pcr = 4.599 МПа; критическая плотность ρcr = 162.66 кг/м3; нормальная температура кипения T0 = 111.67 К; температура тройной точки Ttr.p = 90.69 К.
Формование МОКС Zr-BDC
Для увеличения насыпной плотности адсорбента и, соответственно, для увеличения объемной емкости по метану адсорбционной системы на его основе, предложено проводить формование МОКС путем прессования под давлением с использованием связующего и без него.
Формование МОКС проводили с использованием гидравлического пресса ПГМ-500МГ4. Для этого пресс-форму наполняли предварительно гомогенизированной смесью синтезированного порошка Zr-BDC в количестве 14 грамм в первом случае с раствором связующего, а во втором без него. В качестве связующего использовали 5% раствор поливинилового спирта (ПВС) в количестве 14 г. Условное обозначение образцов со связующим – Zr-BDC-ПВС. Образцы формовали при давлениях 30, 80, 110, 160, 190, 240 МПа и выдерживали в течение 1 мин и далее сушили в печи при температуре 110°С в течение времени до 12 ч с периодическим замером изменения массы. Полученные функциональные адсорбционные материалы с повышенной насыпной плотностью представляли собой цилиндрические моноблоки диаметром 20 мм и высотой 10 мм.
Измерение активной удельной объемной емкости по метану
На рис. 4 представлена принципиальная схема экспериментального стенда, предназначенного для определения величин активной удельной объемной емкости по метану различных образцов адсорбентов – как в исходном, так и в формованном видах.
Рис. 4.
Принципиальная схема экспериментального стенда для определения величин активной удельной объемной емкости по метану образцов адсорбентов. Обозначения: 1 – баллон с метаном; 2 – ресивер низкого давления; 3 – газовый компрессор марки Phill HRA 1,5 P36 SMART; 4 – ресивер высокого давления; 5 – адсорбер с адсорбентом; 6 – криотермостат марки LOIP FT-311-80, заполненный этиловым спиртом; РД1, РД2 – регуляторы давления; В1, В2 – вентили газовые запорные; PI1 – манометр показывающий марки МО-1226; TT1 – датчик температуры, FQI1 – счетчик газа марки ГСБ-400.
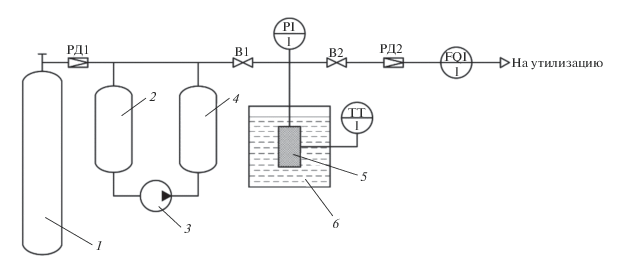
Перед проведением экспериментов адсорбер 5 с помещенным в него адсорбционным материалом предварительно регенерировали. Непосредственно в самом эксперименте адсорбер с адсорбентом был погружен в ванну криотермостата 6, заполненную этиловым спиртом, в которой поддерживалась требуемая температура 243, 273 и 303 К. Точность поддержания температуры составляла ±0.1 К. Температура в адсорбере контролировалась с помощью датчика температуры (платинового термометра сопротивления) TT1.
Метан ВЧ из баллона 1 перепускали в ресивер низкого давления 2 через регулятор давления РД1. Далее с помощью компрессора 3 газ перекачивали из ресивера низкого давления в ресивер высокого давления 4. При закрытом вентиле В2 открывали вентиль В1 и перепускали газ в адсорбер до давления 35 или 100 бар. Давление в адсорбере контролировали с помощью образцового манометра PI1 с относительной погрешностью ±0.15%. После достижения равновесия в системе по температуре и давлению начинали процесс выдачи газа из адсорбера при закрытом вентиле В1 и открытом вентиле В2. Выдача газа осуществлялась со скоростью около 10 л/мин через регулятор давления РД2 и барабанный газовый счетчик FQI1 с избыточного давления 35 или 100 бар до конечного избыточного давления 1 бар при условии достижения равновесия в системе по температуре и давлению. Относительная погрешность измерения количества газа газовым счетчиком составляла ±1%.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Согласно работам [19–23] для теоретического анализа общих закономерностей адсорбции метана на микропористых адсорбентах в широких интервалах давлений и температур, в том числе в области сверхкритических температур, наиболее предпочтительно использование ТОЗМ М.М. Дубинина [15]. В соответствии с термическим уравнением Дубинина–Радушкевича (1) адсорбция выражается следующим образом:
(1)
$a = {{a}_{0}}\exp \left[ { - {{{\left( {\frac{{RT\ln \left( {{{{{f}_{s}}} \mathord{\left/ {\vphantom {{{{f}_{s}}} f}} \right. \kern-0em} f}} \right)}}{{\beta {{E}_{0}}}}} \right)}}^{2}}} \right],$Величину предельной адсорбции a0 при температуре T определяли по уравнению Дубинина–Николаева:
где $a_{0}^{0}$ – предельная адсорбция в ммоль/г при температуре кипения T0; α – термический коэффициент предельной адсорбции, К–1. В соответствии с [24] принято α = 1.52 × 10–3 К–1.В области сверхкритических температур стандартные состояния fs газовой фазы определяли из условия линейного продолжения давления насыщенного пара адсорбтива в эту область:
где M и N – константы, которые могут быть вычислены по критическому давлению для критической температуры и нормальной температуре кипения при ps = 101.3 кПа. Стандартные состояния а0= f(T) в области сверхкритических температур определяли по уравнению (2).Полное удельное объемное количество аккумулированного газа в системе при условиях p и T, приведенное к нормальным температуре и давлению, определяли как сумму адсорбированной и газовой фаз по выражению:
(4)
${{V}_{{acc}}}\left( {p,T} \right) = \frac{{a\left( {p,T} \right)\mu d + \varepsilon {{\rho }_{g}}\left( {p,T} \right)}}{{{{\rho }_{{NTP}}}}},$Активную удельную объемную емкость определяли как разность полной удельной объемной емкости аккумулятора при условиях заправки (p1 и T) и выдачи газа из него (p2 и T):
(6)
$\Delta {{V}_{{acc}}}\left( {p,T} \right) = {{V}_{{acc}}}\left( {{{p}_{1}},T} \right) - {{V}_{{acc}}}\left( {{{p}_{2}},T} \right).$В настоящей работе рассчитывалось интегральное количество газа, которое может выдать адсорбционный аккумулятор потребителю при изотермическом понижении давления до p2 = 1 бар.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 5 представлены зависимости изменения насыпной плотности и удельной площади поверхности формованных образцов Zr-BDC с использованием связующего и без него, от приложенного давления прессования.
Рис. 5.
Зависимость насыпной плотности d (а) и удельной площади поверхности SBET (б) формованных МОКС Zr-BDC от давления прессования: 1 – Zr-BDC без связующего; 2 – Zr-BDC-ПВС.

Из рис. 5а следует, что чем больше давление формования, тем выше итоговая насыпная плотность получаемых уплотненных образцов функциональных адсорбционных материалов. Образцы МОКС Zr-BDC, формованные без использования связующего, показали более высокую насыпную плотность по сравнению с образцами, формованными со связующим. При изменении давления формования от 30 до 240 МПа насыпная плотность формованных образцов Zr-BDC без использования связующего увеличивается от 0.6 до 1.6 г/см3, а образцов Zr-BDC-ПВС от 0.7 до 1.1 г/см3.
Однако, как показано на рис. 5б при использовании связующего пористая структура исходного МОКС подвергается меньшей деградации, что выражается в меньшем падении величины SBET таких образцов. При изменении давления формования от 30 до 240 МПа удельная площадь поверхности формованных образцов Zr-BDC без использования связующего уменьшается от 1160 до 340 м2/г, а образцов Zr-BDC-ПВС от 1030 до 700 м2/г.
Деградация пористой структуры МОКС Zr-BDC при формовании подтверждается и данными рентгенофазового анализа образцов, сформованных при различном давлении. Рентгеновские дифрактограммы образцов МОКС Zr-BDC в исходном и формованном видах представлены на рис. 6.
Рис. 6.
Рентгеновские дифрактограммы синтезированного образца Zr-BDC в исходном виде (1) и образцов Zr-BDC, формованных при давлениях, МПа: 2– 80; 3 – 160; 4 – 240.

Представленные данные указывают на то, что давление формования при 80 МПа не оказывает существенного влияния на кристаллическую структуру Zr-BDC, наблюдаются лишь незначительные отличия в спектрах данного образца (спектр 2) и синтезированного исходного МОКС (спектр 1), уменьшение интенсивности характерных пиков при углах 2θ равных ~7°, 8°, 12° и 25°. Дальнейшее повышение давления приводит к значительному увеличению аморфной фазы в образцах, что подтверждается уменьшением интенсивности всех характерных полос спектра, а в некоторых случаях и их полному исчезновению (спектры 3 и 4).
Для измерения активной удельной объемной емкости адсорбционной системы по метану отдельно был изготовлен уплотненный образец адсорбента Zr-BDC-ПВС диаметром 37.8 мм и высотой 15.4 мм, фотография которого представлена на рис. 7.
Рис. 7.
Внешний вид функционального нанопористого материала Zr-BDC-ПВС. Давление формования 30 МПа; температура 298 К.

Давление формования 30 МПа выбрали таким образом, чтобы получить механически прочные таблетки. Так в [26] было показано, что при формовании без связующего давление прессования ниже 30 МПа не приводит к получению механически стабильных таблеток. Способ формования без использования связующего на первый взгляд кажется более предпочтительным, так как связующее частично забивает поры материала, что приводит к снижению удельной площади поверхности по БЭТ и объема микропор, а это в свою очередь ведет к снижению объемной емкости по метану. Однако, наши исследования показали, что формованные образцы, изготовленные с использованием ПВС менее подвержены разрушению пористой структуры, что наглядно иллюстрирует рис. 5б.
Структурно энергетические характеристики формованного образца МОКС Zr-BDC-ПВС, изготовленного для измерения активной удельной объемной емкости адсорбционной системы на его основе, представлены в табл. 2.
Таблица 2.
Структурно-энергетические характеристики формованного образца Zr-BDC-ПВС
| Адсорбент | W0, см3/г | E, кДж/моль | E0, кДж/моль | x0, нм | d0, г/см3 | SBET, м2/г |
|---|---|---|---|---|---|---|
| Zr-BDC-ПВС | 0.38 | 7.80 | 23.6 | 0.51 | 0.664 | 930 |
Как следует из табл. 1 и 2, уплотненный образец адсорбента Zr-BDC-ПВС характеризуется частичной деградацией пористой структуры по сравнению с исходной синтезированной МОКС.
На рис. 8 представлены расчетные зависимости активной удельной объемной емкости по метану на адсорбенте Zr-BDC от давления при температурах 243 К (а), 273 К (б) и 303 К (в): для уплотненного образца Zr-BDC-ПВС (кривая 1) и адсорбента в исходном рассыпном виде (кривая 2). Для сравнения приведены зависимости активной емкости для системы сжатого газа без адсорбента (кривая 3). Также на рисунке представлены экспериментальные данные по активной удельной объемной емкости на уплотненном адсорбенте Zr-BDC-ПВС при 35 бар (символ 4) и 100 бар (символ 5).
Рис. 8.
Зависимости активной удельной объемной емкости по метану на адсорбенте Zr-BDC от давления при температурах 243 (а), 273 (б) и 303 К (в): 1 – уплотненный адсорбент с ПВС в качестве связующего, 2 – исходный рассыпной адсорбент, 3 – система сжатого газа без адсорбента, 4 – эксперимент на уплотненном адсорбенте с ПВС в качестве связующего при 35 бар, 5 – эксперимент на уплотненном адсорбенте с ПВС в качестве связующего при 100 бар. Примечание: планки относительной погрешности расчета по ТОЗМ для системы “Zr-BDC-CH4” – 15%.

Из рисунка следует, что наибольшие значения расчетной активной удельной объемной емкости показывает формованный образец Zr-BDC-ПВС, однако при температуре 243 К и давлениях свыше 73 бар расчетные значения активной емкости для исходного рассыпного адсорбента становятся выше. Так, при давлении 100 бар значение емкости для исходного Zr-BDC составляет 175 м3(НТД)/м3 против 154 м3(НТД)/м3 для формованного образца. Этот эффект, помимо снижения активности из-за частичной деградации пористой структуры уплотненного образца адсорбента, объясняется еще и тем, что при определенных давлениях и пониженных температурах начинает значительный вклад в удельную емкость вносит свободная газовая фаза в межгранульном пространстве. Также стоит отметить, что при температуре 243 К и давлениях выше 82 бар система с адсорбентом начинает проигрывать по емкости системе сжатого газа (без адсорбента), что также связано с нарастающим влиянием плотности свободной газовой фазы метана. Так при давлении 100 бар значение активной емкости для системы сжатого газа без адсорбента составляет 182 м3(НТД)/м3.
Расчетные и экспериментальные значения активной удельной объемной емкости по метану на уплотненном образце адсорбента Zr-BDC-ПВС при температурах 243, 273 и 303 К и давлениях 35 и 100 бар представлены в табл. 3.
Таблица 3.
Расчетные и экспериментальные значения активной удельной объемной емкости по метану на уплотненном образце адсорбента Zr-BDC-ПВС
| Температура, К | Расчет | Эксперимент | ||
|---|---|---|---|---|
| давление, бар | ||||
| 35 | 100 | 35 | 100 | |
| 243 | 99 | 154 | 80 | 174 |
| 273 | 99 | 148 | 65 | 140 |
| 303 | 86 | 138 | 58 | 128 |
Из таблицы следует, что значения, полученные в результате расчета по ТОЗМ и значения, измеренные непосредственно в результате эксперимента, достаточно хорошо согласуются друг с другом при давлении 100 бар. Однако при давлении 35 бар расхождения между теоретическими и экспериментальными данными заметно увеличиваются. Этот результат может быть следствием отсутствия учета температурной зависимости характеристической энергии адсорбции, при температурах выше критической [19] в уравнении (1).
ЗАКЛЮЧЕНИЕ
Синтезированы образцы металл-органической каркасной структуры Zr-BDC сольвотермальным методом в органическом растворителе N,N-диметилформамиде при температуре 110°С. Полученный адсорбент характеризуется площадью поверхности по БЭТ равной 1060 м2/г и объемом микропор, составляющим 0.44 см3/г, что позволяет рассматривать его в качестве эффективного адсорбента для хранения метана в системах АПГ. Проведено формование образцов на основе МОКС Zr-BDC с ПВС в качестве связующего и без связующего при давлениях прессования от 30 до 240 МПа. Показано, что чем выше давление прессования, тем выше итоговая насыпная плотность получаемых уплотненных образцов адсорбционных материалов. При этом формование без использования связующего позволяет достичь более высоких насыпных плотностей. Однако при использовании связующего пористая структура исходного МОКС подвергается меньшей деградации. Рассчитаны и построены зависимости активной удельной объемной емкости по метану от давления на исходном рассыпном и формованном с ПВС в качестве связующего адсорбенте Zr-BDC при температурах 243, 273 и 303 К и давлениях до 100 бар. Наибольшие значения расчетной активной емкости показали уплотненные образцы Zr-BDC-ПВС. Однако при температуре 243 К при давлениях свыше примерно 73 бар расчетные значения активной емкости для исходного рассыпного адсорбента оказались выше, что помимо частичной деградации пористой структуры при формовании, можно объяснить еще и более существенным влиянием газовой фазы. Экспериментально измерена активная удельная объемная емкость по метану адсорбционной системы на основе уплотненного адсорбента Zr-BDC-ПВС при давлениях 35 и 100 бар и температурах 243, 273 и 303 К. Получена хорошая сходимость значений экспериментальных и теоретических значений активной удельной объемной емкости по метану.
Работа выполнена в рамках темы государственного задания № 01201353185.
Список литературы
Schroder M. Functional Metal-Organic Frameworks: Gas Storage, Separation and Catalysis. Topics in Current Chemistry. UK, London. Springer. 2010. V. 293. 269 p.
Исаева В.И., Кустов Л.М. // Рос. хим. журн. 2006. Т. 50. С. 56–72.
Tsivadze A.Yu., Aksyutin O.E., Ishkov A.G. et al. // Russian Chemical Reviews. 2019. V. 88. P. 925–978.
Solovtsova O.V., Shkolin A.V., Men’shchikov I.E. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2019. V. 55. P. 826–832.
Meili Ding, Xuechao Cai, Hai-Long Jiang // Chemical Science. 2019. V. 10. P. 10209–10230.
Cavka J.H., Jakobsen S., Olsbye U. et al. // J. Am. Chem. Soc. 2008. V. 130. P. 13850–13851.
Yang Q., Wiersum A.D., Llewellyn P.L. et al. // Chemical Communications. 2011. V. 47. P. 9603–9605.
Yang Q., Zhao Q., Ren S.S. et al. // Chemical Engineering Journal. 2017. V. 323. P. 74–83.
Yuan S., Feng L., Wang Dr.K. et al. // Zhou Adv. Mater. 2018. V. 30. P. 1704303–1704338.
Solis K.L.B., Kwon Y.-H., Kim M.-H. et al. // Chemosphere. 2020. V. 238. P. 124656–124666.
Butova V.V., Budnyk A.P., Charykov K.M. et al. // Inorg. Chem. 2019. V. 58. P. 1607–1620.
Peterson G.W., DeCoste J.B., Glover T.G. et al. // Microporous and Mesoporous Materials. 2013. V. 179. P. 48–53.
Abid H.R., Pham G.H., Ang H.-M. et al. // J. Colloid and Interface Science. 2012. V. 366. P. 120–124.
Wiersum A.D., Chang J.-S., Serre C. et al. // Langmuir. 2013. V. 29. P. 3301–3309.
Дубинин М.М. Адсорбция и пористость. М.: Изд-во ВАХЗ, 1972. 127 с.
ISO 697:1981. Surface active agents. Washing powders. Determination of apparent density. Method by measuring the mass of a given volume.
Brunauer S., Emmett P.H., Teller E. // J. Am. Chem. Soc. 1938. V. 60. P. 309–319.
Lemmon E.W., Huber M.L., McLinden M.O. NIST Standard Reference Database 23: Reference Fluid Thermodynamic and Transport Properties-REFPROP. Version 9.1. 2013.
Men’shchikov I.E., Fomkin A.A., Tsivadze A.Yu. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2015. V. 51. P. 493–498.
Men’shchikov I.E., Fomkin A.A., Arabei A.B. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2016. V. 52. P. 575–580.
Tsivadze A.Yu., Aksyutin O.E., Ishkov A.G. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2016. V. 52. P. 24–29.
Fomkin A.A., Tsivadze A.Y., Aksyutin O.E. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2018. V. 54. P. 347–353.
Solovtsova O.V., Shkolin A.V., Men’shchikov I.E. et al. // Protection of Metals and Physical Chemistry of Surfaces. 2019. V. 55. P. 1080–1084.
Shkolin A.V., Fomkin A.A. // Russian Chemical Bulletin. 2009. V. 58. P. 717–721.
Bambalaza S.E., Langmi H.W., Mokaya R. et al. // J. Materials Chemistry A. 2018. V. 6. P. 23569–23577.
Terracina A., Todaro M., Mazaj M. et al. // The J. Physical Chemistry C. 2019. V. 123. P. 1730−1741.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



