Физикохимия поверхности и защита материалов, 2021, T. 57, № 1, стр. 94-98
Радиационно-химическое восстановление ионов Cu2+ в водном растворе
Г. Л. Быков 1, *, Б. Г. Ершов 1
1 Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук (ИФХЭ РАН)
119071 Москва, Ленинский пр., 31, корп. 4, Россия
* E-mail: bykov@ipc.rssi.ru
Поступила в редакцию 20.02.2020
После доработки 02.03.2020
Принята к публикации 02.03.2020
Аннотация
При облучении ускоренными электронами водных растворов солей меди, содержащих метиловый спирт, наблюдается образование осадка, содержащего металлическую медь и оксид одновалентной меди Cu2O в соотношении масс 75.2 и 24.8% соответственно. Изучен процесс выделения металла и его свойства. Радиационно-химический выход массы выделившегося осадка составляет (7.2 ± 0.2) × 10–3 г/кГр. Обоснована эффективность радиационного способа восстановления меди из водных растворов ее солей. Метод может быть перспективным для получения осадков чистых и аморфных металлов, а также для очистки водных стоков, содержащих токсичные переходные металлы.
ВВЕДЕНИЕ
Восстановление ионов переходных металлов в водных растворах их солей представляет значительный интерес по нескольким причинам. Во-первых, таким способом можно получать высокодисперсные и чистые осадки с большой поверхностью и высокой реакционной способностью для последующего применения в катализе, электронике и синтезе новых материалов. Во-вторых, использовать его как метод очистки водных стоков от токсичных металлов и органических примесей.
Ранее нами был разработан метод выделения чистых осадков кадмия и свинца [1–4] при облучении ускоренными электронами водных растворов их солей, содержащих органические соединения. В присутствии метилового спирта, в частности, были получены осадки металлов с плотностями 1.17 и 1.1 г/см3 и пористостью 86.5 и 90.3%, соответственно. Они имели большие площади поверхности [4]. Был изучен процесс осаждения металлов и рассчитаны радиационно-химические выходы, которые составили (1.7 ± 0.2) × 10–2 и (3.4 ± 0.3) × 10–2 г на 1 кГр для кадмия и свинца, соответственно. Разработанный подход можно рассматривать как практический способ выделения осадков чистых и аморфных металлов из водных растворов их солей.
В отличие от кадмия и свинца медь характеризуется переменной степенью окисления +1 и +2. Это должно было, по-видимому, оказать влияние на особенности ее радиационно-химического восстановления из водных растворов ее солей и состав образующихся продуктов. Настоящая работа ставит своей задачей изучить влияние этого фактора на состав и свойства осадков меди, получаемых при облучении ускоренными электронами водных растворов ее солей, содержащих метиловый спирт.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались реактивы: сернокислая медь CuSO4 ⋅ 5H2O марки “ос. ч.”, метиловый спирт (HPLC grade, “Fisher Chemical”) и трижды дистиллированная вода.
Растворы облучались на линейном ускорителе УЭЛВ-10-10-С-70 с энергией электронов 5 МэВ. Объем раствора для облучения составлял 30 мл. Результаты экспериментов пересчитывались на 1 л раствора.
Доза облучения составляла от 10 до 80 кГр. Облучение производилось в стеклянных ампулах размером 3 × 9.5 см и объемом 100 мл с возможностью отбора проб газовой фазы. Ампулы вакуумировались.
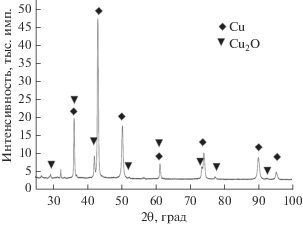
Рентгенофазовый анализ проводился на рентгеновском дифрактометре ДРОН-3 с использованием медного излучения. Фотографии поверхности частиц получены на бинокулярном микроскопе Revelation III (LW Scientific, US).
Количество водорода определялось по градуировочному графику на хроматографе Chrom 5 (Laboratorni pristroje, Praha) с катарометром в качестве детектора на колонке с цеолитом Са 5 Å, длиной 2 м.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После облучения ускоренными электронами водный раствор 0.1 M CuSO4, содержащий 1 M CH3OH, изменял исходную синюю окраску на желто-зеленую. В стеклянной ампуле выделялся осадок красного цвета, который постепенно оседал на дно в течение примерно двух часов. Рентгенофазовый анализ показал, что осадок после высушивания в вакууме состоит на 75.2% из металлической меди и на 24.8% из закиси меди Cu2O (рис. 1).
Желто-зеленый цвет раствора постепенно изменяется и спустя 2 ч практически он становился голубым по завершению процесса образования осадка. Изменение окраски раствора вызвано тем, что процесс восстановления ионов меди и выделение осадка является стадийным. При восстановлении иона Cu2+ образуется ион Cu+, который гидролизуется далее с образованием неустойчивого гидроксида одновалентной меди желтого цвета – CuOH [5]. На следующем этапе возникает металлическая медь. Восстановление ионов Cu2+ можно описать следующей совокупностью реакций. При радиолизе водного раствора в нем генерируются активные частицы радикальной природы – продукты распада воды [6, 7]: ‒ гидратированный электрон (${\text{e}}_{{aq}}^{--}$) и атом водорода (H), обладающие высоким восстановительным потенциалом (–2.7 и –2.3 В [8]), а также гидроксильный радикал (ОН), имеющий, напротив, высокий окислительный потенциал (2.9 В [8]) и молекулярные продукты – водород и пероксид водорода.
(1)
${{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} /{\kern 1pt} \backslash {\kern 1pt} /{\kern 1pt} \backslash \to {\text{e}}_{{aq}}^{ - },\,\,{\text{H}},{{\,}^{ \bullet }}{\text{OH}},{{{\text{H}}}_{2}},{{{\text{H}}}_{2}}{{{\text{O}}}_{2}}.$Присутствие метилового спирта благоприятствует трансформации сильного окислителя – радикала •ОН в органический радикал •CH2OH, который уже обладает свойствами сильного восстановителя (–1.0 В [8]).
(2)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH }} + {{\,}^{ \bullet }}{\text{OH }} \to \,{{~}^{ \bullet }}{\text{C}}{{{\text{H}}}_{2}}{\text{OH}} + {{{\text{H}}}_{2}}{\text{O}}~ \\ (k{\text{ }} = 8.3 \times {{10}^{8}}\,\,{{{\text{M}}}^{{--1}}}{{{\text{c}}}^{{--1}}}\left[ 7 \right]). \\ \end{gathered} $Таким образом, в результате действия радиации на водный раствор, содержащий метиловый спирт, в нем образуются радикалы (${\text{e}}_{{aq}}^{--}$, H и •CH2OH), способные восстанавливать ионы меди Cu2+ (E0[Cu2+/Cu+] = 0.153 В [9]) в реакциях одноэлектронного переноса:
(3)
$\begin{gathered} {\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{e}}_{{aq}}^{--}\left( {{\text{H}},{}^{ \bullet }{\text{C}}{{{\text{H}}}_{2}}{\text{OH}}} \right)~\,\, = > \\ = > {\text{C}}{{{\text{u}}}^{ + }} + \left( {{{{\text{H}}}^{ + }},{\text{HCHO}} + {{{\text{H}}}^{ + }}} \right). \\ \end{gathered} $Ионы Cu+ гидролизуются в воде [5]:
(4)
$\begin{gathered} {\text{C}}{{{\text{u}}}^{ + }} + {{{\text{H}}}_{2}}{\text{O\;}} = > {\text{CuOH}}~\,\, + \,~{{{\text{H}}}^{ + }} \\ ({\text{ПР}} = {\text{ }}1{\text{ }} \times {\text{ }}{{10}^{{--14}}}\left[ {10} \right]). \\ \end{gathered} $Соединение CuOH неустойчиво и медленно разлагается с образованием оксида Cu2O [5]:
(5)
$2{\text{CuOH}} \to {\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Металлическая медь возникает преимущественно в результате протекания следующих реакций (E0[Cu+/Cu0] = 0.521 В [9]):
(6)
$\begin{gathered} {\text{C}}{{{\text{u}}}^{ + }} + {\text{e}}_{{aq}}^{--}({\text{H}},{}^{ \bullet }{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}})~\,\, = > \\ = > {\text{C}}{{{\text{u}}}^{0}}{\kern 1pt} \downarrow + {\text{ (}}{{{\text{H}}}^{ + }},{\text{HCHO}} + {{{\text{H}}}^{ + }}{\text{),}} \\ \end{gathered} $(7)
$\begin{gathered} {\text{CuOH}} + {\text{e}}_{{aq}}^{--}({\text{H}},{}^{ \bullet }{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}) = > \\ = > {\text{C}}{{{\text{u}}}^{0}}{\kern 1pt} \downarrow + {\text{ O}}{{{\text{H}}}^{ - }}({{{\text{H}}}^{ + }},{\text{HCHO}} + {{{\text{H}}}^{ + }}). \\ \end{gathered} $Соединения CuOH и Cu2O частично окисляются образующимся при радиолизе воды пероксидом водорода, что обусловливает изменение желтого цвета раствора на голубой, свойственный ионам Cu2+:
(8)
$2{\text{CuOH}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}} = > 2{\text{C}}{{{\text{u}}}^{{2 + }}} + 4{\text{O}}{{{\text{H}}}^{--}},$(9)
${\text{C}}{{{\text{u}}}_{2}}{\text{O}} + {{{\text{H}}}_{2}}{\text{O}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}} = > 2{\text{C}}{{{\text{u}}}^{{2 + }}} + 4{\text{O}}{{{\text{H}}}^{--}}.$На микрофотографии (рис. 2а) при увеличении в 200 раз видно, что на начальной стадии облучения образуются частицы размером до 10 мк. Это частицы меди. Атомы меди слипаются и укрупняются. На рис. 2б – частицы осадка на конечном этапе. Видно, что крупные частицы размером до 0.2 мм обрамлены мелкими частицами размером порядка 1–5 мк. По-видимому, на поверхности крупных частиц металлической меди происходит нуклеация CuOH и образование частиц Cu2O.
Рис. 2.
Микрофотографии осадка: (а) сразу после облучения раствора 0.1 M CuSO4, содержащего 1 M CH3OH, до дозы 42 кГр, (б) по завершении образования осадка. Увеличение 200.

После завершения процесса образования осадка в течение примерно 2–4 ч он представляет собой тонко диспергированный порошок красно-коричневого цвета (рис. 3).
При восстановлении ионов Cu2+ в водных растворах 0.1 M CuSO4, содержащих 1 M CH3OH, масса образующихся соединений Cu и Cu2O увеличивается, а значение рН растворов уменьшается (табл. 1) с увеличением поглощенной дозы.
Таблица 1.
Изменение рН раствора 0.1 M CuSO4, содержащего 1 M CH3OH, массы осадка и радиационно-химического выхода Cu и Cu2O от поглощенной дозы
| Доза | 21 кГр | 42 кГр | 63 кГр | |
|---|---|---|---|---|
| рН0 | 4.14 | 4.14 | 4.14 | |
| рНк | 2.42 | 1.90 | 1.80 | |
| Масса, г/л |
Cu | 0.138 | 0.287 | 0.451 |
| Cu2O | 0.045 | 0.094 | 0.149 | |
| G молек/100 |
Cu | 0.98 | 1.037 | 1.087 |
| Cu2O | 0.145 | 0.150 | 0.159 | |
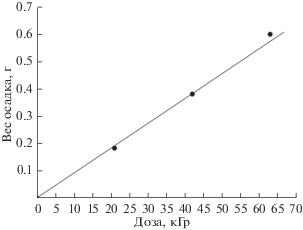
Массы Cu и Cu2O рассчитывались с учетом их соотношения из анализа рентгенограмм. Видно (табл. 1), что масса меди примерно втрое больше массы закиси меди и это соотношение сохраняется в изученном диапазоне поглощенных доз. Согласно данным, представленным на рис. 4, суммарная масса осадка, как и в отдельности массы Cu и Cu2O, пропорционально увеличиваются с увеличением поглощенной дозы.
Рис. 4.
Зависимости массы осадка меди и закиси меди от поглощенной дозы, выделившихся из 1 л раствора 0.1 М CuSO4 и 1 М СН3ОН.
В процессе радиационно-химического восстановления ионов Cu2+ в водном растворе образуются водород и ионы H+. Вследствие короткого импульсного облучения (не более 5 мин) раствор вначале пересыщается образующимся водородом, который далее постепенно выделяется в свободный объем ампулы. Подкисление раствора объясняется аккумулированием электронов ионами Cu2+ (реакции (3), (6) и (7)) при их восстановлении и выделении осадка металла. Чем больше поглощенная доза, тем больше металла образуется и тем сильнее подкисляется раствор (табл. 1). Процесс выделения водорода в результате радиолиза воды (реакция (1)) в свободный объем ампулы растянут во времени (рис. 5). Чем больше поглощенная доза, тем более пересыщается раствор газом и тем быстрее происходит выделение водорода. Завершается процесс газовыделения примерно за 0.5–1 час.
Рис. 5.
Выделение водорода от времени после облучения из 1 л раствора: 1 – 21 кГр, 2 – 42 кГр, 3 – 63 кГр. Раствор: 0.1 М CuSO4 и 1 М CH3OH.

На рис. 5 представлена зависимость объема образовавшегося водорода от дозы облучения, которая носит линейный характер, т.е. с увеличением дозы пропорционально возрастает количество газа.
ЗАКЛЮЧЕНИЕ
Таким образом, облучение ускоренными электронами раствора сернокислой меди в присутствии метилового спирта инициирует восстановление Cu2+ и в осадок выделяются металлическая медь и оксид меди Cu2O в соотношении 75.2 и 24.8% соответственно. Радиационно-химический выход, рассчитанный как число атомов меди, выделившихся в осадок при поглощении 100 эВ энергии ионизирующего излучения, не зависит от дозы облучения в изученном интервале вплоть до 80 кГр и составляет 1.0 ± 0.1 и 0.3 ± 0.01 ат/100 эВ, соответственно. В ходе облучения образуется водород с выходом 0.21 ± 0.01 молек/100 эВ. Выделяющийся осадок включает относительно крупные частицы меди размером до 0.2 мм, обрамленные мелкими частицами Cu2O размером 1–5 мк. Необходимо отметить, что были выполнены отдельные опыты с использованием вместо метилового спирта других органических соединений (спирты, органические кислоты и др.). При этом были получены практически те же результаты по осадкообразованию меди и закиси меди. Это объясняется тем, что во всех случаях происходила трансформация окислительных гидроксильных радикалов •ОН в органические радикалы восстановительной природы.
Радиационно-химический метод восстановления ионов токсичных металлов и выделения их в осадок (на примере меди) в водных средах, содержащих ядовитые органические загрязнители (в нашем случае таковым соединением был метиловый спирт) может быть использован для очистки водных стоков. Этот метод может быть также перспективным для получения осадков чистых и аморфных металлов из водных растворов их солей.
Работа выполнена на линейном ускорителе УЭЛВ-10-10-С-70 в ЦКП ФМИ ИФХЭ РАН.
Список литературы
Быков Г.Л., Макаренков В.И., Ершов Б.Г. // Журн. прикладной химии. 2018. Т. 91. Вып. 4. С. 484–489. SDI: 007.001.0044-4618.2018.091.004.4
Bykov G.L., Makarenkov V.I., Ershov B.G. // Russian journal of applied chemistry. 2018. V. 91. C. 555–559. WOS:000436895300004.https://doi.org/10.1134/S1070427218040043
Ershov B.G., Bykov G.L. // Radiation Physics and Chemistry. 2018. V. 153. P. 245–250. https://doi.org/10.1016/j.radphyschem.2018.10.006
Быков Г.Л., Ершов Б.Г. // Физикохимия поверхности и защита материалов. 2020. Т. 56. № 4. С. 422–427.
Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н. Неорганическая химия. Т. 2. Химия, М., 2001. с. 498.
Ershov B.G., Gordeev A.V. // Radiat. Phys. Chem. 2008. V. 77. P. 928–935. https://doi.org/10.1016/j.radphyschem.2007.12.005
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. // J. Phys. Chem. Ref. 1988. V. 17. P. 513–886. https://doi.org/10.1063/1.555805
Wardman P. // J. Phys. Chem. Ref. 1989. V. 18. № 4. P. 1637–1755. https://doi.org/10.1063/1.555843
CRC Handbook of Chemistry and Physics. CRC Press, Boca Raton, FL. Petr Vanysek, Lide, D.R. (ed). 2005. P. 8–20.
Лурье Ю.Ю. Справочник по аналитической химии. Химия, М., 1971. С. 98.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов