Физикохимия поверхности и защита материалов, 2021, T. 57, № 1, стр. 74-85
Емкостная деионизация воды с электродами из нанопористого активированного угля и катионо-анионообменной мембраной мозаичной структуры
Ю. М. Вольфкович 1, *, А. А. Михалин 1, А. Ю. Рычагов 1, М. М. Кардаш 2
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН (ИФХЭ РАН)
119071 Моcква, Ленинский пр., 31, Россия
2 Саратовский государственный технологический институт
Энгельс, Саратовская обл., Россия
* E-mail: yuvolf40@mail.ru
Поступила в редакцию 20.01.2020
После доработки 06.02.2020
Принята к публикации 13.02.2020
Аннотация
Была исследована емкостная деионизация воды (ЕДВ) с целью получения чистой воды. Для этого были применены катионо-анионообменные мембраны мозаичной структуры а также активированные угольные электроды. Мозаичные мембраны содержали катионообменные и анионообменные компоненты в матрицах на основе синтетических волокон. Способ получения прессованных мозаичных мембран включал в себя впрессовывание катионообменной и анионообменной мембран друг в друга. Другим способом было последующее образование полос катионообменника и анионообменника в волокнистой матрице (в полосатой мембране). Активированные угольные электроды и мозаичные мембраны обладали достаточными величинами удельной ионной поверхностной проводимости даже в чистой воде. Удельные энергозатраты составили 31.9 и 111.7 Вт-моль-1 для установок ЕДВ, содержавших полосатые и прессованные мембраны, соответственно. Таким образом, полосатая мембрана была предпочтительна для получения чистой питьевой воды. Было установлено, что максимальная производительность работы установки ЕДВ с полосатой мозаичной мембраной имеет место при напряжении 2 В и потоке раствора 15 см3/мин.
ВВЕДЕНИЕ
Метод емкостной деионизации водных растворов (ЕДВ) – это новый перспективный и наиболее экономичный метод опреснения воды [1–26 ]. Он заключается в прокачке водного раствора через электрохимическую ячейку между двумя пористыми электродами с высокоразвитой поверхностью, между которыми, задается определенная разность потенциалов >1.2 В. Под действием электрического поля, анионы адсорбируются на положительном, а катионы на отрицательном электродах, и таким образом происходит заряжение двойного электрического слоя (ДЭС), как в суперконденсаторах [27–34]. В результате имеет место деионизация (опреснение) водного раствора. В качестве электродов обычно используются углеродные электроды с высокой удельной поверхностью S = 500–3000 м2/г. Чаще всего используются электроды на основе активированных углей (АУ). При замыкании цепи или преполюсовке ионы с межфазной поверхности диффундируют в раствор, что приводит к концентрированию отводимого из установки раствора и регенерации энергии. Таким образом, стадия деионизации соответствует заряжению, а стадия концентрирования (регенерации) разряжению суперконденсатора.
Основным преимуществом ЕДВ является самый низкий расход энергии, составляющий примерно одну треть от главного конкурирующего метода – обратного осмоса, который в настоящее время в основном применяется в промышленности. В [35] установлено, что измеренная для ЕДВ энергия удаления соли приближается к термодинамическому минимуму для опреснения таких концентрированных растворов, как морская вода. У ЕДВ есть следующие существенные преимущества перед другими методами очистки воды: 1) низкие эксплуатационные расходы, которые составляет приблизительно одну треть от соответствующих эксплуатационных расходов для обратного осмоса; 2) длительная циклируемость материалов электродов; 3) химически стабильные компоненты исключают введение инородных материалов в обрабатываемый поток; 4) ЕДВ может работать при разных уровнях удаления ионов и получения чистой воды; 5) минимальная забивка пор осадком; 6) очень высокая потенциальная наукоемкость ЕДВ, на основе которой можно прогнозировать существенный рост эффективности этого метода в ближайшие годы.
Как было отмечено выше, в стадии концентрирования, т.е. регенерации, энергия возвращается в установку для ЕДВ и поэтому происходит частичная компенсация затрат на деионизацию. Поэтому результирующая энергия деионизации WЕДВ равна разности
где Wдеион – энергия, затраченная на стадии деионизации, а Wконц – энергия, высвободившаяся при концентрировании. Именно энергия WЕДВ должна учитываться при работе установки, так как имеет место выигрыш за счет энергии на стадии концентрирования. Этот фактор объясняет минимальные затраты энергии в ЕДВ по сравнению с другими опреснительными методами. В стадии деионизации имеет место заряжение двойнослойного конденсатора (ДСК), являющегося основой метода, а в стадии концентрирования происходит разряжение ДСК.Зарядно-разрядные процессы в электрохимической ячейке для ЕДВ могут осуществляться в одном из двух режимов: в потенциостатическом режиме при постоянном напряжении (U) или в гальваностатическом режиме при постоянном токе (I). Для потенциостатического режима энергия деионизации и концентрирования рассчитывается по формуле:
а для гальваностатического режима энергия рассчитывается по формуле: где t – время.Целью настоящей работы является усовершенствование метода ЕДВ с целью получения чистой питьевой воды. Для этого в первую очередь в качестве основы для электродов было применение активированных углей (АУ).
1. МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДИКИ
1.1. Материалы
В данной работе исследовались следующие материалы на основе АУ: 1) активированная углеродная ткань (АУТ) “ВИСКУМАК”, НПО “Неорганика”, г. Электросталь (РФ); 2) АУТ СН900 компании Kuraray (Япония); 3) Композитные электроды SAIT на основе АУ SAIT + 5% политетрафторэтилен (ПТФЭ) (республика Корея); 4) Композитные электроды СКБ “РИКОН” (г. Воронеж, РФ), изготовленные путем каландрирования смеси АУ Norit со связующим в виде 4% порошка ПТФЭ. 5) АУ АГ-3, НПО “Неорганика”, г. Электросталь (РФ); 6) АУ СКТ-6А, НПО “Неорганика”, г. Электросталь (РФ); 7) KJEC 600, Nouryon Polymer chemistry, США.
Синтез мозаичных мембран (ММ)
Впервые мозаичные мембраны для ЕДВ были использованы в [36]. В настоящей работы были использованы два варианта катионо- анионообменных мембран мозаичной структуры. 1) Волокнистые “Polycon” ММ готовили по методике, предложенной в [37, 38]. Затем мембраны были термостатированы при 120оС и 60 МПа [38, 39]. Затем катионообменная и анионообменная мембраны были методом горячего прессования впрессованы друг в друга. Толщина такой прессованной мембраны мембраны составляла 0.45 мм. 2) Полосатая мембрана получена на основе фенолоформальдегидной волокнистой матрицы “Kynol” (KYNOL EUROPA GmbH, Германия [40]). Те же катионообменные и анионообменные смолы были применены для модификации матрицы. Полосы толщиной 4 мм таких мембран формировались последовательно на поверхности и в объеме волокнистой матрицы. Формирование осуществлялось непосредственно в волокнистых матрицах. Прежде всего были сформированы катионообменные полосы, а затем анионообменные полосы. Толщина полосатой ММ составляла 0.6 мм.
1.2. Исследование пористой структуры
Для исследования пористой структуры и гидрофильно- гидрофобных свойств АУ использовался метод эталонной контактной порометрии (МЭКП) [41–44]. Этот метод позволяет не только исследовать пористую структуру любых материалов в максимально широком диапазоне радиусов пор ~ от 1 до 3 × 105 нм, но и изучать их гидрофильно-гидрофобные свойства. При использовании в качестве измерительной жидкости октана измеряются порометрические кривые для всех пор, а при использовании воды – только гидрофильных пор. Этот метод был признан IUPAC [45].
1.3. Измерение катионообменной и анионообменной емкости
Полную катионообменную и анионообменную ёмкость мозаичных мембран определяли по стандартной методике [46]. Катионообменная емкость (Qc) была определена для образцов H +-формы путем титрования H + -ионов, полученных в ходе нейтрализации основания. Анионообменную емкость (Qa) определяли для образцов OH- формы путем титрования ионов OH-, образующихся в процессе кислотной нейтрализации [47].
1.4. Измерение электропроводности мембран в зависимости от концентрации
Электропроводность мозаичной мембраны определяли из сопротивления мембраны, измеренному как активная часть импеданса мембраны с помощью ртутно-контактного метода [48]. Измерения проводимости мембраны проводились в разбавленных растворах для определения предельного значения (поверхностной проводимости) в воде путем экстраполяции полученных концентрационных зависимостей на нулевую концентрацию [36].
1.5.Электрохимические измерения
Измерение гальваностатических и циклических вольамперных (ЦВА) кривых осуществлялось во фторопластовой ячейке согласно методике, описанной в [49]. Известно, что в активированных углях содержится большое количество поверхностных групп [50, 51]. Ионогенные поверхностные группы (ПГ) придают активированным углям свойство поверхностной проводимости (ПП). В [52] была впервые разработана и детально описана методика измерений ионной поверхностной проводимости пористых электродов вообще и угольных электродов в частности. Для измерений ПП использовалась 6-камерная 5-электродная стеклянная ячейка. Один из этих электродов – исследуемый угольный электрод; кроме того в состав ячейки входят два противоэлектрода из платинированной платины и два электрода сравнения. Данный метод измерения ПП является еще одним методом исследования ДЭС.
1.6. Исследования в динамической ячейке ЕДВ
На рис. 1 приведена схема динамической установки Samsung Electronics Co., для ЕДВ. Перестальтиковый насос подает раствор для закачивания. Далее он поступает во входной клапан и проходит через датчики давления, затем он протекает через саму ячейку где при рабочих режимах и происходят либо стадия деионизации, либо стадия концентрирования. Для этого от корпуса установки к токоотводам ячейки подведены контакты, с помощью которых задаются и измеряются ток и напряжение, Далее раствор протекает по очереди через кондуктометр и PH-метр; и на завершающей стадии он проходит через последний клапан и в слив.
Поскольку на стадии концентрирования происходит замыкание контактов ячейки, важной информацией являлось количество электричества, прошедшего при этом через ячейку. Однако в схеме ячейки Samsung Electronics Co. не было не предусмотрено измерения тока при коротком замыкании, поэтому мы присоединили свой амперметр к схеме последовательно с ячейкой. Амперметр был связан с ПК и в дальнейшем после интегрирования кривой для зависимости тока от времени для стадии концентрирования предоставлял информацию о количестве электричества.
2. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
2.1 Исследование пористой структуры активированных угольных электродов
Основные результаты измерений МЭКП приведены в табл. 1 [53]. Как видно, пористая структура всех АУ электродов включает как гидрофильную, так и гидрофобную пористость. Величины гидрофобной пористости у композитных АУ электродов SAIT и РИКОН больше, чем у АУТ электродов СН900 и ВИСКУМАК, потому что в состав композитных электродов входят частицы гидрофобного фторопластового связующего.
Даже для АУТ CH900 и ВИСКУМАК, не содержащих гидрофобного связующего, имеются как гидрофильные, так и гидрофобные поры. Это является существенным свойством активированных углей, отличающих их от практически всех других материалов, являющихся или полностью гидрофильными (например, металлы, их оксиды, иониты), или полностью гидрофобными (например, политетрафторэтилен и полиэтилен). Это можно объяснить тем, что гидрофильные свойства обусловлены кислородосодержащими ПГ, имеющимися в большом количестве в АУ [52, 53], тогда как графит, не содержащий ПГ, является гидрофобным материалом. Эти гидрофильно- гидрофобные свойства АУ нужно учитывать при их применении в водных растворах, в которых электрохимические процессы протекают только в гидрофильных порах. Как видно из табл. 1 , значения в октане полной площади удельной поверхности довольно высоки (600–2500 м2/г ) и они достаточно сильно отличаются друг от друга. Сравнение данных, полученных в водной и октановой средах, показывает более высокую гидрофильную пористость по сравнению с гидрофобной. Согласно [53] все АУ имеют максимально широкий диапазон радиусов пор от долей нанометра до 100 микрон, т.е. более 5 порядков. Следовательно, АУ по широте диапазона размеров пор являются уникальными материалами.
Таблица 1.
Характеристики пористой структуры и гидрофильно-гидрофобных свойств АУ электродов [53]
| Электрод | Площадь удельной поверхности, м2/ г | Отношение гидрофильной к полной удельной поверхности | Пористость полная (по октану) | Пористость гидрофильная (по воде) | Пористость гидро фобная | |
|---|---|---|---|---|---|---|
| полная (по октану) | гидрофильная (по воде) | |||||
| СН900 | 1520 | 850 | 0.56 | 0.85 | 0.786 | 0.064 |
| “ВИСКУ-МАК” | 600 | 416 | 0.70 | 0.729 | 0.623 | 0.106 |
| SAIT | 940 | 520 | 0.55 | 0.715 | 0.490 | 0.225 |
| “РИКОН” | 1705 | 825 | 0.48 | 0.762 | 0.673 | 0.089 |
| KJEC 600 | 2500 | 2600 | – | 0.89 | 0.84 | 0.05 |
2.2. Поверхностная проводимость
Удельная электропроводность раствора в порах (κ) представляет собой сумму удельной электропроводности свободного равновесного раствора (κv) и ПП. Поверхностная проводимость является, таким образом, продольной (тангенциальной) проводимостью двойного электрического слоя (ДЭС). В свою очередь, ПП, согласно нашим представлениям, равна сумме проводимости, обусловленной проводимостью противоионов ПГ в высокодисперсном углеродном электроде (κsg) и поверхностной проводимости (κsch), обусловленной электростатическим зарядом, т.е. классическим ДЭС [42]. Величина κsg зависит от концентрации поверхностных групп Сsgна угле, т.е. их обменной емкости Q, а κsch зависит от потенциала E и концентрации раствора (с). Таким образом, можно написать:
(4)
$\begin{gathered} \kappa \left( {с,Е} \right) = {{\kappa }_{v}}\left( с \right) + {{\kappa }_{s}}\left( {с,Е} \right) = \\ = {{\kappa }_{v}}\left( с \right) + {{\kappa }_{{sch}}}\left( {Е,с} \right) + {{\kappa }_{{sg}}}(Q).~ \\ \end{gathered} $На рис. 2а, 2б приведены зависимости измеренных величин электропроводности κ от концентраций KCl для электродов CH900 и SAIT при их стационарных потенциалах. Как видим, в области c = 0.0001–0.0004 М эти зависимости практически линейны. Величины κsg были получены путем экстраполяции этих зависимостей на величину с = 0.
Рис. 2.
Зависимости электропроводности κ от концентраций KCl для электродов CH900 (а) и SAIT (б) при их стационарных потенциалах. Иллюстрация экстраполяционного получения величины κsg.

Таким образом, даже в чистой воде АУ обладают ионной электропроводностью, обусловленной наличием большого количества ПГ. Этой электропроводности достаточно для получения чистой воды методом ЕДВ [37].
Из рис. 2 видно, что величины κsgравны 1.25 × × 10–4 и 0.4 × 10–4 См/см2 соответственно для СН900 и SAIT. Поскольку величины κsg зависят от концентрации ПГ, то были измерены величины их обменной емкости Q в разбавленных растворах KCl.
В табл. 2 приведены величины стационарных потенциалов (Eстац) для поверхностной проводимости (κsg), и величины обменной емкость по иону калия (Q).11
Таблица 2.
Стационарные потенциалы (Eстац) для поверхностной проводимости (κsg), и обменная емкость по иону калия (Q) [53]
| CH900 | SAIT |
|---|---|
| Eстац = 0.497 В | Eстац = 0.482 В |
| κsg = 0.000123 См/см | κsg= 0.00004 См/см |
| Q (по иону Ka+) = 1.14 мг-экв/г | Q (по иону Ka+) = 0.37 мг-экв/г |
Из таблицы видно, что соотношение величин Q для электродов CH900 и SAIT равно 3.08, а соответствующее соотношение величин κsg равно 3.12. Из практического равенства между собой этих величин можно сделать важный вывод, что при с = 0 величина κsg практически пропорциональна обменной емкости поверхностных групп:
где κsgi– ПП приходящаяся на единичную обменную емкость Q = 1 мгэкв/г.В отличие от ПП, исследовавшейся в работах по коллоидной химии для пористых мембран и капилляров, принципиальным отличием ПП для АУ электродов является то, что АУ обладают не только ионной проводимостью, но также и электронной проводимостью. Таким образом, активированные угли являются электроно-ионообменниками, что является их уникальной особенностью.
При применении АУ электродов для емкостной деионизации воды важно было измерить их величины катионообменной и анионообменной емкости. В табл. 3 приведены эти величины, измеренные для АУ Norit и CH900 [36].
Таблица 3.
Катионообменная и анионообменная емкость АУ
| Активированные угли | Статическая катионообменная емкость, ммоль/г | Статическая анионообменная емкость, ммоль/г |
|---|---|---|
| Norit | 0.56 | 0.20 |
| CH900 | 0.06 | 0.70 |
Таким образом, активированные угли обладают как катионообменными, так и анионообменными свойствами. Благодаря этому свойству АУ являются наиболее предпочтительными электродными материалами для получения чистой воды методом ЕДВ. Однако при этом лимитирующим элементом становится пористый сепаратор, поскольку вода в его порах обладает огромным сопротивлением, что приводит к очень большим энергозатратам. Поэтому в [36] была разработана ионообменная мембрана мозаичной структуры, обладающая катионообменными и анионообменными свойствами.
2.3. Мозаичные мембраны
Такая мозаичная мембрана (ММ) была использована вместо обычного пористого сепаратора для получения чистой воды, поскольку она обладает достаточной ионной проводимостью даже в чистой воде. На рис. 3 приведено схематическое изображение структуры мозаичной мембраны.
Рис. 3.
Схематическое изображение структуры мозаичной мембраны. 1 – полимерная матрица; 2 – микропоры, 3 – положительно заряженные фиксированные ионогенные группы, входящие в состав частиц анионита; 4 – анионы; 5 – отрицательно заряженные фиксированные ионогенные группы, входящие в состав частиц катионита; 6 – катионы.

2.3.1. Проблема неоднородности структуры мозаичных мембран. На рис. 4 приведены СЭМ фотографии, сделанные в разных местах торца спрессованной мозаичной мембраны. Из рис. 4 видно, что прессование не привело к достаточно однородной по толщине и по поверхности структуре мембраны.
Полосатая мозаичная мембрана имела коричневую окраску (см. рис. 5). Исходная суммарная масса катионитовых и анионитовых полосок бралась одинаковой – по 4 мм. Однако, при пропитке в мономере волокна стали занимать больший объем и в результате ширина полосок увеличивалась, причем в разной степени. В результате светлые (анионитовые) полоски становились более широкими, чем темные (катионитовые) полоски. В отличие от спрессованной мембраны, полосатая мембрана имела однородную структуру по толщине.
Рис. 6.
Зависимость удельной электропроводности прессованных и полосатых ММ от концентрации равновесного раствора. 1 – прессованная мембрана, 2 – полосатая мембрана.

2.3.2. Ионообменная емкость мозаичных мембран. Величины катионообменной (Qc) и анионообменной (Qa) емкости были измерены для мозаичных мембран (табл. 4). Из табл. 3 и 4 видно, что как АУ электроды, так и мозаичные мембраны обладают как катионообменной, так и анионообменной емкостью. Это принципиально важно для метода ЕДВ для получения чистой воды.
Таблица 4.
Катионообменнaя и анионообменная емкость мозаичных мембран
| Мозаичная мембрана | Qc, ммоль г–1 | Qa, ммоль г–1 |
|---|---|---|
| Полосатая | 1.00 ± 0.01 | 0.50 ± 0.02 |
| Прессованная | 1.50 ± 0.02 | 1.03 ± 0.01 |
2.3.3. Проводимость мозаичных мембран. Рисунок 6 показывает зависимости удельной электропроводности прессованных и полосатых ММ от концентрации равновесного раствора. Экстраполяция кривых до нулевой концентрации дает значение проводимости мембран в деионизированной воде (поверхностная проводимость), которая зависит от наличия функциональных групп, аналогичных обычным ионообменным мембранам.
Как видно из рис. 6, обе исследованные ММ обладают существенной поверхностной проводимостью, что обуславливает их возможное применение для ЕДВ при получении чистой воды. Из этого рисунка также видно, что величина поверхностной проводимости у прессованной мембраны больше, чем у полосатой мембраны. Это объясняется тем, что согласно табл. 4 суммарная величина катионобменной и анионообменной емкости у спрессованной ММ больше, чем у полосатой ММ (см. табл. 4).
2.3.4. Измерения в статических ячейках в чистой воде. В статической электрохимической ячейке для ЕДВ (без потока жидкости) были проведены измерения ЦВА кривых. Ячейка состояла из двух АУ электродов Norit, между которыми находилась ММ. Поры электродов и ММ были пропитаны дважды перегнанной водой.
На рис. 7 приведены измеренные таким образом циклические вольтфарадные (ЦВФ) кривые при разных скоростях развертки напряжения (w), где С = I/w – емкость, I – удельный ток, деленный на массу.
Рис. 7.
Вольтфарадные кривые, для концентраций KCl (а) с = 0, (б) с = 0; 0.01; 0.05 М при скоростях развертки напряжения 0.1 мВ/с (а и б), 0.5 мВ/с (а), 2 мВ/с (а), 5 мВ/с (а). Электроды Norit и мозаичная мембрана.

Был установлен следующий механизм работы электрохимической ячейки с чистой водой. При включении электрического поля противокатионы одного АУ электрода вследствие наличия поверхностных групп и поверхностной проводимости мигрируют по эстафетному механизму от одного противокатиона к другому, и далее они мигрируют к ММ, где они по аналогичному механизму мигрируют к противоэлектроду. В это же время противоанионы первого АУ электрода мигрируют по эстафетному механизму от одного противоаниона к другому, и далее к ММ, где они также переносятся по эстафетному механизму от одного противоаниона к другому, и далее мигрируют к противоэлектроду, в котором они мигрируют от одного противоаниона к другому. Таким образом происходит заряжение двойного электрического слоя (ДЭС) обоих электродов.
Как видим, форма ЦВФ кривых на рис. 7а соответствует форме соответствующих кривых для двойнослойного конденсатора, и при минимальной скорости развертки напряжения 0.1 мВ/с она имеет вид близкий к прямоугольнику, т.е. характеризует заряжение ДЭС [27, 29, 30]. При этом величина удельной емкости АУ электродов равна 66 Ф/г. Учитывая, что согласно данным МЭКП величина гидрофильной удельной поверхности АУ Норит (электроды “РИКОН”) равна 825 м2/г (см. табл. 1 ), то удельная емкость этих электродов на единицу гидрофильной удельной поверхности рана 8 мкФ/см2. Поскольку измерения проводились в чистой воде, то, учитывая также микропористый характер структуры АУ, влияние диффузного ДЭС здесь практически исключено, и вероятно, можно говорить только о плотном двойном электрическом слое Гельмгольца.
На рис. 7б приведены ЦВФ кривые для ячейки с АУ электродами Норит и ММ для концентраций KCl с = 0; 0.01 и 0.05 М при скорости развертки напряжения 0.1 мВ/с.
Рис. 8.
(а) Зависимости концентрации KCl от времени деионизации и концентрирования для потока 2.5 см3/мин для ЕДВ с спрессованной (1) и с полосатой (2) мембраной; (б) зависимости концентрации KCl от времени деионизации и концентрирования для потока 10 см3/мин; (в) зависимости концентрации KCl от времени деионизации и концентрирования для потока 15 см3/мин для ЕДВ с спрессованной (1) и с полосатой (2) мембраной.

Как видим, эти кривые имеют типичный двойнослойный вид и они практически совпадают друг с другом. Следовательно, концентрация соли практически не влияет на емкость ДЭС АУ электродов, в отличие от емкости ДЭС для металлических электродов, например, для Pt и Hg, для которых, как известно, диффузная часть емкости возрастает (как корень квадратный) с увеличением концентрации электролита [54]. Отсюда можно сделать вывод, что емкость ДЭС АУ электродов определяется практически только концентрацией ПГ.
3. ИЗМЕРЕНИЯ В ДИНАМИЧЕСКОЙ ЯЧЕЙКЕ ЕДВ
3.1. Степень деионизации и удельный расход энергии на деионизацию
В динамической ячейке (см. рис. 1) были проведены сравнительные исследования работы ЕДВ для электрохимической ячейки с двумя мозаичными мембранами. Целью работы было получение чистой питьевой воды. В качестве исходной соли была взята соль KCl с концентрацией 0.004 М. Задавались следующие постоянные величины напряжения на ячейке: 1.2, 1.4, 1.6, 1.8 и 2.0 В при скоростях потока 2.5, 5, 10 и 15 мл/мин. Измерялись зависимости электропроводности водного раствора от времени в процессе стадий деионизации (заряжения) и концентрирования (разряжения) а также зависимости тока от времени. Из этих данных рассчитывались зависимости концентрации от времени (рис. 8а–8в), а также степени деионизации γ = [(Cисход – Cконеч)/Cисход] × 100% и удельных затрат энергии на единицу изменения концентрации соли (ΔС = Cисход – Cконеч) в деионизованном водном растворе $W_{{{\text{ЕДВ}}}}^{*}$ (табл. 5–12).
Таблица 5.
Величины степени деионизации для скорости потока w =2.5 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 0.626 | 0.774 | 0.810 | 0.856 | 0.866 |
| Полосатая мембрана | 0.544 | 0.597 | 0.620 | 0.658 | 0.679 |
Таблица 6.
Величины степени деионизации для w = 5 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 0.365 | 0.467 | 0.531 | 0.627 | 0.688 |
| Полосатая мембрана | 0.366 | 0.471 | 0.515 | 0.638 | 0.673 |
Таблица 7.
Величины степени деионизации для w = 10 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 0.248 | 0.282 | 0.280 | 0.409 | 0.547 |
| Полосатая мембрана | 0.496 | 0.531 | 0.558 | 0.579 | 0.676 |
Таблица 8.
Величины степени деионизации для скорости потока 15 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 0.152 | 0.153 | 0.165 | 0.254 | 0.323 |
| Полосатая мембрана | 0.164 | 0.222 | 0.320 | 0.409 | 0.470 |
Таблица 9.
Величины удельного расхода энергии на деионизацию в Втч/моль для w = 2.5 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 31.8 | 31.0 | 35.1 | 45.8 | 67.0 |
| Полосатая мембрана | 39.5 | 49.9 | 55.6 | 64.5 | 90.0 |
Таблица 10.
Величины удельного расхода энергии на деионизацию в Втч/моль для w = 5 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 35.6 | 38.8 | 40.5 | 48.7 | 61.9 |
| Полосатая мембрана | 34.3 | 46.7 | 44.3 | 33.5 | 39.5 |
Таблица 11.
Величины удельного расхода энергии на деионизацию в Втч/моль для w = 10 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 57.2 | 37.5 | 53.5 | 56.6 | 57.1 |
| Полосатая мембрана | 12.7 | 15.4 | 19.1 | 17.9 | 18.2 |
Таблица 12.
Величины удельного расхода энергии на деионизацию в Втч/моль для w = 15 см3/мин
| U, В | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
|---|---|---|---|---|---|
| Спрессованная мембрана | 69.5 | 101.4 | 114.3 | 107.6 | 111.7 |
| Полосатая мембрана | 41.7 | 42.7 | 25.6 | 33.3 | 31.9 |
При увеличении скорости потока степень деионизации уменьшается при прочих равных условиях, однако, возрастает производительность по очищенной воде в единицу времени. С увеличением напряжения степень деионизации в общем случае возрастает,-энергозатраты также возрастают, а удельные энергозатраты на моль воды мало изменяются.
На стадии регенерации энергия частично передается в ячейку для ЕДВ. Таким образом, энергия для опреснения воды частично компенсируется. Результирующая энергия (WЕДВ) описывается выражением (1). Энергия деионизации и энергия концентрирования описываются выражением (2). Удельный расход энергии на единицу изменения концентрации соли (ΔС) в деионизованном водном растворе определяется как
(6)
$W_{{{\text{ЕДВ}}}}^{*}\,\,~ = {{{{W}_{{{\text{ЕДВ}}}}}} \mathord{\left/ {\vphantom {{{{W}_{{{\text{ЕДВ}}}}}} {\Delta С}}} \right. \kern-0em} {\Delta С}}.~$Было установлено, что при малой скорости потока (2.5 мл/мин) величина $W_{{{\text{ЕДВ}}}}^{*}$ меньше для спрессованной мембраны, в то время как для больших скоростей потока (10–15 мл/мин) удельный расход энергии меньше для полосатой мембраны. Степень деионизайии γ для малых скоростей потока больше для спрессованной мембраны, а для больших скоростей потока больше для полосатой мембраны. Эти факты иллюстрируются рис. 8a–8в и табл. 5–12, в которых приведены величины степени деионизации а также величины удельного расхода энергии на деионизацию для разных напряжений и скоростей потока w = 2.5, 10 и 15 см3/мин.
Из этих данных следует, что для получения чистой питьевой воды с учетом производительности установки ЕДВ намного предпочтительнее использовать полосатую мембрану. В этом случае имеют место большие величины степени деионизации и меньшие величины удельных затрат энергии.
3.2. Производительность деионизации
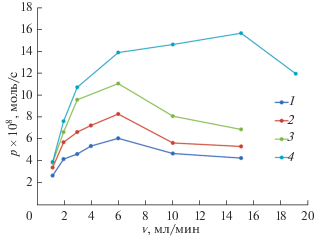
В целях оптимизации режимов работы ЕДВ были рассчитаны зависимости производительности Р по удалению NaCl от скорости потока раствора v при разных напряжениях U. Величины Р рассчитывались из зависимостей концентрации (NaCl) С от времени деионизации t (подобных рис. 8) по выражению
где Сисх – исходная концентрация, Δt – интервал времени от начала стадии деионизации до ее окончания и начала стадии концентрирования. На рис. 9 приведены рассчитанные таким образом зависимости Р от v для различных напряжений U для ЕДВ с полосатой мозаичной мембраной и Сисх = 0.004 М NaCl. Как видим, эти зависимости имеют максимумы, что объясняется следующим образом. Как видно из табл. 5–8, наибольшие степени деионизации γ имеют место при малых скоростях потока, однако при этом наблюдаются минимальные величины производительности удаления соли в единицу времени. При очень больших величинах v, наоборот, имеют место очень малые величины γ, которые не компенсируются этими большими потоками. Этими двумя тенденциями и объясняются максимумы на кривых, изображенных на рис. 9. При построении этих кривых использовалось Δt – время, при котором кривая концентрации соли опускалась ниже исходной концентрации. Из этого рисунка видно, что для напряжений 1.2, 1.4, 1.6 В максимумы Р имеют место при v = 6 см3/мин, а для U = 2 В максимум Р имеет место при v = 15 см3/мин. Поскольку при одинаковых потоках величины Р возрастают при увеличении напряжения, то максимальная производительность работы установки ЕДВ имеет место при напряжении 2 В и потоке раствора 15 см3/мин.4. ЗАКЛЮЧЕНИЕ
Была исследована емкостная деионизация воды (ЕДВ) с целью получения чистой воды. Для этого были применены катионо- анионообменные мембраны мозаичной структуры а также активированные угольные электроды. Мозаичные мембраны содержали катионообменные и анионообменные компоненты в матрицах на основе синтетических волокон. Способ получения прессованных мозаичных мембран включал в себя впрессовывание катионообменной и анионообменной мембран друг в друга. Другим способом было последующее образование полос катионообменника и анионообменника в волокнистой матрице (в полосатой мембране). Активированные угольные электроды и мозаичные мембраны обладали достаточными величинами удельной ионной поверхностной проводимости даже в чистой воде. Удельные энергозатраты составили 31.9 и 111.7 Вт-моль-1 для установок ЕДВ, содержавших полосатые и прессованные мембраны, соответственно. Таким образом, полосатая мембрана была предпочтительна для получения чистой питьевой воды. Было установлено, что максимальная производительность работы установки ЕДВ с полосатой мозаичной мембраной имеет место при напряжении 2 В и потоке раствора 15 см3/мин.
Список литературы
Oren Y. // Desalination. 2008. V. 228. P. 10.
Avraham E., Noked M., Bouhadana Y. et al. // J. Electrochem. Soc. 2009. V. 156. P. 157.
Suss M.E., Baumann T.F., Bourcier W.L. et al. // Energy Environ Sci. 2012. V. 5. P. 9511.
Farmer J.C., Fix D.V., Mack G.V. et al. // “The Use of Capacitive Deionization with Carbon Aerogel Electrodes to Remove Inorganic Contaminants from Water,” Low Level Waste Conference, Orlando, USA (1995).
Strathmann H. // Ion-Exchange Membrane Processes in Water Treatment Sustainability Scienceand Engineering, Elsevier Pabl., 2010.
Rica R.A., Ziano R., Salerno et al. // Phys. Rev. Lett. 2012. V. 109. P. 156103.
Porada S., Zhao R., Van Der Wal et al. // Prog. Mater. Sci. 2013. V. 58. P. 1388.
Jande Y.A., Kim W.S. // Desalination. 2013. V. 329. P. 29.
Soffer A., Folman M. // J. Electroanal. Chem. 1972. V. 38. P. 25.
Li H., Pan L., Lu T. et al. // J. Electroanal. Chem. 2011. V. 653. P. 40.
Вольфкович Ю.М. // Электрохимия. 2020. Т. 56. С. 20. [Volfkovich Yu.M. // Russ. J. Electrochem. 2020. V. 56. P. 1.]
Kang J., Kim T, Jo K. et al. // Desalination. 2014. V. 352. P. 52.
Kim T., Dykstra J.E., Porada S. et al. // J. Colloid Interface Sci. 2015. V. 446. P. 317.
Yang Li., She J., Jiansheng Li. et al. // Carbon, 2017. V. 116. P. 21.
Krüner B., Srimuk P., Fleischmann S. et al. // Carbon. 2017. V. 117. P. 46.
Choi S., Chang B., Kang J.H. et al. // J. Membrane Sci. 2017. V. 541. P. 580.
Andelman M. // Separation and Purification Technology. 2011. V. 80. P. 262.
Anderson M.A., Cudero A.L., Palma J. // Electrochimica Acta. 2010. V. 55. P. 3845.
Xu P., Jorg E., Drewes J.E. et al. // Water Research. 2008. V. 42. P. 2605.
Strathmann H. // Ion-exchange membrane process: their principle and practical applications. Balaban Desalination pub. Hopkinton. USA. 2016.
Liu S., Kyle C., Smith K.C. // Electrochimica Acta. 2017. V. 230. P. 333.
Yang S.C., Choi J., Yeo J. et al. // Environ. Sci. Technol. 2016. V. 50. P. 5892.
Biesheuvel P.M., Bazant M.Z., Cusick R.D. et al. // Applied Physics. 2017. V. 16. P. 19.
Xie J., Xue Y., He M. // Carbon. 2017. V. 123. P. 574.
Tang W., He D., Zhang et al. // Water Research. 2017. V. 121. P. 302.
Hassanvand A., Chen G.Q., Webley P.A. et al. // Desalination. 2017. V. 417. P. 36.
Conway B.E. // Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications, Springer, 1999.
Burke A. // J. Power Sources. 2000. V. 91. P. 37.
Вольфкович Ю.М., Сердюк Т.М. // Электрохимия. 2002. Т. 38. С. 1043. [Volfkovich Yu.M., Serdyuk T.M. // Russ. J. Electrochem. 2002. V. 38. P. 93.]
Pandolfo A.G., Hollenkamp A.F. // J. Power Sources. 2006. V. 157. P. 11.
Sharma P., Bhatti T.S. // Energy Conversion and Management. 2010. V. 51. P. 2901.
Volfkovich Yu.M., Bograchev D.A., Mikhalin A.A., Bagotsky V.S. // J. Solid State Electrochem. 2014. V. 18. P. 1351.
Вольфкович Ю.М., Мазин В.М., Уриссон Н.А. // Электрохимия. 1998. Т. 34. С. 825. [Volfkovich Y.M., Mazin V.M., Urisson N.A. // Russian J. Electrochemistry. 1998. V. 34. P. 740.]
Bagotsky V.S., Skundin A.M., Volfkovich Yu.M. // Electrochemical Power Sources. Batteries, Fuel Cells, Supercapacitors. Jhon Wiely & Sons Inc. Publisher. N.J. 2015.
Andelman M. // Separation and Purification Technology. 2011. V. 80. P. 262.
Volfkovich Yu.M., Rychagov A.Yu., Mikhalin A.A. et al. // Desalination. 2018. V. 426. P. 1.
Kardash M.M., Volfkovich Yu.M., Tyurin I.A. et al. // Petroleum Chemistry. 2013. V. 53. P. 482.
Kardash M.M., Terin D.V. // Petroleum Chemistry. 2016. V. 56. P. 413.
Kardash M.M., Fedorchenko N.B., Epancheva O.V. // Fibre Chem. 2002. V. 34. P. 466.
http://www.kynol.de/pdf/
Volfkovich Yu.M., Bagotzky V.S. // J. Power Sources. 1994. V. 48. P. 339.
Volfkovich Yu.M., Filippov A.N., Bagotsky V.S. // Structural properties of porous materials and powders used in different fields of science and technology. 2014. Springer Publisher. London.
Volfkovich Yu.M., Sakars A.V., Volinsky A.A. // Int. J. Nanotechnology. 2005. V. 2. P. 292.
Dzyazko Yu.S., Ponomaryova L.N., Volfkovich Yu.M. et al. // Microporous and Mesoporous Materials. 2014. V. 198. P. 55.
Rouquerol J., Baron G., Denoyel et al. // Pure Appl. Chem. 2012. V. 84. P. 107.
Fedorchenko N.B., Kardash M.M., Fedorchenko A.A. // Fibre Chemistry. 2003. № 5. P. 352.
ГОСТ 17552-72. Ионообменнные мембраны. Методы измерения общей и равновесной обменной емкости. Москва. 1972.
Berezina N.P., Kononenko N.A., Dyomina O.A. et al. // Advances in Colloid and Interface Sci. 2008. V. 139. P. 3.
Volfkovich Yu.M., Bograchev D.A., Mikhalin A.A., Bagotsky V.S. // J. Solid State Electrochem. 2014. V. 18. P. 1351.
Kinoshita K. // Carbon: electrochemical and physicochemical properties. New York, 1988.
Тарасевич М.Р. // Электрохимия углеродных материалов. М.: Изд. “Наука”, 1984.
Вольфкович Ю.М., Михалин А.А., Рычагов А.Ю. // Электрохимия. 2013. Т. 49. С. 667. [Volfkovich Yu.M., Mikhalin A.A., Rychagov A.Yu. // Russ. J. Electrochemistry. 2013. V. 49. P. 594.]
Volfkovich Yu.M., Bograchev D.A., Mikhalin et al. // Cahapter 9. Nano-Optics, Nanophotonics, Nanomaterials, and Their Applications. Edited by Olena Fesenko and Leonid Fesenko. Shpringer publ. 2018. P. 127.
Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. “Химия”. Москва. 2001.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов