Физикохимия поверхности и защита материалов, 2021, T. 57, № 2, стр. 153-159
Адсорбция пропана на супермикропористом углеродном адсорбенте с широким распределением пор по размерам в условиях докритических температур
С. Д. Артамонова 1, *, А. А. Фомкин 1, А. А. Прибылов 1, А. Л. Пулин 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, стр. 4, Россия
* E-mail: svetlana.artamonova@gmail.com
Поступила в редакцию 10.03.2020
После доработки 17.03.2020
Принята к публикации 24.03.2020
Аннотация
Исследована адсорбция пропана на супермикропористом адсорбенте ACW с широким распределением пор по размерам при давлениях до 1 МПа и температурах 303, 313, 323 и 333 К. Максимальная величина адсорбции пропана при температуре 303 К и давлении 1 МПа равна 21.6 ммоль/г. Рассчитаны зависимости дифференциальной мольной изостерической теплоты адсорбции пропана от величины адсорбции. В начальной области заполнений микропор, до ~6 ммоль/г, теплота адсорбции пропана на микропористом адсорбенте практически постоянна (~27 кДж/моль). Затем, по мере заполнения микропор, теплота адсорбции падает до 25 и 23 кДж/моль при температурах 303 и 333 К соответственно. Далее происходит более резкое падение теплоты до 20 кДж/моль при адсорбции 20 ммоль/г. В результате расчетов получается температурная зависимость теплоты от адсорбции пропана в виде веера кривых. Экспериментальные данные сопоставлены с результатами расчетов адсорбции пропана на основе теории объемного заполнения микропор Дубинина с использованием структурно-энергетических характеристик адсорбента.
ВВЕДЕНИЕ
Природный газ, газовый конденсат и попутные нефтяные газы кроме метана обычно содержат легкие углеводороды, такие как этан, пропан, бутан, а также и другие, более тяжелые углеводороды [1]. Эти ценные компоненты широко используются как в быту, так и в разных отраслях химической промышленности, в частности, при производстве полиэтилена, полипропилена и других полимерных материалов [2–4]. Содержание пропана в природном газе, как правило, колеблется в интервале 0.1–11 мас. %; в попутных газах нефтедобычи и нефтепереработки 16–20 мас. % [4, 5]. В газовой отрасли задачи выделения легких углеводородов, в том числе пропана, из природного газа являются важными и актуальными, поскольку эти процессы позволяют дополнительно получать углеводороды для химической промышленности без существенной потери энергоемкости природного газа. Для решения этих задач в основном используются криогенные технологии (низкотемпературная сепарация, конденсация, ректификация) [6]; реже – мембранные [7] и адсорбционные [1] технологии. В процессах адсорбционного выделения используют различные материалы, в основном активный уголь, цеолиты, силикагели [8]. Микропористые углеродные адсорбенты обладают высокой адсорбционной емкостью к парам легких углеводородов (этан, пропан, бутан) поскольку их энергии адсорбции на углеродных поверхностях значительно превышают энергии адсорбции основного компонента природного газа – метана [9]. Эффективность адсорбционного аккумулирования существенно зависит от структурно-энергетических характеристик адсорбентов и прежде всего от развитости объема микропор адсорбента [10].
В связи с этим важной и актуальной задачей является исследование процесса адсорбции пропана на перспективном супермикропористом углеродном адсорбенте с высоким удельным объемом пор и бимодальным распределением пор по размерам, позволяющим увеличить эффективность разделения метан-пропановой смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Адсорбент
В работе исследовали микропористый углеродный адсорбент ACW [11], полученный методом химической активации смеси кукурузного декстрина, этиленгликоля и фенолформальдегидной смолы, импрегнированной гидроксидом калия. Активацию проводили при 750°С.
Анализ пористой структуры адсорбента ACW проводили на основе изотермы адсорбции/десорбции паров азота (рис. 1), полученной при температуре 77 К на установке Autosorb-iQ (Quantachrom).
Рис. 1.
Изотерма адсорбции азота при 77 К на адсорбенте ACW (светлые кружки – адсорбция, черные – десорбция).

Изотерма адсорбции/десорбции паров азота на адсорбенте ACW приведена на рис. 1. Десорбционная ветвь имеет две области, существенно различающиеся темпом ростом адсорбции (0–20 ммоль/г) с ростом давления от 0 до 2 кПа, и характеризуется более пологим ходом адсорбции (20–52 ммоль/г) при давлениях от 2 до 40 кПа. В средней области заполнений (52–60 ммоль/г) видна узкая петля адсорбционного гистерезиса при изменении давления от 40 до 100 кПа, что свидетельствует о наличии в структуре микро- и мезопор. Резкое изменение хода изотермы адсорбции при а ≈ 20 ммоль/г указывает на бимодальность структуры активного угля ACW.
На рис. 2 представлены результаты DFT-расчетов распределения пор по размерам адсорбента ACW.
Рис. 2.
Распределение объема пор по размерам адсорбента ACW dV/dD = f(D) (см3 г–1 нм–1), полученное методом DFT для цилиндрических пор (QSDFT-модель). V – объем пор (см3/г); D – диаметр пор (нм).
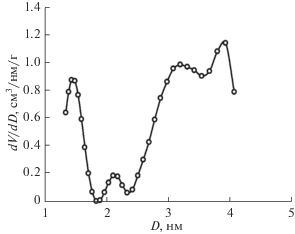
На рис. 2 можно видеть два характерных максимума при ~1.5 и ~3–4 нм, что также указывает на бимодальный характер распределения пор по размерам. По классификации М.М. Дубинина микропоры таких размеров относятся к супермикропорам. Общий объем микропор равен 1.44 см3/г. Качественно это согласуется с определением бимодальной пористой структуры по уравнению (1) теории объемного заполнения пор (ТОЗМ). Адсорбция азота сначала протекает в микропорах, обладающих более высокой энергией адсорбции, а затем в супермикропорах – порах большего размера.
Характеристики пористой структуры адсорбента ACW (объем и ширина микропор, удельная поверхность, характеристическая энергия) определяли из анализа изотерм паров азота с помощью ТОЗМ с использованием уравнения Дубинина–Радушкевича (1) [12], предложенного для бимодального распределения микропор по размерам:
(1)
$a = {{a}_{{01}}}\exp \left[ { - {{{\left( {\frac{A}{{{{E}_{{01}}}}}} \right)}}^{{{{n}_{{01}}}}}}} \right] + {{a}_{{02}}}\exp \left[ { - {{{\left( {\frac{A}{{{{E}_{{02}}}}}} \right)}}^{{{{n}_{{02}}}}}}} \right],$Уравнение (1) применимо для описания изотерм адсорбции в интервале малых и средних относительных давлений (P/Ps), поэтому использовали на изотерме адсорбции интервал P/Ps от 0.01 до 0.3.
Эффективные радиусы микропор (нм) определяли как х01 = 12/Е01, х02 = 12/Е02 [13]. Для перехода от данных по адсорбции азота на ACW к данным по адсорбции стандартного пара бензола использовали коэффициент подобия β = 0.33 [12]: ${{E}_{{01({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}})}}} = {{{{E}_{{01({{{\text{N}}}_{2}})}}}} \mathord{\left/ {\vphantom {{{{E}_{{01({{{\text{N}}}_{2}})}}}} \beta }} \right. \kern-0em} \beta }$; ${{E}_{{02({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}})}}} = {{{{E}_{{02({{{\text{N}}}_{2}})}}}} \mathord{\left/ {\vphantom {{{{E}_{{02({{{\text{N}}}_{2}})}}}} \beta }} \right. \kern-0em} \beta }$. Удельную поверхность SБЭТ определяли по начальной части изотермы адсорбции азота при относительных давлениях P/Ps до 0.1.
В общем случае адсорбция происходит не только в микропорах, но и на поверхности и в объеме мезопор. Это наглядно демонстрирует рис. 3, на котором представлена изотерма адсорбции паров азота на адсорбенте ACW, рассчитанная по уравнению (1). При относительном давлении P/Ps > 0.2 в основном завершается заполнение микропор и начинается полимолекулярная адсорбция азота на поверхности, а затем и в объеме мезопор. Адсорбцию в мезопорах определяли как разницу между адсорбцией паров азота, полученной экспериментально (рис. 3, кривая 1) и рассчитанной по уравнению (1) (рис. 3, кривая 2).
Рис. 3.
Изотерма адсорбции паров азота при 77 К на адсорбенте ACW: 1 – эксперимент; 2 – расчет по уравнению (1).

Результаты определения структурно-энергетических характеристик адсорбента ACW представлены в табл. 1.
Таблица 1.
Cтруктурно-энергетические характеристики адсорбента ACW
| Удельный объем микропор, (W0 = W01 + W02), см3/г | 1.44 |
| Удельный объем микропор первой моды, W01, см3/г | 0.94 |
| Удельный объем микропор второй моды, W02, см3/г | 0.50 |
| Характеристическая энергия адсорбции по бензолу первой моды, ${{Е}_{{01({{{\text{С}}}_{{\text{6}}}}{{{\text{Н}}}_{{\text{6}}}})}}},$ кДж/моль | 15.6 |
| Характеристическая энергия адсорбции по бензолу второй моды, ${{Е}_{{02({{{\text{С}}}_{{\text{6}}}}{{{\text{Н}}}_{{\text{6}}}})}}},$ кДж/моль | 4.3 |
| Ширина микропор первой моды, x01, нм | 1.5 |
| Ширина микропор второй моды, x02, нм | 3.5 |
| Удельная поверхность по азоту SБЭТ , м2/г | 2520 |
| Удельная поверхность мезопор, SМЕ , м2/г | 444 |
| Удельный объем мезопор, VME, см3/г | 0.59 |
| Общий удельный объем пор, (W0 + VME), см3/г | 2.03 |
Адсорбат
В работе использовали газообразный пропан (С3Н8) высокой чистоты 99.999%. По данным [14] обладает следующими физико-химическими характеристиками: молекулярная масса: µ = 44.096 г/моль; нормальная температура кипения Tb = 231.04 К; критическая температура Tс = 369.89 К; критическое давление pс = 4.251 МПа.
Методика измерения адсорбции
Адсорбцию пропана измеряли при давлениях в интервале 0.01–1 МПа при температурах 303, 313, 323, 333 К объемно-весовым методом [15] как абсолютную величину по изменению массы ампулы с адсорбентом, заполненной пропаном.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Изотермы адсорбции пропана
На рис. 4 приведены изотермы адсорбции пропана на микропористом углеродном адсорбенте ACW при температурах 303, 313, 323 и 333 К, полученные на основе экспериментальных данных. Аппроксимация изотерм проводилась с использованием уравнения адсорбции Бакаева [16]:
(2)
$a = {{k}_{0}}\frac{{{{k}_{1}}P + 2{{k}_{2}}{{P}^{2}}3{{k}_{3}}{{P}^{3}}}}{{1 + {{k}_{1}}P + {{k}_{2}}{{P}^{2}} + {{k}_{3}}{{P}^{3}}}}.$Рис. 4.
Изотермы адсорбции пропана на микропористом углеродном адсорбенте ACW при температурах 303, 313, 323 и 333 К. Сплошные линии – аппроксимация по уравнению Бакаева (2), символы – эксперимент.

Как следует из рис. 4, измеренные изотермы адсорбции во всей области исследованных температур характеризуются плавным подъемом с увеличением давления. С ростом температуры адсорбция падает, что отвечает процессу физической адсорбции. Изотермы адсорбции обратимы и на них отсутствуют скачкообразные изменения, характерные для фазовых переходов. В области давлений до 0.1 МПа подъем изотерм наиболее крутой. В этой области происходит наиболее интенсивное заполнение микропор, и адсорбция пропана при температуре 303 К достигает значения 10 ммоль/г (~44 мас. %), а при температуре 333 К – 6 ммоль/г (~26 мас. %). При дальнейшем заполнении интенсивность адсорбции замедляется, и появляется тенденция к насыщению.
При температуре 303 К и давлении, близком к линии Ps (0.91 МПа) изотерма адсорбции пропана выходит на плато, и адсорбция пропана составляет 22 ммоль/г (97 мас. %). Адсорбция пропана при 303 К на линии Рs, рассчитанная по уравнению (2) с учетом объема мезопор, равна 22.3 ммоль/г, что хорошо согласуется с экспериментальными данными.
Изостеры адсорбции
По экспериментальным данным изотерм адсорбции пропана на адсорбенте ACW построены изостеры адсорбции (рис. 5) в координатах lnP–f(1/T)а.
Рис. 5.
Изостеры адсорбции пропана на микропористом углеродном адсорбенте ACW при величинах адсорбции, a, ммоль/г: 1 – 1, 2 – 2, 3 – 3, 4 – 4, 5 – 5, 6 – 6, 7 – 7, 8 – 8, 9 – 9, 10 – 10, 11 – 11, 12 – 12, 13 – 13, 14 – 14, 15 – 15, 16 – 16, 17 – 17, 18 – 18, 19 – 19, 20 – 20. Символы – экспериментальные данные; линии – аппроксимационные кривые; Ps – линия давления насыщенного пара.

Изостеры адсорбции хорошо аппроксимируются прямыми линиями во всем интервале исследованных температур. Данный факт отмечался для адсорбции газов и паров на микропористых адсорбентах и в других работах [17–19]. Свойство линейности изостер адсорбции характеризует особое состояние адсорбата в микропорах, которое препятствует образованию зародышей жидкой фазы и возникновению фазовых переходов первого рода.
Важно отметить, что свойство линейности изостер адсорбции позволяет проводить расчеты величины адсорбции в широком интервале температур и давлений, не прибегая к трудоемким экспериментальным измерениям.
Дифференциальная мольная изостерическая теплота адсорбции
Теплоты адсорбции отражают энергетику всего адсорбционного процесса, а также энергию межмолекулярных взаимодействий адсорбированных молекул с поверхностью адсорбента и между собой. По форме кривой теплоты адсорбции можно судить о поверхности адсорбента и энергетикe процесса адсорбции на различных стадиях заполнения микропор.
Дифференциальная мольная изостерическая теплота адсорбции qst является одним из важных энергетических параметров адсорбционных систем адсорбции и определяется как разность мольной энтальпии газовой фазы hg и дифференциальной мольной энтальпии адсорбционной системы Hl [12]:
Дифференциальную мольную изостерическую теплоту адсорбции рассчитывали по уравнению Бакаева [16, 20] c использованием изостер абсолютной адсорбции пропана в координатах lnp–f(1/T)а:
(3)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}}\left\{ {{{1 - {{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{1 - {{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} {{{V}_{g}}}}} \right. \kern-0em} {{{V}_{g}}}}} \right\} - \\ - \,\,{{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}\left[ {V\left( {a,Т} \right) - T{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial T}}} \right)}}_{a}}} \right], \\ \end{gathered} $Из (3) следует, что дифференциальная мольная изостерическая теплота адсорбции зависит от угла наклона изостер адсорбции (д(lnp)/д(1/T))a, интенсивности изотермической (дV(a)/дa)T и изостерической деформации системы (дV(a)/дТ)а, неидеальности газовой фазы (Z ≠ 1), удельного объема равновесной газовой фазы vg(р, Т) при высоких давлениях, а также от крутизны наклона изотермы адсорбции (дP/дa)T.
В [17] было показано, что относительная адсорбционная деформация адсорбентов при адсорбции в области высоких давлений не превосходит 1%, и вклад интенсивностей адсорбционной и температурной деформации углеродных адсорбентов также мал. Поэтому расчет теплоты адсорбции пропана на адсорбенте проводили по уравнению
(4)
${{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}} - {{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{а}}V.$Результаты расчетов дифференциальной мольной изостерической теплоты адсорбции метана на микропористом углеродном адсорбенте ACW по экспериментальным данным представлены на рис. 6.
Рис. 6.
Зависимость дифференциальной мольной изостерической теплоты адсорбции пропана на микропористом углеродном адсорбенте ACW при температурах 303–333 K. Символы – экспериментальные данные; линии – аппроксимация; пунктирная линия ql – теплота конденсации пропана при 303 K.

Как следует из рис. 6, в начальной области заполнений микропор, до ~6 ммоль/г, теплота адсорбции пропана на микропористом адсорбенте, полученная из экспериментальных данных, практически постоянна и составляет ~27 кДж/моль. Затем по мере заполнения микропор (а = 6–14 ммоль/г) происходит плавное падение теплоты адсорбции. В области высоких заполнений микропор от ~10 до ~18 ммоль/г наблюдается незначительное уменьшение теплот адсорбции, а также расхождение кривых вследствие уменьшения коэффициента сжимаемости с ростом давления и температуры. При величине абсолютной адсорбции, равной 18 ммоль/г, и температурах 303 и 333 К теплоты адсорбции составляют соответственно 25.3 и 23.7 кДж/моль. Дальнейшее заполнение приводит к резкому падению теплоты адсорбции, обусловленному увеличением энергии отталкивания между молекулами пропана в адсорбате. Такой ход кривых можно объяснить наличием широкого распределения пор по размерам, а также процессом ассоциирования молекул пропана в супермикропорах при высоком заполнении, связанным с межмолекулярным отталкиванием на малых расстояниях. Однако дифференциальная теплота адсорбции остается достаточно высокой по сравнению с теплотой конденсации пропана при температуре 303 К.
Расчет адсорбции пропана
Адсорбцию пропана в микропорах рассчитывали на основе структурно-энергетических характеристик адсорбента (табл. 1) с использованием бимодального уравнения ТОЗМ (1) и уравнения Дубинина–Николаева (5):
где $a_{0}^{0}$, ммоль/г – предельная адсорбция при температуре кипения пропана T0, К; α, 1/К – термический коэффициент предельной адсорбции пропана: α = –(∂lna0/∂T)p = ps = 1.16 × 10–3 K–1 .На рис. 7 представлены расчетные кривые (сплошные линии) адсорбции пропана на адсорбенте ACW в сравнении с экспериментальными изотермами адсорбции. Для исследованной системы наиболее сильное расхождение между экспериментальными данными и рассчитанными значениями адсорбции наблюдается для области высоких заполнений. Это может быть связано с наличием дополнительной адсорбции на поверхности и в объеме мезопор. При этом с увеличением температуры это расхождение уменьшается из-за уменьшения эффектов конденсации при приближении к критической температуре. Отклонение расчетных кривых от экспериментальных изотерм адсорбции в области малых заполнений при а/a0 = 0.25 вероятно связано с ограничением области применимости уравнения (1) [12].
ЗАКЛЮЧЕНИЕ
На микропористом углеродном адсорбенте ACW с широким распределением пор по размерам исследована адсорбция пропана при давлениях до 1 МПа и температурах 303, 313, 323, 333 К. Максимальная величина адсорбции пропана на ACW при температуре 303 К и давлении 1 МПа составляет 21.6 ммоль/г. На основе полученных данных построены изостеры адсорбции, которые хорошо аппроксимируются линейными зависимостями в координатах lnP–1/Т при постоянной величине адсорбции. Рассчитаны дифференциальные мольные изостерические теплоты адсорбции пропана на углеродном микропористом адсорбенте в зависимости от величины адсорбции. Установлено, что теплота адсорбции пропана в начальной области заполнений микропор составляет 27.7 кДж/моль и не изменяется с увеличением заполнений до ~6 ммоль/г, а затем постепенно снижается и при адсорбции 18 ммоль/г составляет 25.3 и 23.7 кДж/моль при температурах 303 и 333 К соответственно. Такой ход кривых теплоты адсорбции может быть вызван наличием широкого распределения пор по размерам в адсорбенте, смещенном в область супермикропор, и образованием ассоциатов в адсорбированном пропане.
Проведена оценка возможности описания адсорбционных равновесий с использованием двухчленного уравнения теории объемного заполнения микропор (ТОЗМ). Наилучшее соответствие результатов расчета с экспериментальными данными найдено в области средних заполнений до 15 ммоль/г.
Список литературы
Старосельский В.И. Этан, пропан, бутан в природных газах нефтегазоносных бассейнов, Москва: Недра, 1990. С. 184.
Азингер Ф. Химия и технология парафиновых углеводородов, пер. с нем. М., 1959.
Бартон Д., Оллис У.Д. Общая органическая химия, пер. с англ. / Под ред. Кочеткова. Н.К. Т. 1. М.: Химия, 1981.
Пэрэушану В., Коробя М., Муска Г. Производство и использование углеводородов, пер. с рум. М., 1987.
Соколова В.А., Бестужев М.А., Тихомолова Т.В. Химический состав нефтей и природных газов в связи с их происхождением. М.: Недра, 1972.
Архаров А.М., Марфенина И.В., Микулин Е.И. Криогенные системы. М.: Машиностроение. 1996.
Хванг С.Т., Каммермаейер К. Мембранные процессы разделения. М.: Химия, 1981. C. 464.
Кельцев Н.В. Основы адсорбционной техники. М.: Химия, 1976.
Авгуль Н.П., Киселев А.В., Пошкус Д.П. Адсорбция газов и паров на однородных поверхностях. М.: Химия, 1975.
Меньщиков И.Е., Фомкин А.А., Школин А.В., Стриженов Е.М., Зайцев Д.С., Твардовский А.В. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 5. С. 459.
Фомкин А.А., Приибылов А.А., Ткачев А.Г., Меметов Н.Р., Мележик А.В., Кучерова А.Е., Шубин И.Н., Пулин А.Л., Школин А.В., Меньщиков И.Е., Жедулов С.А., Мурдмаа К.О., Артамонова С.Д // Коллоидный журнал. 2019. Т. 81. № 5. С. 660.
Дубинин М.М. Адсорбция и пористость. М.: ВАХЗ, 1972.
Дубинин М.М. В Сб. Адсорбция в микропорах. М.: Наука, 1987. 511 с.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: Наука, 1972.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233.
Бакаев В.А. // Изв. АН СССР, Сер. хим. 1971. № 2. С. 2648.
Fomkin A.A. // Adsorption. 2005. V. 11. № 3/4. P. 425.
Barrer R.M., Papadopoulos R. // Proc. R. Soc. London. 1972. A326. P. 315.
Yakovlev V.Yu., Fomkin A.A. // Colloid J. 2009. V. 71. № 6. P. 877.
Школин А.В., Фомкин А.А. // Коллоидный журнал. 2009. Т. 71. № 1. С. 116.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



