Физикохимия поверхности и защита материалов, 2021, T. 57, № 2, стр. 166-171
Исследование адсорбции токсичных ионов электрогенерируемым гиббситом
В. И. Дударев 1, Е. Г. Филатова 1, *
1 Иркутский национальный исследовательский технический университет
Иркутск, Россия
* E-mail: efila@list.ru
Поступила в редакцию 15.11.2018
После доработки 10.01.2019
Принята к публикации 17.01.2019
Аннотация
Изучена адсорбция ионов Ni(II), Zn(II) и Cu(II) электрогенерируемым гиббситом (гидроксидом алюминия γ-модификации). Электрогенерируемый гиббсит, получали электролизом водных растворов с использованием алюминиевых электродов. В работе использован гиббсит, полученный в течение первых пяти минут электролиза. Такой адсорбент имеет аморфное состояние и сетчатую структуру и как следствие хорошую адсорбционную способность. Величина адсорбции для ионов Ni(II) составила 437.0 мг/г; для Zn(II) – 362.5 мг/г и для Cu(II) – 148.8 мг/г. Полученные изотермы имеют ступенчатый характер что объясняется неоднородностью адсорбирующей поверхности, на которой расположены группы активных центров, резко отличающихся друг от друга по своей активности. Адсорбция токсичных ионов изучена с использованием моделей Ленгмюра, Фрейндлиха и Дубинина–Радушкевича. Значения коэффициентов корреляции свидетельствуют, о том, что адсорбцию ионов Zn(II) Cu(II) наилучшим образом описывает модель Ленгмюра, а ионов Ni(II) – модель Дубинина–Радушкевича. На основании модели адсорбции Дубинина–Радушкевича определены значения свободной энергии адсорбции, указывающие на физическую природу взаимодействия адсорбтива и адсорбента. Адсорбция токсичных ионов на поверхности гиббсита протекает в основном за счет дисперсионного взаимодействия.
ВВЕДЕНИЕ
В настоящее время во многих отраслях промышленности используют различного рода адсорбенты. С целью минимизации антропогенного влияния на окружающую среду в качестве адсорбентов используют, например, отходы пищевого производства, теплоэнергетических станций, строительства и др.
В исследовании [1] изучена адсорбционная способность относительно дешевых адсорбентов, таких как уголь, полученный из шелухи арахиса, и зола по отношению к ионам Cu(II) и Zn(II). Рассмотрена возможность применение указанных адсорбентов для очистки сточных вод гальванического производства. Исследованы такие параметры как рН, время контакта, начальная концентрация металлов. Оптимальное значение рН для удаления ионов Cu(II) и Zn(II) составило 6 для угля, полученного из шелухи арахиса, и 8 – в случае летучей золы. Адсорбционное равновесие устанавливается в течение 2-х часов для обоих адсорбентов. Адсорбционные параметры определяли с использованием изотерм Ленгмюра и Фрейндлиха. Уравнение Лэнгмюра наилучшим образом описывает адсорбционный процесс.
Для удаления токсичных ионов металлов из сточных вод гальванического завода, расположенного на северо-востоке Бразилии, использован жмых, полученный из отходов сахарного тростника [2]. Обработка кислотой повышает эффективность адсорбции в серии экспериментов. Микроструктура материала до и после обработки исследована методом рентгеновской дифракции, инфракрасной спектроскопии и сканирующей электронной микроскопии. Адсорбция ионов тяжелых металлов Cu(II), Ni(II) и Zn(II) из сточных вод (при отсутствии цианидов) составила 95.5, 96.3 и 97.1%, соответственно. Эффективность регенерация адсорбента, полученного в кислой среде, снизилась только после четвертого цикла повторного использования. Жмых, полученный из отходов сахарного тростника, обработанный кислотой можно считать альтернативой общих методов, используемых для удаления ионов токсичных металлов из сточных вод гальванических производств.
В работе [3] для удаления ионов тяжелых металлов из водных растворов использовали канкринит – цеолит типа (ZFA) синтезируемый из летучей золы. Исследованы адсорбционные равновесия ионов Pb(II), Cu(II), Ni(II), Co(II) и Zn(II) на ZFA в водных растворах. Представлены изотермы адсорбции Ленгмюра. Увеличение рН во время процесса адсорбции показывает, что поглощение ионов тяжелых металлов на ZFA имеет механизм ионного обмена. Установлено, что максимальная обменная емкость: Pb(II) (2.530 ммоль/г) > Cu(II) (2.081 ммоль/г) > Ni(II) (1.532 ммоль/г) > Co(II) (1.242 ммоль/г) > Zn(II) (1.154 ммоль/г). Сравнение с предыдущими исследованиями показывает, что максимальная обменная емкость для ZFA выше, чем у природных цеолитов, а это также сопоставимо (или выше) с несколькими синтетическими цеолитами и ионообменными смолами. Высокая обменная емкость тяжелых металлов на ZFA объясняется высокой емкостью катионного обмена и надлежащего размера пор канкринита.
К эффективным показателям практического применения адсорбентов можно отнести адсорбционную емкость, время наступления равновесия в системе адсорбат–адсорбент, скорость адсорбции и др. При этом синтетические адсорбенты, как правило, отличают высокие адсорбционные емкости.
Методом мокрого формования подготовлен новый композитный адсорбент цеолит/волокна ацетат целлюлозы [4]. Результаты сканирующей электронной микроскопии показали, что частицы цеолита сохранены и завернуты в сетях волокон ацетат целлюлозы. Адсорбцию ионов Cu(II) из водного раствора изучали в уплотненном слое волокон. Исследованы параметры, такие как рН раствора, начальная концентрация металла, толщина слоя и скорость потока. Оценивали динамическую обработку сточных вод гальванического производства с использованием волокон. Регенерировали адсорбенты с использованием раствора HCl. Рассмотрены три цикла адсорбции. Отмечено снижение концентрации Cu(II) от 20 до 0.1 мг/л.
В исследовании [5] получены и использованы для удаления ионов Cu(II) три различных хитозан-цеолит композита (CZ-0, CZ-1 и CZ-2). Композиты охарактеризованы с помощью инфракрасной спектроскопии, анализа по определению размера пор, сканирующей электронной микроскопии в сочетании с энергией рентгеновского (SEM-EDX) анализа, термогравиметрического анализа и рентгеновской дифракции. На основе модели адсорбции Ленгмюра определена максимальная емкость адсорбции 25.61, 51.32 и 14.75 мг/г для CZ-0, CZ-1 и CZ-2 соответственно.
Известно, что адсорбционная емкость синтетических адсорбентов при извлечении токсичных ионов может достигать: 152.4 мг/г – для Cu(II) [6]; 122.4 мг/г – для Ni(II) [7] и 72.32 мг/г – для Zn(II) [8].
При извлечении токсичных ионов помимо адсорбентов, широко используют разного рода коагулянты в том числе относительно не дорогие такие как гидроксиды алюминия и железа. Известно, что эти вещества помимо коагулирующей способности обладают адсорбционными свойствами. В случает практического применения реагентных адсорбентов-коагулянтов, помимо коагулируюших катионов, в водных растворах существенно увеличивается концентрация анионов, приводящая ко вторичному загрязнению воды. Использование электрогенерирумых адсорбентов-коагулянтов, т.е. гидроксида алюминия и железа, полученных электрохимическим путем, существенно повышает эффективность удаления загрязнений, а также позволяет избегать вторичного загрязнения воды.
Целью работы явилось исследование адсорбции ионов Ni(II), Zn(II) и Cu(II) из водных растворов электрогенерируемым гиббситом (гидроксидом алюминия γ-модификации).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали электрогенерируемый гиббсит, полученный при электролизе водных растворов с использованием алюминиевых электродов [9]. В работе использован гиббсит, полученный в течение первых пяти минут электролиза. Известно, что такой гидроксид алюминия имеет аморфное состояние и сетчатую структуру [10] и как следствие хорошую адсорбционную способность.
Рентгенофазовый анализ проводили на автоматизированном рентгеновском дифрактометре D8 ADVANCE, оснащенном зеркалом Гебеля и детектором VÅNTEC-1 PSD. Съемку проводили в пошаговом режиме в диапазоне углов 20 от 5 до 70 градусов, с использованием Cu-излучения. Расчет рентгенограмм выполнен с помощью программного обеспечения дифрактометра.
Исследование адсорбционных свойств электрогенерируемого гиббсита по отношению к ионам Ni(II), Zn(II) и Cu(II) проводили на модельных растворах, приготовленных из реактивов NiSO4 ⋅ 7H2O, ZnSO4 ⋅ 7H2O и CuSO4 ⋅ 5H2O квалификации “х. ч.” и дистиллированной воды. Выбор исходной концентрации модельных растворов обоснован реальным составом производственных сточных вод. Содержание ионов металлов в растворах определяли по стандартным методикам [11, 12].
Адсорбционную способность изучали статическим методом. В работе использован метод неизменных навесок (0.1 г) и переменных концентраций (от 1 до 100 мг/л). Исследуемые растворы готовили объемом 100 мл. Массовое отношение жидкой и твердой фаз составляло 1 : 100. Величину адсорбции (А, ммоль/г) вычисляли по формуле:
где С0 и Сравн – исходная и равновесная концентрации металла в растворе, ммоль/л; V – объем раствора, л; m – масса сорбента, г.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно результатам рентгенофазового исследования установлено, что полученный спектр идентичен спектру гидроксида алюминия γ-модификации – гиббситу (рис. 1).
Известно, что образовавшийся электрохимическим путем гидроксид алюминия имеет аморфное состояние и сетчатую структуру [10]. Активность такого электрогенерируемого образца оказывается значительно выше, чем у аналога полученного реагентным путем [13]. Исследование адсорбционной способности полученного гиббсита проводили с помощью изотерм адсорбции (рис. 2).
Известно, что изотермы, полученные при адсорбции растворенных веществ на гидроксиде алюминия, имеют ступенчатый характер [14]. На поверхности адсорбента, которая является неоднородной, находятся группы активных центров, резко отличающихся друг от друга по своей адсорбционной активности. К таким поверхностям можно отнести агрегаты Al(OH)3, в которых наблюдается цепочечная структура [15], что свидетельствует о наличии на шарообразных частицах более активных центров.
Установлено, что адсорбция истинно растворенных веществ на гидроксиде алюминия описывается изотермой Лэнгмюра [14]. Уравнение изотермы адсорбции Лэнгмюра ($A = {{A}_{\infty }}\frac{{K{{С}_{{{\text{равн}}}}}}}{{1 + K{{С}_{{{\text{равн}}}}}}}$) адекватно для описания процесса достижения предельного значения адсорбции. В линейной форме имеет вид:
(1)
$\frac{1}{A} = \frac{1}{{{{A}_{\infty }}}} + \frac{1}{{{{A}_{\infty }}K}}\frac{1}{{{{C}_{{{\text{равн}}}}}}}{\text{,}}$С помощью графической обработки представленных изотерм (рис. 3) определены постоянные адсорбционные параметры для ионов Ni(II), Zn(II) и Cu(II). Экстраполяция зависимостей по оси ординат дает отрезок, равный 1/А∞, а тангенс угла наклона прямых равен 1/(А∞K) (табл. 1).
Таблица 1.
Параметры модели Ленгмюра
| ИТМ | А∞, ммоль/г | А∞, мг/г | К | Линейная форма уравнения Ленгмюра | R2 |
|---|---|---|---|---|---|
| Ni(II) | 12.27 | 723.93 | 9.26 | 1/А = 0.0088(1/Сравн) + 0.0815 | 0.77 |
| Zn(II) | 11.34 | 736.96 | 7.29 | 1/А = 0.0121(1/Сравн) + 0.0882 | 0.98 |
| Cu(II) | 3.70 | 234.92 | 19.88 | 1/А = 0.0136(1/Сравн) + 0.2703 | 0.91 |
Из представленных данных (табл. 1), очевидно, что по значениям предельной адсорбции ионы тяжелых металлов располагаются в следующий ряд адсорбционной активности: Ni(II) > Zn(II) > Cu(II). Судя по коэффициентам корреляции, адсорбцию истинно растворенных веществ гидроксидом алюминия наилучшим образом описывает модель адсорбции Лэнгмюра для ионов Zn(II).
Уравнение Фрейндлиха широко используют при обработке экспериментальных адсорбционных результатов:
где А – величина адсорбции, ммоль/г; Сравн – равновесная концентрация ионов тяжелого металла, ммоль/л; Kф и n – постоянные. Чаще используют уравнение Фрейндлиха в логарифмической форме lgA = lgKф + 1/n lg Cравн. Построены линейные зависимости логарифмической формы уравнения Фрейндлиха (рис. 4) и графически определены оба постоянных параметра Kф и n (табл. 2).Таблица 2.
Параметры модели Фрейндлиха
| ИТМ | Линейная форма уравнения Фрейндлиха | Kф | n | R |
|---|---|---|---|---|
| Ni(II) | lg A = 0.9810 lg Cравн + 1.8346 | 68.33 | 1.02 | 0.85 |
| Zn(II) | lg A = 0.7013 lg Cравн + 1.3826 | 24.13 | 1.43 | 0.97 |
| Cu(II) | lg A = 0.4140 lg Cравн + 0.7910 | 6.18 | 2.42 | 0.88 |
Константы Kф и n позволяют проводить сравнение адсорбционной способности. При концентрации ионов тяжелых металлов в растворе 1 моль/л величина адсорбции этих ионов будет равна постоянной Kф (табл. 2).
Как видно из представленных данных (табл. 2), наибольшее значение Kф = 68.33 соответствует ионам Ni(II). По значениям постоянной Kф ионы исследуемых тяжелых металлов располагаются в следующий ряд адсорбционной активности: Ni(II) > Zn(II) > Cu(II).
Параметр n указывает на интенсивность взаимодействия адсорбент-адсорбат. Таким образом, адсорбция ионов Cu(II) электрогенерируемым гиббситом протекает быстрее и более интенсивно.
Равновесные данные адсорбционного процесса были обработаны с помощью модели изотермы Дубинина–Радушкевича
где k – константа (моль2/кДж2), связанная с энергией адсорбции; ε – потенциал Поляни (кДж/моль), отражающий изотермическую работу переноса одного моля ионов тяжелого металла из объема равновесного раствора к поверхности адсорбента и определяемый из выражения где R – универсальная газовая постоянная, кДж/моль К; Т – абсолютная температура, К.Уравнение Дубинина–Радушкевича (3) в логарифмической форме:
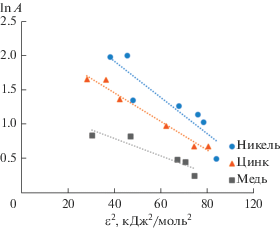
Используя уравнение адсорбции Дубинина–Радушкевича в линейной форме, построены зависимости lnA = f (ɛ2) (рис. 5).
По наклону представленных прямых и отрезку, отсекаемому на оси ординат определяли константы k и Аm. Модель Дубинина–Радушкевича указывает на природу адсорбции адсорбата на адсорбенте и может быть использована для расчета свободной энергии адсорбции:
Полученные результаты представлены в табл. 3.
Таблица 3.
Параметры модели Дубинина–Радушкевича
| ИТМ | Аm, ммоль/г | k, моль2/кДж2 | E, кДж/моль | R |
|---|---|---|---|---|
| Ni(II) | 19.83 | 0.026 | 4.35 | 0.87 |
| Zn(II) | 10.07 | 0.021 | 4.90 | 0.97 |
| Cu(II) | 3.77 | 0.013 | 6.25 | 0.90 |
Известно, что если значение Е лежит между 8 и 16 кДж/моль, то адсорбционный процесс протекает по механизму хемосорбции [16]. Если же значение Е меньше 8 кДж/моль, то процесс адсорбции носит физический характер. Значения свободной энергии адсорбции (табл. 3), указывают на физическую природу взаимодействия адсорбтива и адсорбента. Адсорбция токсичных ионов на поверхности гиббсита протекает в основном за счет дисперсионного взаимодействия. Дисперсионное взаимодействие осуществляется силой электростатического притяжения мгновенного и индуцированного (наведенного) диполей электрически нейтральных атомов или молекул, каковыми являются образующиеся гидроксоаквакомплексы, содержащие ионы исследуемых металлов.
ВЫВОДЫ
1. Изучена адсорбция ионов Ni(II), Zn(II) и Cu(II) электрогенерируемым гиббситом (гидроксидом алюминия γ-модификации). Полученные изотермы имеют ступенчатый характер что объясняется неоднородностью адсорбирующей поверхности, на которой расположены группы активных центров, резко отличающихся друг от друга по своей активности. Величина адсорбции для ионов Ni(II) составила 437.0 мг/г; для Zn(II) – 362.5 мг/г и для Cu(II) – 148.8 мг/г.
2. Адсорбция токсичных ионов изучена с использованием моделей Ленгмюра, Фрейндлиха и Дубинина–Радушкевича. Значения коэффициентов корреляции свидетельствуют, о том, что адсорбцию ионов Zn(II) Cu(II) наилучшим образом описывает модель Ленгмюра, а для ионов Ni(II) – модель Дубинина–Радушкевича.
3. На основании модели адсорбции Дубинина–Радушкевича определены значения свободной энергии адсорбции, указывающие на физическую природу взаимодействия адсорбтива и адсорбента.
4. Установлено, что адсорбция токсичных ионов на поверхности гиббсита протекает в основном за счет дисперсионного взаимодействия. Дисперсионное взаимодействие осуществляется силой электростатического притяжения мгновенного и индуцированного (наведенного) диполей электрически нейтральных атомов или молекул, каковыми являются образующиеся гидроксоаквакомплексы, содержащие ионы исследуемых металлов.
Список литературы
Abdel Salam O.E., Reiad N.A., ElShafei M.M. // J. Advanced Research. 2011. V. 2. № 4. P. 297–303.
Sousa F.W., Sousa M.J., Oliveira I.R.N. // J. Environmental Management. 2009. V. 90. № 11. P. 3340–3344.
Ji Fei, Li Chaolin, Xu Jialin, Liu Peng // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2013. V. 434. № 5. P. 88–94.
Wan Ngah W.S., Teong L.C., Toh R.H., Hanafiah M.A.K.M. // Chemical Engineering J. 2013. V. 223. № 1. P. 231–238.
Qiu W., Ying Zheng Y. // Chemical Engineering J. 2009. V. 145. № 3. P. 483–488.
Song H., Song H., Wan, X., Dai M., Zhang J., Li. F. // Fuel Processing Technology. 2013. V. 116. P. 52–62.
Keane M. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 1998. V. 138. № 1. P. 11–20.
Oliveira M.L.M., Miranda A.A.L., Barbosa C.M.B.M., Cavalcante Jr. C.L., Azevedo D.C.S. // Fuel. 2009. V. 88. № 10. P. 1885–1892.
Filatova E.G. // Journal of Water Chemistry and Technology. 2016. V. 38. № 3. P. 167–172.
Филатова Е.Г., Дударев В.И. Оптимизация электрокоагуляционной очистки сточных вод гальванических производств. Иркутск : ИрГТУ, 2013. 140 с.
Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М.: Химия, 1974. 336 с.
Марченко. З. Фотометрическое определение элементов. М.: Мир, 1971. 502 с.
Бабенков Е.Д. Воду очищают коагулянты. М.: Знание, 1983. 64 с.
Бабенков Е.Д. Очистка воды коагулянтами. М.: Наука, 1977. 356 с.
Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. СПб.: Лань, 2004. 336 с.
Физическая химия адсорбционных явлений / А.Ю. Цивадзе, А.И. Русанов, А.А. Фомкин и др. М.: Граница, 2011. 304 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов