Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 240-248
Адсорбция 2,4-дихлорфеноксиуксусной кислоты на мезопористом материале на основе технического углерода
С. А. Кулайшин 1, *, М. Д. Веденяпина 1, Е. А. Райская 2, О. Б. Бельская 2, Ю. Г. Кряжев 2, **
1 ФГБУН Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
2 Центр новых химических технологий ИК СО РАН, Институт катализа СО РАН
644040 Омск, ул. Нефтезаводская, 54, Россия
* E-mail: S.Kulaishin@mail.ru
** E-mail: carbonfibre@yandex.ru
Поступила в редакцию 23.03.2020
После доработки 30.12.2020
Принята к публикации 12.01.2021
Аннотация
Изучена кинетика адсорбции 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) из водной среды на двух микросферических нанопористых углеродных материалах (МНУМ) с различным временем активации в среде водяного пара. Изучено влияние перераспределения пористой структуры, формируемой в ходе активации, на процесс адсорбции. Определен псевдопорядок адсорбции, а также проведено сравнение параметров адсорбционных характеристик с ранее изученными микропорстыми и мезопористыми образцами.
ВВЕДЕНИЕ
Углеродные материалы находят применение как носители катализаторов, самостоятельные катализаторы и как адсорбенты. Разработка новых углеродных материалов необходима для получения образцов, способных выдержать нагрузки технологического цикла, а также обладающих различными порометрическими характеристиками и составом поверхностных групп. С этой целью ведется работа по усовершенствованию углеродного материала “Сибунит”, обладающего сравнительно высокой прочностью в ряду активированных углей [1].
Ранее нами была изучена адсорбция 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) на образце активированного угля из скорлупы кокосового ореха (АУКО) с преобладанием микропор [2], на мезопористых образцах, приготовленных на основе поливинилхлорида (ПВХ) [3] и на основе технического углерода - материал Сибунит [4]. На основании проведенных исследований адсорбционных характеристик материала было показано, что наибольшая адсорбционная емкость (qe, мг/г) присуща образцам с преобладанием микропор. Работы [5–7] также указывают на высокую адсорбционную емкость микропористых углеродных материалов по отношению к 2,4-Д. Однако, данных по адсорбции 2,4-Д на образцах с преобладанием мезопор в литературе недостаточно.
В настоящей работе нами были изучены образцы углеродных материалов с различным объемом мезопор. Были взяты два образца микросферического нанопористого углеродного материала (МНУМ) с различным временем активации образцов водяным паром при 850–900°C (МНУМ-1 и МНУМ-2). Для сравнения характеристик адсорбции и пористой структуры был использован образец Сибунит [4]. В качестве адсорбата был исследован типичный гербицид 2,4-дихлорфеноксиуксусная кислота в водной среде в стационарных условиях. Данный гербицид практически не адсорбируется почвой, поэтому может попадать в сточные воды и является потенциальным токсикантом [8–10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
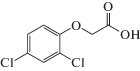
Использовали 2,4-Д фирмы “Sigma-Aldrich Chemie”. Структурная формула 2,4-Д приведена ниже.
Приготовление исследуемых образцов МНУМ-1 и МНУМ-2 проводилось по технологии синтеза материала Сибунит [11]. В качестве основы (темплата) для приготовления данных углеродных материалов был выбран технический углерод (ТУ) марки П-145. Фракция технического углерода марки П-145 с размером частиц 0.5–0.8 мм обрабатывалась пропан-бутановой смесью в диапазоне температур 850–900°C. При этом на поверхности и между гранулами ТУ происходило образование прочного пиролитического углерода. Затем проводилась обработка полученных карбонизованных образцов водяным паром при 850–900°С, в результате которой происходило окисление и удаление частиц темплата и формирование мезопористого, прочного углеродного материала. Образцы МНУМ-1 и МНУМ-2 отличались временем активации в среде водяного пара (H2O, 850–900°C). Для образца МНУМ-2 дополнительное время активации составляло 1.5 ч (H2O, 850°С).
Величину удельной поверхности и пористую структуру образцов определяли на объемной вакуумной статической установке ASAP 2020M “Micromeritics” с использованием низкотемпературной адсорбции азота при 77 K. Текстурные характеристики образцов рассчитывали из изотерм адсорбции – десорбции с применением сервисной DFT-программы “Micromeritics” к прибору ASAP-2020М.
Изучение адсорбции проводили для исходных концентраций гербицида 25–200 мг/л для массы МНУМ-1, МНУМ-2 равной 0.025 г. Для приготовления растворов 2,4-Д использовалась дистиллированная вода. Адсорбцию 2,4-Д на исследуемых образцах проводили в конической колбе объемом 250 мл (объем раствора 100 мл) при постоянном перемешивании на магнитной мешалке (150 об./мин) при комнатной температуре. Перемешивание растворов проводили в первые 6 часов эксперимента, поскольку было установлено, что скорость извлечения 2,4-Д по прошествии 5–6 ч замедлялась, и дальнейшее перемешивание не влияло на ход эксперимента [2]. Концентрацию гербицида во время адсорбции (сt) определяли по отобранным пробам методом УФ-спектроскопии по поглощению при 283 нм на приборе Hitachi U-1900.
Наличие функциональных групп на поверхности МНУМ-1 и МНУМ-2 определяли методом ИК-спектроскопии при помощи ИК-Фурье спектрометра Bruker Alpha. Образец в протертом виде массой 1 мг смешивали с KBr (из монокристалла) и помещали под пресс, затем пластинку с прессованным веществом исследовали на пропускание ИК-излучения.
Структура поверхности углей изучалась методом электронной микроскопии. Оптимизация аналитических измерений проведена в рамках описанного ранее подхода [12]. Перед съемкой образцы помещали на поверхность алюминиевого столика диаметром 25 мм, фиксировали при помощи проводящей липкой ленты. Морфология образцов исследовалась в нативных условиях, чтобы исключить поверхностные эффекты от напыления проводящего слоя [13]. Микроструктуру образцов изучали методом сканирующей электронной микроскопии с полевой эмиссией (FE-SEM) на электронном микроскопе Hitachi SU8000. Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 10 кВ и рабочем расстоянии 8–10 мм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование пористой структуры путем низкотемпературной адсорбции азота позволило определить, что оба исследуемых образца обладают мезопористой структурой, на что указывает большая площадь петли гистерезиса, образуемая на изотермах при десорбции азота (рис. 1) [14]. Определенный методом Баррета–Джойнера–Халенды (BJH) общий объем пор, расположился в следующем порядке убывания: МНУМ-1 > “Сибунит” > МНУМ-2 (табл. 1). При этом площадь удельной поверхности по БЭТ возрастает в ряду: “Сибунит” < МНУМ-1 < МНУМ-2. Содержание микропор для всех образцов по сравнению с мезопорами незначительно.
Рис. 1.
Изотермы адсорбции/десорбции азота: (77 K) ◼ (адсорбции), ⬜ (десорбции) – “Сибунит”,
▲ (адсорбции), △ (десорбции) – МНУМ-1,  (адсорбции),
(адсорбции),  (десорбции) – МНУМ-2.
(десорбции) – МНУМ-2.
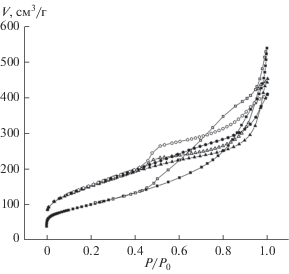
Таблица 1.
Удельная поверхность и структура пор МНУМ-1, МНУМ-2, АУКО и Сибунит определенная методом низкотемпературной адсорбции азота (N2, 77 K)
| Образец | Адсорбционная емкость по 2,4-Д, мг/г |
Площадь поверхности (БЭТ), м2/г | Площадь микропор, м2/г | Общий объем пора, см3/г | Объем микропор, см3/г | Объем мезопор, см3/г | Средний диаметр порб, нм |
|---|---|---|---|---|---|---|---|
| АУКО | 383 | 936.7 | 856.2 | 0.34 | 0.34 | – | 0.76 |
| МНУМ-2 | 232 | 568.8 | 75.9 | 0.64 | 0.03 | 0.61 | 9 |
| МНУМ-1 | 185 | 557.2 | 89.6 | 0.69 | 0.04 | 0.65 | 13 |
| Сибунит | 160 | 373 | 14 | 0.641 | 0.006 | 0.635 | 9.1 |
Сравнение образцов МНУМ-1, МНУМ-2 и микропористого образца активированного угля из скорлупы кокосового ореха (АУКО) показало у последнего более высокую величину площади удельной поверхности, определенную методом БЭТ, и в 10 раз больший объем и площадь микропор. При этом величина адсорбционной емкости 2,4-Д возрастает только в 1.7 раза (232 мг/г для МНУМ-2 и 383 мг/г для АУКО [2] табл. 1). По видимому здесь играет роль различный размер молекул 2,4-Д и азота.
Более высокие значения адсорбционной емкости МНУМ-1 и МНУМ-2 в сравнении с величиной адсорбции Сибунит вызваны сравнительно малым объемом микропор образца Сибунит (0.006 см3/г) относительно большего объема микропор образцов МНУМ-1 (0.04 см3/г) и МНУМ-2 (0.03 см3/г) (табл. 1).
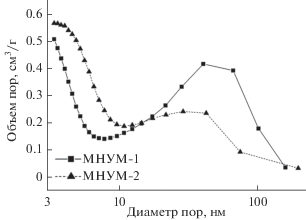
При проведении порометрических исследований было показано, что более продолжительная активация образца МНУМ-2 практически не влияет на величину удельной поверхности образцов (560–570 м2/г), но приводит к заметному перераспределению мезопор по размерам. Из рис. 2 следует, что образцы характеризуются бимодальным распределением, и доля пор размером больше 10 нм для образца МНУМ-1 превышает 70%. Для образца МНУМ-2 наблюдается увеличение доли пор размером менее 10 нм от 30 до 50%.
При анализе положения и формы изотермы адсорбции азота, а также формы петли гистерезиса (рис. 1), для образцов Сибунит, МНУМ-1 и МНУМ-2 определено, что поры этих образцов относятся к щелевидным [15]. Что может приводить к более затрудненному доступу к порам молекул адсорбата.
На рис. 3 показаны микрофотографии поверхности углеродных материалов. Поверхность образцов МНУМ представлена частицами неправильной формы, так же как и частицы образца Сибунит [4]. При этом размеры конгломератов уменьшаются в ряду Сибунит (50–250 нм) > > МНУМ-1 (100–150 нм) > МНУМ-2 (50–150 нм)], что соотносится с размерами исходных частиц, используемых при синтезе [Сибунит (50 нм) и МНУМ (18 нм)]. Размеры пор образцов по данным микрофотографий составили: Сибунит (10–50 нм), МНУМ-1 (10–50 нм), МНУМ-2 (20–70 нм).
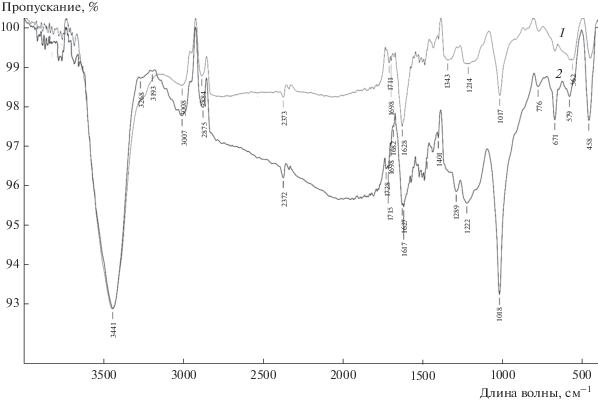
Функциональные группы на поверхности исследуемых образцов определяли исходя из анализа ИК спектров (рис. 4). Согласно литературным данным [16] интенсивные и широкие полосы при 3441 см–1 (МНУМ-1), 3444 см–1 (МНУМ-2) относятся к гидроксильным группам в адсорбированной воде, появление которых связано с использованным методом подготовки образца (прессование таблеток в смеси с KBr). Полосы 3007 см–1 (МНУМ-1), 3008 см–1 (МНУМ-2) характерны для валентных колебаний C–H в алкенах ароматических и малых циклов, 2875 см–1 (МНУМ-1), 2884 см–1 (МНУМ-2) колебания структурных фрагментов алканов, область пиков 2000–1600 см–1 – группа слабых полос ароматических соединений, интенсивные полосы валентных колебаний алкенового фрагмента 1627 см–1 (МНУМ-1), 1628 см–1 (МНУМ-2) обусловлены сопряжением двойной связи с ароматическим ядром. Область пиков 1780–1535 см–1 отвечает валентным колебаниям С=О в кетонах, слабые широкие полосы 1222 см–1 (МНУМ-1), 1214 см–1 (МНУМ-2) деформационные колебания C–H. Полосы 1018 см–1 (МНУМ-1), 1017 см–1 (МНУМ-2) плоскостных колебаний C–H ароматического ядра, 671 см–1 (МНУМ-1) внеплоскостные деформационные колебания в алкенах. Полосы 579 см–1 (МНУМ-1), 458 см–1 (МНУМ-1) характерны для внеплоскостных деформационных колебаний ароматического ядра замещенных бензола.
Наложение спектров, полученных для обоих исследуемых образцов, показало отсутствие изменений в составе для большиинства функциональных групп. Однако отмечается снижение интенсивности для большей части характеристических полос, что указывает на снижение их количества для образца МНУМ-2. Наибольшее снижение интенсивности отмечается для валентных колебаний С=О в кетонах, бензолзамещенных фрагментов. Сопряженная двойная связь ароматического ядра, соответствующая полосам 1627, 1628 см–1, практически не утратила своей интенсивности для образца с более продолжительной активацией. Снижение содержания бензолзамещенных фрагментов выраженных полосами 579, 458 см–1 для образца МНУМ-2, вероятно способствовало π-π “стекинг” взаимодействию электрон дефицитного ароматического ядра и молекул 2,4-Д.
Ранее изученный образец Сибунит практически не обладал поверхностными группами, что связано, по-видимому, с использованием другого исходного сырья для этого образца [4].
Кинетику адсорбции изучали по изменению концентрации раствора 2,4-Д во времени. Величину адсорбции q (масса адсорбированного гербицида, приходящаяся на 1 г адсорбента) рассчитывали по формуле:
Рис. 5.
Кинетика адсорбции 2,4-Д на МНУМ-1 (0.025 г), (а) 7 ч, (б) 400 ч при концентрациях c0 = 25 (1), 50 (2), 100 (3), 150 (4), 200 (5) мг/л.
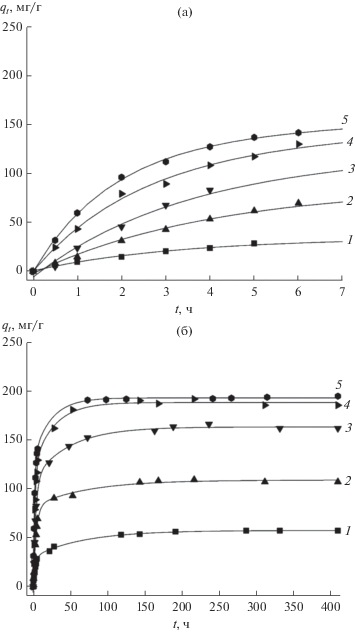
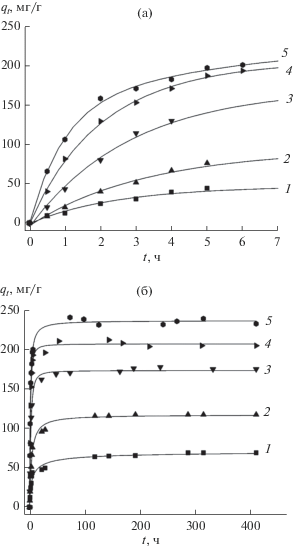
Рис. 6.
Кинетика адсорбции 2,4-Д на МНУМ-2 (0.025 г), (а) 7 ч, (б) 400 ч при концентрациях c0 = 25 (1), 50 (2), 100 (3), 150 (4), 200 (5) мг/л.
Анализ кинетических кривых проводили, предполагая протекание адсорбции по псевдопервому и псевдовторому порядку. Уравнение первого порядка в дифференциальной форме (уравнение Лагергрена [17, 18]):
(1)
${{d{{q}_{t}}} \mathord{\left/ {\vphantom {{d{{q}_{t}}} {~{{d}_{t}}}}} \right. \kern-0em} {~{{d}_{t}}}} = {{k}_{{1~}}}\left( {{{q}_{e}} - {{q}_{t}}} \right),$В такой линейной форме уравнение псевдопервого порядка может быть применено для визуального анализа экспериментальных данных. Однако в интегральной нелинейной форме (2) уравнение псевдопервого порядка позволяет анализировать опытные данные, не прибегая ни к каким специальным преобразованиям:
В дальнейшем все вычисления проводили для нелинейных форм кинетических уравнений. Из уравнения (2) ${{q}_{e}}$ и ${{k}_{1}}$ рассчитывали при помощи функции minerr программы Mathcad-14 [4]. В табл. 2, 3 приведены значения параметров уравнения (1) для пяти значений исходной концентрации 2,4-Д. Высокие значения коэффициентов корреляции указывают на удовлетворительное соответствие уравнения псевдопервого порядка экспериментальным данным.
Таблица 2.
Кинетические параметры адсорбции 2,4-Д на МНУМ-1 для mадс = 0.025 г
| c0, мг/л | Псевдопервый порядок | Псевдовторой порядок | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ${{q}_{e}}$, мг/г | ${{k}_{1}} \times {{10}^{{ - 1}}}$, 1/ч | ${{R}^{2}}$ | ${{q}_{e}}$, мг/г | $b$, ч | ${{k}_{2}} \times {{10}^{{ - 3}}}$, г/(мг ч) | $h,\,\,~{{{\text{мг}}} \mathord{\left/ {\vphantom {{{\text{мг}}} {\left( {{\text{г}}\,{\text{ч}}} \right)}}} \right. \kern-0em} {\left( {{\text{г}}\,{\text{ч}}} \right)}}$ | ${{R}^{2}}$ | Δq, мг/г | |
| 25 | 50 | 1.5 | 0.97 | 55 | 5.7 | 3.2 | 9.6 | 0.989 | 4.6 |
| 50 | 102 | 1.8 | 0.992 | 108 | 4.4 | 2.1 | 24.6 | 0.996 | 5.9 |
| 100 | 154 | 1.8 | 0.989 | 164 | 4.9 | 1.2 | 33.3 | 0.996 | 9.7 |
| 150 | 182 | 2.3 | 0.993 | 190 | 3.2 | 1.7 | 60.2 | 0.998 | 8.1 |
| 200 | 181 | 3.1 | 0.994 | 186 | 2 | 2.7 | 93.3 | 0.998 | 4.2 |
Таблица 3.
Кинетические параметры адсорбции 2,4-Д на МНУМ-2 для mадс = 0.025 г
| c0, мг/л | Псевдопервый порядок | Псевдовторой порядок | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ${{q}_{e}}$, мг/г | ${{k}_{1}} \times {{10}^{{ - 1}}}$, 1/ч | ${{R}^{2}}$ | ${{q}_{e}}$, мг/г | $b$, ч | ${{k}_{2}} \times {{10}^{{ - 3}}}$, г/(мг ч) | $h,\,\,~{{{\text{мг}}} \mathord{\left/ {\vphantom {{{\text{мг}}} {\left( {{\text{г}}\,{\text{ч}}} \right)}}} \right. \kern-0em} {\left( {{\text{г}}\,{\text{ч}}} \right)}}$ | ${{R}^{2}}$ | Δq, мг/г | |
| 25 | 60 | 2.5 | 0.968 | 64 | 3 | 4.8 | 19.9 | 0.983 | 4.1 |
| 50 | 111 | 2.2 | 0.988 | 118 | 4 | 2.3 | 31.9 | 0.995 | 7.3 |
| 100 | 170 | 3.4 | 0.995 | 175 | 2 | 2.7 | 82.3 | 0.99 | 5.6 |
| 150 | 206 | 4.7 | 0.998 | 214 | 1 | 3.6 | 164.6 | 0.989 | 8 |
| 200 | 231 | 4.9 | 0.989 | 238 | 1 | 3.6 | 202.8 | 0.998 | 6.8 |
Была проведена проверка выполнимости уравнения псевдовторого порядка [17]:
(3)
${{d{{q}_{t}}} \mathord{\left/ {\vphantom {{d{{q}_{t}}} {dt}}} \right. \kern-0em} {dt}} = {{k}_{2}}{{\left( {{{q}_{e}} - {{q}_{t}}} \right)}^{2}},$(4)
${{q}_{t}} = {{q_{e}^{2}{{k}_{2}}t} \mathord{\left/ {\vphantom {{q_{e}^{2}{{k}_{2}}t} {\left( {1 + {{k}_{2}}{{q}_{e}}t} \right)}}} \right. \kern-0em} {\left( {1 + {{k}_{2}}{{q}_{e}}t} \right)}}.$Выражение (4) для удобства использования в Mathcad преобразовали в следующее выражение:
В табл. 2, 3 приведены кинетические параметры адсорбции 2,4-Д, рассчитанные для псевдовторого порядка.
Высокие значения коэффициентов корреляции показывают, что и это уравнение может удовлетворительно описывать кинетику процесса. Как и для уравнения псевдопервого порядка расчетные величины ${{q}_{e}}$ увеличиваются с ростом c0. При этом для псевдовторого порядка они оказываются на 5–10 мг/г в случае МНУМ-1 и 4–8 мг/г для МНУМ-2 выше, чем для псевдопервого порядка. С увеличением c0 константы $b$ убывают. Так в случае МНУМ-1 коэффициент корреляции (R2) для уравнения псевдовторого порядка более высокий относительно значений коэффициента корреляции уравнения псевдопервого порядка, поэтому можно говорить о соответствии протекания процесса уравнению псевдовторого порядка. Для образца МНУМ-2 нельзя однозначно определить псевдопорядок адсорбции, так как значение коэффициента корреляции второго порядка выше не при всех концентрациях. С целью уточнения псевдопорядка процесса адсорбции необходимо провести анализ расчетных данных с использованием моделей Ленгмюра, Фрейндлиха и Темкина.
Из параметров уравнения (3) по уравнению (4) были рассчитаны начальные скорости адсорбции 2,4-Д, ${{{\text{мг}}} \mathord{\left/ {\vphantom {{{\text{мг}}} {\left( {{\text{г}}\,{\text{ч}}} \right)}}} \right. \kern-0em} {\left( {{\text{г}}\,{\text{ч}}} \right)}}$ для различных значений c0:
Прослеживается (табл. 2, 3) монотонное увеличение h с ростом c0, что так же подтверждает соответствие уравнения (3) исследуемому процессу. Проведем анализ расчетных данных с использованием моделей Ленгмюра, Фрейндлиха и Темкина. Из величин ${{q}_{e}}$, приведенных в табл. 3, 4, были рассчитаны изотермы адсорбции по трем моделям: Ленгмюра (6), Фрейндлиха (7) и Темкина (8), уравнения которых приведены ниже.
(6)
${{q}_{e}} = {{{{q}_{m}}{{b}_{l}}{{c}_{e}}} \mathord{\left/ {\vphantom {{{{q}_{m}}{{b}_{l}}{{c}_{e}}} {\left( {1 + {{b}_{L}}{{c}_{e}}} \right)}}} \right. \kern-0em} {\left( {1 + {{b}_{L}}{{c}_{e}}} \right)}},$Таблица 4.
Параметры изотерм адсорбции Ленгмюра, Темкина и Фрейндлиха (МНУМ-1)
| Изотерма Ленгмюра | Изотерма Темкина | Изотерма Фрейндлиха | |||
|---|---|---|---|---|---|
| ${{q}_{m}}$, мг/г | 225 | ${{b}_{t}}$, Дж/моль | 277 | ${{K}_{F}}$, л/г | 34.7 |
| ${{b}_{L}}$, л/мг | 0.041 | $A$, л/г | 71.665 | 1/n | 0.351 |
| ${{R}^{2}}$ | 0.997 | ${{R}^{2}}$ | 0.983 | ${{R}^{2}}$ | 0.76 |
Изотерма Фрейндлиха описывается уравнением:
(7)
${{q}_{e}} = {\text{\;}}{{K}_{F}}c_{e}^{{{1 \mathord{\left/ {\vphantom {1 n}} \right. \kern-0em} n}}},$Изотерма Темкина выражается уравнением
(8)
${{q}_{e}} = \left( {{{RT} \mathord{\left/ {\vphantom {{RT} {{{b}_{T}}}}} \right. \kern-0em} {{{b}_{T}}}}} \right)\ln \left( {A{{c}_{e}}} \right),$Анализ изотермы адсорбции 2,4-Д на МНУМ-1, МНУМ-2 также проводили при помощи системы Mathcad. Рассчитанные параметры уравнений (6)–(8) приведены в табл. 4, 5. Из данных таблицы следует, что изотермы образцов МНУМ-1, МНУМ-2 с высокой точностью могут быть описаны изотермами Ленгмюра (6) и Темкина (8) и в меньшей степени изотермой Фрейндлиха (7). Кинетика адсорбции данных образцов соответствует второму порядку, так как расчетные данные для второго порядка имеют наибольшую степень корреляции для рассчитанных уравнений Ленгмюра, Фрейндлиха и Темкина.
Таблица 5.
Параметры изотерм адсорбции Ленгмюра, Темкина и Фрейндлиха (МНУМ-2)
| Изотерма Ленгмюра | Изотерма Темкина | Изотерма Фрейндлиха | |||
|---|---|---|---|---|---|
| ${{q}_{m}}$, мг/г | 268.7 | ${{b}_{t}}$, Дж/моль | 89.7 | ${{K}_{F}}$, л/г | 36.681 |
| ${{b}_{L}}$, л/мг | 0.04 | $A$, л/г | 5.24 | 1/n | 0.38 |
| ${{R}^{2}}$ | 0.996 | ${{R}^{2}}$ | 0.993 | ${{R}^{2}}$ | 0.74 |
По экспериментальным и расчетным данным кинетических зависимостей были построены изотермы адсорбции для образцов МНУМ-1, МНУМ-2, а данные для образца Сибунит приведены из работы [4]. Все изотермы представлены на рис. 7.
Рис. 7.
Изотермы адсорбции 2,4-Д на: (1) Сибунит ( – экспериментальное,
– экспериментальное,  – расчетное), (2) МНУМ-1 (◼ – экспериментальное, ◻ – расчетное), (3) МНУМ-2 (▲ – экспериметнальное, △ – расчетное).
– расчетное), (2) МНУМ-1 (◼ – экспериментальное, ◻ – расчетное), (3) МНУМ-2 (▲ – экспериметнальное, △ – расчетное).
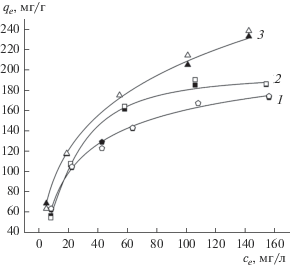
По данным рис. 7 показано, что результаты экспериментальных и расчетных данных второго порядка для всех образцов близки. При проведении анализа изотерм, построенных с использованием экспериментальных данных, отметим, что более продолжительный участок и крутой наклон на изотерме (рис. 7) в области Генри для образцов МНУМ-1, МНУМ-2 относительно изотермы для образца Сибунит позволяет сделать вывод о более высокой степени взаимодействия адсорбированных молекул с поверхностью исследуемых в данной работе адсорбентов [19]. Таким образом, образцы МНУМ оказываются более пригодными для адсорбции 2,4-Д из водной среды по сравнению с образцами Сибунит.
ЗАКЛЮЧЕНИЕ
Дополнительная паровая активация образца мезопористого наноразмерного углеродного материала приводит к перераспределению объема пор в сторону уменьшения мезопор c размером более 10 нм на 70% и увеличения объема мезопор меньше 10 нм на 30–50% (при сохранении величины удельной поверхности), что увеличивает адсорбционную емкость образца МНУМ-2 по отношению к 2,4-Д. Изменение продолжительности активации образцов мезопористого наноразмерного углеродного материала позволяет регулировать соотношение пор.
Список литературы
Плаксин Г.В. // Химия в интересах устойчивого развития. 2001. № 9. С. 609.
Веденяпина М.Д., Шарифуллина Л.Р., Кулайшин С.А. и др. // ХТТ. 2017. № 2. С. 51. [Vedenyapina M.D., Sharifullina L.R., Kulaishin S.A. et al. // Solid Fuel Chem. 2017. V. 51. № 2. P. 115.]
Веденяпина М.Д., Кряжев Ю.Г., Райская С.А. и др. // ХТТ. 2017. № 4. С. 36. [Vedenyapina M.D., Kryazhev Yu.G., Raiskaya E.A. et al. // Solid Fuel Chem. 2017. V. 51. № 4. P. 229.]
Веденяпина М.Д., Шарифуллина Л.Р., Кулайшин С.А. и др. // ХТТ. 2018. № 1. 2018. № 1. С. 55. [Vedenyapina M.D., Sharifullina L.R., Kulaishin S.A. et al. // Solid Fuel Chem. 2018. V. 52. № 1. P. 53.]
Spaltro A., Pila M., Simonetti S., Álvarez-Torrellas S. et al. // Conhyd. 2018. V. 218. P. 84.
Njoku V.O., Foo K.Y., Hameed B.H. // Chem. Eng. 2013.
Kim S.J., Shim W.G., Kim T.Y. // Korean J. Chem. Eng. 2002. 19 (6). P. 967.
Arias-Este´vez M., Lo´pez-Periago E., Martı´nez-Carballo E. et al. // Agr. Ecosyst. Environ. 2008. V. 123 I. 4. P. 247.
Burns C.J., Swaen G.M.H. // Crit. Rev. Toxicol. 2012. V. 42. I. 9. P. 768.
Upadhyaya A.M., Rao M.V., Jhala D.D. // Asian J. Pharm. Clin. Res. 2018. V. 11 I. 1.
Плаксин Г.В., Бакланов О.Н., Лавренов А.В. и др. // ХТТ. 2014. № 6. С. 26. [Plaksin G.V., Baklanova O.N., Lavrenov A.V. et al. // Solid Fuel Chem. 2014. V. 48. № 6. P. 349.]
Качала В.В., Хемчян Л.Л., Кашин А.С.B. и др. // Успехи химии. 2013 г. Т. 82. С. 648. [Kachala V.V., Hemchian L.L., Kashin A.S. et al. // Russ. Chem. Rev. 2013. V. 82. P. 648.]
Кашин А.С., Анаников В.П. // Изв. АН Сер. Хим. 2011. № 12. С. 2551. [Kashin A.S., Ananikov V.P. // Russ. Chem. Bull. Int. Ed. 2011. V. 60. P. 2602.]
Sing K.S.W., Everett D.H., W. Haul R.A. et al. // T. Pure & Appl. Chem. 1985. V. 57. № 4. P. 603.
Sing K.S.W. // Pure & Appl.Chem. 1982. V.54. № 11. P. 2201.
Сильверстейн Р., Ведстер Ф., Кимл Д.. Спектрометрическая идентификация органических соединений Пер. с англ. проф. д.х.н. Сергеева Н.М. и к.х.н. Тарасевича Б.Н. М.: Бином, 2011.
Shahvan. T. // Chem. Eng. Res. and Des. 2015. V. 95. P. 172.
Shahvan. T. // J. Environ. Chem. Eng. . 2014. V. 2. P. 1001.
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. Нск.: Наука, 1999. Гл. 4. С. 470.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов