Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 231-239
Изотермы абсолютной адсорбции для системы псевдокумол + н-октан + цеолит NaX: определение коэффициентов активности для адсорбционной фазы
Э. С. Якубов *
Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: edjakub@mail.ru
Поступила в редакцию 10.05.2020
После доработки 11.10.2020
Принята к публикации 10.01.2021
Аннотация
Изотермы избыточной адсорбции псевдокумола из растворов в н-октане на цеолите NaX измерены при температурах 303.15, 338.15 и 363.15 К с использованием общепринятого статического метода. Предельные (абсолютные) величины адсорбции чистых компонентов измерены пикнометрическим методом. Изотермы абсолютной адсорбции для указанной системы рассчитаны по модифицированному уравнению Дубинина–Радушкевича с тремя неподгоночными параметрами. Данные по абсолютной адсорбции далее используются для оценки средней плотности адсорбата, коэффициентов активности компонентов в адсорбционной фазе и других характеристик адсорбционной фазы.
ВВЕДЕНИЕ
В нашей предыдущей статье [1] мы изучали адсорбционную систему кумол + н-октан + цеолит NaX. В настоящей работе представлены экспериментальные данные по избыточной адсорбции и рассчитанные изотермы абсолютной адсорбции для системы псевдокумол + н-октан + цеолит NaX при 303.15, 338.15 и 363.15 К. На основании изотерм абсолютной адсорбции были определены основные термодинамические характеристики адсорбированного раствора, а именно коэффициенты активности, избыточные термодинамические функции смешения, избыточный объем смешения и средняя плотность.
РАСЧЕТНАЯ СХЕМА
Для расчета изотермы абсолютной адсорбции мы использовали следующее уравнение [1]
(1)
${{n}^{s}} = n_{{m2}}^{s} + (n_{{m1}}^{s} - n_{{m2}}^{s})\exp ( - k{{\left| {\ln {{x}_{1}}} \right|}^{n}}),$Здесь через ${{x}_{{1m}}}$ обозначена концентрация, соответствующая максимальной избыточной адсорбции. Используя хорошо известное соотношение (4), связывающее избыточную адсорбцию $n_{1}^{e}$ с абсолютной адсорбцией раствора ${{n}^{s}}$ и составом адсорбционной фазы $x_{1}^{s}$
мы можем вычислить изотермы абсолютной адсорбции для предпочтительно адсорбируемого компонента 1, $n_{1}^{s}$.Таким образом, на основе величин предельной адсорбции для чистых компонентов $n_{{m1}}^{s}$ и $n_{{m2}}^{s}$ (измеряемые в отдельном эксперименте) и концентрации ${{x}_{{1m}}}$, определяемой из изотермы избыточной адсорбции $n_{1}^{e}$, можно рассчитать константы $k$ и $n$ по формулам (2) и (3), абсолютную адсорбцию бинарного раствора ${{n}^{s}}$ по формуле (1) и, наконец, изотерму абсолютной адсорбции $n_{1}^{s}$ по уравнению (4).
Изотермы абсолютной адсорбции $n_{1}^{s}$ и ${{n}^{s}}$ позволяют нам определить избыточный объем смешения адсорбированного раствора ${{V}^{{Es}}}$ согласно следующей формуле
(5)
${{V}^{{Es}}} = \left( {\frac{{{{W}_{0}}}}{{{{n}^{s}}}}} \right)\left[ {1 - \left( {\frac{{n_{1}^{s}}}{{n_{{m1}}^{s}}} + \frac{{n_{2}^{s}}}{{n_{{m2}}^{s}}}} \right)} \right],$где W0 – объем микропор (в см3/г). Кроме того, мы можем рассчитать плотность адсорбционного раствора ${{\rho }^{s}}$ (в ммоль/см3) по следующему соотношению
Основываясь на изотермах абсолютной адсорбции, мы можем далее вычислить коэффициенты активности компонентов адсорбционной фазы $\gamma _{i}^{s}$ по хорошо известной формуле
(7)
$\ln \gamma _{i}^{s} = \ln ({{{{x}_{i}}{{\gamma }_{i}}} \mathord{\left/ {\vphantom {{{{x}_{i}}{{\gamma }_{i}}} {x_{i}^{s}}}} \right. \kern-0em} {x_{i}^{s}}}) - ({1 \mathord{\left/ {\vphantom {1 {RT}}} \right. \kern-0em} {RT}})\int\limits_{{{\Phi }_{i}}}^\Phi {({{\bar {v}_{{mi}}^{s}} \mathord{\left/ {\vphantom {{\bar {v}_{{mi}}^{s}} {{{W}_{0}}}}} \right. \kern-0em} {{{W}_{0}}}})} d\Phi ,$(8)
$\Delta \Phi = \Phi - {{\Phi }_{2}} = RT\int\limits_0^{{{x}_{1}}{{\gamma }_{1}}} {({{n_{1}^{e}} \mathord{\left/ {\vphantom {{n_{1}^{e}} {{{x}_{2}}{{x}_{1}}{{\gamma }_{1}}}}} \right. \kern-0em} {{{x}_{2}}{{x}_{1}}{{\gamma }_{1}}}})d({{x}_{1}}{{\gamma }_{1}})} .$Здесь нижний предел интегрирования соответствует состоянию, когда сорбент погружен в чистый компонент 2.
Зная $\gamma _{i}^{s}$, можно рассчитать для адсорбционного раствора избыточную свободную энергию смешения ${{g}^{{Es}}}$, энтропию смешения ${{s}^{{Es}}}$ и энтальпию смешения ${{h}^{{Es}}}$по формулам
(10)
${{s}^{{Es}}} = - {{({{\partial {{g}^{{Es}}}} \mathord{\left/ {\vphantom {{\partial {{g}^{{Es}}}} {\partial T}}} \right. \kern-0em} {\partial T}})}_{{x_{i}^{S}}}},$(11)
${{h}^{{Es}}} = {{g}^{{Es}}} - T{{({{\partial {{g}^{{Es}}}} \mathord{\left/ {\vphantom {{\partial {{g}^{{Es}}}} {\partial T}}} \right. \kern-0em} {\partial T}})}_{{x_{i}^{S}}}}.$Кроме того, представляется возможным оценить изотермический коэффициент сжимаемости адсорбционной фазы по формуле [2]
(12)
$\beta _{T}^{s} = {{{{V}^{{Es}}}(1 + {{\alpha }^{s}}T)} \mathord{\left/ {\vphantom {{{{V}^{{Es}}}(1 + {{\alpha }^{s}}T)} {{{h}^{{Es}}}}}} \right. \kern-0em} {{{h}^{{Es}}}}}.$Здесь ${{\alpha }^{s}}$ – коэффициент объемного расширения адсорбционного раствора, определяемый выражением
(13)
${{\alpha }^{s}} = {{{{{({{\partial v_{m}^{s}} \mathord{\left/ {\vphantom {{\partial v_{m}^{s}} {\partial T}}} \right. \kern-0em} {\partial T}})}}_{p}}} \mathord{\left/ {\vphantom {{{{{({{\partial v_{m}^{s}} \mathord{\left/ {\vphantom {{\partial v_{m}^{s}} {\partial T}}} \right. \kern-0em} {\partial T}})}}_{p}}} {v_{{m{\kern 1pt} {\kern 1pt} }}^{s}}}} \right. \kern-0em} {v_{{m{\kern 1pt} {\kern 1pt} }}^{s}}}.$ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве адсорбента использовали исходный коммерческий цеолит NaX (ГОБ – партия 21) производства ВНИИНП (г. Н. Новгород). Цеолит активировали нагреванием при 450°C в течение 8–10 ч в вакууме. Псевдокумол и н-октан квалификации “ч. д. а.” перед использованием сушили цеолитом NaA.
Изотермы избыточной адсорбции измеряли по модифицированному статическому методу [3]. Основным преимуществом этого метода является то, что эксперимент можно проводить на одном образце адсорбента во всей области концентраций без доступа воздуха. Равновесная концентрация в массовых долях предпочтительно адсорбируемого компонента измеряли на дифференциальном рефрактометре, кюветы которого образуют один узел с адсорбционной камерой.
Предельные величины адсорбции измеряли пикнометрическим методом [4, 5].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изотермы избыточной адсорбции $n_{1}^{e}$ (в ммоль/г) для системы псевдокумол + н-октан + NaX были измерены при трех температурах: 303.15, 338.15 и 363.15 K. Численные данные представлены в табл. 1. Экспериментальные результаты для 303.15 K показаны также на рис. 1 как функция квадратного корня концентрации псевдокумола $\sqrt {{{x}_{1}}} $, где ${{x}_{1}}$ – мольная доля. Данные представлены в этой форме для удобства восприятия, так как в начальной области концентраций кривые очень крутые. Предельные абсолютные значения адсорбции чистых компонентов $n_{{m1}}^{s}$ и $n_{{m2}}^{s}$ при трех температурах представлены в табл. 2.
Таблица 1.
Изотермы избыточной адсорбции для системы псевдокумол (компонент 1) + н-октан + NaX (${{x}_{1}}$, мольная доля; $n_{1}^{e}$, ммоль/г)
| 303.15 K | 338.15 K | 363.15 K | |||
|---|---|---|---|---|---|
| ${{x}_{1}}$ | $n_{1}^{e}$ | ${{x}_{1}}$ | $n_{1}^{e}$ | ${{x}_{1}}$ | $n_{1}^{e}$ |
| 0 | 0 | 0 | 0 | 0 | 0 |
| 0.001515 | 1.23348 | 0.000071 | 0.37616 | 0.000134 | 0.37391 |
| 0.005303 | 1.47083 | 0.000250 | 0.58525 | 0.000580 | 0.88754 |
| 0.012304 | 1.52415 | 0.002736 | 1.18721 | 0.003610 | 1.15414 |
| 0.019976 | 1.60722 | 0.007672 | 1.38020 | 0.009076 | 1.26468 |
| 0.028532 | 1.64968 | 0.014375 | 1.44422 | 0.016160 | 1.37532 |
| 0.039791 | 1.64523 | 0.022344 | 1.51504 | 0.024345 | 1.43705 |
| 0.052664 | 1.66870 | 0.042145 | 1.55146 | 0.033647 | 1.44850 |
| 0.067465 | 1.66464 | 0.069852 | 1.56681 | 0.044070 | 1.47489 |
| 0.087086 | 1.64511 | 0.089381 | 1.54910 | 0.057675 | 1.46651 |
| 0.106983 | 1.57561 | 0.108741 | 1.50053 | 0.072448 | 1.46046 |
| 0.182539 | 1.48253 | 0.184124 | 1.39887 | 0.091270 | 1.47008 |
| 0.265892 | 1.33033 | 0.267557 | 1.25736 | 0.110292 | 1.43438 |
| 0.370961 | 1.13382 | 0.372662 | 1.06844 | 0.185794 | 1.3228 |
| 1 | 0 | 1 | 0 | 1 | 0 |
Рис. 1.
Изотерма избыточной адсорбции $n_{1}^{e}$ (ммоль/г) как функция $\sqrt {{{x}_{1}}} $(${{x}_{1}}$ – мольная доля) исследованной адсорбционной системы при 303.15 K.
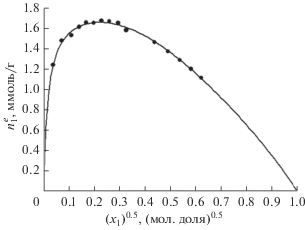
Таблица 2.
Предельные (абсолютные) значения адсорбции чистых псевдокумола (компонент 1) и н-октана в цеолите NaX
| T, K | $n_{{m1}}^{s}$, ммоль/г | $n_{{m2}}^{s}$, ммоль/г |
|---|---|---|
| 303.15 | 2.056 | 1.602 |
| 338.15 | 1.956 | 1.545 |
| 363.15 | 1.867 | 1.505 |
Основываясь на этих экспериментальных данных, мы далее рассчитали изотермы абсолютной адсорбции по уравнениям (1), (2) и (3).
Рассмотрим нашу адсорбционную систему при температуре 303.15 K более подробно. Прежде всего, исходная избыточная изотерма адсорбции сглаживалась, затем численным дифференцированием $n_{1}^{e}$ по ${{x}_{1}}$ находилась ее производная. Приравняв последнюю к нулю определялась концентрация ${{x}_{{1m}}}$, при которой $n_{1}^{e}$ достигает максимального значения. Численное значение искомой концентрации составляет ${{x}_{{1m}}}$ = 0.049294, а соответствующая максимальная избыточная адсорбция равна $n_{{1m}}^{e}$ = 1.65246. Далее по формулам (2) и (3) вычислялись константы n и k: n = 3.087328; k = = 1.68366 × 10–3. Как можно видеть из табл. 2, предельные адсорбции для псевдокумола и н-октана принимают следующие значения $n_{{m1}}^{s}$ = 2.056 ммоль/г и $n_{{m2}}^{s}$ = 1.602 ммоль/г. Используя эти данные, мы рассчитали изотерму абсолютной адсорбции ${{n}^{s}}({{x}_{1}})$ по формуле (1) и изотерму абсолютной адсорбции предпочтительно адсорбируемого компонента $n_{1}^{s}$ по формуле (4). Следует отметить, что в формуле (4) мы использовали фиттированные (сглаженные) значения $n_{1}^{e}$. Все рассчитанные величины сведены в табл. 3.
Таблица 3.
Изотерма избыточной адсорбции $n_{1}^{e}$ (сглаженные значения), изотерма абсолютной адсорбции раствора ${{n}^{s}}$, изотерма абсолютной (индивидуальной) адсорбции $n_{1}^{s}$ и равновесная концентрация компонента 1 в адсорбционной фазе $x_{1}^{s}$ при 303.15 К для системы псевдокумол + н-октан + NaX
| ${{x}_{1}}$, мольная доля | $n_{1}^{e}$, ммоль/г (сглаж) | ${{n}^{s}}$, ммоль/г | $n_{1}^{s}$, ммоль/г | $x_{1}^{s}$, мольная доля |
|---|---|---|---|---|
| 0 0.001515 0.005303 0.012304 0.019976 0.028532 0.039791 0.052664 0.067465 0.087086 0.106983 0.191973 0.240570 0.289411 0.338501 0.387837 0.487265 0.587712 0.689192 0.791724 0.895321 1 |
0 1.23220 1.45404 1.56446 1.61129 1.63604 1.64971 1.65218 1.64554 1.62770 1.60321 1.46584 1.37740 1.28635 1.19439 1.10247 0.92028 0.74070 0.56235 0.38239 0.19680 0 |
1.602 1.86591 1.94518 1.98772 2.00722 2.01916 2.02849 2.03507 2.03995 2.04414 2.04694 2.05242 2.05373 2.05452 2.05502 2.05535 2.05572 2.05589 2.05596 2.05599 2.056 2.056 |
0 1.23503 1.46436 1.58892 1.65181 1.69365 1.73043 1.75935 1.78317 1.80572 1.82220 1.85985 1.87147 1.88095 1.89002 1.89961 1.92196 1.94897 1.97930 2.01017 2.03758 2.056 |
0 0.661892 0.752815 0.799368 0.822934 0.838789 0.853063 0.864516 0.874124 0.883364 0.890207 0.906174 0.911254 0.915518 0.919709 0.924227 0.934933 0.947993 0.962713 0.977714 0.991041 1 |
Далее полученные результаты были проверены на обоснованность допущений, лежащих в основе вывода основного уравнения (1), а именно следующие производные
(14)
${{\left( {\frac{{dn_{1}^{s}}}{{d{{x}_{1}}}}} \right)}_{{{{x}_{1}} = {{x}_{{1m}}}}}} = n_{{m1}}^{s},$(15)
${{\left( {\frac{{d{{n}^{s}}}}{{d{{x}_{1}}}}} \right)}_{{{{x}_{1}} = {{x}_{{1m}}}}}} = n_{{m1}}^{s} - n_{{m2}}^{s}.$Было найдено, что производная функции $n_{1}^{s} = {{f}_{1}}(\sqrt {{{x}_{1}}} )$ в точке $\sqrt {{{x}_{{1m}}}} $ равна 0.91527. Отсюда
Отклонение расчетного значения от экспериментального, выраженное относительной ошибкой в процентах δ, составило
Аналогично, производная функции ${{n}^{s}} = {{f}_{2}}\left( {\sqrt {{{x}_{1}}} } \right)$ в точке $\sqrt {{{x}_{{1m}}}} $ равна 0.201956. Отсюда
В этом случае относительная ошибка $\delta \left( {n_{{m1}}^{s} - n_{{m2}}^{s}} \right)$ не превосходит 0.18%. Таким образом, в обоих случаях значение ошибки меньше, чем 0.3%, что вполне приемлемо.
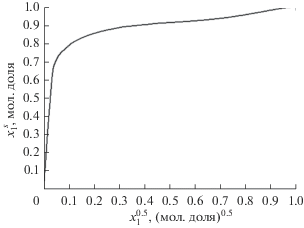
Следующий шаг – расчет концентрации компонента 1 в адсорбционной фазе $x_{1}^{s}$ путем деления $n_{1}^{s}$ на ${{n}^{s}}$. На рис. 2 представлена зависимость состава адсорбционной фазы от равновесной концентрации объемного раствора $\sqrt {{{x}_{1}}} $.
Рис. 2.
Изотерма состава адсорбированного раствора $x_{1}^{s}$ как функция $\sqrt {{{x}_{1}}} $ (${{x}_{1}}$ – мольная доля) для исследованной адсорбционной системы при 303.15 K.
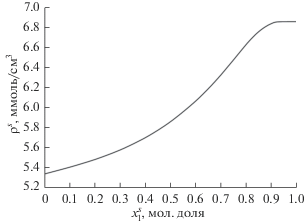
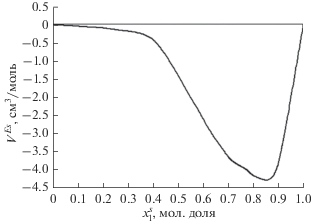
Далее по уравнению (5) был рассчитан избыточный объем смешения адсорбированного раствора ${{V}^{{Es}}}$. Эта величина как функция $x_{1}^{s}$ представлена на рис. 3. Кроме того, была рассчитана плотность адсорбированного раствора по соотноше-нию (6). На рис. 4 приведена концентрационная зависимость ${{\rho }^{s}}$. В этих расчетах для ${{W}_{0}}$ было принято значение 0.3 см3/г [6]. Также следует отметить, что расчет объема микропор W0 по формуле, предложенной в нашей статье [7], дал значение 0.298 cm3/g. Относительное отклонение от значения, даваемое Бреком [6], составляет 0.67%. Эта формула имеет вид:
(16)
${{W}_{0}} = {{(w_{{1m}}^{e}{{\rho }_{{01}}})} \mathord{\left/ {\vphantom {{(w_{{1m}}^{e}{{\rho }_{{01}}})} {[{{\rho }_{{02}}}(1 - {{c}_{{1m}}})({{\rho }_{{01}}} + ({{\rho }_{{01}}} - {{\rho }_{{02}}}){{c}_{{1m}}})]}}} \right. \kern-0em} {[{{\rho }_{{02}}}(1 - {{c}_{{1m}}})({{\rho }_{{01}}} + ({{\rho }_{{01}}} - {{\rho }_{{02}}}){{c}_{{1m}}})]}},$Рис. 3.
Зависимость избыточного объема смешения адсорбированного раствора ${{V}^{{Es}}}$ от состава $x_{1}^{s}$ при 303.15 K.
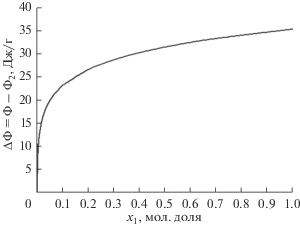
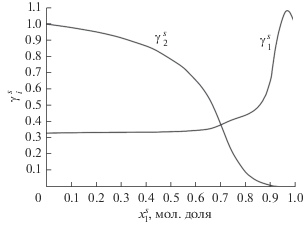
Теперь мы перейдем к расчету коэффициентов активности для адсорбционной фазы по уравнению (7). С этой целью мы, прежде всего, рассчитали мольный объем адсорбционной фазы, а затем парциальный мольный объем и его зависимость от функции Φ. Эта последняя функция, рассчитанная по уравнению (8), представлена на рис. 5. Здесь следует отметить, что поскольку в литературе отсутствуют данные по коэффициенту активности объемной фазы ${{\gamma }_{1}}$, который является частью подынтегральной функции, то мы использовали данные по равновесию пар–жидкость, полученные на основе обобщенной решеточной теории Гугенгейма [8]. Коэффициенты активности адсорбционной фазы $\gamma _{i}^{s}$ как функция концентрации адсорбционной фазы представлены на рис. 6.
Рис. 6.
Коэффициенты активности компонентов адсорбционного раствора исследованной системы при 303.15 K.
Теперь рассмотрим кратко результаты при двух других температурах. Исходные данные для расчета изотерм абсолютной адсорбции представлены ниже:
T = 338.15 K, ${{x}_{{1m}}}$ = 0.049437, $\sqrt {{{x}_{{1m}}}} $ = 0.222343, n = = 3.0845989, k = 1.69876 × 10–3, $n_{{1m}}^{e}$ = 1.56035 ммоль/г;
T = 363.15 K, ${{x}_{{1m}}}$ = 0.056248, $\sqrt {{{x}_{{1m}}}} $ = 0.237168, n = = 2.9629144, k = 2.52572 × 10–3, $n_{{1m}}^{e}$ = 1.46851 ммоль/г.
Используя эти данные, были вычислены изотермы абсолютной адсорбции ${{n}^{s}}({{x}_{1}})$ и индивидуальные изотермы абсолютной адсорбции $n_{1}^{s}({{x}_{1}})$ по уравнениям (1) и (4). Для этих температур были также рассчитаны избыточный объем смешения ${{V}^{{Es}}}$ и плотность ${{\rho }^{s}}$ адсорбированного раствора. Кроме того, была подтверждена обоснованность соотношений (14) и (15), причем относительные ошибки в % составляли не более, чем 0.3.
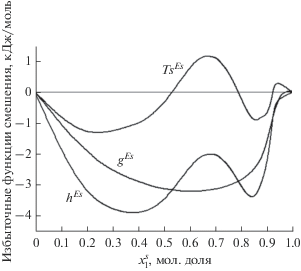
Коэффициенты активности адсорбционной фазы для всех трех температур были рассчитаны по уравнению (7). Результаты суммированы в табл. 4. Далее на основе рассчитанных коэффициентов активности адсорбционной фазы были определены избыточные термодинамические функции смешения для адсорбционной фазы с использованием уравнений (9), (10) и (11). На рис. 7 представлены избыточная энергия Гиббса смешения, избыточная энтропия смешения и избыточная энтальпия смешения при 338.15 К.
Таблица 4.
Коэффициенты активности компонентов адсорбционной фазы для системы псевдокумол + н-октан + NaX при 303.15, 338.15 и 363.15 К, рассчитанные на основе изотерм абсолютной адсорбции
| 303.15 K | 338.15 K | 363.15 K | ||||||
|---|---|---|---|---|---|---|---|---|
| $x_{1}^{s}$, мол. доля | $\gamma _{1}^{s}$ | $\gamma _{2}^{s}$ | $x_{1}^{s}$, мол. доля | $\gamma _{1}^{s}$ | $\gamma _{2}^{s}$ | $x_{1}^{s}$, мол. доля | $\gamma _{1}^{s}$ | $\gamma _{2}^{s}$ |
| 0 | 0.33002 | 1 | 0 | 0.08510 | 1 | 0 | 0.04500 | 1 |
| 0.24712 | 0.33431 | 0.93684 | 0.23756 | 0.13116 | 0.68867 | 0.30945 | 0.16348 | 1.01155 |
| 0.38596 | 0.33547 | 0.87388 | 0.36555 | 0.20931 | 0.52184 | 0.47174 | 0.28400 | 0.72136 |
| 0.53702 | 0.34017 | 0.74931 | 0.64119 | 0.41431 | 0.20542 | 0.66274 | 0.41948 | 0.29279 |
| 0.61794 | 0.34818 | 0.62783 | 0.73780 | 0.49893 | 0.11454 | 0.73798 | 0.48022 | 0.16304 |
| 0.66285 | 0.35819 | 0.52331 | 0.78454 | 0.54814 | 0.07611 | 0.77757 | 0.51696 | 0.10937 |
| 0.75097 | 0.41273 | 0.20744 | 0.81187 | 0.58390 | 0.05577 | 0.80269 | 0.54427 | 0.08148 |
| 0.79613 | 0.43654 | 0.10145 | 0.82948 | 0.61289 | 0.04367 | 0.82097 | 0.56729 | 0.06421 |
| 0.81906 | 0.45254 | 0.06648 | 0.84390 | 0.64208 | 0.03443 | 0.83520 | 0.58836 | 0.05247 |
| 0.83500 | 0.46727 | 0.04874 | 0.85541 | 0.67210 | 0.02753 | 0.84844 | 0.61080 | 0.04267 |
| 0.86084 | 0.50635 | 0.02895 | 0.86409 | 0.69814 | 0.02265 | 0.85886 | 0.63259 | 0.03567 |
| 0.87991 | 0.55505 | 0.01887 | 0.87257 | 0.73007 | 0.01822 | 0.87588 | 0.67974 | 0.02518 |
| 0.90296 | 0.66060 | 0.00863 | 0.87884 | 0.75852 | 0.01522 | 0.89374 | 0.75450 | 0.01479 |
| 0.91261 | 0.75721 | 0.00536 | 0.89569 | 0.87493 | 0.00884 | 0.90532 | 0.85115 | 0.00958 |
| 0.92192 | 0.85211 | 0.00373 | 0.90890 | 1.00153 | 0.00582 | 0.91584 | 0.93804 | 0.00683 |
| 0.93340 | 0.94045 | 0.00280 | 0.92097 | 1.11950 | 0.00424 | 0.92799 | 1.02093 | 0.00523 |
| 0.94721 | 1.01924 | 0.00224 | 1 | 1 | 0.94213 | 1.09405 | 0.00424 | |
| 0.96250 | 1.07599 | 0.00189 | 1 | 1 | ||||
| 1 | 1 | |||||||
Рис. 7.
Избыточные термодинамические функции смешения адсорбционного раствора как функция $x_{1}^{s}$ при 338.15 К.
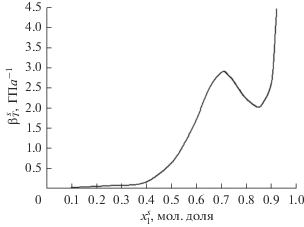
Теперь мы можем оценить изотермический коэффициент сжимаемости адсорбционного раствора по приближенной формуле (12) с использованием соотношений (5), (11) и (13). Отметим, что при выводе соотношения (12) предполагается, что отношение избыточного объема к общему объему компонентов перед их смешением в адсорбционной фазе мало. Концентрационные зависимости коэффициентов объемного расширения и изотермической сжимаемости адсорбционного раствора ${{\alpha }^{s}}$и $\beta _{T}^{s}$ при 338.15 K показаны на рис. 8 и 9.
Рис. 8.
Концентрационная зависимость коэффициента объемного расширения адсорбционного раствора при 338.15 К.
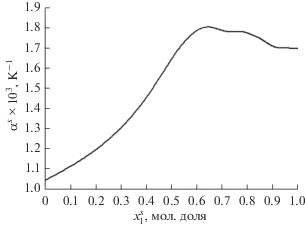
Рис. 9.
Концентрационная зависимость изотермического коэффициента сжимаемости адсорбционного раствора при 338.15 К.
На основе результатов, полученных с использованием экспериментальных изотерм избыточной адсорбции и рассчитанных изотерм абсолютной адсорбции при трех температурах, можно дать следующую предварительную характеристику адсорбционной фазе.
Как следует из рис. 1, измеренные изотермы избыточной адсорбции очень крутые в начальной области концентраций, что указывает на сильную адсорбцию предпочтительно адсорбируемого компонента. Соответственно, изотерма состава, как можно видеть из рис. 2, близка к единице в широкой области концентраций.
Избыточный объем смешения адсорбированной фазы, представленный на рис. 3, проявляет отрицательное отклонение от аддитивности во всей области концентраций, свидетельствующее о сжатии объема. Кроме того, кривая определенно асимметрична с максимумом по абсолютной величине, смещенным в область высоких концентраций псевдокумола.
Как можно видеть из рис. 4, плотность адсорбционного раствора заметно меньше плотности объемного раствора во всей области концентраций. Такое поведение адсорбционного раствора можно приписать неблагоприятному отношению размеров молекул в полостях цеолита.
Важно отметить, что для рассчитанных коэффициентов объемного расширения и изотермической сжимаемости адсорбционной фазы (рис. 8 и 9) были получены разумные для жидкостей значения, причем при увеличении концентрации компонента 1 обе величины росли. Помимо этого, коэффициент сжимаемости адсорбционной фазы приблизительно на порядок больше наблюдаемой для объемной фазы. Это свидетельствует о том, что адсорбционная фаза более “рыхлая”. Поскольку численное значение коэффициента сжимаемости псевдокумола при 338.15 К в литературе отсутствует, этот вывод был сделан путем сравнения с численным значением при комнатной температуре.
Коэффициенты активности компонентов адсорбционной фазы, рассчитанные на основе данных по абсолютной адсорбции, проявляют отрицательное отклонение от идеальности (рис. 6). Отрицательные отклонения свидетельствуют о доминировании межмолекулярных взаимодействий между разнородными молекулами.
Одними из важных характеристик растворов являются избыточные термодинамические функции смешения. Из рис. 7 видно, что избыточные свободная энергия и энтальпия смешения адсорбционного раствора отрицательны во всей области концентраций. В случае объемного раствора это указывает на усиления взаимодействия между различными молекулами. Что касается избыточной энтропии смешения, ее поведение более сложное: кривая имеет как отрицательные, так и положительные участки. Для того чтобы дать одну из возможных интерпретаций, можно провести следующие простые вычисления.
Исходные данные для расчетов следующие:
1. Значения предельной адсорбции для псевдокумола (компонент 1) и н-октана при 338.15 К равны $n_{{m1}}^{s} = 1.956$ ммоль/г и $n_{{m2}}^{s} = 1.545$ ммоль/г соотвественно;
2. Молярная масса компонента 1M1 = 120.192 и молярная масса компонента 2M2 = 114.229;
3. Объем больших α-полостей цеолита NaX составляет ${{V}_{\alpha }} = 828$ Å3 , а число α-полостей в 1 г цеолита NaX равно ${{N}_{\alpha }} = $ 3.60 × 1020 (согласно Бреку [6]);
4. Число Авогадро ${{N}_{{\text{A}}}}$ = 6.02214 × 1020 молекул/ммоль, ${{N}_{{\text{A}}}} = 6.02214 \times {{10}^{{23}}}$ молекул/моль.
Среднее число молекул на одну полость при предельном заполнении компонентом 1 равно
а для компонента 2 $n_{2}^{{\max }}$ равно 2.5845.Вычислим объем, занимаемый одной молекулой в α-полости при предельном заполнении. Он дается выражением
В результате мы имеем ${{v}_{1}}$ = 253.056 Å3 и ${{v}_{2}}$ = = 320.371 Å3. Видно, что эти величины различаются на 26.6%.
Максимум избыточной энтропии смешения мы имеем при составе $x_{1}^{s}$ = 0.664 и $x_{2}^{s}$ = 0.336. $x_{i}^{s}$ определяется как
Подставляя численные значения, мы имеем ${{{{m}_{1}}} \mathord{\left/ {\vphantom {{{{m}_{1}}} {{{m}_{2}}}}} \right. \kern-0em} {{{m}_{2}}}}$ = 2.079.
Отметим, что масса одной молекулы компонента i в граммах равна ${{{{M}_{i}}} \mathord{\left/ {\vphantom {{{{M}_{i}}} {{{N}_{{\text{A}}}}}}} \right. \kern-0em} {{{N}_{{\text{A}}}}}}$. Итак, получаем следующие значения: 1.9958 × 10–22 и 1.8968 × 10–22 для компонентов 1 и 2 соответственно.
Если через ${{n}_{1}}$ и ${{n}_{2}}$ мы обозначим число молекул на одну полость компонентов 1 и 2 соответственно при составе $x_{1}^{s} = 0.664$ и $x_{2}^{s}$ = 0.336, тогда их массы составят: ${{m}_{1}}$ = ${{n}_{1}}$ × 1.9958 × 10–22, ${{m}_{2}} = {{n}_{1}} \times 1.8968 \times {{10}^{{ - 22}}}$, и взяв отношение этих величин ${{{{m}_{1}}} \mathord{\left/ {\vphantom {{{{m}_{1}}} {{{m}_{2}}}}} \right. \kern-0em} {{{m}_{2}}}} = ({{{{n}_{1}}} \mathord{\left/ {\vphantom {{{{n}_{1}}} {{{n}_{2}}}}} \right. \kern-0em} {{{n}_{2}}}}) \times 1.0522$, получим ${{n}_{1}} = {{n}_{2}} \times 1.976$.
Далее найдем ${{n}_{1}}$ и ${{n}_{2}}$ из следующих выражений: ${{v}_{1}}{{n}_{1}} + {{v}_{2}}{{n}_{2}} = {{V}_{\alpha }} = 828$ и ${{n}_{1}} = {{n}_{2}} \times 1.976$. В результате получим ${{n}_{1}} = 1.994 \approx 2$ и ${{n}_{2}} = 1.009 \approx 1$.
Наконец, можно найти число молекул ${{n}_{{0i}}}$ объемной жидкости плотности ${{\rho }_{{0i}}}$ в объеме, равном ${{V}_{\alpha }} = 828$ Å3, по выражению
Подставив численные значения, получим
n01 = 0.86378 × 8.28 × 10–22 × $6.02214\,\, \times $ ${{ \times \,\,{{{10}}^{{23}}}} \mathord{\left/ {\vphantom {{ \times \,\,{{{10}}^{{23}}}} {120.192}}} \right. \kern-0em} {120.192}}$ = 3.58, что больше на 8%, чем в адсорбционной фазе;
n02 = 0.690167 × 8.28 × 10–22 × $6.02214\,\, \times $ ${{ \times \,\,{{{10}}^{{23}}}} \mathord{\left/ {\vphantom {{ \times \,\,{{{10}}^{{23}}}} {114.229}}} \right. \kern-0em} {114.229}}$ = 3.01, что больше на 10% ,чем в адсорбционной фазе.
Таким образом, на основе вышеприведенных расчетов можно заключить, что положительный знак избыточной энтропии смешения адсорбционного раствора в указанной области концентраций связан с тем фактом, что число способов расположения молекул различного размера (26.6%) в адсорбционном растворе оказывается большим, чем число способов расположения молекул в объемном жидком растворе.
ЗАКЛЮЧЕНИЕ
Изотермы избыточной адсорбции псевдокумола из растворов в н-октане на цеолите NaX и абсолютные (предельные) величины адсорбции чистых компонентов были измерены при 303.15, 338.15 и 363.15 К. Изотермы абсолютной адсорбции для указанной системы были рассчитаны по уравнению с тремя неподгоночными параметрами. На основе этих данных были рассчитаны основные физико-химические характеристики адсорбционного раствора. Наиболее значительными являются такие свойства как избыточный объем смешения, плотность, коэффициенты активности компонентов и избыточные термодинамические функции смешения. Также была предпринята попытка приблизительной оценки изотермического коэффициента сжимаемости адсорбционной фазы. Показано, что он отличается на порядок от значения для объемной фазы.
Полученные результаты показывают, что данные по абсолютной адсорбции дают дополнительную информацию об адсорбционной фазе и позволяют лучше понять ее свойства.
Список литературы
Якубов Э.С. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 3. С. 273–281.
Шахпаронов М.И. // Введение в молекулярную теорию растворов. М.: ГИТТЛ. 1956. С. 299.
Якубов Э.С. // Дис. … канд. хим. наук. М.: ИФХ РАН. 2001.
Якубов Э.С. // Сорбционные и хроматографические процессы. 2017. Т. 17. № 4. С. 564.
Рахмуков Б.Х., Селиверстова И.И., Серпинский В.В., Фомкин А.А. // Изв. АН СССР. Сер. хим. 1979. Т. 28. № 11. С. 2419.
Брек Д. // Цеолитовые молекулярные сита. М.: Мир, 1976. С. 440.
Якубов Э.С., Якубов Т.С., Ларионов О.Г. // Коллоидный журнал. 2007. Т. 69. № 5. С. 714.
Кутьин А.М., Зорин А.Д. // Журн. физ. химии. 1984. Т. 58. № 3. С. 596.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов