Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 295-303
Синтез в обратных мицеллах биметаллических наночастиц PdNi и нанокомпозитов на их основе
М. О. Сергеев 1, *, А. А. Ревина 1, 2, О. В. Суворова 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: mihail-ol-sergeev@yandex.ru
Поступила в редакцию 12.10.2020
После доработки 22.12.2020
Принята к публикации 12.01.2021
Аннотация
В работе представлены результаты синтеза биметаллических наночастиц (НЧ) на основе переходных металлов Pd, Ni, Fe, восстановленных кверцетином в обратномицеллярном растворе (ОМР) Н2О/AOT/изооктан. Методом флуоресцентной спектроскопии показана возможность формирования биметаллической структуры НЧ PdядрNiобол, в спектрах плазмонного резонанса которых в диапазонах длин волн, характерных для НЧ монометаллов, выявлено синергетическое усиление оптического поглощения. Исследование процесса адсорбции биметаллических НЧ на поверхность гамма-оксида алюминия доказало преимущество палладий-содержащих частиц со структурой Feядро/Pdобл, полученной в результате целенаправленного восстановления в ОМР на поверхности крупных НЧ Fe атомов палладия, проявившееся в повышении эффективности адсорбции такой структуры за счет более прочного связывания с поверхностью носителя. Использование данного приема позволяет уменьшить количество дорогостоящего металла при производстве палладиевых нанокомпозитов, существенно снижая производственные затраты.
ВВЕДЕНИЕ
За последнее десятилетие были разработаны различные методы синтеза биметаллических наночастиц и изучены их свойства. Биметаллические НЧ находят широкое применение в фотохимических, электрохимических и каталитических процессах [1, 2]. Повышение характеристик фотохимических процессов связано с наличием локализованных поверхностных плазмонов у НЧ и их влиянием на оптические и электрооптические свойства других веществ, что позволяет их применять в фотоэлектрохимических ячейках. Повышение эксплуатационных характеристик сенсорных устройств основано на особых электрохимических свойствах и энергетических характеристиках НЧ. Использование биметаллических НЧ помогает сократить расход дорогостоящего металла в катализаторах, повысить их стабильность работы, а также усилить каталитическую активность, обусловленную синергетическим эффектом [3].
В данной работе в качестве основного металла был выбран Ni, обладающий хорошей способностью к разрыву С–С и С–Н связей, а в качестве синергетической добавки благородный металл Pd, играющий важную роль в каталитических процессах с участием водорода и позволяющий уменьшить деактивацию основного металла. Немаловажной проблемой также является эффективность методов синтеза соответствующих нанокомпозитов, повышение которой снижает затраты на извлечение дорогостоящих металлов из использованных растворов и их дальнейшую переработку.
Целью данной работы является разработка эффективного синтеза биметаллических НЧ PdNi и нанокомпозитов на их основе, которые могут быть потенциально использованы в топливных ячейках конверсии этанола [4], а также в процессах дегидрирования углеводородов. Также рассматривается возможность использования крупных НЧ Fe как транспортных частиц для НЧ палладия в виде биметалла Feядро/Pdобл в процессах адсорбционного синтеза нанокомпозитов. Данный выбор обусловлен дешевизной металла и легкостью вытравливания железа после нанесения при необходимости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использовались соли никеля NiCl2 · 6H2O, (ч. д. а., 98 мас. %, Химреактив), палладия PdCl2 (99.9 мас. %, Aldrich), железа FeSO4 · (NH4)2SO4 · 6H2O (х. ч.), дигидрат кверцетина C15H10O7 · 2H2O (Qr) (98 мас. %, Merck), бис(2-этилгексил)сульфосукцинат натрия C20H37NaO7S (АОТ) (96 мас. %, Acros organics), изооктан (99.95 мас. %, Эталонный-1, Компонент-реактив), н-гептан (х. ч.), дистиллированная вода и γ-Al2O3 (порошок) как основа для нанокомпозитов. Все реагенты использованы без дополнительной очистки.
Химический синтез наночастиц металлов в обратных мицеллах. Синтез НЧ металлов [5] проводился в соответствии с методикой [6] в базовом обратномицеллярном растворе 0.15 моль дм–3 AOT в изооктане в присутствии 150 мкмоль дм–3 Qr и молекулярного кислорода. Коэффициент солюбилизации (ω) (1) для обратномицеллярных растворов (ОМР) составлял 5.0, в случае НЧ FePd – 8.7.
(1)
$\omega = \frac{{\left[ {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]}}{{\left[ {{\text{AOT}}} \right]}}.$Концентрации солей и мольное отношение металлов (M1/M2) в ОМР приведены в табл. 1.
Таблица 1.
Содержание ионов металлов в обратномицеллярных системах
| Образец | ω | Концентрация металла в водном пуле, моль дм–3 | Концентрация металла в ОМР, мкмоль дм–3 | Концентрация ионов металла в ОМР, мг дм–3 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Pd2+ | Fe2+ | Ni2+ | Pd2+ | Fe2+ | Ni2+ | Pd2+ | Fe2+ | Ni2+ | ||
| НЧ Pd ОМР | 5 | 0.015 | – | – | 202 | – | – | 21.55 | – | – |
| НЧ Ni ОМР | 5 | – | – | 0.015 | – | – | 202 | – | – | 11.89 |
| НЧ Fe ОМР | 5 | – | 0.300 | – | – | 4050 | – | – | 226.2 | – |
| НЧ PdNi ОМР | 5 | 0.0075 | – | 0.0075 | 101 | – | 101 | 10.78 | – | 5.94 |
| НЧ Fe/Pd ОМР | 8.7 | 0.0064 | 0.172 | – | 150 | 4010 | – | 15.80 | 224.0 | – |
Концентрация ионов металлов в водном пуле мицеллы ($c_{{{{M}_{i}}}}^{{{\text{в}}{\text{.п}}.}}$) в начале синтеза монометаллических наночастиц составляла 0.015 моль дм–3, биметаллических PdNi – по 0.0075 моль дм–3 каждого металла, FePd: железа – 0.172 моль дм–3, палладия – 0.0064 моль дм–3. Данные концентрации рассчитывалась по уравнению:
(2)
$c_{{{{M}_{i}}}}^{{{\text{в}}{\text{.п}}{\text{.}}}} = \frac{{{{с}_{{{{M}_{i}}}}}{{x}_{i}}{{v}_{i}}}}{{{{v}_{1}} + {{v}_{2}}}},$${{x}_{i}}$ – число атомов металла в эмпирической формуле соли соответствующего i-ого металла (для использованных солей ${{x}_{i}}$ = 1);
${{v}_{i}}$ – объем водного раствора i-той соли, добавленного в базовый ОМР, дм3. В знаменателе стоит суммарный объем воды в ОМР.
При синтезе биметаллических НЧ PdNi соотношения металлов составляло 1 : 1 (моль), для НЧ Fe/Pd – 27 : 1 (моль).
Количества ионов металлов, приходящихся на объем ОМР, рассчитывались по уравнению:
где V – объем обратномицеллярного раствора, дм3, а остальные параметры такие, как и в уравнении (2).Мольные концентрации ионов металлов в ОМР (3) [Ni]омр и [Pd]омр при получении монометаллических НЧ были равны 202 мкмоль дм–3, в случае биметаллических НЧ PdNi – по 101 мкмоль дм–3, для НЧ Fe/Pd – концентрация [Fe]омр = 4010 мкмоль дм–3, а [Pd]омр = 150 мкмоль дм–3.
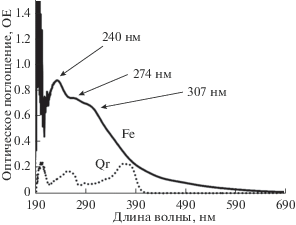
Биметаллические НЧ PdNi готовились методом совместного восстановления ионов металлов в ОМР при одновременном смешивании солей никеля и палладия (1 : 1 по молям) с ожидаемой внутренней структурой типа “сплав”. Наночастицы Fe/Pd со структурой ядро/оболочка FeядрPdобол получены добавлением 10 мкл водного раствора соли палладия концентрации 0.015 М к 1 мл ОМР со стабильными (более 25 мес.) НЧ Fe ω = 5.0, полученными из водного раствора соли железа с концентрацией 0.3 М. Характерный для НЧ Fe спектр оптического поглощения (рис. 1) имеет пики при λ ~ 240, ~274 и 307 нм.
Температура окружающей среды во время синтеза и инструментальных измерений находилась в интервале 20–25°С. Процесс осуществлялся на воздухе в конических колбах на 25 см3 с притертыми пробками из стекла марки ТС, а для НЧ Fe/Pd – в полипропиленовой микроцентрифужной пробирке типа Eppendorf объемом 1.5 мл.
Приготовление нанокомпозитов. НЧ металлов наносились на поверхность носителя γ-Al2O3 из ОМР методом “пропитки”. Для приготовления каждого нанокомпозита бралось по 3 мл каждого ОМР на 1.00 г γ-Al2O3, для НЧ Fe/Pd – 1 мл на 0.50 г оксида алюминия. Время адсорбции наночастиц составляло 90 мин, а для НЧ Fe/Pd – 5 сут.
Для удаления остатков органики после адсорбции образцы нанокомпозитов трехкратно промывались н-гептаном (по 1 мл) и высушивались на воздухе в течение 24 ч.
Приборы и инструменты. Процессы образования наночастиц при синтезе и их адсорбции на носитель контролировались методом электронной абсорбционной спектрофотометрии при использовании прибора Hitachi U-3310 в диапазоне длин волн 190–800 нм и кварцевых кювет с длиной оптического пути 1 мм. Сканирование проводилось от длинных волн к коротким. В качестве образца сравнения использовался раствор 0.15 моль дм–3 AOT в изооктане. Параметром, характеризующим интенсивность прошедшего пучка света через раствор, было выбрано оптическое поглощение (ОП) вместо ослабления, так как для данных образцов рассеянием света можно пренебречь, а влияние на форму спектра, вызываемое флуоресценцией образца, исключалось сканированием спектра от длинных волн к коротким.
Синтез НЧ также контролировался методом флуоресцентной спектроскопии при использовании прибора Hitachi F-7000. Спектры испускания снимались в режиме сканирования по длинам волн при возбуждении образца электромагнитным излучением с длиной волны 255 нм. Сканирование проводилось в диапазоне от 250 до 600 нм со скоростью развертки 1200 нм/мин и шагом сбора данных 1 нм. Ширины спектральных щелей для потоков возбуждения и испускания составляли по 5 нм. Спектр испускания регистрировался под углом 90° к пучку возбуждения. Напряжение на фотоэлектронном умножителе составляло 700 В, постоянная отклика 0.5 с. Спектры сняты без коррекции линейных характеристик источника возбуждения и системы детектирования. Для устранения в записываемых спектрах пика рэлеевского рассеяния, а также его второй гармоники, на линии пучка испускания устанавливался фильтр UV-29 с границей отсечения ультрафиолетового диапазона ~290 нм. Образец помещался в кварцевую кювету из синтетического (нефлулоресцирующего) кварца с внутренней шириной 10 мм.
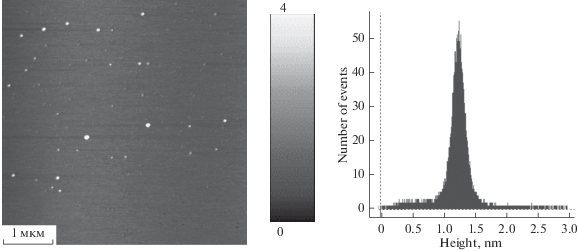
Размеры НЧ определялись методом атомно-силовой микроскопии (АСМ) с использованием прибора MultiMode (Bruker) с кремниевыми кантилеверами NSG-01 (NT-MDT) в полуконтактном режиме. Разрешение по высоте составляло ±0.1 нм, по латерали – ±12 нм. Растворы НЧ наносились на подложку атомарно гладкого слоя слюды. После чего высушивались на воздухе, промывались водой и сушились повторно. Перед измерением образцы оставляли в помещении атомно-силового микроскопа для выравнивания их температур, что исключало искажения результатов, вызываемые температурным дрейфом. Обработка изображений осуществлялась в ПО WSxM 5.0 [7 ]. За размер частиц принималась их высота (Z-параметр).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез наночастиц металлов. Электронная спектрофотометрия
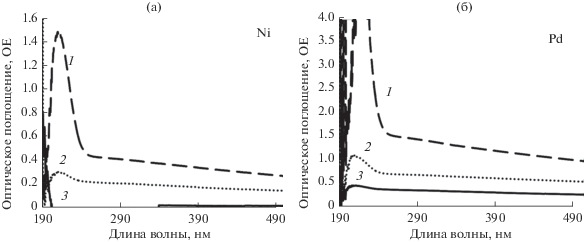
На рис. 2 представлены спектры НЧ Pd (а), Ni (б), PdNi (в) и Fe/Pd (г) с исходным спектром кверцетина (Qr). Образование наночастиц палладия характеризуется падением интенсивности поглощения в области 218 нм в первые 60 мин, после чего происходит ее рост в течение последующих 7 дн.; на 67 день синтеза также отмечаются изменения спектра особенно в длинноволновой его части, что говорит о наличии продолжительных изменений в выбранной системе синтеза. Наночастицы Pd (рис. 2а) характеризуются пиками с максимумами λ ~ 220, ~272 и ~327 нм, что согласуется с ранее полученными данными для НЧ Pd, синтезированных радиационно-химическим способом [8–10], а также теоретическими расчетами и данными, полученных другими методами [11–13]. Как и НЧ палладия, НЧ Ni (рис. 2б) характеризуются поглощением в УФ-области 210–220 нм [14], обусловленным поверхностным плазмонным резонансом, но имеет несколько большую ширину пика, что связано с наличием второго близко расположенного, но менее интенсивного пика. Следует обратить внимание на то, что в отличие от НЧ палладия, НЧ Ni формируются иначе: на это указывает остаточное содержание кверцетина в ОМР с НЧ металла на 7-е сутки после начала химического синтеза с характерными пиками в области 365–390 нм, соответствующими поглощению B-кольца циннамоильной системы кверцетина. Но на 67 сутки интенсивность в области поглощения кверцетина падает приблизительно в 2 раза, а интенсивность поглощения НЧ возрастает на 40%.
Рис. 2.
Спектры поглощения ОМР ω = 5.0 (а) НЧ Pd; (б) НЧ Ni; (в) НЧ PdNi; (г) исходные НЧ
Fe и сформированные НЧ Fe/Pd (2 дн.):  – 3 мин,
– 3 мин,  — 15 мин,
— 15 мин,  — 30 мин,
— 30 мин,  — 60 мин,
— 60 мин,  — 90 мин,
— 90 мин,  — 7 дн.,
— 7 дн.,  — 67 дн. после начала синтеза. Qr (
— 67 дн. после начала синтеза. Qr ( ) – спектр раствора Qr/AOT/изооктан.
) – спектр раствора Qr/AOT/изооктан.
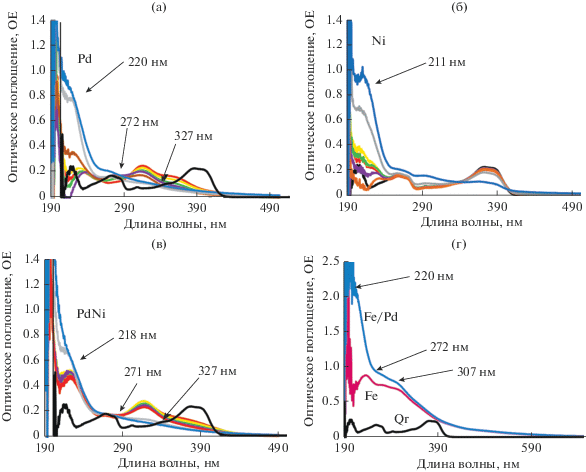
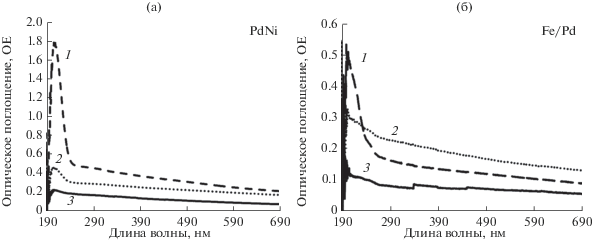
Спектр ОМР биметаллических НЧ PdNi (рис. 2в) с ожидаемой структурой гомогенного сплава характеризуется суперпозицией отдельных полос поглощения плазмонных резонансов никеля и палладия, которая выше алгебраической суммы спектров каждого металла. Таким образом проявляется синергизм в спектральных характеристиках сформированных НЧ PdNi и подтверждается возникновением биметаллической структуры, которое завершается на 7 сут после начала синтеза. В отличие от монометаллических НЧ в ходе этого синтеза не отмечается падения интенсивности поглощения в области дальнего ультрафиолета. На спектре отмечен максимум λ на ~218 нм, сопоставимый с максимумом поглощения НЧ Pd, но более широкий за счет вклада поглощения НЧ Ni. Последние два пика обусловлены наличием атомов палладия в наночастице, а первый имеет максимум сопоставимый с максимумом для монометаллических НЧ Pd, но более широкий, как у НЧ Ni.
За время синтеза обратномицеллярные растворы изменяют свою окраску от прозрачной бесцветной до светло-желтой.
Наночастицы железа (рис. 1) имеют характерные пики в УФ-области с максимумами на 240, 274 и 307 нм, что согласуется с литературными данными [6]. После добавления палладия и формирования биметаллических НЧ Fe/Pd отмечается сильное увеличение интенсивности оптического поглощения в области λ ~ 220 нм и менее выраженные в области от 250 до 320 нм (рис. 2г). На основе этих данных можно сделать предположение о формировании слоя из более мелких НЧ Pd на поверхности НЧ Fe.
Флуоресцентная спектроскопия
Спектр флуоресценции мицеллярного раствора AOT/изооктан (рис. 3а, АОТ) характеризуется пиками при 314 и 453 нм. При добавлении кверцетина (рис. 3а, Qr) к данному раствору интенсивность флуоресценции последнего уменьшается, но неравномерно в разных областях, приводя к смещению максимумов пиков. Это можно объяснить, например, акцепторным связыванием ионов примесей металлов кверцетином. Экспериментально наблюдается смещение полос оптического поглощения за счет образующихся комплексов по связи ионов Ме с разными группами –ОН Qr. Также появляются пики флуоресценции кверцетина на 549 и 416 нм.
Рис. 3.
Спектры флуоресценции растворов ОМР с (а) НЧ Ni; (б) НЧ Pd; (в) НЧ PdNi в день синтеза и через 67 дн.
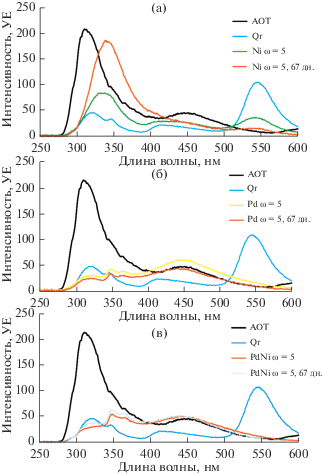
После добавления ионов никеля к системе Qr/AOT/изооктан (рис. 3а, Ni) интенсивность пика флуоресценции Qr (549 нм) снижается в 3.8 раза. Кверцетин лишь частично связывает ионы никеля в данных условиях (сами по себе ионы никеля уменьшают интенсивность кверцетина при образовании комплекса Qr : Ni = 1 : 2 в условиях насыщения [15]), но при более низкой концентрации ионов никеля формируются комплексы с соотношением 1 : 1 [16]. Наличие пика кверцетина на 67 день после синтеза говорит о медленной скорости восстановления ионов никеля в данных условиях. Пик с высокой интенсивностью при 338 нм может принадлежать как первичным промежуточным продуктам окисления кверцетина, так и их комплексам с никелем.
Важно отметить, что добавление ионов палладия к системе Qr/AOT/изооктан (рис. 3б, Pd) приводит к полному исчезновению пика кверцетина уже в первый день синтеза. Палладий должен тушить флуоресценцию кверцетина сильнее, чем никель. Вначале образуются комплексы с мольным отношением 1 : 1, которые несколько более стабильны, чем комплексы с никелем [16]. Отмечается усиление пика при λ ~ 450 нм, который можно приписать комплексу ионов палладия с кверцетином и молекулярным кислородом.
При совместном добавлении ионов никеля и палладия (концентрации в 2 раза меньше, чем в предыдущих случаях) (рис. 3в, PdNi) форма спектра в основном близка к форме спектра для палладия, что говорит о преимущественной роли ионов палладия в образовании комплексов и, возможно, в дальнейшем до их восстановления и формирования НЧ. Скорость исчезновения свободного кверцетина в этом случае максимальна. Такое изменение спектров может указывать на формирование наночастиц типа ядро/оболочка, где ядром служат НЧ Pd, а оболочка из никеля.
Размеры наночастиц
Размеры наночастиц металлов определялись после их формирования и выдерживания в течение 7 дн., непосредственно перед адсорбцией на носитель. Результаты представлены в табл. 2. В качестве примера рис. 4 представлены топографическое изображение подложки слюды с нанесенными НЧ Pd и их гистограмма распределения по размерам. Можно отметить достаточно узкий разброс НЧ по размерам, характерный для данного метода синтеза при малых значениях коэффициента солюбилизации. НЧ Ni имеют схожие характеристики, а биметаллические НЧ PdNi представлены в виде агрегатов из более мелких наночастиц (в табл. 2 для них указаны только размеры агрегатов, т.к. размеры отдельных НЧ невозможно установить). В табл. 2 приведены оценочные данные по среднему количеству атомов в монометаллической наночастице, предполагая, что все ионы восстановлены, а форма частиц сферическая, что рассчитывалось по формуле [17]:
(4)
${{N}_{{{\text{ат}}}}} = \frac{{{{v}_{{{\text{НЧ}}}}}}}{{{{v}_{{\text{а}}}}}} = {{\left( {\frac{{{{{{d}_{{{\text{НЧ}}}}}} \mathord{\left/ {\vphantom {{{{d}_{{{\text{НЧ}}}}}} 2}} \right. \kern-0em} 2}}}{{{{r}_{{{\text{ВЗ}}}}}}}} \right)}^{3}},$Таблица 2.
Параметры НЧ
| ОМР | Средний диаметр, нм | Число атомов в НЧ | Концентрация НЧ, нч дм–3 |
|---|---|---|---|
| Ni ω = 5.0 | 1.1 | 63 | 1.8 × 1018 |
| Pd ω = 5.0 | 1.3 | 78 | 1.5 × 1018 |
| PdNi ω = 5.0 | 4.4 | – | – |
Средняя концентрация НЧ в растворе, которая удобна для оценки количества каталитических центров нанокомпозита, рассчитывалась по уравнению:
(5)
${{c}_{{{\text{НЧ}}}}}(Me) = \frac{{c_{M}^{{{\text{OMP}}}}(Me){{N}_{{\text{A}}}}}}{{{{N}_{{{\text{ат}}}}}(Me)}},$Приготовление нанокомпозитов
В ходе приготовления нанокомпозитов на основе γ-Al2O3 по результатам спектрофотометрического контроля адсорбции НЧ из обратномицеллярного раствора зафиксировано приблизительно двукратное снижение интенсивности поглощения в области локализованного поверхностного плазмонного резонанса НЧ металлов Pd, Ni и биметаллов PdNi (рис. 5). Оптическое поглощение ОМР НЧ Fe/Pd после завершения адсорбции на γ-Al2O3 снижается до нулевых значений в видимом диапазоне длин волн начиная с λ ~ 250 нм. Резкое изменение интенсивности ОП данного образца в области спектра от 190 до 250 нм и ее снижение ниже нулевого значения можно связать с адсорбцией носителем не только НЧ Fe/Pd, но и АОТ, полоса поглощения которого также находится в этой же области спектра [8]. При этом интенсивность ОП АОТ в 0.15 М системе состава AOT/изооктан ниже, чем оптическое поглощение ОМР НЧ Fe/Pd в данном диапазоне длин волн, что позволяет говорить о полной адсорбции НЧ Fe/Pd, зарегистрированных в УФ-области спектра. При адсорбции Ni и PdNi отмечается увеличение интенсивности оптического поглощения на при Δt = 60 мин для Ni и Δt = 10 мин для PdNi, а также более быстрое завершение этого процесса по сравнению с Pd.
Рис. 5.
Изменение спектров ОМР во время адсорбции:  — исходный,
— исходный,  — 10 мин,
— 10 мин,  — 30 мин,
— 30 мин,  — 60 мин,
— 60 мин,  — 90 мин. Указан процент падения интенсивности ОП после адсорбции.
— 90 мин. Указан процент падения интенсивности ОП после адсорбции.

Теоретическое возможное содержание металла в нанокомпозитах не превышает: 36 мкг/г (3.9 × × 1015 нч/г) для Ni/γ–Al2O3, 65 мкг/г (3.6 × 1015 нч/г) Pd/γ-Al2O3 и, соответственно, по 32 и 18 мкг/г палладия и никеля для PdNi/γ-Al2O3, 32 мкг/г палладия и 452 мкг/г железа для Fe/Pd/γ-Al2O3. Об эффективности адсорбции и максимально возможном расчетном содержании НЧ металла в нанокомпозитах можно судить по данным, приведенным в табл. 3. Отметим эффективность использования в процессах адсорбции на носитель достаточно крупных НЧ Fe как транспортных частиц для НЧ палладия, сформированных на их поверхности. Концентрации палладия в исходных растворах монометаллических и биметаллических НЧ сравнимы друг с другом – 21.55 и 12.80 мг дм–3 соответственно, а эффективность адсорбции (по доле адсорбированных частиц) в случае биметаллических НЧ Fe/Pd выше в 2 раза.
Таблица 3.
Расчетное содержание металла в нанокомпозитах
| Образец | α, % | Содержание металла в нанокомпозите, мкг/г (ppm) | Содержание металла в нанокомпозите, мкмоль/г | ||||
|---|---|---|---|---|---|---|---|
| Pd | Fe | Ni | Pd | Fe | Ni | ||
| НЧ Pd ОМР | 43 | 28 | – | – | 0.26 | – | – |
| НЧ Ni ОМР | 56 | – | – | 20 | – | – | 0.34 |
| НЧ PdNi ОМР | 48 | 15 | – | 9 | 0.14 | – | 0.15 |
| НЧ Fe/Pd ОМР | 93 | 30 | 420 | – | 0.28 | 7.53 | – |
Определение качественной характеристики удерживания НЧ металлов на поверхности носителя и одновременное удаление лишней органики осуществлялось отмывкой нанокомпозитов н-гептаном. На рис. 6 в качестве примера представлены спектры трех последовательных смывов с поверхности адсорбента НЧ Ni и Pd. Отмечается достаточно сильное удерживание наночастиц никеля на поверхности γ-Al2O3 и слабое удерживание на нем частиц палладия, что отражается на остаточном содержании НЧ Pd в готовом катализаторе. Нанокомпозит состава PdNi/γ-Al2O3 (рис. 7) проявляет схожие свойства удерживания НЧ с композитом Ni/γ-Al2O3, отличаясь немного сниженной степенью удерживания, а самым сильным удерживанием НЧ из всех рассмотренных обладает образец Fe/Pd/γ-Al2O3 (рис. 7).
ЗАКЛЮЧЕНИЕ
Формирование биметаллической структуры НЧ PdNi подтверждается синергетическим характером усиления оптического поглощения их раствора по сравнению с ОП растворов индивидуальных монометаллических НЧ. Анализ спектров флуоресценции указывает на возможное формирование структуры типа ядро/оболочка, где ядром служит Pd. Использование крупных частиц позволяет повысить эффективность адсорбции НЧ Pd в форме биметалла Fe/Pd поверхностью гамма-оксида алюминия за счет более сильного связывания. Это увеличивает степень извлечения металлов из растворов [19] поверхностью носителя, что позволяет уменьшить количество используемого дорогостоящего металла, тем самым снизив затраты на производство нанокомпозитных материалов на основе рассматриваемых переходных металлов.
Список литературы
Walther A., Müller A.H.E. // Chemical Reviews. 2013. V. 113(7). P. 5194–5261. https://doi.org/10.1021/cr300089t
Gilroy K.D., Ruditskiy A., Peng H.-C. et al. // Chemical Reviews. 2016. V. 116(18). P. 10414–10472. https://doi.org/10.1021/acs.chemrev.6b00211
Сергеев М.О., Ревина А.А., Боева О.А., Жаворонкова К.Н., Золотаревский В.И. // Физикохимия поверхности и защита материалов. 2020. Т. 56. № 1. С. 58–70.
Chagas C.A., Manfro R.L., Toniolo F.S. // Catal. Lett. 2020. https://doi.org/10.1007/s10562-020-03257-1
Ревина А.А. Патент РФ № 2312741. Препарат наноразмерных частиц металлов и способ его получения. Бюл. Изобр. № 35. 20.12.2007.
Ревина А.А., Суворова О.В., Павлов Ю.С., Тытик Д.Л. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 5. С. 531–537.
Horcas I., Fernandez R., Gomez-Rodriguez J.M. et al. // Rev. Sci. Instrum. 2007. V. 78. P.013705. https://doi.org/10.1063/1.2432410
Патент РФ 2322327. Препарат наноструктурных частиц металлов и способ его получения (2008).
Ревина А.А., Белякова Л.Д., Паркаева С.А., Суворова О.В., Сергеев М.О., Золотаревский В.И. // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 6. С. 578–583. https://doi.org/10.1134/S2070205110060043
Sergeev M.O., Revina A.A., Busev S.A., Zolotarevskiy V.I., Zhavoronkova K.N., Boeva O.A. // Nanotechnol. Rev. 2014. V. 3(5). P. 515–525. https://doi.org/10.1515/ntrev-2014-0011
Creighton A.J., Eadon D.G. // J. Chem. Soc., Faraday Trans. 1991. V. 87(24). P. 3881–3891. https://doi.org/10.1039/FT9918703881
Teranishi T., Miyake M. // Chem. Mater. 1998. V. 10. P. 594–600. https://doi.org/10.1021/cm9705808
Shaochun Tang, Sascha Vongehr, Zhou Zheng, Hua Ren, Xiangkang Meng // Nanotechnology. 2012. V. 23. P. 255606. https://doi.org/10.1088/0957-4484/23/25/255606
Ревина А.А., Магомедбеков Э.П., Веретенникова Г.В. // Радиохимия. 2018. Т. 60. № 1. С. 60–65.
Kiana Kakavand, Vahid Niknam, Farnoush Faridbod, Hassan Ebrahimzadeh, Assiyeh Hamidipour // Anal. Bioanal. Electrochem. 2012. V. 4. № 6. P. 635–645.
Malesev D., Kuntic V. // J. Serb. Chem. Soc. 2007. V. 72. № 10. P. 921–939. https://doi.org/10.2298/JSC0710921M
Мазалова В.Л., Кравцова А.Н., Солдатов А.В. Нанокластеры: рентгеноспектральные исследования и компьютерное моделирование. М.: Физматлит, 2013. 184 с. ISBN 978-5-9221-1457-8.
Fengzhang Ren, Ke Cao, Jiangzhuo Ren et al. // J. Comput. Theor. Nanosci. 2014. V. 11. № 2. P. 344–347. https://doi.org/10.1166/jctn.2014.3358
Цивадзе А.Ю. // Вестн. РАН. 2020. Т. 90. № 4. С. 20–30.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов