Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 304-311
Плазменно-электролитический синтез и характеристика гетероструктур WO3–FeO–Fe2O3 и WO3–FeO–Fe2(WO4)3
М. С. Васильева 1, 2, *, И. В. Лукиянчук 2, А. А. Сергеев 3, К. А. Сергеева 3, И. В. Черных 2
1 Дальневосточный федеральный университет
690922 Владивосток, Приморский край, п. Аякс, 10, Россия
2 Институт химии Дальневосточного отделения Российской академии наук
690022 Владивосток, просп. 100-летия Владивостока, 159, Россия
3 Институт автоматики и процессов управления Дальневосточного отделения Российской академии наук
690041 Владивосток, ул. Радио, 5, Россия
* E-mail: vasileva.ms@dvfu.ru
Поступила в редакцию 25.03.2020
После доработки 03.06.2020
Принята к публикации 12.01.2021
Аннотация
Fe-, W-содержащие оксидные гетероструктуры на поверхности титана сформированы методом плазменно-электролитического оксидирования в щелочном вольфраматно-боратном электролите, содержащем комплексные ионы Fe(III)‑ЭДТА при плотностях анодного тока 0.1 и 0.2 А/см2. По данным рентгенофазового анализа в составе всех сформированных образцов преобладает оксид вольфрама WO3 в кубической модификации. Кроме того, оксидные слои, полученные при плотности тока 0.1 А/см2, содержат Na0.28WO3, Fe2O3 и TiO2 в модификациях рутил и анатаз, а в покрытиях, полученных при плотности тока 0.2 А/см2, обнаружены кристаллические фазы вюстита FeO и Fe2(WO4)3. Значение ширины запрещенной зоны, определенное методом Тауца для прямого разрешенного перехода, для всех образцов составляет 2.64 эВ. Все сформированные покрытия проявляют фотокаталитическую активность в реакции разложения метилового оранжевого (20 мг/л, рН 3.3) в присутствии пероксида водорода в условиях УФ облучения. При рН раствора метилового оранжевого 5.9 (близкого к рН сточных вод) активны покрытия, полученные при плотности тока 0.1 А/см2.
1. ВВЕДЕНИЕ
В последние годы композиционные материалы на основе оксидов вольфрама и железа привлекают значительное внимание благодаря широкому спектру их функциональных свойств, таких как магнитные, каталитические и фото- и электрокаталитические, люминесцентные, оптические [1–13]. Такие материалы получают преимущественно в виде дисперсных частиц методами золь-гель синтеза, соосаждения, гидротермального и сольвотермального синтеза, микроволнового, темплатного, нисходящего и микрофлюидного синтеза [1–13]. В то же время для решения многих практических задач более приемлемо использовать гетероструктуры, иммобилизованные на твердых поверхностях, в том числе на металлах. Определенные возможности в синтезе на поверхности металлов разнообразных оксидных структур предоставляет метод плазменно-электролитического оксидирования (ПЭО) [14, 15], суть которого заключается в электрохимическом формировании поверхностных слоев на вентильных металлах и сплавах под действием искровых и микродуговых электрических разрядов. Под действием таких разрядов на поверхности анода протекают термолитические превращения компонентов электролита и их взаимодействия с оксидами обрабатываемого металла с образованием на поверхности соответствующих оксидных структур. В связи с этим, наиболее важной задачей для получения методом ПЭО желаемых оксидных структур на поверхности металлов является выбор электролита, компоненты которого могут принимать участие в определенных электродных процессах с образованием нерастворимых кислородных соединений.
Сведения о работах по получению методом ПЭО смешанных оксидных систем WO3–FeOx в настоящее время в литературе отсутствуют. В то же время имеются работы по получению Fe-содержащих [16–23] и W-содержащих ПЭО-покрытий [25–28].
Покрытия со стехиометрическими или нестехиометрическими оксидами вольфрама получают методом ПЭО в водных электролитах, содержащих Na2WO4 [25–28].
Для получения Fe‑содержащих ПЭО-покрытий широко применяют электролиты-суспензии с дисперсными частицами железа [16] или оксида железа Fe2O3 [17, 18], коллоидные электролиты с полифосфатными комплексами железа [19] и частицами гидроксида железа [20].
В то же время, по мнению авторов [21–23] электролиты-суспензии имеют ряд недостатков, среди которых изменение с течением времени размера и состава дисперсных частиц и их распределения в объеме электролита, а также неоднородность формируемых в них покрытий. В связи с этим, для получения качественных, хорошо воспроизводимых покрытий предпочтение следует отдавать гомогенным электролитам – истинным растворам, которые являются более стабильными и управляемыми системами по сравнению с электролитами-суспензиями. Для получения Fe-содержащих ПЭО-покрытий на алюминии авторы [21–23] предложили использовать щелочной раствор, содержащий комплексные ионы Fe-ЭДТА. Получение в этом случае гомогенных электролитов обусловлено тем, что введение комплексонов в растворы солей металлов подавляет гидролиз катионов железа и предотвращает образование дисперсных частиц гидроксида железа [24]. При этом применение щелочных электролитов на основе растворимых силикатов, боратов, фосфатов, алюминатов или других растворимых солей щелочных металлов предпочтительнее, поскольку они имеют относительно высокую экологическую совместимость и низкое коррозионное действие.
В связи с этим, было сделано предположение, что использование в качестве электролита щелочного водного раствора с добавлением вольфрамата натрия и комплексных ионов железа позволит получить одностадийным методом ПЭО сложные гетероструктуры на основе оксидов вольфрама и железа, закрепленные на поверхности титана.
В настоящей работе приведены результаты исследования условий плазменно-электролитического синтеза, морфологии, состава, оптоэлектронных и фотокаталитических свойств гетеростуруктур на основе оксидов железа и вольфрама.
2. МАТЕРИАЛЫ И МЕТОДЫ
Образцы для плазменно-электролитического оксидирования изготавливали из листового титана марки ВТ1-0 в виде пластинок размером 2.0 × × 2.0 × 0.05 см3. Для стандартизации поверхности и удаления естественной оксидной пленки образцы механически шлифовали, химически полировали в смеси концентрированных кислот HF : HNO3 = = 1 : 3 (по объему) при 60–80°С до образования зеркальной поверхности, промывали дистиллированной водой и сушили на воздухе при 70°С.
Оксидные слои формировали в гальваностатических условиях на анодно-поляризованном титане в водном электролите, содержащем 0.1 М Na2B4O7 + 0.1 М Na2WO4 + 0.02 или 0.03 М Na2H2γ (ЭДТА) + 0.02 М FeSO4(NH4)2SO4 (далее BW-Feγ, где γ-[C2H4N2(CH2COO)4]4–)). Для приготовления электролитов использовали дистиллированную воду и соответствующие коммерческие реактивы: Na2B4O7 ⋅ 10Н2О (ч.), FeSO4(NH4)2SO4 ⋅ 6Н2О (x. ч.), Na2WO4 ⋅ 2Н2О (ч. д. а.), С10Н14N2Na2 ⋅ 2Н2О (стандарт-титр).
В качестве источника тока использовали тиристорный агрегат ТЕP4-63/460Р-2-2-УХЛ4 с однополярной формой тока. Процесс вели в стакане из термостойкого стекла емкостью 1000 мл. Катод – трубчатый змеевик из нержавеющей стали марки Х18Н9Т, охлаждаемый водопроводной водой, одновременно служил холодильником. Электролит перемешивали с помощью магнитной мешалки. Температура электролита в ходе ПЭО не превышала 35°С.
ПЭО-покрытия формировали в течение 10 мин при эффективных плотностях анодного тока 0.1 и 0.2 А/см2, полученные покрытия обозначали Ti/Fe/W-0.1 и Ti/Fe/W-0.2, соответственно. После ПЭО-обработки образцы промывали дистиллированной водой и сушили на воздухе при 70°С.
Фазовый состав титановых образцов с Fe-, W-содержащими ПЭО-покрытиями определяли методом рентгенофазового анализа (РФА) на дифрактометре D8 ADVANCE (Германия) в CuKα‑излучении по стандартной методике. Идентификация соединений, входящих в состав исследуемых образцов, выполнена в автоматическом режиме поиска “EVA” с использованием банка данных “PDF-2”.
Строение поверхности и элементный состав покрытий изучали на сканирующем электронном микроскопе высокого разрешения Hitachi S5500 (Япония), оснащенном приставкой для энергодисперсионного анализа Thermo Scientific (США). Предварительно на поверхность напыляли тонкую пленку золота с целью устранения эффекта зарядки поверхности.
Спектры диффузного отражения образцов регистрировали в диапазоне 200–800 нм с помощью спектрофотометра Cary Varian 5000 (Agilent Technologies, USA) со спектральным разрешением 1 нм. В качестве источника излучения использовали галогенную и дейтериевую лампы.
Ширина запрещенной зоны Еg определялась по положению полосы фундаментального поглощения по уравнению Тауца:
(2.1)
${{(h\nu F(r))}^{{{1 \mathord{\left/ {\vphantom {1 n}} \right. \kern-0em} n}}}} = A(h\nu - {{E}_{g}}),$Исследование фотокаталитических свойств сформированных покрытий проводили на примере реакции разложения водного раствора метилового оранжевого МО (20 мг/л, рН 3.3 и 5.9) как в присутствии, так и в отсутствие Н2О2 (10 ммоль/л), в условиях видимого и ультрафиолетового облучения. Свежеприготовленный раствор МО имел рН 5.9. Подкисление раствора МО до рН 3.3 осуществляли добавлением 0.1 М H2SO4.
Концентрацию МО определяли с помощью спектрофотометра “ЮНИКО-1200/1201” (США), основываясь на уравнении Бугера–Ламберта–Бера:
где A – оптическая плотность раствора, ε – молярный коэффициент поглощения, l – толщина поглощающего слоя и C – концентрация раствора. Поскольку ε и l это константы, то C прямо пропорциональна оптической плотности; следовательно, она может быть получена путем измерения параметра А.Для проведения фотокаталитических исследований в кварцевую ячейку с 50 мл раствора МО (с или без H2O2) помещали образец с ПЭО-покрытием. В качестве источника излучения использовали УФ лампу (SB-100P) с максимумом эмиссии на длине волны λ = 365 нм. В каждом эксперименте до начала облучения раствор с образцом оставляли в темноте на 30 мин для установления равновесия адсорбция/десорбция, после чего измеряли оптическую плотность раствора, величину которой использовали как точку отсчета А0. Затем находящийся в растворе образец облучали УФ-светом в течение 3 ч. Измерение оптической плотности растворов МО с рН 5.9 проводили при λ = = 460 нм, с рН 3.3 – λ = 500 нм. Степень деградации МО χ вычисляли по формуле
где A0 и А – это оптические плотности раствора до и после облучения, соответственно.3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения электролитов в качестве источника железа использовали наиболее устойчивое соединение железа (II) – соль Мора. Выбор Fe(II) обусловлен тем, что Fe(OH)2 имеет более высокое произведение растворимости (7.94 × 10–16) по сравнению с Fe(OH)3 (3.72 × 10–40) и, следовательно, в водном растворе железо(II) гидролизуется в меньшей степени по сравнению с железом(III). Во всех случаях полученные электролиты представляли собой прозрачные истинные растворы светло-коричневого цвета с величиной рН ~ 10. В этих условиях образуется достаточно устойчивый комплекс ЭДТА с катионами Fe(II) Feγ2–, десятичный логарифм условной константы устойчивости которого (рβ') при данном значении рН равен 12.34 [29].
В электролитах, содержащих избыток ЭДТА по отношению к концентрации катионов железа(II) (0.03 моль/л) оксидные покрытия на титане не формируются, по-видимому, вследствие травления поверхности металла, связанного с избытком в растворе анионов ЭДТА, образующих водорастворимые комплексы с титаном. Это согласуется с данными работы [30], в которой описано плазменно-электролитическое формирование оксидных слоев на титане в водных электролитах с комплексами ЭДТА-Mn2+.
При оксидировании первых партий образцов электролит практически сразу приобрел более темную окраску и далее его цвет в процессе ПЭО больше не менялся. Изменение окраски очевидно связано с тем, что комплексонат Fe(II) Feγ2– в растворе очень неустойчив, он легко окисляется с образованием устойчивых комплексных ионов Feγ–, рβ' = 11.19 [29]. Что касается вольфрамат-ионов, то согласно [31] в щелочной среде они присутствуют в растворе преимущественно в виде анионов ${\text{WO}}_{4}^{{2 - }}$. Таким образом, проработанный электролит, в котором были получены исследованные в работе покрытия, в качестве предшественников предполагаемых кислородных соединений содержал преимущественно вольфрамат-ионы ${\text{WO}}_{4}^{{2 - }}$ и комплексные ионы Feγ–.
На рис. 1 приведены временные зависимости напряжения на электродах при ПЭО-обработке титана в BW-Feγ электролите в анодном режиме при двух плотностях тока. В обоих случаях в первую минуту процесса наблюдается резкий рост напряжения на электродах до значений ~75 и ~85 В при плотностях тока 0.1 и 0.2 А/см2, соответственно. Далее с течением времени напряжение на электродах увеличивается незначительно и достигает максимума через 540 с (Umax = 90 В) в первом и через 280 с (Umax = 98 В) во втором случае, то есть при прохождении через ячейку примерно одинакового количества электричества. Через 10 мин напряжение формирования для обеих плотностей тока составляет около 90 В. В целом вид кривой U = f(t) соответствует известным зависимостям, полученным при формировании методом ПЭО покрытий на металлах вентильной группы в электролитах, не растворяющих металл и образующийся оксид [14]. В обоих случаях при времени обработки свыше 4–6 мин возникает характерный для ПЭО гул, сопровождающий искровые и дуговые разряды и связанный с кавитацией парогазовых пузырьков. В этих условиях на титане формируются плотные оксидные покрытия коричневатого цвета, интенсивность окраски которых возрастает с ростом плотности тока формирования, что косвенно может свидетельствовать о более высоком содержании в них железа.
Рис. 1.
Зависимость напряжения на электродах U от времени оксидирования титана t в BWFe-ЭДТА электролите при плотностях тока i, А/см2: 1 – 0.1 и 2 – 0.2.

С помощью сканирующей электронной микроскопии (СЭМ) установлено, что покрытия, сформированные в BWFe-ЭДТА-электролите, имеют неоднородную пористую поверхность, рис. 2а, 2в. С увеличением плотности тока формирования доля гладких беспористных участков поверхности уменьшается, растет число мелких пор, пронизывающих всю поверхность Ti/W/Fe-0.2 образца, рис. 2в.
Рис. 2.
СЭМ изображения поверхности покрытий (а, в) и примеры энергодисперсионных спектров (б, г) образцов Ti/Fe/W-0.1 (a, б) и Ti/Fe/W-0.2 (в, г).

Согласно данным энергодисперсионного анализа (глубина анализа ~1–2 мкм) все сформированные покрытия содержат кислород, вольфрам и железо, рис. 2б, 2г. С ростом плотности тока содержание железа и вольфрама в составе покрытий увеличивается, но при этом несколько снижается содержание кислорода. Кроме того, меняется атомное отношение W/Fe в покрытиях: при i = 0.1 А/см2 оно составляет ~2.0, при i = 0.2 А/см2 – 1.4. Отметим, что атомное отношение W/Fe в покрытиях отличается от мольного отношения ионов ${\text{WO}}_{4}^{{2 - }}$: Feγ– = 5 в электролите в пользу железа, что свидетельствует о предпочтительном встраивании железа по сравнению с вольфрамом в ходе ПЭО.
На рис. 3 приведены рентгенограммы сформированных образцов. На рентгенограмме образца Ti/W/Fe-0.1 присутствуют интенсивные рефлексы, отнесенные к WO3 в кубической модификации и более слабые рефлексы, соответствующие натрий-вольфрамовой бронзе Na0.28WO3, гематиту Fe2O3, вюститу FeO и диоксиду титана в модификациях рутил и анатаз. На рентгенограмме образца Ti/W/Fe-0.2 также имеются интенсивные рефлексы WO3, более слабые пики, соответствующие вюститу FeO, диоксиду титана в модификации рутил. Гематит и анатаз в составе таких покрытий не обнаружены. Вместо этого, в составе образца Ti/W/Fe-0.2 обнаружен вольфрамат железа(III) Fe2(WO4)3, который мог образоваться в результате твердофазного взаимодействия Fe2O3 и WO3. Отметим, что образование Fe2(WO4)3 косвенно подтверждается данными энергодисперсионного анализа: атомные отношения W/Fe в вольфрамате железа(III) и в поверхностном слое образца Ti/W/Fe-0.2 близки и составляют 1.5 и 1.4, соответственно. Таким образом ПЭО-обработка титана при большей плотности тока, а значит, в более жестких условиях, приводит к образованию более высокотемпературных соединений – рутила (в отсутствие анатаза) и вольфрамата железа(III).
Сопоставление данных энергодисперсионного (рис. 2б, 2г) и рентгенофазового анализов (рис. 3), свидетельствует о том, что поверхностные слои обоих образцов содержат избыток кислорода по отношению к стехиометрическим формулам обнаруженных кристаллических фаз. Такой избыток может быть связан с гидратацией поверхностного слоя покрытий и образованием гидроксоформ, например WO3 ⋅ H2O и Fe(OH)2, Fe(OH)3. Кроме того, по данным энергодисперсионного анализа в составе покрытий отсутствует титан, тогда как согласно РФА образцы содержат кристаллические фазы диоксида титана. Это свидетельствует о том, что покрытия многослойны, а фазы оксида титана располагаются на глубине более 2 мкм, то есть не доступной для энергодисперсионного анализа.
Следует отметить, что методом ПЭО кристаллические фазы Fe2(WO4)3 в составе покрытий получены впервые. Из литературы известно [13], что поскольку Fe2(WO4)3 является метастабильной фазой, то его трудно синтезировать, так как обычно получается более стабильная фаза FeWO4. Вместе с тем, материалы на основе полученных соединений представляют большой практический и научный интерес благодаря сочетанию широкого спектра функциональных свойств [12, 13, 32, 33], в том числе фотокаталитических и фотоэлектрохимических [12, 33].
В связи с этим, мы исследовали оптоэлектронные свойства полученных образцов и провели оценку их фотокаталитической активности в модельной реакции разложения водного раствора метилового оранжевого.
На рис. 4а приведены спектры диффузного отражения сформированных оксидных слоев на титане в диапазоне 200–800 нм. Экстраполяция линейного спада кривой (F(r)hν)1/n на ось абсцисс (hν), показала, что значение Eg для прямого разрешенного перехода составляет 2.64 эВ для обоих образцов (рис. 4б). Полученные значения оказались значительно ниже, чем известные для недопированного анатаза (~3.3 эВ) [34]. Существенное уменьшение Eg способствует поглощению фотонов не только УФ-, но и видимого диапазона, и, может влиять на эффективность фотокаталитической реакции. Тот факт, что для обоих образцов значения Eg оказались одинаковыми, несмотря на различие их фазового и элементного состава, может быть обусловлено тем, основной вклад в оптоэлектронные свойства полученных оксидных слоев вносит преобладающий в них WO3. Согласно [35] значение Eg для WO3 близко к полученным значениям и составляет 2.87 эВ.
Рис. 4.
Спектры диффузного отражения (а) и определение края фундаментального поглощения для прямых разрешенных электронных переходов (б) в образцах: 1 – Ti/Fe/W-0.1 и 2 – Ti/Fe/W-0.2.

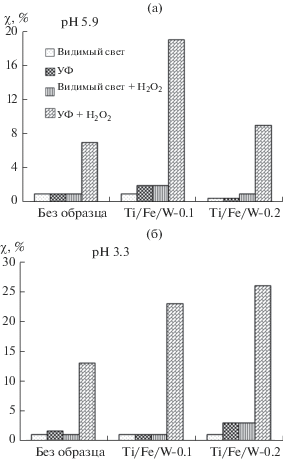
Проведенные исследования показали, что титановые образцы с W-, Fe-содержащими ПЭО-покрытиями не катализируют разложение МО в условиях видимого и УФ-облучения в отсутствие окислителя рис. 5. Заметная деколоризация раствора МО происходит только при одновременном воздействии пероксида водорода и УФ‑облучения. В этих условиях скорость фотокаталитического разложения зависит от рН раствора. При естественном значении рН раствора МО (без подкисления серной кислотой) в отсутствие образцов и в присутствии Ti/W/Fe-0.2 степень деколоризации МО не превышает 9%, тогда как в присутствии образца Ti/W/Fe-0.1 она достигает 20%.
Наиболее высокая активность образца Ti/W/Fe-0.1 может быть обусловлена присутствием в нем гематита Fe2O3, с участием которого осуществляется гетерогенный фото-Фентон процесс, который может быть представлен следующими реакциями [36]:
(3.1)
${\text{F}}{{{\text{e}}}^{{3 + }}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}} \leftrightarrow {\text{Fe}}{{\left( {{\text{OOH}}} \right)}^{{2 + }}} + {{{\text{H}}}^{ + }},$(3.2)
${\text{Fe}}{{\left( {{\text{OOH}}} \right)}^{{2 + }}} \leftrightarrow {\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{HO}}{{{\text{O}}}^{\centerdot }},$(3.3)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}} \leftrightarrow {\text{F}}{{{\text{e}}}^{{3 + }}}~ + {\text{ H}}{{{\text{O}}}^{ - }} + {\text{ H}}{{{\text{O}}}^{\centerdot }},$(3.4)
${\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{HO}}{{{\text{O}}}^{\centerdot }} \leftrightarrow {\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{H}}}^{ + }} + {{{\text{O}}}_{2}},~$(3.5)
${\text{Fe}}{{({\text{OOH}})}^{{2 + }}} + h\nu \to {\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{H}}{{{\text{O}}}^{\centerdot }}.$Разложение фотоактивных Fe(ОOH)2+ частиц промотирует дополнительное образование радикалов НО• в растворе, т.е. процесс Фентона ускоряется при воздействии света, что повышает степень минерализации органических веществ [37].
Подкисление раствора МО до pH 3.3 во всех случаях приводит к повышению степени его превращения, особенно в присутствии Ti/W/Fe-0.2 образца. В последнем случае можно предположить, что в кислой среде происходит частичное растворение вюстита FeO, вследствие чего в раствор попадают катионы железа(II) и основную роль в деколоризации МО играет гомогенный фото-Фентон процесс, в котором образование гидроксильных радикалов (НО•) происходит в результате каталитического разложения Н2О2 в кислой среде (рН 2.8–4.0) в присутствии Fe2+ ионов [37]:
(3.6)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{H}}{{{\text{O}}}^{--}} + {\text{Н}}{{{\text{О}}}^{\centerdot }}.$В целом можно отметить, что фотокаталитическая активность сформированных образцов в исследуемых условиях невысока. С одной стороны, это может быть обусловлено высокой скоростью рекомбинации фотогенерируемых электронов и дырок. С другой стороны, высокая пористость и шероховатость поверхности сформированных ПЭО-образцов может являться причиной диффузионного торможения и снижения скорости фотокаталитического процесса.
4. ЗАКЛЮЧЕНИЕ
Таким образом, гетероструктуры, содержащие в своем составе оксиды вольфрама и железа, были сформированы на поверхности титана методом плазменно-электролитического оксидирования в щелочном гомогенном вольфраматно-боратном электролите с комплексными ионами Feγ–.
Фазовый и элементный составы оксидных слоев зависит от плотности тока формирования. Оксидные слои, полученные при плотности тока 0.1 А/см2, включают в составе триоксид вольфрама WO3, натрий-вольфрамовую бронзу Na0.28WO3, гематит Fe2O3, вюстит FeO и TiO2 в модификациях рутил и анатаз. В покрытиях, сформированных при плотности тока 0.2 А/см2, обнаружены WO3, FeO, Fe2(WO4)3 и TiO2 в модификации рутил. По данным энергодисперсионного анализа, увеличение плотности тока приводит к увеличению концентраций W и Fe и изменению их атомного отношения в поверхностном слое покрытий. Следовательно, увеличение плотности тока приводит к кристаллизации более высокотемпературных соединений в составе покрытий.
Несмотря на различие фазового и элементного состава ПЭО-слоев, синтезированных при различных плотностях тока, значение ширины запрещенной зоны Eg для прямого разрешенного перехода для них совпадает и составляет 2.64 эВ. Данный факт может быть обусловлен тем, основной вклад в оптоэлектронные свойства полученных оксидных слоев вносит преобладающий в них WO3.
Проведенные фотокаталитические исследования показали, что все сформированные покрытия активны в деградации метилового оранжевого только в условиях одновременного воздействия пероксида водорода, УФ-облучения и подкисления водного раствора МО до рН 3.3. В отсутствие подкисления раствора метилового оранжевого (pH 5.9) наибольшую активность демонстрируют покрытия, полученные при плотности тока 0.1 А/см2 и содержащие своем составе оксиды железа(II) и (III).
Работа поддержана грантом РФФИ № 18-03-00418.
Список литературы
Chen Z.G., Ma H.J., Xia J.X., Zeng J., Di J., Yin S., Xu L., Li H.M. Ionic liquid-induced strategy for FeWO4 microspheres with advanced visible light photocatalysis // Ceram. Int. 2016. V. 43. № 7. P. 8997–9003. https://doi.org/10.1016/j.ceramint.2016.02.117
Cao X., Chen Y., Jiao S.H., Fang Z.X., Xu M., Liu X., Li L., Pang G.S., Feng S.H. Magnetic photocatalysts with a p–n junction: Fe3O4 nanoparticle and FeWO4 nanowire heterostructures // Nanoscale. 2014. V. 6. № 21. P. 12366–12370. https://doi.org/10.1039/c4nr03729d
Sun B., Liu Y.H., Chen P. Room-temperature multiferroic properties of single-crystalline FeWO4 nanowires // Scripta Mater. 2014. V. 89. P. 17–20. https://doi.org/10.1016/j.scriptamat.2014.06.030
Hu W.B., Zhao Y.M., Liu Z.L., Dunnill C.W., Gregory D.H., Zhu Y.Q. Nanostructural evolution: From one-dimensional tungsten oxide nanowires to three-dimensional ferberite flowers // Chem. Mater. 2008. V. 20. № 17. P. 5657–5665. https://doi.org/10.1021/cm801369h
He G.L., Chen M.J., Liu Y.Q., Li X., Liu Y.J., Xu Y.H. Hydrothermal synthesis of FeWO4-graphene composites and their photocatalytic activities under visible light // Appl. Surf. Sci. 2015. V. 351. P. 474–479. https://doi.org/10.1016/j.apsusc.2015.05.159
Gao Q.X., Liu Z.J. FeWO4 nanorods with excellent UV–Visible light photocatalysis // Prog. Nat. Sci.-Mater. 2017. V. 27. № 5. P. 556–560. https://doi.org/10.1016/j.pnsc.2017.08.016
Zhang J., Zhang Y., Yan J.Y., Li S.K., Wang H.S., Huang F.Z., Shen Y.H., Xie A.J. A novel synthesis of star-like FeWO4 nanocrystals via a biomolecule-assisted route // J. Nanopart. Res. 2012. V. 14. № 4. P. 796. https://doi.org/10.1007/s11051-012-0796-6
Zhou Y.X., Yao H.B., Zhang Q., Gong J.Y., Liu S.J., Yu S.H. Hierarchical FeWO4 microcrystals: solvothermal synthesis and their photocatalytic and magnetic properties // Inorg. Chem. 2009. V. 48. № 3. P. 1082–1090. https://doi.org/10.1021/ic801806r
Sun B., Liu Y.H., Chen P. Room-temperature multiferroic properties of single-crystalline FeWO4 nanowires // Scr. Mater. 2014. V. 89. P. 17–20. https://doi.org/10.1016/j.scriptamat.2014.06.030
Guo. J.X., Zhou X.Y., Lu Y.B., Zhang X., Kuang S.P., Hou W.G. Monodisperse spindle-like FeWO4 nanoparticles: Controlled hydrothermal synthesis and enhanced optical properties // J. Solid State Chem. 2012. V.196. P. 550–556. https://doi.org/10.1016/j.jssc.2012.07.026
Wang H., Ning P., Zhang Y., Ma Y., Wang J., Wang L., Zhang Q. Highly efficient WO3-FeOx catalysts synthesized using a novel solvent-free method for NH3-SCR // J. Hazard. Mater. 2020. V. 388. Paper 121812. https://doi.org/10.1016/j.jhazmat.2019.121812
Aslam I., Cao C., Tanveer M., Farooq M.H., Tahir M., Khalid S., Khan W.S., Idrees F., Rizwan M., Butt F.K. A facile one-step fabrication of novel WO3/Fe2(WO4)3 ⋅ 10.7H2O porous microplates with remarkable photocatalytic activities // CrystEngComm. 2015. V. 17. P. 4809–4817. https://doi.org/10.1039/C5CE00712G
Sriraman A.K., Tyagi A.K. A new method of Fe2(WO4)3 preparation and its thermal stability // Thermochemical Acta. 2003. V 406. P. 29–33. https://doi.org/10.1016/S0040-6031(03)00201-6
Руднев В.С. Многофазные анодные слои и перспективы их применения // Защита металлов. 2008. Т. 44. № 3. С. 283-292. [Rudnev V.S. Multiphase anodic layers and prospects of their application // Prot. Met. 2008. V. 44. № 3. P. 263–272. https://doi.org/10.1134/S0033173208030089].
Walsh F.C., Low C.T.J., Wood R.J.K., Stevens K.T., Archer J., Poeton A.R., Ryder A. Plasma electrolytic oxidation (PEO) for production of anodised coatings on lightweight metal (Al, Mg, Ti) alloys // Trans. Inst. Metal Finish. 2009. V. 87. № 3. P. 122–135. https://doi.org/10.1179/174591908X372482
Jin F.Y., Tong H.H., Li J., Shen L.R., Chu P.K. Structure and microwave-absorbing properties of Fe-particle containing alumina prepared by micro-arc discharge oxidation // Surf. Coat. Technol. 2006. V. 201. № 1–2. P. 292–295. https://doi.org/10.1016/j.surfcoat.2005.11.116
Tang H., Wang F. Effects of nano-Fe2O3 powder on thermal emission property of microarc oxidation coating on titanium alloy // Mater. Sci. Technol. 2012. V. 28. № 12. P. 1523–1526. https://doi.org/10.1179/1743284710Y.0000000050
Jagminas A. Ragalevicius R., Mazeika K., Reklaitis J., Jasulaitiene V., Selskis A., Baltrunas D. A new strategy for fabrication Fe2O3/SiO2 composite coatings on the Ti substrate // J. Solid State Electrochem. 2010. V. 14. № 2. P. 271–277. https://doi.org/10.1007/s10008-009-0820-7
Руднев В.С., Устинов А.Ю., Лукиянчук И.В., Харитонский П.В. Фролов А.М., Ткаченко И.А., Морозова В.П. Магнитоактивные оксидные слои на титане, сформированные плазменно-электролитическим методом // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 5. С. 494‑500. [Rudnev V.S., Ustinov A.Yu., Lukiyanchuk I.V., Kharitonskii P.V., Frolov A.M., Tkachenko I.A., Morozova V.P. Magnetoactive Oxide Layers Formed on Titanium by Plasma Electrolytic Technique // Prot. Met. Phys. Chem. Surf. 2010. V. 46. № 5. P. 566–572. https://doi.org/10.1134/S2070205110050114].
Руднев В.С., Адигамова М.В., Лукиянчук И.В., Устинов А.Ю., Ткаченко И.А., Харитонский П.В., Фролов А.М., Морозова В.П. Влияние условий формирования на ферромагнитные свойства железосодержащих оксидных покрытий на титане // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 5. С. 459–469. [Rudnev V.S., Adigamova M.V., Lukiyanchuk I.V., Ustinov A.Yu., Tkachenko I.A., Kharitonskii P.V., Frolov A.M., Morozova V.P. The effect of the conditions of formation on ferromagnetic properties of iron-containing oxide coatings on titanium // Prot. Met. Phys. Chem. Surf. 2012. V. 48. № 5. P. 543–552. https://doi.org/10.1134/S2070205112050097].
Rogov A.B., Terleeva O.P., Mironov I.V., Slonova A.I. Iron-containing coatings obtained by microplasma method on aluminum with usage of homogeneous electrolytes // Appl. Surf. Sci. 2012. V. 258. № 7. P. 2761–2765. https://doi.org/10.1016/j.apsusc.2011.10.128
Rogov A.B., Slonova A.I., Mironov I.V. The influence of homogeneous electrolyte composition on microplasma synthesis and characteristics of Fe-containing coatings on A1050 alloy // Appl. Surf. Sci. 2013. V. 287. P. 22–29. https://doi.org/10.1016/j.apsusc.2013.09.047
Рогов А.Б., Терлеева О.П., Миронов И.В., Слонова А.И. Микроплазменный синтез Fe‑содержащих покрытий на алюминии в гомогенных электролитах // Физикохимия поверхности и защита материалов // 2012. Т. 48. № 3. С. 293–298 [Rogov A.B., Terleeva O.P., Mironov I.V., Slonova A.I. Microplasma synthesis of Fe-containing coatings on aluminum in homogeneous electrolytes // Prot. Met. Phys. Chem. Surf. 2012. V. 48. № 3. P. 340–345. https://doi.org/10.1134/S2070205112030148]
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия. 1988. 544 с. [Dyatlova N.M., Temkina V.Ya., Popov K.I. Complexones and complexonates of metals. Moscow: Khi-miya, 1988. (in Russian)]
Gruss L.L., McNeil W. Anodic spark reaction product in aluminate, tungstate and silicate solutions // Electrochem. Technol. 1963. V. 1. № 9–10. P. 283–287.
Lukiyanchuk I.V., Rudnev V.S., Kuryavyi V.G., Boguta D.L., Bulanova S.B., Gordienko P.S. Surface morphology, composition and thermal behavior of tungsten-containing anodic spark coatings on aluminum alloy // Thin Solid Films. 2004. V. 446. № 1. P. 54–60. https://doi.org/10.1016/S0040-6090(03)01318-X
Bayati M.R., Golestani-Fard F., Moshfegh A.Z. Visible photodecomposition of methylene blue over micro arc oxidized WO3-loaded TiO2 nano-porous layers // Appl. Catal. A-Gen. 2010. V. 382. № 2. P. 322–331. https://doi.org/10.1016/j.apcata.2010.05.017
Chen L., Qu Y., Yang X., Liao B., Xue W.B., Cheng W. Characterization and first-principles calculations of WO3/TiO2 composite films on titanium prepared by microarc oxidation // Mater. Chem. Phys. 2017. V. 201. P. 311–322. https://doi.org/10.1016/j.matchemphys.2017.08.013
Амшеева A.A. Условные константы устойчивости этилендиаминтетрацетатов металлов и их использование в комплексометрии // Журн. аналит. химии. 1978. Т. 33. № 6. С. 1054–1061. [Amsheeva A.A. Apparent stability-constants of metal ethylenediaminetetra-acetates and their use in complexonometry // J. Anal. Chem.-USSR. 1978. V. 33. № 6. P. 814–820. WOS:A1978GF08000003].
Васильева М.С., Руднев В.С., Устинов А.Ю., Недозоров П.М., Кондриков Н.Б. Плазменно-электрохимическое формирование оксидных слоев на титане в водных электролитах с комплексами ЭДТА-Mn2+, их состав, строение и каталитические свойства // Журн. прикладной химии. 2010. Т. 83. № 3. С. 435–440. [Vasil’eva M.S., Rudnev V.S., Ustinov A.Yu., Nedozorov P.M., Kondrikov N.B. Plasma-electrochemical formation of oxide layers on titanium in aqueous electrolytes with trilonate complexes of manganese // Russ. J. Appl. Chem. 2010. V.83, № 3. P. 434–439. https://doi.org/10.1134/S1070427210030122].
Мохосоев М.В., Швецова Н.А. Состояние ионов молибдена и вольфрама в водных растворах. Улан-Удэ, Бурятское книжное издательство, 1977. 168 с. [Mohosoev M.V., Shvetsova N.A. Sostoyanie ionov molibdena i volframa v vodnyh rastvorah (The State of ions of Molybdenum and Tungsten in Aqueous Solutions), Ulan-Ude, 1977 (in Russian)].
Barim G., Cottingham P., Zhou S., Melot BC., Brutchey R.L. Investigation of the reversible lithium insertion into anti-NASICON Fe2(WO4)3 // ACS Appl Mater. Interfaces. 2017. V. 9. № 12. P. 10813–10819. https://doi.org/10.1021/acsami.6b16216
Kment S., Sivula K., Naldoni A., Sarmah S.P., Kmentova H., Kulkarni M., Rambabu Y., Schmuki P., Zboril R. FeO-based nanostructures and nanohybrids for photoelectrochemical water splitting // Prog. Mater Sci. 2020. V. 110. Paper 100632. https://doi.org/10.1016/j.pmatsci.2019.100632
Frova A., Body P.J., Chen Y.S. Electromodulation of the optical constants of rutile in the uv // Phys. Rev. 1967. V. 157. P. 700‑708. https://doi.org/10.1103/PhysRev.157.700
Bayati M.R., Moshfegh A.Z., Golestani-Fard F., Molaei R. (WO3)x–(TiO2)1 – x nano-structured porous catalysts grown by micro-arc oxidation method: Characterization and formation mechanism // Mater. Chem. Phys. 2010. V. 124. № 1. P. 203–207. https://doi.org/10.1016/j.matchemphys.2010.06.020
Walling C., Goosen A. Mechanism of the ferric ion catalyzed decomposition of hydrogen peroxide. Effect of organic substrates // J. Am. Chem. Soc. 1973. V. 95. № 9. P. 2987–2991. https://doi.org/10.1021/ja00790a042
Nadtochenko V., Kiwi J. Photolysis of FeOH2+ and FeCl2+ in aqueous solution. Photodissociation kinetics and quantum yields // Inorg. Chem. 1998. V. 37. P. 5233–5238. https://doi.org/10.1021/ic9804723
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов