Физикохимия поверхности и защита материалов, 2022, T. 58, № 5, стр. 480-488
Анализ сорбционной активности яблочного пектина, модифицированного органическими фармакофорами по отношению к катионам d-металлов (Cu2+, Co2+, Mn2+)
Р. Х. Мударисова 1, *, А. Ф. Сагитова 2, О. С. Куковинец 2
1 Уфимский институт химии УФИЦ РАН
Уфа, Россия
2 Башкирский государственный университет
Уфа, Россия
* E-mail: mudarisova@anrb.ru
Поступила в редакцию 27.01.2022
После доработки 30.05.2022
Принята к публикации 06.06.2022
- EDN: HGSIVN
- DOI: 10.31857/S0044185622050175
Аннотация
Представлены результаты изучения сорбции катионов d-металлов (Cu2+, Co2+ и Mn2+) из водных растворов их солей сорбентами на основе яблочного пектина, модифицированного органическими фармакофорами (салициловой, антраниловой, 5-аминосалициловой, никотиновой кислотами). Определено влияние структуры введенного фармакофора в пектиновую матрицу на кинетику и термодинамику распределения ионов d-металлов в гетерофазной системе водный раствор–биополимерный сорбент. Выявлено увеличение эффективности извлечения ионов d-металлов фармакофорсодержащими пектиновыми сорбентами по сравнению с исходным полисахаридом. Подобраны оптимальные условия сорбции ионов Cu2+, Co2+ и Mn2+ исследуемыми сорбентами (время контакта фаз, рН среды, температура). Предложен механизм взаимодействия ионов d-металлов с модифицированным пектиновым сорбентом.
ВВЕДЕНИЕ
Природный полисахарид пектин (ПК) является одним из наиболее распространенных и эффективных биосорбентов, обладающих комплексом полезных свойств – низкой токсичностью, разнообразной биологической активностью, способностью к биодеградации и может быть получен из доступного, дешевого и возобновляемого природного сырья [1–3]. Благодаря наличию свободных карбоксильных групп в мономерных фрагментах основной цепи полимера, пектиновые полисахариды образуют с металлами стойкие малодиссоциирующие соединения – хелаты, которые не распадаются и не подвергаются метаболизму при прохождении через желудочно-кишечный тракт. Данное свойство пектинов широко используется для выведения тяжелых металлов и радионуклидов из организма человека [4–9]. Следует отметить, что нативный ПК не удовлетворяет всему широкому спектру требований, предъявляемых сегодня к сорбционным материалам, что ограничивает возможности его применения в ряде перспективных областей. Для повышения сорбционной активности ПК широко применяют различные способы его модификации [10–16]. Одним из эффективных способов является комплексообразование ПК путем введения в полимерную матрицу биологически активных органических соединений, имеющих сорбционно-активные функциональные группы [17–19]. При этом наблюдается изменение гидрофильности, заряда макромолекулы полимера, комплексообразующей способности, морфологических и структурных характеристик пектина, что может отражаться на его сорбционных свойствах [20–25].
В связи с этим, целью настоящей работы является изучение сорбционных свойств яблочного пектина, модифицированного органическими фармакофорами (салициловой, антраниловой, 5‑аминосалициловой и никотиновой кислотами) по отношению к ионам d-металлов (Cu2+, Co2+, Mn2+) и установление взаимосвязи структуры биосорбентов с его сорбционной активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сорбента выбран яблочный пектин товарной марки Unipectine XPP 240 с молекулярной массой 26 кDa и степенью этерифицирования 66.0%.
Структурная формула макромолекулы пектина
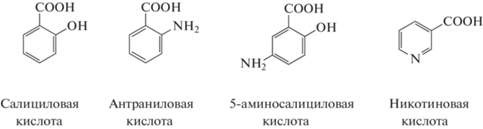
В качестве модифицирующих агентов использовали никотиновую (НК), антраниловую (АК), 5-аминосалициловую (5АСК) и салициловую (СК) кислоты марки “ч. д. а.”.
Структурные формулы фармакофоров.
В качестве источников ионов Cu2+, Co2+ и Mn2+ использовали сернокислую медь–CuSO4⋅ ⋅5H2O, хлористый кобальт – СоCl2⋅6H2O, хлористый марганец – MnCl2⋅4H2O марки “ч. д. а.”.
Методика получения пектиновых сорбентов: растворяли 1.0 г ПК (5.68 осново-ммоль) в 20 мл дистиллированной воды и 5.68 ммоль фармакофора (ФК) в 20 мл дистиллированной воды и доводили pH до 7.0 ± 0.1 раствором 0.1 М NaOH. К раствору ПК при постоянном перемешивании прикапывали раствор ФК при температуре 25°С и выдерживали в течение 4–5 ч. По окончании реакции продукт выделяли осаждением ацетоном, переосаждали в этиловый спирт, осадок отделяли и промывали еще три раза этиловым спиртом, затем диэтиловым эфиром и высушивали в вакууме. Изучение структуры фармакофорсодержащих пектинов представлено в работе [17].
Структурно-адсорбционные характеристики фармакофорсодержащих пектинов (ФП) представлены в табл. 1. Пористость W сорбентов находили методом суммарной пористости по ацетону, а площадь удельной поверхности Sуд определяли по адсорбции метиленового синего [26]. Характеристическую вязкость [η] водных растворов ПК и ФП измеряли при 25.0 ± 0.1°С в вискозиметре Уббелоде с висячим уровнем [27]. Значения характеристической вязкости рассчитывали методом двойной экстраполяции зависимостей ηуд/С к нулевой концентрации. Ошибка определения составляет 3–5%. ИК-спектры образцов записывали на спектрометре Shimadzu IR-Prestige-21 (700–3600 см–1, вазелиновое масло). УФ-спектры водных растворов соединений снимали в кварцевых кюветах толщиной 1 см на спектрофотометре UV-VIS SPECORD M-40. Кислотность растворов контролировали на pH–метре “АНИОН 4100”. Необходимую кислотность раствора создавали растворами НCl и NaOH. Величину удельного вращения измеряли на поляриметре “Perkin-Elmer” (модель 141). Содержание свободных карбоксильных групп в образцах определяли по методике [28]. Фармакофорсодержащие пектиновые сорбенты анализировали на азот, углерод и водород на анализаторе марки EUKO EA-3000. Диаметры частиц образцов определяли в вазелиновом масле методом лазерного рассеяния на приборе Sald 7101 (Shimadzu). Длина волны полупроводникового лазера 375 нм. Рабочий диапазон измерения диаметров частиц 10 нм–300 мкм. Измерения проводили в специальных кварцевых кюветах Sald-BC с механическим вертикальным перемешиванием при комнатной температуре. В кювете и камере для измерения создавали инертную атмосферу с помощью сухого очищенного аргона. Для сравнительной характеристики частиц по размеру были взяты медианные размеры частиц, соответствующие точке на дифференциальной кривой распределения, слева и справа от которой находится по 50% площади под кривой распределения. Ошибка измерения составляет 1%.
Таблица 1.
Физико-химические характеристики биосорбентов
| Показатель | Полисахаридная матрица | ||||
|---|---|---|---|---|---|
| ПК | ПК-СК | ПК-АК | ПК-5АСК | ПК-НК | |
| Сэксп/Стеор, % | 40.3/42.1 | 47.2/46.2 | 46.0/44.4 | 45.3/44.3 | 44.8/42.9 |
| Нэксп/Нтеор, % | 5.5/4.9 | 5.0/4.6 | 5.2/4.7 | 5.0/4.9 | 4.8/4.2 |
| Nэксп/Nтеор, % | – | – | 4.9/3.5 | 5.0/3.4 | 5.4/3.6 |
| W, см3/г | 0.63 | 0.90 | 0.75 | 0.77 | 0.87 |
| Sуд (теор.), м2/г | 210.8 | 240.8 | 228.7 | 219.2 | 218.2 |
| D, мкм | 1.79 | 0.71 | 1.08 | 0.84 | 1.40 |
| [η], дл/г | 2.3 | 0.9 | 1.1 | 0.8 | 3.5 |
| рКа | 4.5 | 2.5 | 3.9 | 3.6 | 4.1 |
| Свободные СООН-группы, % | 7.65 | 5.54 | 7.56 | 7.25 | 6.17 |
| λmax, нм | 210 | 303 | 304 | 310 | 265 |
| $\alpha _{{\text{D}}}^{{20}}$ (град см3)/(дм г) | +180 ± 2 | +84 ± 2 | +47 ± 1 | +52 ± 2 | +115 ± 2 |
Константы кислотной диссоциации pKa (табл. 1) определяли методом потенциометрического титрования раствором 0.5 М NaOH [29]. Расчет значений констант кислотной диссоциации функциональных групп биополимера проводили с использованием уравнения Гендерсона–Гассельбаха: рКа = рН + lg[HA]/[A–] (1), где [HA] – концентрация ФП, оставшаяся после добавления каждой кратной порции раствора 0.5 М NaOH; [A–] – концентрация иона пектата после нейтрализации ОН-группы в результате титрования добавлением 0.1 части раствора 0.5 М NaOH.
Изучение процесса сорбции ФП ионов Cu2+, Со2+, Mn2+ осуществляли в статических условиях при перемешивании и термостатировании при 298 К и при оптимальном значении рН для каждой сорбционной системы. Для получения кинетических кривых сорбции в серию пробирок (V = 20 мл) помещали навески сорбента по 0.1 г, заливали их 2 мл водного раствора сульфата меди(II) или хлорида кобальта(II) или хлорида марганца(II) с начальной концентрацией 0.1 моль/л, доводили до 20 мл дистиллированной водой и выдерживали от 15 до 240 мин. Начальная концентрация (С0) ионов Cu2+, Со2+ и Mn2+ составляла 0.01 моль/л. Через каждые 15 мин раствор отделяли от сорбента фильтрованием и определяли в нем текущую концентрацию (Сτ) ионов Cu2+ методом йодометрического титрования [30], ионов Cо2+ – титрованием броматом калия в присутствии индигокармина [31], ионов Mn2+ – спектрофотометрическим методом [30].
Сорбционную емкость (Аt) сорбентов в момент времени t рассчитывали по формуле: Аt = (С0 – Сt) V/m. В условиях установившегося равновесия в системе определяли равновесную концентрацию ионов металла (М2+) в растворе (Ср) и рассчитывали равновесную сорбционную емкость (Ар): Ар = (С0 – Ср) V/m. Степень извлечения ионов металлов (II) определяли по формуле: α = (С0 – Ср) × 100%/С0.
Термодинамические параметры сорбции рассчитывали по уравнениям [32]:
Уравнение (2) показывает, что в графической форме температурная зависимость lnKD = f(1/T) представляет собой прямую, тангенс угла наклона которой позволяет найти ΔH°/R, а отсечение на графике дает ΔS°/R. Изменение свободной энергии Гиббса ΔG° вычисляли по уравнению (3).
Относительная погрешность экспериментов рассчитывалась на основании данных равновесных и кинетических опытов, в которых каждая точка представляет собой среднее значение из трех параллельных опытов. Погрешность эксперимента не превышала 5–7%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для определения предельной сорбционной емкости ФП получены экспериментальные изотермы сорбции ионов Cu2+, Со2+ и Mn2+ из водных растворов их солей (рис. 1), которые обработаны в рамках двух уравнений адсорбции: Ленгмюра и Фрейндлиха, наиболее часто используемых исследователями при описании полученных изотерм сорбции ионов различных металлов пектинсодержащими материалами [33–37]. Обнаружено, что по сравнению с моделью Фрейндлиха модель Ленгмюра дает хорошую сходимость с экспериментальными результатами, о чем свидетельствуют высокие коэффициенты корреляции, полученные при линеаризации экспериментальных изотерм (табл. 2). Это свидетельствует в пользу того, что на поверхности сорбента образуется мономолекулярный сорбционный слой и все активные центры энергетически эквивалентны. Константа сорбционного равновесия KD в уравнении Ленгмюра и параметр К в уравнении Фрейндлиха характеризуют химическое сродство сорбата к сорбенту. Сродство сорбата к сорбенту определяется его свойствами и, следовательно, степень влияния сорбента на величину сорбционной емкости определяется химической природой его поверхности и размером пор. Из полученных результатов видно, что наибольшим сродством к катионам М2+ обладает сорбент ПК-СК (табл. 2), что закономерно для данной системы, обладающей самой высокой сорбционной емкостью и площадью удельной поверхности (табл. 1).
Таблица 2.
Параметры обработки изотерм сорбции ионов Co2+ биосорбентами по уравнению Ленгмюра и Фрейндлиха
| Биосорбент | Обработка изотерм по уравнению Ленгмюра | Обработка изотерм по уравнению Фрейндлиха | ||||
|---|---|---|---|---|---|---|
| А∞ | КD, л/ммоль | R2 | K, ммоль/г | n | R2 | |
| ПК | 1.59 | 0.53 | 0.998 | 0.62 | 1.18 | 0.979 |
| ПК-СК | 1.78 | 0.67 | 0.996 | 0.78 | 1.64 | 0.978 |
| ПК-АК | 1.73 | 0.65 | 0.996 | 0.76 | 1.55 | 0.974 |
| ПК-5АСК | 1.60 | 0.63 | 0.996 | 0.68 | 1.31 | 0.985 |
| ПК-НК | 1.74 | 0.61 | 0.990 | 0.73 | 1.54 | 0.957 |
Исследование кинетических закономерностей сорбции ионов Cu2+, Co2+ и Mn2+ из водных растворов их солей пектиновыми сорбентами показало, что время достижения равновесия в системе “фармакофорсодержащий пектин-водный раствор соли металла (II)” сокращается по сравнению с нативным пектином в 1.3–6.0 раз, а степень извлечения (α) ионов М2+ увеличивается до 12.5% в зависимости от природы ФП и иона М2+ (рис. 2, табл. 3). Различие в сорбционной способности ФП по отношению к катионам M2+ можно объяснить появлением новых функциональных групп, ответственных за взаимодействие с катионами М2+, а также изменением структурно-адсорбционных характеристик ФП (табл. 1), что приводит к повышению доступности активных центров сорбентов. На примере сорбции ионов Со2+ фармакофорсодержащими пектинами видно (рис. 2), что в начальный период процесса количество сорбирующегося на поверхности ФП катионов Со2+ увеличивается быстро, а затем, по мере приближения к равновесию, сорбционный процесс замедляется, что может указывать на быстрый массоперенос катионов М2+ из раствора к активным центрам сорбентов с последующим химическим связыванием катионов М2+ с активными центрами пектиновых сорбентов на их поверхности.
Рис. 2.
Интегральные кинетические кривые сорбции ионов Со2+ биосорбентами из водного раствора хлорида кобальта(II).

Таблица 3.
Сорбционные характеристики биосорбентов по отношению к ионам Cu2+, Co2+, Mn2+
| Показатель | Биосорбент | ||||
|---|---|---|---|---|---|
| ПК | ПК-СК | ПК-АК | ПК-5АСК | ПК-НК | |
| α (Cu2+), % | 83.0 | 95.5 | 84.4 | 85.7 | 83.6 |
| Аэксп, ммоль/г | 1.66 | 1.91 | 1.69 | 1.71 | 1.67 |
| t, мин | 60 | 10 | 45 | 15 | 45 |
| α (Cо2+), % | 79.5 | 89.1 | 86.7 | 80.1 | 87.2 |
| Аэксп, ммоль/г | 1.59 | 1.78 | 1.73 | 1.60 | 1.74 |
| t, мин | 60 | 45 | 40 | 45 | 45 |
| α (Mn2+), % | 74.4 | 86.0 | 85.2 | 80.1 | 74.5 |
| Аэксп, ммоль/г | 1.49 | 1.72 | 1.70 | 1.60 | 1.49 |
| t, мин | 120 | 90 | 90 | 90 | 60 |
Процесс сорбции ионов М2+ исследуемыми сорбентами зависит от многих факторов, таких как pH среды, температура, природа биосорбента, которая, в свою очередь, определяется природой и содержанием функциональных групп, надмолекулярной структурой, поверхностными свойствами и т.д. Известно [5], что кислотность среды оказывает решающее влияние на ионный обмен и комплексообразование, электростатические взаимодействия при физической адсорбции и заряд поверхности сорбента. Зависимость степени извлечения ионов M2+ биосорбентами от кислотности водной фазы имеет экстремальный характер с максимумом сорбции в интервале рН 6.0–7.0 для ионов Cu2+ (рис. 3), рН 4.0–7.2 для ионов Cо2+, pH 4.0–6.0 для ионов Mn2+ в зависимости от структуры введенного в пектин фармакофора. В области низких рН отсутствие сорбции ионов Cu2+, Co2+ и Mn2+ можно объяснить конкуренцией за сорбционные центры сорбента между ионами M2+ и H+. С ростом рН среды возрастает количество свободных сорбционных центров на сорбенте, что приводит к существенному росту величины сорбционной емкости. В области максимума сорбционно-активные группы сорбента находятся в диссоциированном состоянии (СОО–). В сильно щелочной области рН происходит образование осадка гидроксида металла (II).
Обнаружено, что с увеличением температуры от 273 до 333 К степень извлечения ионов M2+ фармакофорсодержащими пектинами заметно снижается. Термодинамические параметры ΔH°, ΔS° и ΔG° сорбционного процесса представлены в табл. 4. Значения ΔH° имеют отрицательные величины, что свидетельствует об экзотермичности процесса сорбции, который можно рассматривать как обратимую хемосорбцию с участием сорбционных центров и молекул растворителя в реакциях сольватации и комплексообразования [38]. Отрицательное значение ΔG° свидетельствует о смещении равновесия в сторону перехода ионов M2+ из водного раствора в фазу сорбента. Что касается энтропии, то она принимает как положительные, так и отрицательные значения в зависимости от природы компонентов сорбционной системы. Так, в случае сорбции ионов Cu2+ нативным пектином, ПК-5АСК, ПК-АК и ПК-НК, значения ΔS° положительны, что, вероятно, связано с изменением структуры биополимерного материала, приводящего к росту беспорядка системы, тогда как отрицательные величины энтропии в процессах сорбции ионов Co2+ и Mn2+ пектиновыми сорбентами могут указывать на увеличение упорядоченности при взаимодействии иона М2+ с поверхностью сорбента. Таким образом, исследование равновесия сорбции ионов Cu2+, Co2+, Mn2+ фармакофорсодержащими пектинами в интервале температур 273–333 К показало, что оптимальные условия процесса для каждого образца индивидуальны и зависят от температурного режима.
Таблица 4.
Термодинамические параметры сорбции ионов Cu2+, Со2+ и Mn2+ биосорбентами
| Сорбционная система | ∆H°, кДж/моль | ∆S°, Дж/моль К | $\Delta G_{{298}}^{^\circ }$, кДж/моль |
|---|---|---|---|
| ПК–Cu2+ | –6.2 ± 0.2 | 35.9 ± 0.8 | –16.7 ± 0.4 |
| ПК–СК–Cu2+ | –27.2 ± 0.5 | –27.9 ± 0.7 | –19.0 ± 0.2 |
| ПК–АК–Cu2+ | –4.7 ± 0.1 | 41.8 ± 0.2 | –16.9 ± 0.2 |
| ПК–5АСК–Cu2+ | –10.4 ± 0.5 | 22.4 ± 0.6 | –16.9 ± 0.2 |
| ПК–НК–Cu2+ | –11.7 ± 0.2 | 16.3 ± 0.4 | –16.5 ± 0.3 |
| ПК–Со2+ | –34.9 ± 0.5 | –68.3 ± 0.8 | –14.9 ± 0.5 |
| ПК–СК–Со2+ | –31.5 ± 0.5 | –46.5 ± 0.4 | –17.8 ± 0.4 |
| ПК–АК–Со2+ | –21.1 ± 0.6 | –14.0 ± 0.6 | –17.0 ± 0.1 |
| ПК–5АСК–Со2+ | –22.7 ± 0.5 | –25.2 ± 0.4 | –15.4 ± 0.2 |
| ПК–НК–Со2+ | –36.9 ± 0.2 | –68.8 ± 0.3 | –16.7 ± 0.5 |
| ПК–Mn2+ | –24.3 ± 0.5 | –26.8 ± 0.4 | –16.4 ± 0.1 |
| ПК–СК–Mn2+ | –48.7 ± 0.4 | –113.7 ± 0.7 | –15.4 ± 0.2 |
| ПК–АК–Mn2+ | –45.6 ± 0.6 | –100.5 ± 0.5 | –16.2 ± 0.3 |
| ПК–5АСК–Mn2+ | –37.5 ± 0.7 | –74.0 ± 0.6 | –15.7 ± 0.5 |
| ПК–НК–Mn2+ | –23.4 ± 0.5 | –29.5 ± 0.7 | –14.7 ± 0.2 |
Разнообразие моделей и механизмов сорбции, описывающих распределение веществ между фазами, во многом определяется многообразием природы межмолекулярных взаимодействий. Чтобы определить характер взаимодействия металлов с исследуемыми сорбентами, важно установить какие функциональные группы отвечают за связывание ионов М2+. Известно [7, 10, 24, 39], что активными центрами пектиновых полисахаридов могут служить карбоксильные, гидроксильные и гликозидные группы элементарного звена ПК, связывающие ионы М2+ по механизму ионного обмена и комплексообразования.
Возможность комплексообразования ФП с катионами Cu2+, Co2+ и Mn2+ изучали методами УФ- и ИК-спектроскопии. Так, при взаимодействии ФП с ионами M2+ образуются комплексные соединения, что подтверждается смещением их λmax в УФ-спектрах и увеличением интенсивности полос поглощения (ПП) по сравнению с индивидуальными компонентами системы [40]. Методом ИК-спектроскопии выявлены спектральные области, в которых наиболее заметно наблюдались различия в характере и интенсивности полос поглощения ФП по сравнению с их металлокомплексами. Первая область изменений относится к ПП валентных колебаний гидроксильных групп, ассоциированных водородной связью (3400–3200 см–1). Значительный сдвиг ПП ν(OH–) в низкочастотную область в присутствии катионов М2+ (10–150 см–1) свидетельствует о координации катионов М2+ к гидроксильным группам ФП, что приводит к образованию прочных хелатных комплексов. Во второй области ИК-спектров наблюдается исчезновение ПП карбоксильных групп 1740–1700 см–1 и появление характерной ПП для карбоксианиона 1610–1590 см–1.В третьей из наблюдаемых областей в ИК-спектрах металлокомплексов происходит изменение контура ПП ν(С-О) пиранозного цикла (1200–1000 см–1), наблюдается высокочастотный сдвиг, обусловленный образованием связи ионов указанных М2+ с кислородным атомом пиранозного цикла. Данные УФ- и ИК-спектров свидетельствуют о координационном взаимодействии ПК и ФП с катионами М2+ не только за счет СООН-групп, но и посредством ОН– и С–О групп полимерной матрицы.
На основании литературных [4, 7, 10, 24, 37] и полученных нами экспериментальных данных, можно предположить, что механизмом сорбции ионов d-металлов фармакофорсодержащими пектинами является ионный обмен и комплексообразование по следующей схеме (рис. 4).
ЗАКЛЮЧЕНИЕ
Таким образом, путем модифицирования яблочного пектина органическими фармакофорами получены новые биосорбенты, обладающие высокой сорбционной активностью по отношению к ионам Cu2+, Co2+, Mn2+. Рядом физико-химических методов анализа изучены структурно-адсорбционные характеристики полученных сорбентов. Обнаружено, что модификация пектина фармакофорами приводит к увеличению пористости и удельной поверхности, уменьшению размера частиц и изменению кислотно-основных свойств в зависимости от природы органической кислоты, что обуславливает более высокую адсорбционную способность фармакофорсодержащих пектинов по отношению к ионам Cu2+, Co2+, Mn2+ по сравнению с нативным пектином. Установлено, что сорбционная емкость фармакофорсодержащих пектинов изменяется в рядах: ПК-СК > ПК-5АСК > ПК-АК > ПК-НК > ПК при извлечении ионов Cu2+; ПК-СК > ПК-НК > ПК-АК > ПК-5АСК > ПК при извлечении ионов > Co2+; ПК-СК > ПК-АК > ПК-5АСК > ПК-НК > ПК при извлечении ионов Mn2+. Показано, что зависимость величины сорбционной емкости от равновесной концентрации ионов Cu2+, Co2+ и Mn2+ подчиняется уравнению Ленгмюра. Увеличение степени сродства ионов М2+ к поверхности ФП изменяется в ряду Cu2+ > Co2+ > Mn2+, что соответствует эмпирическому ряду Ирвинга–Уильямса, который отражает влияние электростатических эффектов на величины сорбционной емкости сорбентов. Подобраны оптимальные условия проведения процесса сорбции ионов Cu2+, Co2+ и Mn2 исследуемыми сорбентами, при которых достигаются максимальные значения сорбционной емкости (время контакта фаз – 10–90 мин, рН 4.0–6.0, Т = 273 К). Согласно рассчитанным термодинамическим параметрам процесса сорбции ионов Cu2+, Co2+ и Mn2+ пектиновыми сорбентами установлено, что сорбция ионов М2+ полисахаридными материалами представляет собой экзотермический процесс, который можно рассматривать как химическую адсорбцию. На основании полученных результатов предложен механизм сорбции ионов d-металлов (Cu2+, Co2+ и Mn2+) фармакофорсодержащими пектинами, который представляет собой сложный процесс, включающий как ионный обмен, так и образование металлокомплексов.
Анализы (измерения и расчеты) выполнены на оборудовании ЦКП “Химия” УфИХ РАН и РЦКП “Агидель” УФИЦ РАН. Статья подготовлена в рамках выполнения программы ФНИ государственных академий на 2013–2020 гг. Гос. задание № 1021062311391-0-1.4.4.
Список литературы
Bush P.L. Pectin. Chemical properties. Uses and health benefits. Nova Science Publishers, Inc. New York, 2014. 268 p.
Sriamornsak P. // Silpakorn University International Journal. 2003. V. 3. P. 206–228.
Thakur B.R., Singh R.K., Handa A.K. // Critical Reviews in Food Science and Nutrition. 1997. V. 37. P. 47–73.
Кайшева Н.Ш., Кайшев А.Ш. Фармакохимические основы применения пектинов и альгинатов. Пятигорск: РИА-КМВ, 2016. 260 с.; Kaisheva N.S., Kaishev A.S. Pharmacokhimicheskie osnovy primeneniya pectinov i alginatov (Pharmacochemical bases of application of pectins and alginates), Pyatigorsk: RIA-KMV, 2016. 260 p.
Хотимченко Ю.С., Одинцова М.В., Ковалев В.В. Полисорбовит. Томск: Изд-во НТЛ, 2001. 132 с.; Khotimchenko Yu.S., Odintsovа M.V., Kovalev V.V. Polysorbovit, Tomsk: NTL, 2001. 132 p.
Uryash V.F., Kokurina N.Yu., Gruzdeva A.E. et al. // J. General Chemistry. 2017. V. 87. № 13. P. 3212–3219.
Khotimchenko M.Y., Kolenchenko E.A., Khotimchenko Y.S. et al. // Colloids and Surfaces B: Biointerfaces. 2010. V. 77. P. 104–110.
Aleeva S.V., Chistyakova G.V., Lepilova O.V. et al. // Russian J. Physical Chemistry A. 2018. V. 92. № 8. P. 1583–1589.
Balaria A., Schiewer S. // Separation and Purification Technology. 2008. V. 63. № 3. P. 577–581.
Kupchik L.A., Kartel N.T., Bogdanov E.S. et al. // Russian J. Applied Chemistry. 2006. V. 79. № 3. P. 457–460.
Yamada M., Shiiba S. // J. Applied Polymer Science. 2015. V. 132. № 24. P. 42056.
Gong J.-L., Wang X.-Y., Zeng G.-M. et al. // Chemical Engineering J. 2012. V. 185–186. P. 100–107.
Zauro S., Vashalakshi B. // Separation Science and Technology. 2018. V. 53. № 14. P. 2170–2185.
Sivagangi R.N., Rao K.M., Vani T.S. et al. // Desalination and Water Treatment. 2016. V. 57. № 14. P. 1–12.
Li F.T., Yang H., Zhao Y. et al. // Chinese Chemical Letters. 2007. V. 18. P. 325–328.
Guo J.J., Zhang J.Y., Yue Y. et al. // Bulgarian Chemical Communications. 2014. V. 46. P. 801–805.
Mudarisova R., Kukovinets O., Sagitova A. et al. // Biointerface Research in Applied Chemistry. 2020. V. 10. № 4. P. 5724–5732.
Минзанова С.Т., Чекунков Е.В., Милюков В.А. и др. // Докл. Российской академии наук. Химия, науки о материалах. 2020. Т. 491. № 1. С. 49–54; Minzanova S.T., Chekunkov E.V., Milyukov V.A. et al. // Doklady Physical Chemistry. 2020. Т. 491. № 1. Р. 24–28.
Мударисова Р.Х., Куковинец О.С., Колесов С.В. и др. // Журн. физической химии. 2021. Т. 95. № 9. С. 1379–1384; Mudarisova R.Kh., Kukovinets O.S., Kolesov S.V. et al. // Russian J. Physical Chemistry A. 2021. V. 95. №. 9. Р. 1835–1840.
Aqdas N., Zill-i-Huma N., Javeria A. et al. // International J. Biological Macromolecules 2017. V. 101. P. 254–272.
Wang R., Liang R., Dai T. // Trends in Food Science Technology. 2019. V. 91. P. 319–329.
Bhuyan M., Okabe H., Hidaka Y. et al. // J. Applied Polymer Science. 2018. V. 135. P. 45906.
Praveen Sharma, Kshipra Sen, Pankaj Thakur, Manoj Chauhan, Kalpana Chauhan // International J. Biological Macromolecules. 2019. V. 140. P. 78–90.
Сагитова А.Ф., Мударисова Р.Х., Куковинец О.С., Ахметшина Л.И // Вестник Башкирского университета. 2018. Т. 23. № 2. С. 323–328; Sagitova A.F., Mudarisova R.Kh., Kukovinets O.S., Akhmetshina L.I. // Bulletin of Bashkir University. 2018. V. 23. № 2. P. 323–328.
Liang R., Li Y., Huang Li, et al. // Carbohydrate Polymers. 2020. V. 234. P. 115911.
Hang P.T., Brindley G.W. // Clays and Clay Minerals. 1970. V. 18. P. 203–212.
Рафиков С.Р., Будтов В.Т., Монаков Ю.Б. Введение в физико-химию растворов полимеров. М.: Наука, 1978. 328 с.; Rafikov S.R., Budtov V.T., Monakov Yu.B. Vvedenie v phiziko-khimiyu rastvorov polimerov (Introduction to the physico-chemistry of polymer solutions), Moscow: Nauka, 1978. 328 p.
Донченко Л.В. Технология пектинов и пектинопродуктов. М.: ДеЛи, 2000. 256 с.; Donchenko L.V. Technologiya pectinov i pectinoproductov (Technology of pectins and pectin products), Moscow: DeLi, 2000. 256 p.
Альберт A., Сержент E. Константы ионизации кислот и оснований. Москва, Ленинград: Химия, 1964. 380 c.; Albert A., Sergeant E. Konstanty ionizacii kislot i osnovanii (Ionization constants of acids and bases), Moscow, Leningrad: Chemistry, 1964. 380 p.
Золотов Ю.А. Основы аналитической химии. Практическое руководство. М.: Высшая школа, 2001. 463 с.; Zolotov Yu.A. Osnovy analiticheskoy khimii. Practicheskoe rukovodstvo (Fundamentals of analytical chemistry. Practical guide), Moscow: Higher School, 2001. 463 p.
Korenman I.M. New titrometric methods. M.: Chemistry, 1983. 173 p.
Hawari A., Rawajfih Z., Nsour N. // J. Hazardous Materials. 2009. V. 168. P. 1284–1289.
Koksharov S.A., Aleeva S.V., Lepilova O.V. // J. Molecular Liquids. 2019. V. 283. P. 606–616.
Nikiforova T.E., Kozlov V.A. // Protection of metals and physical chemistry of surfaces. 2016. V. 52. № 3. P. 399–424.
Khotimchenko M.Y., Kolenchenko E.A., Khotimchenko Yu.S. // J. Colloid and Interface Science. 2008. V. 323. P. 216–222.
Nikiforova T.E., Kozlov V.A., Sionikhina A.N. // Protection of metals and physical chemistry of surfaces. 2019. V. 55. № 5. P. 849–857.
Lia J., Yang Z., Ding T. et al. // Carbohydrate Polymers. 2022. V. 276. P. 118789.
Farooq U., Kozinski J, Mishabul A. et al. // Bioresource Technology. 2010. V. 101. P. 5043–5053.
Wang R., Liang R., Dai T. // Trends in Food Science Technology. 2019. V. 91. P. 319–329.
Мударисова Р.Х., Сагитова А.Ф., Куковинец О.С. и др. // Журн. общей химии. 2020. Т. 90. № 4. С. 604–612; Mudarisova R.Kh., Sagitova A.F., Kukovinets O.S. et al. // Russian J. General Chemistry. 2020. V. 90. №. 4. P. 660–666.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов