Зоологический журнал, 2019, T. 98, № 4, стр. 407-414
Паразитоиды (Hymenoptera) липовой моли-пестрянки (Phyllonorycter issikii, Lepidoptera, Gracillariidae) разных городов Российской Федереции и роль этих паразитоидов в смертности инвазивного вида
И. В. Ермолаев 1, 3, *, З. А. Ефремова 2, **, Н. А. Герасимова 1, Е. А. Королёва 1, Н. Н. Лушников 1, А. И. Петров 1, А. А. Пчельников 1
1 Удмуртский государственный университет
426034 Ижевск, Россия
2 Тель-Авивский университет
69978 Тель-Авив, Израиль
3 Тобольская комплексная научная станция УрО РАН
626152 Тобольск, Россия
* E-mail: ermolaev-i@yandex.ru
** E-mail: eulophids@mail.ru
Поступила в редакцию 23.03.2018
После доработки 18.05.2018
Принята к публикации 10.07.2018
Аннотация
Впервые исследованы комплексы паразитоидов инвазивного вида липовой моли-пестрянки (Phyllonorycter issikii, Lepidoptera, Gracillariidae) городов Москва, Нижний Новгород, Казань, Екатеринбург и Тюмень. В общей сложности выявлено двенадцать видов семейства Eulophidae, один вид из семейства Braconidae. Achrysocharoides altilis впервые отмечен в качестве паразитоида минера. Смертность гусениц и куколок Ph. issikii от паразитоидов была незначительной и варьировала от 1.4 ± 0.4 (Казань) до 15.5 ± 2.4% (Тюмень).
Данные о видовой структуре комплекса паразитоидов инвазивного вида липовой моли-пестрянки (Phyllonorycter issikii, Lepidoptera, Gracillariidae) на территории РФ крайне малочисленны и носят исключительно фрагментарный характер. На сегодняшний день на территории страны известен 31 вид из семейства Eulophidae, выведенных из минера.
Первые исследования паразитоидов Ph. issikii были проведены в Московской обл. На территории Приокско-Террасного заповедника (Осипова, 1992) из минера был выведен ряд паразитоидов: Eulophidae (виды родов Pnigalio, Sympiesis, Chrysocharis и Tetrastichus), Trichogrammatidae (Trichogramma) и Braconidae (два не идентифицированных рода). В 2012−2013 гг. близ деревни Ожигово (Рузский р-н Московской обл.) из Ph. issikii было получено четыре вида эвлофид (Pnigalio agraules (Walker 1839), Hyssopus geniculatus (Hartig 1838), Chrysocharis laomedon Walker 1839, Mischotetrastichus petiolatus (Erdős 1961)) (Gokhman et al., 2014).
Исследование состава паразитокомплекса минёра в Новосибирской обл. показало наличие представителей родов Pnigalio и Chrysocharis (Eulophidae) (Кириченко, 2013). При этом смертность от паразитоидов составила не более 7% особей моли.
В Приморском крае Ph. issikii атакует Sympiesis laevifrons Kamijo 1965 (Сторожева и др., 1995).
Комплексные работы по изучению видовой структуры паразитоидов Ph. issikii были проведены лишь на территории двух субъектов РФ: в Ульяновской обл. и Удмуртской Республике.
Исследование, проведенное на территории Ульяновской области под руководством З.А. Ефремовой (Мищенко и др., 2007; Егоренкова, 2008; Мищенко, 2009; 2011; Ефремова, Мищенко, 2008; 2009; 2010; Yefremova, Mishchenko, 2012; Ефремова и др., 2009), позволило выявить двадцать видов. Восемнадцать из них были представителями эвлофид (Pnigalio soemius Walker 1839, Sympiesis gordius (Walker 1839), S. sericeicornis (Nees 1834), Cirrospilus diallus Walker 1838, C. elegantissimus Westwood 1832, C. lyncus Walker 1838, C. viticola (Rondani 1877), Hyssopus geniculatus, Pediobius cassidae Erdős 1958, P. metallicus (Nees 1834), Chrysocharis laomedon, Ch. pubicornis Zetterstedt 1838, Aprostocetus zoilus (Walker 1839), Minotetrastichus frontalis Nees 1834, Mischotetrastichus petiolatus, Oomyzus incertus (Ratzeburg 1844), Entedon sp., Aprostocetus sp.). Кроме того, был обнаружен Apanteles sp. (Braconidae) и не идентифицированный представитель семейства Pteromalidae. В 2006 г. общая средняя зараженность паразитоидами Ph. issikii в 22 пунктах Ульяновской обл. составила 21.4 ± 1.8% (Ефремова, Мищенко, 2008). Доминировали Sympiesis gordius (42%), Minotetrastichus frontalis (20%) и Chrysocharis laomedon (11%).
В течение 2001−2005 гг. на трех пробных площадях в г. Ижевске (Удмуртская Республика) было выявлено 23 вида паразитоидов Ph. issikii (Ермолаев и др., 2011). Из них 22 – представители эвлофид из трех подсемейств (Eulophinae, Entedoninae, Tetrastichinae) (Dicladocerus westwoodi Westwood 1832, Pnigalio nemati (Westwood 1838), P. soemius, Sympiesis dolichogaster Ashmead 1888, S. gordius, S. sericeicornis, Cirrospilus diallus, C. lyncus, C. pictus Nees 1834, C. vittatus Walker 1838, Elachertus fenestratus Nees 1834, Hyssopus geniculatus, H. nigritulus (Zetterstedt 1838), Chrysocharis laomedon, Ch. nephereus Walker 1839, Ch. pubicornis, Ch. phryne Walker 1839, Neochrysocharis formosus (Westwood 1833), N. cuprifrons Erdős 1954, Minotetrastichus frontalis, Mischotetrastichus petiolatus, Oomyzus incertus) и один (Apanteles sp.) из семейства Braconidae. Основу паразитокомлекса составили P. soemius, S. gordius и Ch. laomedon. Зараженность паразитоидами гусениц и куколок липовой моли-пестрянки не превышал 12.5% (Ермолаев и др., 2011). Повторное исследование пробных площадей в 2015 г. показало незначительную трансформацию структуры комплекса паразитоидов в виде сокращения числа и смене доминантных видов на M. frontalis, S. sericeicornis и S. gordius (Ермолаев и др., 2018). Маршрутное исследование 2016 г. позволило исследовать видовую структуру паразитиодов минера в 22 населенных пунктах Удмуртии, в том числе выявить пять новых паразитоидов липовой моли-пестрянки (Ермолаев и др., 2018). Это Pnigalio pectinicornis (Linnaeus 1758), Sympiesis acalle (Walker 1848), Chrysocharis amanus (Walker 1839), Ch. pentheus (Walker 1839) и Ch. polyzo (Walker 1839).
Цель представленной работы – исследовать видовую структуру паразитоидов (Hymenoptera, Eulophidae) липовой моли-пестрянки (Ph. issikii) в городах Москва, Нижней Новгород, Казань, Екатеринбург и Тюмень, а также оценить влияние паразитоидов на смертность моли.
МАТЕРИАЛ И МЕТОДИКА
Комплекс паразитоидов Ph. issikii исследовали по единой методике на примере популяций минера из городов Москва, Нижний Новгород, Казань, Екатеринбург и Тюмень. Эти города образуют линию (близ 56° с.ш.) с запада на восток протяженностью около 1720 км. В Москве работу провели в июне−июле 2016−2017 гг. в Филевском парке (55°75′ с.ш., 37°49′ в.д.), в Нижнем Новгороде, Казани, Екатеринбурге и Тюмени в июле 2017 г. – в городских парках “Швейцария” (56°30′ с.ш., 43°97′ в.д.), “Лебяжье” (55°84′ с.ш., 48°97′ в.д.), “XXII партсъезд” (56°83′ с.ш., 60°57′ в.д.) и близ п. Московский (57°11′ с.ш., 65°42′ в.д.), соответственно. Во всех случаях сборы листьев осуществляли с модельных деревьев липы мелколистной (Tilia cordata Mill.). В Москве было исследовано 30 деревьев, в Нижнем Новгороде и Казани – по 11, Екатеринбурге и Тюмени – 20 и 19, соответственно. В период окукливания молей первой генерации на ветвях первого порядка нижнего яруса северной экспозиции каждого дерева собирали в среднем по 60–70 листьев с минами. Мины были вырезаны ножницами и помещены в пластиковые боксы в соответствии с номером модельного дерева. Собранный материал оперативно был доставлен в г. Ижевск. Выход молей и паразитоидов фиксировали ежедневно в условиях полевой лаборатории на биостанции Удмуртского государственного университета “Сива”. В общей сложности в пяти городах было исследовано 91 модельное дерево липы, вырезано 9041 мин, выведено 6657 экз. Ph. issikii и 390 экз. паразитоидов.
Выведенные паразитоиды из семейств паразитических перепончатокрылых были определены З.А. Ефремовой. При определении видов рода Chrysocharis и Achrysocharoides использованы ключи для Пареарктических видов (Hansson, 1985; 1985a), видов рода Minotetrastichus − ключ для европейских видов Tetrastichinae (Graham, 1987), представителей семейства Braconidae − ключ для видов рода Pholetesor (Whitfield, 2006).
Рассчитывали следующие показатели:
R = 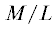 , где R − плотность заселения индивидуального модельного дерева первым поколением моли, M − общее число мин на трех модельных ветвях одной экспозиции нижнего яруса кроны,
L − общее число листьев на этих ветвях.
, где R − плотность заселения индивидуального модельного дерева первым поколением моли, M − общее число мин на трех модельных ветвях одной экспозиции нижнего яруса кроны,
L − общее число листьев на этих ветвях.
V = $B{\;}/N$ × 100, где V − выживаемость куколок, B − число вышедших из мин бабочек, N − общее число собранных мин.
P = W/N × 100, P – зараженность паразитоидами, W − общее число экземпляров паразитоидов, N − общее число собранных мин.
Во всех случаях рассчитывали среднее арифметическое значение и его ошибку. Статистическую обработку материала проводили стандартными методами (Ивантер, Коросов, 2011).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выход молей московской популяции происходил с 23 июня по 6 июля 2016 г. (с максимумами 24 и 27 июля), паразитоидов − с 24 июня по 8 июля (с максимумом 2 июля) (рис. 1). Выживаемость гусениц и куколок положительно и достоверно была связана со средней плотностью популяции моли (табл. 2) и была 73.5 ± 3.4% (табл. 1). Общая смертность составила 26.5 ± 3.4% и имела обратную зависимость от средней плотности заселения (r = −0.36, n = 30, P < 0.05). При этом смертность от неизвестных причин составила 24.7 ± 3.2%, а от паразитоидов только 1.8 ± 0.4% (табл. 1). В обоих случаях была выявлена достоверная отрицательная связь с плотностью заселения минером деревьев (табл. 2).
Рис. 1.
Динамика выхода моли Ph. isskii и ее паразитоидов (Москва, 2016 г.) в условиях полевой лаборатории.
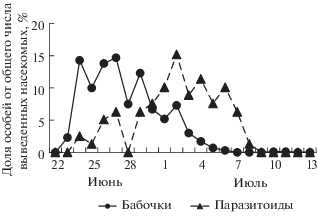
Таблица 1.
Выживаемость и смертность гусениц и куколок липовой моли-пестрянки Ph. issikii в пяти городах РФ
| Город | Плотность заселения модельного дерева, мин на лист | Выживаемость молей, % | Смертность молей, % | |
|---|---|---|---|---|
| паразитоиды | неизвестная причина | |||
| Москва* | 2.8 ± 0.3 | 73.5 ± 3.4 | 1.8 ± 0.4 | 24.7 ± 3.2 |
| Нижний Новгород | 0.06 ± 0.01 | 81.1 ± 1.7 | 2.1 ± 0.5 | 16.8 ± 1.8 |
| Казань | 0.29 ± 0.06 | 72.8 ± 4.4 | 1.4 ± 0.4 | 25.8 ± 4.5 |
| Екатеринбург | 0.03 ± 0.01 | 80.2 ± 2.4 | 6.9 ± 1.9 | 12.9 ± 1.4 |
| Тюмень | 0.08 ± 0.04 | 62.2 ± 3.6 | 15.5 ± 2.4 | 22.3 ± 2.5 |
Таблица 2.
Значения коэффициентов корреляции между показателями плотности заселения липы Ph. issikii и характеристиками выживаемости и смертности гусениц и куколок в городах РФ
| Город | Выживаемость молей, % | Смертность молей, % | |
|---|---|---|---|
| паразитоиды | неизвестная причина | ||
| Москва | r = 0.36*, n = 30 | r = −0.41*, n = 30 | r = −0.33*, n = 30 |
| Нижний Новгород | r = 0.03, n = 11 | r = −0.08, n = 11 | r = −0.01, n = 11 |
| Казань | r = 0.19, n = 11 | r = −0.36, n = 11 | r = −0.16, n = 11 |
| Екатеринбург | r = −0.06, n = 20 | r = 0.29, n = 20 | r = −0.30, n = 20 |
| Тюмень | r = −0.03, n = 19 | r = −0.19, n = 19 | r = 0.23, n = 19 |
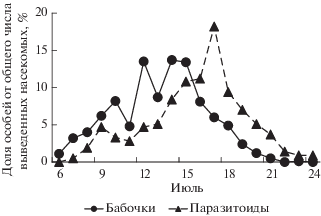
Выход из куколок молей нижегородской популяции наблюдали с 8 по 25 июля 2017 г. (с максимумом 17 июля), паразитоидов − с 16 по 24 июля (с максимумом 19 июля) (рис. 2). Выживаемость гусениц и куколок не коррелировала со средней плотностью популяции моли (табл. 2) и была 81.1 ± 1.7% (табл. 1). Общая смертность составила 18.9 ± 1.7% и не зависела от средней плотности заселения (r = −0.03, n = 11, P > 0.05). При этом смертность от неизвестных причин составила 16.8 ± 1.8, а от паразитоидов 2.1 ± 0.5% (табл. 1). В двух последних случаях смертность не была связана с плотностью заселения деревьев (табл. 2).
Рис. 2.
Динамика выхода моли Ph. isskii и ее паразитоидов (Нижний Новгород, 2017 г.) в условиях полевой лаборатории.
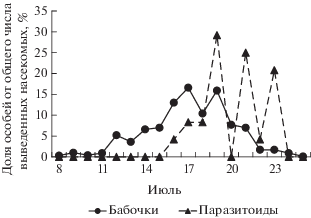
Выход молей казанской популяции происходил с 8 по 26 июля 2017 г. (с максимумом 20 июля), паразитоидов − с 15 по 29 июля (с максимумом 20 июля) (рис. 3). Выживаемость гусениц и куколок не была связана со средней плотностью популяции моли (табл. 2) и была 72.8 ± 4.4% (табл. 1). Общая смертность составила 27.2 ± 4.4% и не зависела от средней плотности заселения (r = −0.19, n = 11, P > 0.05). При этом смертность от неизвестных причин составила 25.8 ± 4.5, а от паразитоидов 1.4 ± 0.4% (табл. 1). В обоих случаях смертность не зависела от плотности заселения деревьев (табл. 2).
Рис. 3.
Динамика выхода моли Ph. isskii и ее паразитоидов (Казань, 2017 г.) в условиях полевой лаборатории.
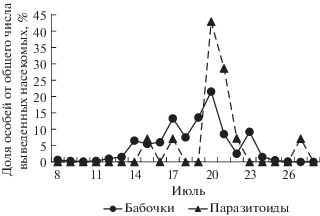
Появление молей уральской популяции наблюдали с 5 по 23 июля 2017 г. (с максимумом 14 июля), паразитоидов − с 8 по 29 июля (с максимумом 17 июля) (рис. 4). Выживаемость гусениц и куколок не коррелировала со средней плотностью популяции моли (табл. 2) и была 80.2 ± 2.4% (табл. 1). Общая смертность составила 19.8 ± 2.4% и не зависела от средней плотности заселения (r = = 0.06, n = 20, P > 0.05). При этом смертность от неизвестных причин составила 12.9 ± 1.4, а от паразитоидов 6.9 ± 1.9% (табл. 1). В двух последних случаях смертность не была связана с плотностью заселения деревьев (табл. 2).
Рис. 4.
Динамика выхода моли Ph. isskii и ее паразитоидов (Екатеринбург, 2017 г.) в условиях полевой лаборатории.
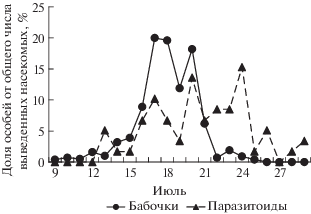
Выход молей тюменской популяции происходил с 6 по 21 июля 2017 г. (с максимумом 14 июля), паразитоидов − с 7 по 24 июля (с максимумом 17 июля) (рис. 5). Выживаемость гусениц и куколок не была связана со средней плотностью популяции моли (табл. 2) и была 62.2 ± 3.6% (табл. 1). Общая смертность составила 37.8 ± 3.6% и не зависела от средней плотности заселения (r = 0.03, n = 19, P > 0.05). При этом смертность от неизвестных причин составила 22.3 ± 2.5, а от паразитоидов 15.5 ± 2.4% (табл. 1). В обоих случаях смертность не зависела от плотности заселения деревьев (табл. 2).
Рис. 5.
Динамика выхода моли Ph. isskii и ее паразитоидов (Тюмень, 2017 г.) в условиях полевой лаборатории.
Из московской популяции моли в 2016 г. было выявлено девять видов паразитоидов: Pnigalio agraules, P. soemius, Sympiesis gordius, S. sericeicornis, Cirrospilus pictus, Hyssopus geniculatus, Chrysocharis laomedon, Ch. nephereus (Eulophidae) и Pholetesor circumscriptus (Braconidae) (табл. 3). Преобладали S. gordius, H. geniculatus и S. sericeicornis. При этом заселенность Ph. issikii доминирующим видом S. gordius была негативно и достоверно (r = −0.54, n = 30, P < 0.01) связана с плотностью заселения минeром дерева-хозяина. Помимо эвлофид и браконид были отмечены и представители других семейств паразитических перепончатокрылых: Pteromalidae, Encyrtidae и Proctotrupidae. Доля представителей этих семейств в общем комплексе паразитоидов составила 0.4 ± 0.4, 4.8 ± 3.8 и 5.6 ± 3.8% (во всех случаях n = 30), соответственно. В 2017 г. вследствие затяжной и холодной весны плотность заселения липы минером в Филевском парке была близка к нулю. Среди паразитоидов удалось вывести только Sympiesis gordius и S. sericeicornis (Eulophidae).
Таблица 3.
Видовая структура комплекса паразитоидов (Hymenoptera, Eulophidae, Braconidae) липовой моли-пестрянки Ph. issikii в городах РФ
| Вид | Москва | Нижний Новгород | Казань | Екатеринбург | Тюмень |
|---|---|---|---|---|---|
| Eulophidae | |||||
| Pnigalio agraules (Walker 1839)* | + | ||||
| P. pectinicornis (Linnaeus 1758)* | + | + | + | ||
| P. soemius (Walker 1839)* | + | ||||
| Sympiesis gordius (Walker 1839)* | + | + | + | ||
| S. sericeicornis (Nees 1834)* | + | + | + | + | |
| Cirrospilus lyncus Walker 1838* | + | ||||
| C. pictus Nees 1834* | + | + | |||
| Hyssopus geniculatus (Hartig 1838)* | + | + | + | + | + |
| Chrysocharis laomedon Walker 1839 | + | + | + | + | |
| Ch. nephereus Walker 1839 | + | + | + | + | |
| Achrysocharoides altilis (Delucchi 1954) | + | ||||
| Minotetrastichus frontalis Nees 1834* | + | + | + | + | |
| Braconidae | |||||
| Pholetesor circumscriptus (Nees 1834) | + | + | + | + | + |
| Всего | 9 | 6 | 6 | 7 | 10 |
Из нижегородской популяции минера было получено шесть видов паразитоидов Ph. issikii: Sympiesis sericeicornis, Hyssopus geniculatus, Chrysocharis laomedon, Achrysocharoides altilis, Minotetrastichus frontalis (Eulophidae) и Pholetesor circumscriptus (Braconidae) (табл. 3). Achrysocharoides altilis (Delucchi, 1954) был впервые отмечен в качестве паразитоида Ph. issikii. Этот вид является эндопаразитоидом личинок насекомых-минеров (Bouček, Askew, 1968). Доминировали Ph. circumscriptus и M. frontalis.
Исследование казанской популяции моли позволили выявить шесть видов паразитоидов: Pnigalio pectinicornis, Sympiesis gordius, Hyssopus geniculatus, Chrysocharis nephereus, Minotetrastichus frontalis (Eulophidae) и Pholetesor circumscriptus (Braconidae) (табл. 3). Также были выведены два экземпляра рода Omphale sp. (Eulophidae). Ph. circumscriptus преобладал в выведенном материале.
Из уральской популяции минера было получено семь видов паразитоидов: Pnigalio pectinicornis, Sympiesis sericeicornis, Hyssopus geniculatus, Chrysocharis laomedon, Ch. nephereus, Minotetrastichus frontalis (Eulophidae) и Pholetesor circumscriptus (Braconidae) (табл. 3). Доминировали S. sericeicornis и Ph. circumscriptus. При этом паразитированность Ph. issikii доминирующим S. sericeicornis была положительно и достоверно (r = 0.64, n = 20, P < 0.001) связана с плотностью заселения минeром дерева-хозяина. Зараженность Ph. circumscriptus не имела подобной связи (r = 0.07, n = 20, P > 0.05).
Исследование тюменской популяции позволило выявить десять видов паразитоидов: Pnigalio pectinicornis, Sympiesis gordius, S. sericeicornis, Cirrospilus lyncus, C. pictus, Hyssopus geniculatus, Chrysocharis laomedon, Ch. nephereus и Minotetrastichus frontalis (Eulophidae) и Pholetesor circumscriptus (Braconidae) (табл. 3). Помимо этого были выведены представители родов Achrysocharoides и Chrysocharis (Eulophidae). Преобладали P. pectinicornis, S. gordius и Ch. laomedon. При этом паразитированность Ph. issikii доминирующими видами P. pectinicornis и S. gordius не была связана с плотностью заселения минером дерева-хозяина: (r = = −0.02, n = 19, P > 0.05) и (r = −0.22, n = 19, P > > 0.05), соответственно.
Комплекс паразитоидов Ph. issikii пяти городов РФ практически полностью состоит из полифагов, по-видимому, перешедших на питание липовой молью-пестрянкой с других видов Gracillariidae. Соотношение экто- и эндопаразитоидов в наших сборах составляет 9 : 4 (табл. 3). В частности для Москвы этот показатель выглядит как 2 : 1, для Нижнего Новгорода – 1 : 1, Казани – 2 : 1, Екатеринбурга − 4 : 3, Тюмени – 7 : 3.
Одним из наиболее значимых видов в комплексе паразитоидов Ph. issikii является грегарный личиночно-куколочный эктопаразитоид − Minotetrastichus frontalis. Самка M. frontalis откладывает яйцо в мину Ph. issikii на гусеницу или рядом с ней (Yefremova, Mishchenko, 2012). При этом специфической локализации на теле гусеницы паразитоид не имеет. На одной гусенице (или куколке) Ph. issikii может проходить развитие от двух до пяти личинок M. frontalis (Yefremova, Mishchenko, 2012).
Minotetrastichus frontalis преобладает в комплексах паразитоидов Ph. issikii в странах Центральной Европы, а также в европейской части РФ. Так, в период 2011−2013 гг. в парках г. Братиславы доля вида в паразитокомплексе составляла 31.8 ± 2.3% (n = 60) (Ермолаев, Аимбетова, 2016). В эти же годы общая доля M. frontalis в сборах по 16 пунктам Венгрии достигала 83.7% (Szőcs et al., 2014; 2015). В 2016 г. в Румынии паразитоид был выявлен в 55% случаев (Andriescu et al., 2016). Помимо этого в 2006 г. M. frontalis был вторым по численности в Ульяновской обл. Доля этого вида составила 19.3 ± 3.8% (n = 22) (Ефремова, Мищенко, 2008). M. frontalis доминировал и в последних пробах из Удмуртии (Ермолаев и др., 2018). В 2015 г. доля этого вида на трeх пробных площадях близ г. Ижевска составила 26%. Наши данные показали преобладание вида и в комплексе паразитоидов Ph. issikii в Нижнем Новгороде. Исследования, проведенные на территории всей Удмуртской республики, показали, что M. frontalis приурочен исключительно к неморальной зоне Удмуртии и отсутствовал в районах севернее 57° северной широты (Ермолаев и др., 2018).
Одиночный эктопаразитоид личинок и куколок насекомых минeров Sympiesis gordius чаще выступает в роли первичного паразита и заражает личинок и куколок представителей ряда семейств отрядов Hymenoptera и Lepidoptera, предпочитает гусениц представителей рода Phyllonorycter (Gracillariidae) (Bouček, Askew, 1968).
Sympiesis gordius преобладал в сборах паразитоидов Ph. issikii на Украине и в Ульяновской обл. Так, доля S. gordius в комплексе паразитоидов, собранных в 1988 г. в трех точках г. Киева, составила 46.4% (Mey, 1991). В Ульяновской обл. эта величина достигала 43.1 ± 3.7% (n = 22) (Ефремова, Мищенко, 2008). Помимо этого S. gordius был вторым по численности в Венгрии и Удмуртской Республике (2001−2005 гг.). Так, доля S. gordius в сборах паразитоидов в Венгрии составила 5.3% (Szőcs et al., 2014), а в Удмуртской Республике – до 32.5% (Ермолаев и др., 2011). Повторное (в 2015 г.) исследование трех пробных площадей близ г. Ижевска показало, что вид стал третьим по численности (8% от общего числа всех паразитоидов) (Ермолаев и др., 2018). Наше исследование показало преобладание вида в комплексе паразитоидов Ph. issikii в Москве (26.5%) и субдоминирование в Тюмени (29.1% от общего количества особей всех видов).
Одиночный первичный или вторичный эктопаразитоид гусениц и куколок минирующих насекомых Sympiesis sericeicornis – обычный компонент комплекса Ph. issikii. Вид был третьим по численности в сборах в Словакии (зараженность паразитоидом 1.6−1.9%) (Ермолаев, Аимбетова, 2016), Венгрии (4.8% от общего количества особей всех видов) (Szőcs et al., 2014) и в наших сборах в г. Москве. Вид был вторым по численности в паразитокомплексе Ph. issikii в Киеве (Mey, 1991) и последних (2015 г.) сборах близ Ижевска (Ермолаев и др., 2018): 21.4 и 14% от общего количества особей всех видов, соответственно. Вид доминировал в наших сборах в Екатеринбурге (38.9% от общего количества особей всех видов).
Chrysocharis laomedon − первичный одиночный эндопаразитоид многих видов молей-пестрянок (Bouček, Askew, 1968). Вид был третьим в комплексе паразитоидов Ph. issikii в Ульяновской обл. (Ефремова, Мищенко, 2008), в ранних (2001−2005 гг.) материалах из Удмуртской Республики (Ермолаев и др., 2011) и наших сборах в Тюмени.
Общая зараженность паразитоидами Ph. issikii в европейской части ареала крайне низка. Так, в период 2011−2013 гг. общая средняя зараженность паразитоидами Ph. issikii в парках г. Братиславы составила 22.1 ± 1.1 (n = 60) (Ермолаев, Аимбетова, 2016). Величина данного показателя в 16 пунктах Венгрии (Szőcs et al., 2014) в 2011 г. была 37.2%, в 2012 и 2013 гг. – 28 и 9.6%, соответственно. Смертность минёра от паразитоидов на территории Приокско-Террасного заповедника составляла до 27% (Осипова, 1995). В 2006 г. общая средняя зараженность паразитоидами Ph. issikii в 22 пунктах Ульяновской обл. составила 21.4 ± 1.8 (Ефремова, Мищенко, 2008). В период 2001−2005 гг. в Удмуртской Республике на трех пробных площадях этот показатель варьировал от 0.9 ± 0.2 до 12.5 ± 0.9% (Ермолаев и др., 2011), а в 2015 г. составил только 1.6 ± 0.3% (Ермолаев и др., 2018). Низкий показатель зараженности паразитоидами (2.2%) был выявлен в период 2008−2011 гг. в Харьковской обл. (Мешкова, Микулина, 2013). Зараженность паразитоидами гусениц и куколок Ph. issikii в наших сборах варьировала от 1.4 ± 0.4 (Казань) до 15.5 ± 2.4% (Тюмень).
Таким образом, впервые исследованы комплексы паразитоидов инвазивного вида липовой моли-пестрянки (Ph. issikii) в городах Москва, Нижний Новгород, Казань, Екатеринбург и Тюмень. В общей сложности выявлено двенадцать видов-полифагов семейства Eulophidae. Achrysocharoides altilis впервые отмечен в качестве паразитоида минера. Роль паразитоидов как фактора смертности гусениц и куколок Ph. issikii была незначительной.
Список литературы
Егоренкова Е.Н., 2008. Фауна наездников-тетрастихин (Hymenoptera, Eulophidae, Tetrastichinae) лесостепной части Среднего Поволжья. Автореф. дис. … канд. биол. наук. М.: ИПЭИЭ им. А.Н. Северцова РАН. 18 с.
Ермолаев И.В., Аимбетова С.И., 2016. Паразитоиды (Hymenoptera, Eulophidae, Ichneumonidae, Braconidae) липовой моли-пестрянки Phyllonorycter issikii (Kumata) (Lepidoptera, Gracillariidae) в г. Братислава // Вестник Удмуртского университета. Серия Биология. Науки о Земле. Т. 26. Вып. 1. С. 118−125.
Ермолаев И.В., Ефремова З.А., Домрачев Т.Б., 2018. О влиянии паразитоидов (Hymenoptera, Eulophidae) на выживаемость липовой моли-пестрянки пестрянки (Phyllonorycter issikii, Lepidoptera, Gracillariidae) в Удмуртии // Зоологический журнал. Т. 97. № 2. С. 401−407.
Ермолаев И.В., Ефремова З.А., Ижболдина Н.В., 2011. Паразитоиды как фактор смертности липовой моли-пестрянки (Phyllonorycter issikii, Lepidoptera, Gracillariidae) // Зоологический журнал. Т. 90. № 1. С. 24−32.
Ефремова З.А., Мищенко А.В., 2008. Комплекс наездников-паразитоидов (Hymenoptera, Eulophidae) липовой моли-пестрянки Phyllonorycter issikii (Lepidoptera, Gracillariidae) в Среднем Поволжье // Зоологический журнал. Т. 87. № 2. С. 189−196.
Ефремова З.А., Мищенко А.В., 2009. Новые данные о трофических связях наездников-эвлофид (Hymenoptera, Eulophidae) с чешуекрылыми (Lepidoptera) в Ульяновской области // Энтомологическое обозрение. Т. 88. № 1. С. 29−37.
Ефремова З.А., Мищенко А.В., 2010. Динамика численности популяций доминирующих паразитоидов (Hymenoptera, Eulophidae) бабочки Phyllonorycter issikii (Kumata) (Lepidoptera, Gracillariidae) на Средней Волге // Труды Русского энтомологического общества. С.-Петербург. Т. 80 (2). С. 64−75.
Ефремова З.А., Краюшкина А.В., Мищенко А.В., 2009. Комплексы паразитоидов (Hymenoptera, Eulophidae) молей-пестрянок рода Phyllonorycter (Lepidoptera, Gracillariidae) в Среднем Поволжье // Зоологический журнал. Т. 88. № 10. С. 1213−1221.
Ивантер Э.В., Коросов А.В., 2011. Введение в количественную биологию. Петрозаводск: Изд-во ПетрГУ. 302 с.
Кириченко Н.И., 2013. Липовая моль-пестрянка Phyllonorycter issikii в Западной Сибири: некоторые экологические характеристики популяции недавнего инвайдера // Сибирский экологический журнал. № 6. С. 813−822.
Мешкова В.Л., Микулина И.Н., 2013. Энтомофаги адвентивных молей-минёров в зеленых насаждениях Харьковщины // Современное состояние и перспективы охраны и защиты лесов в системе устойчивого развития. Материалы международной научно-практической конференции. Гомель, 9–11 октября 2013 г. Гомель: Институт леса НАН Беларуси. С. 92−96.
Мищенко А.В., Ефремова З.А., А.В. Краюшкина А.В., 2007. Динамика популяции липовой моли-пестрянки Phyllonorycter issikii (Lepidoptera, Gracillariidae) и комплекс ее паразитоидов (Hymenoptera, Eulophidae) в Среднем Поволжье // Природа Симбирского Поволжья. Ульяновск: Издательство “Корпорация технологий продвижения”. Вып. 8. С. 169−175.
Мищенко А.В., 2009. Паразитизм наездников-эвлофид (Hymenoptera: Eulophidae) на минирующих чешуекрылых (Lepidoptera, Nepticulidae, Tischeriidae, Gracillariidae) лесостепи европейской России. Автореф. дис. … канд. биол. наук. Санкт-Петербург: ВНИИЗР. 21 с.
Мищенко А.В., 2011. Энтомофауна листовых мин // Вестник Томского государственного педагогического университета. Вып. 5. С. 101−106.
Осипова А.С., 1992. Липовая моль-пестрянка – распространяющийся вредитель липы // Экология и защита леса. СПб.: СПбЛТА. С.75−77.
Осипова А.С., 1995. Комплекс беспозвоночных-филлофагов Приокско-Террасного биосферного заповедника и его использование в лесном мониторинге. Автореф. дис. … канд. биол. наук. М.: МГУЛ. 22 с.
Сторожева Н.А., Костюков В.В., Ефремова З.А., 1995. Семейство Eulophidae – Эвлофиды // Определитель насекомых Дальнего Востока России. T. IV. Сетчатокрылые, скорпионницы, перепончатокрылые. Ч. 2. Перепончатокрылые. Владивосток: Дальнаука. С. 291−505.
Andriescu I., Ureche C., Perju T., Stolnicu A.M., 2016. Formation of the parasitoid complexes in four invasive mining species of macrolepidopterans in Romania // IX-th International Conference of Zoologists. “Sustanable use, protection of animal world and forest management in the context of climate change” dedicated to 70th anniversary from the creation of the first research institutions and 55th of the inauguration and foundation of the Academy of Sciences of Moldova. 12–13 October 2016, Chisinau. Chisinau. P. 90−92.
Bouček Z., Askew R.R., 1968. Index of Palaearctic Eulophidae (excl. Tetrastichinae). Index of Entomophagous Insects. Paris. 260 p.
Hansson, C. 1985. The entedontine genera Achrysocharoides Girault, Chrysocharis Forster and Kratoysma Boucek (Hymenoptera: Eulophidae) in the Oriental region // Entomologica Scandinavica. V. 16. P. 217−226.
Hansson, C. 1985a. Taxonomy and biology of the Palaearctic species of Chrysocharis Forster, 1856 (Hymenoptera: Eulophidae) // Entomologica Scandinavica (supplement). V. 26. P. 1−130.
Gokhman V.E., Yefremova Z.A., Yegorenkova E.N., 2014. Karyotypes of parasitic wasps of the family Eulophidae (Hymenoptera) attacking leaf-mining Lepidoptera (Gracillariidae, Gelechiidae) // Comparative Cytogenetics. V. 8(1). P. 31−41.
Graham M.W.R. de V., 1987. A reclassification of the European Tetrastichinae (Hymenoptera: Eulophidae), with a revision of certain genera // Bulletin of the British Museum (Natural History) (Entomology). V. 55(1). 392 p.
Mey W., 1991. Über die Bedeutung autochthoner Parasitoidenkomplexe bei der rezenten Arealexpansion von vier Phyllonorycter-Arten in Europa (Insecta, Lepidoptera, Hymenoptera) // Mitteilungen aus dem Zoologischen Museum in Berlin. Bd. 67 (1). S. 177−194.
Szőcs L., Melika G., Thuróczy Cs., Csóka G., 2014. Adatok az invázív hárslevél sátorosmoly (Phyllonorycter issikii Kumana, 1963) magyarországi parasitoid együtteseinek ismeretéhez // Nӧvényvédelem. K. 50 (10). O. 445−451.
Szőcs L., Melika G., Thuróczy Cs., Csóka G., 2015. Parasitoids of lime leaf miner Phyllonorycter issikii (Lepidoptera: Gracillariidae) recorded throughout the area it recently colonized // European Journal of Entomology. V. 112(4). P. 591−598.
Whitfield J.B., 2006. Revision of the Nearctic species of the genus Pholetesor Mason (Hymenoptera: Braconidae) // Zootaxa 1144. 94 p.
Yefremova Z., Mishchenko A., 2012. The preimaginal stages of Minotetrastichus frontalis (Nees) and Chrysocharis laomedon (Walker) (Hymenoptera: Eulophidae), parasitoids associated with Phyllonorycter issikii (Kumata, 1963) (Lepidoptera: Gracillariidae) // Journal of Natural History. V. 46. P. 1283−1305.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


